Варианты хирургической тактики и структурные изменения в стенке пищевода при синдроме Бурхаве
Автор: Демальдинов Д.А., Мустафин Р.Д., Куртусунов Б.Т., Рожкова С.В.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Клинические наблюдения
Статья в выпуске: 3 т.19, 2024 года.
Бесплатный доступ
Представляются два клинических наблюдения с использованием различных вариантов хирургической тактики при синдроме Бурхаве (спонтанном разрыве пищевода). Проведена оценка статуса пациентов, характера вмешательств, результатов гистологических исследований и исходов заболевания. В обоих наблюдениях поводом к госпитализации в торакальное отделение явился спонтанный разрыв пищевода, осложненный медиастинитом и эмпиемой плевры.Первому пациенту, 70 лет, было проведено консервативное лечение. В связи с возникшим на 7-е сутки аррозивным кровотечением в экстренном порядке выполнена тораколапаротомия, ушивание дефекта пищевода. В послеоперационном периоде произошло прогрессивное ухудшение состояния, связанное с несостоятельностью швов пищевода и острым инфарктом миокарда, закончившееся летальным исходом.Второму пациенту, 59 лет, была выполнена экстирпация пищевода с наложением гастро- и эзофагостомы. Достигнуто клиническое выздоровление с последующей реконструктивной операцией.
Разрыв пищевода, синдром бурхаве, экстирпация пищевода, гистологическое исследование
Короткий адрес: https://sciup.org/140307873
IDR: 140307873 | DOI: 10.25881/20728255_2024_19_3_150
Текст научной статьи Варианты хирургической тактики и структурные изменения в стенке пищевода при синдроме Бурхаве
Актуальность
Синдром Бурхаве представляет собой трансмуральный разрыв стенки пищевода во время рвоты за счет внезапного повышения внутрипросветного давления при закрытом глоточно-пищеводном переходе. Дефект образуется чаще слева на уровне нижней трети, но возможны и другие локализации [1].
Повреждение стенки приводит к быстрому развитию медиастинита. Уже через 6 часов при гистологическом исследовании краев разрыва пищевода и клетчатки средостения обнаруживаются признаки гнойного воспаления [2–4].
Диагностика и хирургическое лечение данной патологии представляет сложности даже в настоящее время [5; 6]. Результаты лечения зависят от сроков госпитализации, характера повреждения, выбранной тактики и адекватности оперативного вмешательства [7–9].
Пациент С., 69 лет, заболел остро: на фоне многократной рвоты возникла сильная боль в груди и одышка. В районной больнице проведено дренирование левой плевральной полости по поводу пневмогидроторакса, и пациент переведен в торакальное отделение.
При поступлении состояние тяжелое: одышка, бледность, гипотония, тахикардия. При аускультации дыхание слева резко ослаблено, выслушиваются разнокалиберные хрипы. По плевральному дренажу серозно-гнойное отделяемое с примесью пищи.
R- графия грудной клетки с контрастированием пищевода: левое легкое коллаби-ровано на 1/3 объема, определяется уровень жидкости до 5-го межреберья. Определяется пневмомедиастинум. Имеется затек контраста в левую плевральную полость.
Эзофагоскопия: по левой стенке пищевода на 32,5 см от резцов определяется продольный разрыв всех слоев пищевода размером 3,0 х 1,0 см с воспалительной инфильтрацией и налетом фибрина. Диагноз: спонтанный разрыв пищевода. Медиастинит. Эзофагоплевральный свищ. Эмпиема плевры слева. Подкожная эмфизема шеи, груди.
В отделении произведено дополнительное дренирование левой плевраль- ной полости, установлен назогастральный зонд, продолжена антибактериальная и инфузионная терапия, санации плевральной полости.
На 2-е сутки наблюдения отмечено нарастание подкожной эмфиземы головы и шеи, выполнено дренирование переднего средостения.
Данные посева плевральной жидкости: P. aeruginosa, Enterobacter spр., E. Faecalis.
Состояние пациента оставалось тяжелым. При динамическом контроле выявлен двусторонний плевральный выпот и сохраняющийся затек контраста в плевральную полость.

на фоне внезапного ухудшения самочувствия, остановки сердечно-легочной деятельности.
По данным патологоанатомического вскрытия причиной смерти явился острый инфаркт миокарда с развитием сердечной недостаточности. Выявлена полная несостоятельность швов на пищеводе, признаки аррозивного кровотечения.
При гистологическом исследовании стенки пищевода выявлены признаки хронического воспаления. В слизистой оболочке пищевода отмечаются признаки некроза, гнойные очаги, богатые полиморфно-нуклеарными нейтрофильными лейкоцитами, моноцитами и клетками инородных тел, – распространяющиеся во все слои стенки пищевода. Обнаружены фрагменты грануляционной ткани, где между новообразованными сосудами располагаются клетки соединительной ткани – лимфоциты, плазматические и тучные клетки, фибробласты, а также единичные полиморфно-ядерные лейкоциты. Между клетками – рыхлое межуточное вещество (Рис. 1).
Пациент Д., 59 лет, поступил в отделение на 3-е сутки заболевания с жалобами на одышку, слабость, озноб. Заболевание началось остро в виде многократной рвоты после обильного приема пищи и алкоголя.
При осмотре состояние тяжелое. Видимые слизистые бледные. Акроцианоз. Пальпаторно определяется крепитация в области шеи и верхних отделах грудной клетки. Аускультативно: справа дыхание ослаблено, выслушиваются разнокалиберные хрипы.
Рентгеноскопия пищевода с контрастированием («Ультравист 300»): мягкие ткани шеи не изменены, предпозвоноч-ное пространство не расширено. Легочные поля без очаговых и инфильтративных теней. Синусы свободные. Тень сердца в поперечнике не расширена. Пищевод свободно проходим для контраста. Стенки его ровные, четкие. На уровне Th8-Th9 справа определяется затек контраста размерами 3 х 4,5 см.
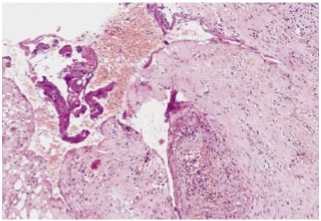
Рис. 1. Гистологическое исследование стенки пищевода, окраска гематоксилином и эозином (ув. 10 x 20).
КТ органов грудной клетки: легкие по дорсальной поверхности поджаты за счет жидкости в обеих плевральных полостях (толщина слоя 8 мм). Средостение расширено, имеется пневмомедиастинум с наличием жидкости и затеком контрастного вещества вправо ниже уровня бифуркации трахеи. Сердце смещено кпереди. Массивная эмфизема мягких тканей шеи и грудной стенки.
Диагноз: спонтанный разрыв пищевода. Медиастинит. Эмпиема плевры справа. Подкожная эмфизема.
Начато интенсивное лечение в отделении реанимации. Установлены назогастральный зонд для питания и аспирационный дренаж в средостение через дефект стенки пищевода.
На 10-е сутки при контроле выявлено нарастание плеврита с затеком контраста в плевральную полость, в связи с чем принято решение о подготовке к операции. Выполнена передне-боковая торакотомия справа в 4-м межреберье. Плевральная полость облитерирована, в заднем синусе осумкованное скопление экссудата. Медиастинальная плевра утолщена, гиперемирована. Прилежащая ткань легкого рубцово изменена. Лимфоузлы легочной связки гиперплазированы. На уровне бронхиального сегмента пищевода по его передней стенке, несколько вправо от средней линии имеется сквозной дефект размерами 4 х 2 см с плотными краями, прилежащий к перикарду. Выполнены резекция грудного отдела пищевода, шейная эзофагостомия и гастростомия.
Заключение: субтотальная десква-мация слизистой оболочки пищевода с умеренной лимфогистиоцитарной инфильтрацией и фиброзом подслизистого слоя. Мышечный слой гипертрофирован
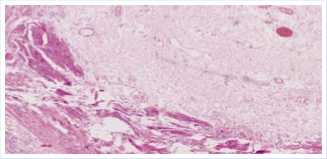
Рис. 2. Гистологическое исследование стенки пищевода, окраска гематоксилином и эозином (ув. 10 x 20).
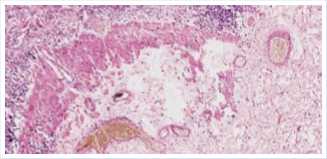
Рис. 3. Гистологическое исследование стенки пищевода, окраска гематоксилином и эозином (ув. 10 x 20).
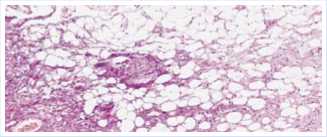
Рис. 4. Гистологическое исследование, окраска гематоксилином и эозином (ув. 10x20).
с очагами разрастания рыхлой волокнистой соединительной ткани вокруг сосудов; диффузная периваскулярная лимфогистиоцитарная инфильтрация. Сосуды расширены, полнокровны. Очаговые кровоизлияния, выраженный отек стромы. В некоторых сосудах выявлено краевое стояние лейкоцитов (Рис. 2).
В окружающих тканях определяются признаки хронического воспаления с множеством макрофагов и гигантских клеток рассасывания инородных тел, с полнокровными сосудами, разрастаниями грануляционной и фиброзной ткани, переходящими в гнойно-некротический детрит, очаговые скопления лейкоцитов в области участков деструкции (Рис. 4).

В послеоперационном периоде продолжалась комплексная интенсивная терапия. Контрольная R-графия органов грудной клетки на 14 сутки после операции: легкие расправлены с обеих сторон. Утолщение париетальной плевры справа в нижних отделах. Выпот не определяется.
Обсуждение
Представленные наблюдения хирургического лечения повреждений пищевода показывают сохраняющуюся актуальность открытых оперативных вмешательств, особенно при поздней госпитализации пациента в специализированное отделение [10–13].
Возможности консервативной терапии имеют свои ограничения и не всегда могут предотвратить развитие гнойно-некротических процессов в стенке пищевода, средостении и плевральной полости [14].
Быстрое обследование, своевременная госпитализация и адекватная индивидуальная хирургическая тактика значительно повышают шансы положительного исхода [15–16].
Заключение
Пациенты с подозрением на наличие спонтанного разрыва пищевода нуждаются в быстром и достаточно полном обследовании для уточнения локализации и распространенности процесса, уточнения коморбидного фона.
Госпитализация в специализированное хирургическое отделение должна происходить в максимально сжатые сроки.
Применение консервативных методов лечения не всегда позволяет контролировать изменения в окружающих пищевод тканях.
Прогрессирование данных изменений может потребовать изменения хирургической тактики в пользу открытых радикальных вмешательств.
Характер и объем оперативного пособия в каждом случае должен определяться индивидуально.
Дополнительная информация
Согласие пациента. Пациенты добровольно подписали информированное согласие на публикацию персональной медицинской информации в обезличенной форме. Конфликт интересов.
Список литературы Варианты хирургической тактики и структурные изменения в стенке пищевода при синдроме Бурхаве
- Haba Y, Yano S, Akizuki H, et al. Boerhaave syndrome due to excessive alcohol consumption: two case reports. Int J Emerg Med. 2020; 13(1): 56. doi: 10.1186/s12245-020-00318-5.
- Cuccì M, Caputo F, Fraternali Orcioni G, et al. Transition of a Mallory-Weiss syndrome to a Boerhaave syndrome confirmed by anamnestic, necroscopic, and autopsy data: A case report. Medicine (Baltimore). 2018; 97(49): e13191. doi: 10.1097/MD.0000000000013191.
- Kimura-Kataoka K, Fujihara J, Kurata S, et al. An autopsy case of spontaneous esophageal perforation (Boerhaave syndrome). Leg Med (Tokyo). 2016; 23:5-9. doi: 10.1016/j.legalmed.2016.08.009.
- Han D, Huang Z, Xiang J, et al. The Role of Operation in the Treatment of Boerhaave’s Syndrome. Biomed Res Int. 2018; 2018: 8483401. doi: 10.1155/2018/8483401.
- Mureșan M, Mureșan S, Balmoș I, Sala D, Suciu B, Torok A. Sepsis in Acute Mediastinitis – A Severe Complication after Oesophageal Perforations. A Review of the Literature. J Crit Care Med (Targu Mures). 2019; 5(2): 49-55. doi: 10.2478/jccm-2019-0008.
- Аснер Т.В., Калягин А.Н., Киселёва Е.Р. и др. Сложности диагностики болезней пищевода: спонтанный разрыв пищевода (синдром Бурхаве) // Доктор.Ру. – 2022. – Т.21. – №6. – С.41–44. doi: 10.31550/1727-2378-2022-21-6-41-44.
- Sohda M, Saeki H, Kuwano H, et al. Current status of surgical treatment of Boerhaave’s syndrome. Esophagus. 2022; 19(1): 175-181. doi: 10.1007/s1038 -021-00858-6.
- Ariza-Traslaviña J, Caballero-Otálora N, Polanía-Sandoval CA, еt al. Two-staged surgical management for complicated Boerhaave syndrome with esophagectomy and deferred gastroplasty: A case report. Int J Surg Case Rep. 2023; 103: 107881. doi: 10.1016/ j.ijscr.2023.107881.
- Шевченко Ю.Л., Сусов Р.П. Послеоперационные инфекционно-воспалительные осложнения в кардиоторакальной хирургии // Вестник НМХЦ им. Н.И. Пирогова. – 2022. – №17(1). – С.84-89. doi: 10.3748/wjg.v20.i35.12696.
- Pezzetta E, Kokudo T, Uldry E, et al. The surgical management of spontaneous esophageal perforation (Boerhaave’s syndrome) ‒ 20 years of experience. Biosci Trends. 2016; 10(2): 120-124. doi: 10.5582/bst.2016.01009.
- Wahed S, Dent B, Jones R, Griffin SM. Spectrum of oesophageal perforations and their influence on management. Br J Surg. 2014; 101(1): e156-e162. doi: 10.1002/bjs.9338.
- Отдельнов Л.А., Малышев И.О. Синдром Бурхаве в практике хирурга: реалии и перспективы // Курский научно-практический вестник «Человек и его здоровье». – 2019. – №1. – С.23-32. doi: 10.21626/vestnik/ 2019-1/03.
- Veltri A, Weindelmayer J, Alberti L, at al. Laparoscopic transhiatal suture and gastric valve as a safe and feasible treatment for Boerhaave’s syndrome: an Italian single center case series study. World J Emerg Surg. 2020; 15(1): 42. doi: 10.1186/s13017-020-00322-3.
- Sudarshan M, Elharram M, Spicer J, at al. Management of esophageal perforation in the endoscopic era: Is operative repair still relevant? Surgery. 2016; 160(4): 1104-1110. doi: 10.1016/j.surg.2016.07.025.
- Zimmermann M, Hoffmann M, Jungbluth T, et al. Predictor of morbility and mortality and mortality in esophageal perforation: retrospective stady of 80 patiens. Scand J Surg. 2017; 106(2): 126-132. doi: 10.1177/14574969166540971.


