Варьирующаяся дозировка статинов и ее влияние на остеопороз
Автор: Чынгышпаев Д.Ш., Малеванная В.А.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 3 т.10, 2024 года.
Бесплатный доступ
Цель исследования -изучить влияние различных доз статинов на прогрессирование остеопороза в течение 36-месячного периода наблюдения. В исследование были включены 98 женщин в постменопаузе с диагнозом остеопороз и наличием атеросклероза артерий нижних конечностей. Пациентки были разделены на 2 группы: женщины, получавшие статины в рамках лечения атеросклероза (1-я группа, n=53) и те, кто не получал статиновую терапию по поводу гиперлипидемии (2-я группа, n=45). Через 36 месяцев наблюдения пациенты были разделены на две группы: с неблагоприятным (n=42) и благоприятным (n=56) течением остеопороза. Прогрессирование остеопороза считалось неблагоприятным, если в период наблюдения у пациентов наблюдались малотравматические переломы крупных костей и/или прогрессирующее снижение минеральной плотности костной ткани (МПК). В зависимости от принимаемой дозы статина больные были разделены на группы: 1) принимающие аторвастатин 20 мг или розувастатин 10 мг; 2) принимающие аторвастатина 40 мг или розувастатина 20 мг. Результаты выявили значительную связь между терапией статинами и благоприятным течением остеопороза (ОШ=0,316, 95% ДИ=0,137-0,727, р=0,003). Применение более высоких доз статинов (аторвастатин 40 мг или розувастатин 20 мг) ассоциировалось с развитием малотравматических переломов крупных костей и/или прогрессирующим снижением МПК в течение 36 мес наблюдения (ОШ=3,0, 95% ДИ=1,119-8,040, р=0,030). С другой стороны, применение более низких доз статинов (20 мг аторвастатина или 10 мг розувастатина) было связано с благоприятным течением остеопороза (ОШ=0,047, 95% ДИ=0,010-0,212, р=0,030). Доза принимаемого статина также умеренно отрицательно коррелировала с МПК (r=-0,45; р=0,005). Таким образом, применение статинов в течение длительного периода (36 месяцев) в низких дозах (аторвастатин 20 мг или розувастатин 10 мг) является эффективным и безопасным методом лечения сопутствующих сердечно-сосудистых заболеваний, представленных атеросклерозом сосудов нижних конечностей и остеопорозом у женщин в постменопаузе, и характеризуется снижением риска развития переломов крупных костей, связанных с остеопорозом.
Статины, коморбидность, атеросклероз, остеопороз
Короткий адрес: https://sciup.org/14129883
IDR: 14129883 | УДК: 615.357.03:616.71-007.23 | DOI: 10.33619/2414-2948/100/41
Текст научной статьи Варьирующаяся дозировка статинов и ее влияние на остеопороз
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 615.357.03:616.71-007.23
Остеопороз — хроническое заболевание, характеризующееся снижением минеральной плотности костной ткани (МПКТ) из-за дисбаланса между образованием и резорбцией кости[1-3]. Это состояние увеличивает риск переломов, что может отрицательно сказаться на качестве жизни пациентов и связано с более высоким уровнем смертности и заболеваемости [4]. Изучению влияния статинов на костный метаболизм при остеопорозе посвящены многочисленные исследования [5-9].
Статины играют решающую роль в лечении дислипидемии, что делает их широко используемыми препаратами [10].
Современные клинические рекомендации по лечению гиперхолестеринемии у пациентов с высоким сердечно-сосудистым риском и диабетом предполагают максимальное снижение уровня липопротеинов низкой плотности (ЛПНП) [11].
В связи с большим количеством пациентов, получающих терапию статинами, большое значение имеют исследования связи между применением статинов и риском развития остеопороза. В частности, не до конца установлены фундаментальные патофизиологические механизмы возможного остеопротекторного действия статинов [12].
Хотя многие наблюдательные исследования сообщают о положительном влиянии применения статинов на минеральную плотность костной ткани (МПКТ) и/или риск переломов, существующих данных недостаточно для подтверждения использования статинов для профилактики остеопороза. В основном это связано с неоднородностью данных о влиянии терапии статинами на формирование костных маркеров и отсутствием данных о корреляции между различными типами и дозами статинов. Еще одна спорная тема — влияют ли статины на уровень половых гормонов, таких как тестостерон или эстроген [13].
Статины действуют путем ингибирования синтеза эндогенного холестерина, который является основным субстратом синтеза половых гормонов, и поэтому мы не можем игнорировать возможность негативного воздействия статинов на здоровье костей, особенно в более высоких дозах. Однако данные о дозозависимом влиянии статинов на развитие и течение остеопороза практически отсутствуют. Таким образом, настоящее исследование направлено на изучение связи между различными дозами статинов и прогрессированием остеопороза в течение 36 месяцев наблюдения.
Материалы и методы
В исследование было включено следующее предложение: 98 женщин в постменопаузе с диагнозом остеопороз и наличием атеросклероза в артериях нижних конечностей. Пациентки были разделены на две группы: женщины, получавшие статиновую терапию по поводу атеросклероза (1-я группа, п=53) и те, кто не получал статиновую терапию (2-я группа, п=45) (Рисунок 1,2). Статиновые препараты включали аторвастатин, принимаемый в дозе 20-40 мг один раз в сутки на ночь, и розувастатин, принимаемый в дозе 10-20 мг один раз в сутки на ночь.
Глюкоза (ммоль/л)
ЛПВП (ммоль/л)
ЛПНП (ммоль/л)
ТГ (ммоль/л)
ОХС (ммоль/л)
|
, 8 |
|||||
|
1,12,3 |
|||||
|
1,16, 7 |
|||||
|
4,59 |
|||||
■ Группа 2 ■ Группа 1
Рисунок 1. Лабораторные данные полученные в ходе исследования
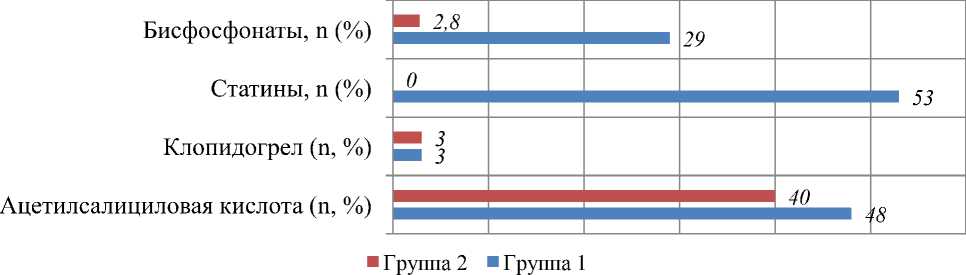
Рисунок 2. Частота и структура применения лекарственных средств у исследуемых групп
Минерализацию костей (МПК) оценивали с помощью двухэнергетической абсорбциометрии, рентгенологического метода, в поясничном и проксимальном отделах бедренных костей. Состояние МПК характеризовали с помощью Т-критерия, при котором диагноз остеопороза устанавливали при значении Т-критерия менее -2,5 СО, а снижение МПК более 1 СО расценивали как остеопения. Атеросклероз артерий нижних конечностей выявляли с помощью дуплексного ультразвукового сканирования артерий с целью определения проходимости артерий нижних конечностей. На продольном срезе оценивали толщину комплекса интима-медиа (КИМ) дистального отдела (10-20 мм) правой и левой общих бедренных артерий.
После 36-месячного наблюдения все пациенты были разделены на две группы — с неблагоприятным (п=42) и благоприятным (n=56) течением остеопороза (Рисунок 3, 4). Течение остеопороза считали неблагоприятным, если в период наблюдения регистрировали малотравматичные переломы крупных костей (бедренной кости, позвонков, лучевой кости) и/или прогрессирующее снижение МПК по данным двухэнергетической абсорбциометрии. В зависимости от дозы статина, введенной больным, их разделили на группы: 1) получавшие аторвастатин 20 мг или розувастатин 10 мг; 2) прием аторвастатина 40 мг или розувастатина
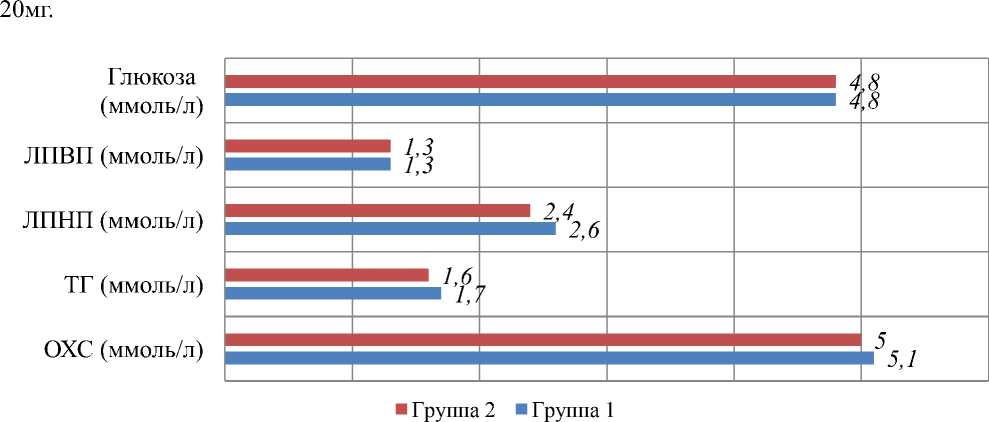
Рисунок 3. Показатели лабораторных параметров у исследуемых
Статины, n (%)
Клопидогрел (n, %)
Ацетилсалициловая кислота (n, %)
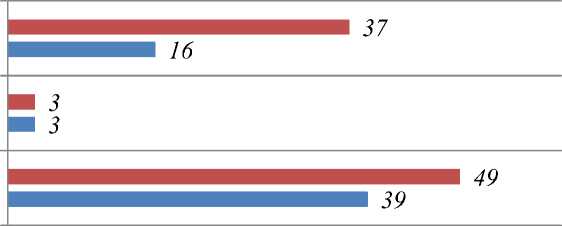
■ Группа 2 ■ Группа 1
Рисунок 4. Частота и структура медикаментозной терапии
Оценка переломов позвонков проводилась с помощью боковой рентгенографии грудного и поясничного отделов позвоночника. Для рентгенографии использовалось стандартное радиологическое оборудование. Были исследованы боковые рентгенограммы грудного (Th4-Th12) и поясничного (L1-L5) позвоночника. Статистический анализ результатов проводился с использованием пакета статистических программ STATISTICA. Распределение количественных данных проверяли с помощью критерия Шапиро-Уилка. Поскольку распределение всех количественных показателей отличалось от нормального, они представлены в виде медиан и квартилей (25-й и 75-й процентили).
Для сравнения групп использовали критерий Манна-Уитни и χ2 (хи-квадрат). Точный критерий Фишера с поправкой Йетса использовался, когда количество наблюдений было небольшим. Отношение шансов (ОШ) использовалось как возможный предиктор неблагоприятных исходов остеопороза с границами доверительного интервала (-95% CL; +95% CL). Для корреляционного анализа использовался коэффициент ранговой корреляции Спирмена.
Результаты и обсуждение
По клинико-анамнестическим данным достоверных различий между 1 и 2 группами по показателю периферического атеросклероза не выявлено. Доли пациентов с проявлениями хронической ишемии нижних конечностей, наличием артериальной гипертензии, курением и продолжительностью курения были одинаковыми в обеих группах. Исследуемые группы были также сопоставимы по показателям липидного обмена, возрасту, длительности менопаузы и уровням МПК (по Т-критериям).
При сравнении клинико-анамнестических данных исследуемых групп в зависимости от характера течения остеопороза выявлено большее количество курящих женщин (р=0,041), у которых в результате 36-месячного наблюдения выявлен прогрессирующий остеопороз. Наблюдаются также сопутствующие малотравматичные переломы крупных костей.
При оценке липидограммы у больных с неблагоприятным течением остеопороза наблюдался несколько более высокий уровень общего холестерина, триглицеридов и липопротеинов низкой плотности, однако эти различия не достигали статистической значимости.
Женщины, у которых не было прогрессирующего снижения МПК и развития остеопоротических переломов за период наблюдения, достоверно чаще получали статины в рамках терапии атеросклероза (p=0,003).
Связь между терапией статинами и прогрессированием остеопороза оказалась статистически значимой (ОШ=0,316, 95% ДИ=0,137-0,727, р=0,003) (Таблица).
Таблица
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ПРЕДИКТОРОВ НЕБЛАГОПРИЯТНОГО ТЕЧЕНИЯ ОСТЕОПОРОЗА
|
Фактор |
OR |
-95%CL; +95%CL |
|
Лечение статинами |
0,316 |
0,137-0,727 |
|
аторвастатин 40 мг/ розувастатин 20 мг |
3,0 |
1,119-8,040 |
|
аторвастатин 20 мг/ розувастатин 40 мг |
0,047 |
0,010-0,212 |
Примечание: OR - odds ratio (отношение шансов).
Было отмечено, что назначение более высоких доз статинов (аторвастатин 40 мг или розувастатин 20 мг) было связано с развитием малотравматических переломов крупных костей (таких как бедренная кость, позвонки или плечевая кость) и/или прогрессивным снижением минеральная плотность костной ткани (МПК) за 36-месячный период (ОШ=3,0, 95% ДИ=1,119-8,040, Р=0,030) (Таблица).
С другой стороны, назначение более низких доз статинов (20 мг аторвастатина или 10 мг розувастатина) было связано с благоприятным исходом при остеопорозе (ОШ=0,047, 95% ДИ=0,010-0,212, р=0,030).
Было обнаружено, что доза введенного статина имела умеренно отрицательную корреляцию с МПК (г=-0,45;P=0,005).
Вклад остеопоротических переломов в бремя болезней, с которыми сталкивается стареющее население, значителен. Заболевания сердца и кровеносных сосудов (СС3) и остеопороз являются возрастными системными заболеваниями, которые могут иметь общие механизмы развития. Воспаление является ключом к патогенезу атеросклероза, а также может играть важную роль в развитии остеопороза. Хроническое воспаление способствует потере костной массы, и между метаболизмом костной ткани и иммунной системой существует определенное взаимодействие.
Существует несколько механизмов, посредством которых статины могут оказывать положительное биологическое воздействие на кости. В исследовании на мышах было показано, что инъекции статина стимулируют костеобразование [16].
Статины и азотсодержащие бисфосфонаты действуют на мевалонатном пути синтеза холестерина [17]. Эти наблюдения вызвали интерес к влиянию статинов на метаболизм костей и появление гипотезы о том, что статины могут иметь клинические преимущества, выходящие за рамки профилактики сердечно-сосудистых заболеваний. Помимо влияния на липидный профиль статины оказывают плейотропные эффекты, опосредованные противовоспалительной, антиоксидантной и иммуномодулирующей активностью [18].
В результате этих универсальных механизмов действия клинические показания к применению статинов расширились от дислипидемии до ишемической болезни сердца и инсульта [19].
Воспаление и иммунная дисфункция также сопровождают развитие остеопороза [20, 21]. Таким образом, можно предположить, что статины могут благотворно влиять на остеопороз. Многочисленные наблюдательные исследования выявили снижение риска переломов при применении статинов [22, 23], однако другие исследователи не обнаружили никакой корреляции [24, 25].
Несколько исследований также показали связь между использованием статинов и увеличением минеральной плотности костей [26, 27]. Однако некоторые рандомизированные клинические исследования терапии статинами не продемонстрировали снижения риска переломов [28, 29].
Мы предположили, что влияние статинов на остеопороз может варьироваться в зависимости от дозы вводимого препарата. Действительно, в недавнем исследовании сообщалось, что статины благотворно влияют на остеопороз в низких дозах, но могут быть вредными в высоких дозах [30].
Статины могут защитить от остеопороза, способствуя остеогенезу и предотвращая остеопоротические изменения. Статины ускоряют дифференцировку мезенхимальных клеток в остеобласты и оказывают на них антиапоптотическое действие [31]. Кроме того, статины ингибируют активацию и дифференцировку остеокластов [31]. В нескольких доклинических исследованиях сообщалось, что статины оказывают анаболическое действие на кости [31, 32]. Например, в исследовании на мышах введение аторвастатина в течение 12 недель увеличивало костную массу и улучшало микроархитектуру трабекулярной кости, повышало экспрессию мРНК остеокальцина и усиливало костеобразование [32].
Напротив, статины могут увеличить риск развития остеопороза, нарушая синтез эстрогена, особенно у женщин. Поскольку холестерин является предшественником половых гормонов, ингибирование синтеза холестерина статинами также может снизить уровень половых гормонов. Действительно, введение симвастатина снижало уровни эстрадиола, прогестерона, тестостерона и общего холестерина в сыворотке крови, а также холестерина липопротеинов и триглицеридов у мышей [33, 34].
Дефицит эстрогена был идентифицирован как одна из основных причин остеопороза у женщин в постменопаузе [35]. Высказано предположение, что усиление резорбции кости вследствие дефицита эстрогенов является основной патофизиологией постменопаузального остеопороза у женщин, тогда как снижение активности остеобластов является основной патофизиологией остеопороза у мужчин [5].
Таким образом, эстрогенснижающий эффект статинов может увеличить риск развития остеопороза у женщин в постменопаузе. В этом исследовании мы показали корреляцию между применением высоких доз статинов и повышенным риском прогрессирования остеопороза у женщин в постменопаузе, что может быть связано с эстрогенснижающим эффектом высоких доз статинов. Таким образом, статины могут быть полезны для снижения риска развития и прогрессирования остеопороза, но в то же время они могут оказывать негативное влияние на течение остеопороза в высоких дозах.
Выводы
Длительное применение статинов в низких дозах — эффективный и безопасный метод лечения сердечно-сосудистых заболеваний, связанных с атеросклерозом сосудов нижних конечностей и остеопорозом у женщин в постменопаузе, характеризующийся снижением риска развития переломов крупных костей, связанных с остеопорозом.
Список литературы Варьирующаяся дозировка статинов и ее влияние на остеопороз
- Чынгышпаев Д. Ш., Узаков О. Ж. Остеопонтин как предиктфактор неблагоприятных случаев у больных с коморбидной патологией // Бюллетень науки и практики. 2022. Т. 8. №11. С. 315-330. https://doi.org/10.33619/2414-2948/84/39
- Chyngyshpaev D. S., Kerimaly M., Pasanova A. M., Alymkulov A. T., Uzakova A. O., Uzakov O. J. Prognostic value of osteoprotegerin in assessing risk of cardiovascular complications and osteoporotic fractures in comorbid pathology // Eurasian Medical Journal. 2022. №7. P. 17-25. https://doi.org/10.52680/16948254_2022_7_17
- Lorentzon M., Cummings S. R. Osteoporosis: the evolution of a diagnosis // Journal of internal medicine. 2015. V. 277. №6. P. 650-661. https://doi.org/10.1111/joim.12369
- Zethraeus N., Borgström F., Ström O., Kanis J. A., Jönsson B. Cost-effectiveness of the treatment and prevention of osteoporosis—a review of the literature and a reference model // Osteoporosis international. 2007. V. 18. P. 9-23. https://doi.org/10.1007/s00198-006-0257-0
- An T., Hao J., Sun S., Li R., Yang M., Cheng G., Zou M.Efficacy of statins for osteoporosis: a systematic review and meta-analysis // Osteoporosis International. 2017. V. 28. P. 47-57. https://doi.org/10.1007/s00198-016-3844-8
- Hippisley-Cox J., Coupland C. Unintended effects of statins in men and women in England and Wales: population based cohort study using the QResearch database // Bmj. 2010. V. 340. https://doi.org/10.1136/bmj.c2197
- Larsson B. A., Sundh D., Mellström D., Axelsson K. F., Nilsson A. G., Lorentzon M. Association between cortical bone microstructure and statin use in older women // The Journal of Clinical Endocrinology & Metabolism. 2019. V. 104. №2. P. 250-257. https://doi.org/10.1210/jc.2018-02054
- Lin T. K., Chou P., Lin C. H., Hung Y. J., Jong G. P. Long-term effect of statins on the risk of new-onset osteoporosis: a nationwide population-based cohort study // PLoS One. 2018. V. 13. №5. P. e0196713. https://doi.org/10.1371/journal.pone.0196713
- Van Staa T. P., Wegman S., de Vries F., Leufkens B., Cooper C. Use of statins and risk of fractures // Jama. 2001. V. 285. №14. P. 1850-1855. https://doi.org/10.1001/jama.285.14.1850
- Johansen M. E., Green L. A., Sen A., Kircher S., Richardson C. R. Cardiovascular risk and statin use in the United States // The Annals of Family Medicine. 2014. V. 12. №3. P. 215-223. https://doi.org/10.1370/afm.1641
- Visseren F. L., Mach F., Smulders Y. M., Carballo D., Koskinas K. C., Bäck M., Williams B. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice: Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies With the special contribution of the European Association of Preventive Cardiology (EAPC) // European journal of preventive cardiology. 2022. V. 29. №1. P. 5-115. https://doi.org/10.1093/eurjpc/zwab154
- Wei W., Schwaid A. G., Wang X., Wang X., Chen S., Chu Q., Wan Y.Ligand activation of ERRα by cholesterol mediates statin and bisphosphonate effects // Cell metabolism. 2016. V. 23. №3. P. 479-491. http://dx.doi.org/10.1016/j.cmet.2015.12.010
- Schooling C. M., Au Yeung S. L., Freeman G., Cowling B. J. The effect of statins on testosterone in men and women, a systematic review and meta-analysis of randomized controlled trials // BMC medicine. 2013. V. 11. №1. P. 1-9. https://doi.org/10.1186/1741-7015-11-57
- Sennerby U., Melhus H., Gedeborg R., Byberg L., Garmo H., Ahlbom A., Michaëlsson K.Cardiovascular diseases and risk of hip fracture // Jama. 2009. V. 302. №15. P. 1666-1673. https://doi.org/10.1001/jama.2009.1463
- Greenblatt M. B., Shim J. H. Osteoimmunology: a brief introduction // Immune network. 2013. V. 13. №4. P. 111-115. http://dx.doi.org/10.4110/in.2013.13.4.111
- Mundy G., Garrett R., Harris S., Chan J., Chen D., Rossini G., Gutierrez G. L. Stimulation of bone formation in vitro and in rodents by statins // Science. 1999. V. 286. №5446. P. 1946-1949. https://doi.org/10.1126/science.286.5446.194
- Cummings S. R., Bauer D. C. Do statins prevent both cardiovascular disease and fracture? // Jama. 2000. V. 283. №24. P. 3255-3257. https://doi.org/10.1001/jama.283.24.3255
- Oesterle A., Laufs U., Liao J. K. Pleiotropic effects of statins on the cardiovascular system // Circulation research. 2017. V. 120. №1. P. 229-243. https://doi.org/10.1161/CIRCRESAHA.116.308537
- Oesterle A., Liao J. K. The pleiotropic effects of statins–from coronary artery disease and stroke to atrial fibrillation and ventricular tachyarrhythmia // Current vascular pharmacology. 2019. V. 17. №3. P. 222-232. https://doi.org/10.2174/1570161116666180817155058
- Locantore P., Del Gatto V., Gelli S., Paragliola R. M., Pontecorvi A. The interplay between immune system and microbiota in osteoporosis // Mediators of inflammation. 2020. V. 2020. https://doi.org/10.1155/2020/3686749
- Mundy G. R. Osteoporosis and inflammation // Nutrition reviews. 2007. V. 65. №suppl_3. P. S147-S151. https://doi.org/10.1111/j.1753-4887.2007.tb00353.x
- Chan K.A., Andrade S.E., Boles M. et al. Inhibitors of hydroxymethylglutaryl-coenzyme A reductase and risk of fracture among older women. Lancet. 2000;355(9222):2185–2188.
- Scranton R. E., Young M., Lawler E., Solomon D., Gagnon D., Gaziano J. M.Statin use and fracture risk: study of a US veterans population // Archives of internal medicine. 2005. V. 165. №17. P. 2007-2012. https://doi.org/10.1001/archinte.165.17.2007
- Van Staa, T. P., Wegman S., de Vries F., Leufkens B., Cooper C. Use of statins and risk of fractures // Jama. 2001. V. 285. №14. P. 1850-1855. https://doi.org/10.1001/jama.285.14.1850
- LaCroix A. Z. et al. Statin use, clinical fracture, and bone density in postmenopausal women: results from the Women's Health Initiative Observational Study //Annals of internal medicine. 2003. V. 139. №2. P. 97-104. https://doi.org/10.7326/0003-4819-139-2-200307150-00009
- Lupattelli G., Scarponi A. M., Vaudo G., Siepi D., Roscini A. R., Gemelli F., Mannarino E. Simvastatin increases bone mineral density in hypercholesterolemic postmenopausal women // Metabolism. 2004. V. 53. №6. P. 744-748. https://doi.org/10.1016/j.metabol.2004.01.010
- Liu J., Zhu L. P., Yang X. L., Huang H. L., Ye D. Q. HMG-CoA reductase inhibitors (statins) and bone mineral density: a meta-analysis // Bone. 2013. V. 54. №1. P. 151-156. https://doi.org/10.1016/j.bone.2013.01.044
- Pedersen T. R., Kjekshus J. Statin drugs and the risk of fracture // Jama. 2000. V. 284. №15. P. 1921-1922. https://doi.org/10.1001/jama.284.15.1921
- Reid I. R., Hague W., Emberson J., Baker J., Tonkin A., Hunt D., Sharpe N. Effect of pravastatin on frequency of fracture in the LIPID study: Secondly analysis of a randomized controlled trial // The Lancet. 2001. V. 357. №9255. P. 509-512. https://doi.org/10.1016/S0140-6736(00)04042-3
- Leutner M., Matzhold C., Bellach L., Deischinger C., Harreiter J., Thurner S., Kautzky- Willer A. Diagnosis of osteoporosis in statin-treated patients is dose-dependent // Annals of the rheumatic diseases. 2019. V. 78. №12. P. 1706-1711. https://doi.org/10.1136/annrheumdis-2019-215714
- Oryan A., Kamali A., Moshiri A. Potential mechanisms and applications of statins on osteogenesis: Current modalities, conflicts and future directions // Journal of controlled release. 2015. V. 215. P. 12-24. https://doi.org/10.1016/j.jconrel.2015.07.022
- Hong W., Wei Z., Qiu Z., Li Z., Fu C., Ye Z., Xu X.Atorvastatin promotes bone formation in aged apoE–/–mice through the Sirt1–Runx2 axis // Journal of orthopaedic surgery and research. 2020. V. 15. P. 1-9. https://doi.org/10.1186/s13018-020-01841-0
- Zhang X., Li J., Zhou X., Guan Q., Zhao J., Gao L., Zuo C. Simvastatin decreases sex hormone levels in male rats // Endocrine Practice. 2017. V. 23. №2. P. 175-181. https://doi.org/10.4158/EP161274.OR
- Guldvang A., Hansen C. H., Weisser J. J., Halling-Sørensen B., Styrishave B. Simvastatin decreases steroid production in the H295R cell line and decreases steroids and FSH in female rats // Reproductive Toxicology. 2015. V. 58. P. 174-183. https://doi.org/10.1016/j.reprotox.2015.10.005
- Bone H. G., Greenspan S. L., McKeever C., Bell N., Davidson M., Downs R. WAlendronate and estrogen effects in postmenopausal women with low bone mineral density // The Journal of Clinical Endocrinology & Metabolism. 2000. V. 85. №2. P. 720-726. https://doi.org/10.1210/jcem.85.2.6393


