Вено-венозное шунтирование при ортотопической трансплантации печени
Автор: Локшин Л.С., Лаптий А.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Анестезиология и реаниматология
Статья в выпуске: 1 т.3, 1999 года.
Бесплатный доступ
При проведении операций ортотопической трансплантации печени у 28 пациентов с различной патологией печени применено вено-венозное шунтирование с использованием центробежного насоса «Biopump». Выявлены преимущества и недостатки данного метода. Установлено, что сочетание методик ВВШ и «Cell-Saver» позволяет избежать массивных кровотечений в беспеченочном периоде операции.
Короткий адрес: https://sciup.org/142233300
IDR: 142233300
Текст научной статьи Вено-венозное шунтирование при ортотопической трансплантации печени
Наличие многочисленного контингента больных с различными диффузными и очаговыми заболеваниями печени требует широкого внедрения в клиническую практику ортотопической трансплантации печени (ОТП) [1, 2, 3,4, 14, 15].
Прошло более 30 лет с момента первой клинической трансплантации печени, выполненной Т.Е. Starzl [14].
К настоящему времени в мире (США, Канада, Франция, Германия, Великобритания, Бельгия, Швеция, Испания, Австрия и др.) насчитывается более 200 центров, занимающихся трансплантацией печени. В зарубежных клиниках накоплен опыт более 200 тыс. подобных операций.
В России первая клиническая трансплантация печени была выполнена 14 февраля 1990 г. группой хирургов РНЦХ РАМН во главе с профессором А.К.Ерамишанцевым.
До настоящего времени операции, требующие длительного выключения печени из кровообращения, остаются одними из самых сложных в хирургии.
Ведущим фактором, вызывающим патофизиологические сдвиги в организме пациента, является блок кровотока по воротной и нижней полой венам. Это приводит к значительным расстройствам гемодинамики, нарушениям метаболических процессов в тканях и органах, ишемии органов брюшной полости, а венозное полнокровие органов делает реальностью громадные кровопотери в сравнительно короткий промежуток времени [5,7, 11].
Для снижения негативного влияния этих факторов во время операций ортотопической трансплантации печени применяют вено-венозное шунтирование (ВВШ) [6, 7, 9, 12].
Однако оптимизация вено-венозной декомп рессии и обеспечение оптимальных условий для больного и оперирующей бригады все еще остается одной из актуальных проблем современной трансплантологии.
С февраля 1990 по май 1999 г. в РНЦХ РАМН 32 больным произведены 33 ОТП, в том числе одна ретрансплантация и 10 трансплантаций части печени от живого родственного донора, что к настоящему времени является самым большим в России опытом ОТП в одном центре.
Проводя вено-венозное шунтирование во время ОТП, мы столкнулись с рядом нетрадиционных и трудных задач, практически не освещенных в отечественной литературе. Предлагаем описание наших наблюдений и обсуждение важнейших вопросов пер-фузиологического обеспечения ОТП.
Клинические наблюдения и методы исследования
Оперированы 12 мужчин и 16 женщин в возрасте от 9 до 49 лет (в среднем 28,5±11,6 лет).
Показаниями к ОТП явились: нерезектабель-ный гепатоцеллюлярный рак (4), цирроз печени вирусной этиологии (12), первичный склерозирующий холангит (4), молниеносная форма гепатита В (1), некупирующийся криз отторжения трансплантата (1), болезнь Вильсона-Коновалова с исходом в цирроз печени (3), болезнь Кароли (1), болезнь Байлера (2).
Д лительность вено-венозного шунтирования составляла от 45 до 284 мин (в среднем 159,5±68,4 мин).
Гепатэктомия во всех случаях предусматривала временное прекращение портального и кавального кровотоков, при этом в 28 из 33 наблюдений
Таблица 1
Характеристика больных ОТП и ОРП
|
Показатель |
ОТП |
ОРП |
|
Возраст (лет) |
28,5±11,6 |
24,0±11,7 |
|
Масса тела (кг) |
56,6±14,1 |
51,6±9,9 |
|
Рост (см) |
174,8±8,3 |
159,8±7,9 |
|
Поверхность тела (м2) |
1,5+0,2 |
1,5+0,3 |
|
Длительность ВВШ (мин) |
159,5±68,4 |
99,8±86,2 |
Во время операции определяли показатели газообмена, кислотно-основного равновесия, электролитного состава и свертывающей системы крови.
Кислотно-щелочное равновесие и газообмен определяли на приборе ABL-3 и OSM-3 фирмы «Radiometr» (Дания). Электролитный баланс определяли на приборе «Flame Photometer» фирмы осуществлялось кава-порто-кавальное шунтирование с использованием центрифужного насоса «Biopump» (США).
С целью уменьшения кровопотери, сохранения аутоэритроцитов и снижения расхода донорской крови на 22 ОТП применяли аппарат «Cell-Saver» - «Stat» (Италия).
ОТП выполнялась с соблюдением основных этапов и методических принципов, подробно описанных в литературе [5, 14, 15].
Общая характеристика оперированных больных представлена в табл. 1.
За 30 мин до БПП начинали готовить систему для ВВШ (см. рисунок).
Перед началом ВВШ катетер, стоящий в бедренной вене (3,5 мм), соединяли с отводящей магистралью через У-коннектор 3/8 дюйма, а канюлю, находящуюся в подмышечной вене (4-5 мм), соединяли с приводящей магистралью через трубку 1/4 дюйма и переходник 1/4—3/8 дюйма.
После сборки систему заполняли физиологическим раствором с гепарином в разведении 1:1000. Объем заполнения системы составлял 500 мл перфузата. Последующим этапом было устранение воздуха из системы и присоединение ее к аппарату. Затем пережимали отводящую магистраль, калибровали датчики потока и давления. После завершения всех подготовительных манипуляций снимали зажимы с отводящей магистрали и начинали ВВШ из бедренной вены в подмышечную вену. Затем канюлировали воротную вену (7-9 мм) катетером и начинали обход по воротной вене в подмышечную вену при продолжающемся обходе из нижней полой вены.
Мониторирование показателей жизненно важных функций реципиента проводили с помощью мониторно-компьютерной системы (МХ-04, персональный компьютер) с обработкой данных и последующим протоколированием в виде наркозной и перфузионной карт.
В процессе проведения операции подсчитывали и восполняли кровопотерю, используя компоненты донорской крови и отмытые аутоэритроциты, аппаратом «Cell-Saver».
«Inst. Labor. Inc» (США), количество тромбоцитов на приборе « Trombocountem (Франция), концентрацию фибриногена наборами фирмы "Dale' (США). Гема-токритное число определяли на микрогематокрит-ной центрифуге МТУ-8 (Россия).
Во время ВВШ измеряли следующие параметры: объемную скорость кровотока (ОС), АД — систолическое, диастолическое, среднее; ЦВД, давление в нижней полой вене (НПВ), СВ.
Результаты клинического исследования
Контроль функции ВВШ осуществлялся автоматически и характеризовался минутным объемом перфузии в пределах 880-1350 (в среднем 1078,2±86,1) мл/мин при бедренно-аксиллярном шунтировании и в объеме 1750-3500 (в среднем 2630,4±110,5) мл/мин во время бедренно-порто-аксиллярного шунтирования.
К моменту начала беспеченочного периода, когда начинали обход по воротной вене, кровоток по шунту увеличивался в 2,1 раза и оставался относительно постоянным в течение всего беспеченочного периода, снижаясь к первоначальным цифрам после прекращения обхода по воротной вене. Отток по нижней полой вене составлял 40% от общего кровотока по шунту.
Во время беспеченочного периода при стабильном ВВШ значительных нарушений функции сердечно-сосудистой системы не было. Отмечалась тенденция к снижению АД^ в конце беспеченочного периода в среднем до 68 мм рт. ст. (р<0,05). ЦВД снижалось в среднем к концу беспеченочного периода до 2 мм рт. ст. (р<0,05). Также отмечалась тенденция к умеренной тахикардии с 93,0±4,2 уд/мин в исходе до 106,3±5,2 уд/мин к концу беспеченочного периода (р<0,05).
В большинстве случаев удавалось получить адекватный кровоток из системы нижней полой вены. В момент обхода по воротной вене давление в системе нижней полой вены увеличивалось на 25% по сравнению с началом обхода (р<0,05), а к середине беспеченочного периода повышалось на 33% (р<0,05). Повышение давления в системе нижней
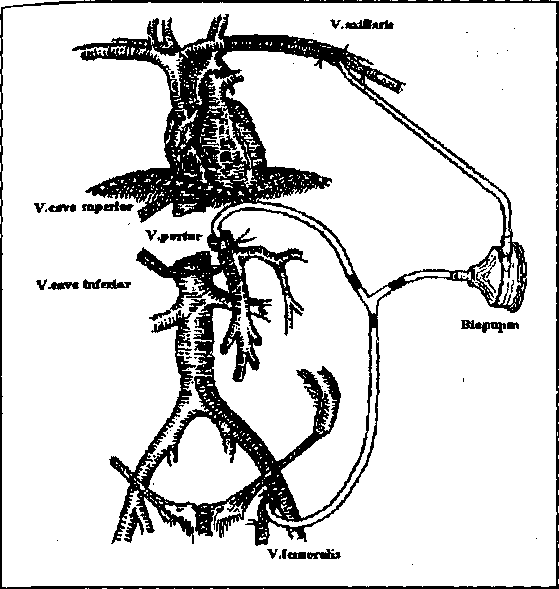
Схема вено-венозного обхода при ортотопической трансплантации печени в клинике
произведена замена катетера. Тромбоз венозных катетеров мы объясняем тем, что система для шунтирования не имеет гепаринизированного покрытия, а лишь заполняется физиологическим раствором с гепарином в разведении 1:1000. После подключения ВВШ к больному без системной гепаринизации и снижения ОС кровотока по шунту до 800 мл/мин в момент бедренно-аксиллярного шунтирования не исключается возможность возникновения подобного осложнения с после-дуюшей тромбоэмболией.
■ Мы пришли к выводу, что в течение вено-венозного шунтирования необходимо поддерживать время активированного свертывания (ВАС) в пределах 200-250 сек. В наших наблюдениях ВАС в среднем составляло 230,0± 10,2 сек. В последних исследованиях нами не отмечено ни одного случая тромбообразования, а также осложнений, которые могли бы быть связаны с введением гепарина. Мы считаем, что подобных осложнений можно избежать, если использовать широко применяемые в зарубежных транспланта-
полой вены мы объясняем возникновением конкурирующего потока. Это явление развивается в момент подключения в систему ВВШ воротной вены. Кровоток по катетеру из нижней полой вены (диаметр которого в 2 раза меньше катетера, находящегося в воротной вене) составляет лишь 40% от общего кровотока по шунту, в результате чего возникает сопротивление в перфузионной системе, создаваемое большим потоком крови из системы портальной вены. Однако такое повышение давления в системе нижней полой вены не вызывало каких-либо осложнений.
У пациентов, перенесших ОТП, не отмечалось существенных колебаний кислотно-основного равновесия, кислородного баланса и электролитного состава крови в течение всего беспеченочного периода.
В ряде случаев проведение ВВШ было осложнено, что, естественно, сказывалось на всех показателях, начиная от гемодинамических (АД, ЦВД, ЧСС, СВ, кровоток по шунту, давление в нижней полой вене) до метаболических.
В четырех наблюдениях отмечался тромбоз катетера в системе нижней полой вены, с повышением давления в среднем до 28,6± 1,3 мм рт. ст., снижением кровотока по шунту до 500,0±29,1 мл/ мин, АДср до 60,0±3,2 мм рт. ст., изменением кислотно-основного равновесия и кислородного баланса крови. В связи с этим ВВШ было прекращено и ционных центрах перкутанные гепаринизированные катетеры для проведения вено-венозного шунтирования.
Эти катетеры имеют большие преимущества: гепаринизированы; имея меньшую длину, исключают петлеобразование и попадание воздуха; легче и быстрее устанавливаются; избегается рассечение паха и подмышечной области, что уменьшает процент возникновения осложнений от этих манипуляций; а также могут использоваться для быстрой инфузии до и после выполнения вено-венозного шунтирования [7, 9,13].
В двух случаях отмечалась нестабильность кровотока по шунту, обусловленная перегибом катетера в системе нижней полой вены. Однако вовремя принятые меры стабилизировали ситуацию, и кратковременное снижение венозного возврата не имело последствий.
В четырех наблюдениях встречалось осложнение, связанное с попаданием воздуха в систему после деканюляции воротной вены при продолжающемся шунтировании по нижней полой вене, вследствие неполного пережатия удаленного катетера. Это приводило к прекращению ВВШ. Подобное осложнение является одним из наиболее частых и грозных во время ОТП и может закончиться воздушной эмболией легочной артерии [10]. Однако в наших случаях шунтирование было прекращено еще до попадания воздуха в центробежную систему, и подобное осложнение не наблюдалось.
Массивная кровопотеря при ОТП является одной из основных причин периоперационной летальности, обусловливая в 30-40% наблюдений смерть пациента во время вмешательства или в раннем послеоперационном периоде [16]. В связи с осложнениями, связанными с переливанием компонентов донорской крови и экономическими затратами, во всем мире стали разрабатываться мероприятия, направленные на сохранение аутокрови и уменьшение потребления донорской крови. Одно из таких меропри
Таблица 2
Преимущества и недостатки вено-венозного шунтирования с использованием центробежного насоса “Biopump”
Преимущества
Стабильность гемодинамических и биохимических показателей, сокращение риска интра-и послеоперационных осложнений
Профилактика ишемии органов брюшной полости и почек Снижение кровопотери
Недостатки
Временные затраты Необходимость эксплорации сосудов Риск возникновения тромбоэмболии и воздушной эмболии
ятий — использование аппарата «Cell-Saver» [8].
Весь объем кровопотери при ОТП приходился на беспеченочный период и реперфузию трансплантата. Объем кровопотери оценивали по количеству отмытых аутоэритроцитов, полученных после обработки собранной крови аппаратом «Cell-Saver».
Суммарное количество собранной в «Cell-Saver» крови составляло в среднем 81,5±27,9 мл/кг веса больного, с гематокритом в среднем 15,2±4,8%. Количество возвращенных отмытых аутоэритроцитов составляло в среднем 17,2±10,7 мл/кг, с гематокритом в среднем 69,2±10,1%.
При проведении экономических расчетов без учета биологических преимуществ аутоэритроцитов мы пришли к выводу, что при возврате больному более 1000 мл отмытых аутоэритроцитов использование одноразовой системы «Cell-Sa ver» оправдано.
Мы считаем, что методика сохранения аутоэритроцитов при помощи аппарата «Cell-Saver»r\o- зволяет уменьшить, а в некоторых случаях полностью отказаться от переливания эритромассы, что способствует стабилизации гемодинамики больного и устраняет осложнения, связанные с переливанием донорской крови. Сочетание методик применения ВВП! и «Cell-Saver» позволяет избежать массивного кровотечения в беспеченочном периоде операции.
Заключение
Как показали наши наблюдения, ВВШ при сравнительно редких ОТП благоприятно сказывается на течении операции и позволяет поддерживать стабильные гемодинамические и биохимические показатели, способствует профилактике ишемии органов брюшной полости и кровопотери во время беспеченочного периода.
Выполнение первой ОТП и двух трансплантаций II, III сегментов от родственного донора без кава-порто-кавального шунтирования сопровождалось тяжелым ишемическим поражением кишечника и поджелудочной железы, что в одном из наблюдений явилось причиной летального исхода.
В связи с этим представляется очевидным, что в условиях становления программы трансплантации печени и отсутствия соответствующего опыта, применение ВВШ необходимо для создания оптимальных условий для реципиента и оперирующей бригады. Необходимость ВВШ усугубляется преобладанием исходно тяжелого контингента реципиентов и длительными сроками ожидания ОТП, сопровождающимися ухудшением их состояния.
Учитывая практическую значимость этого вопроса, мы приводим таблицу преимуществ и недостатков метода ВВШ с использованием центробежного насоса, выявленных в результате проделанной работы (табл. 2).
Список литературы Вено-венозное шунтирование при ортотопической трансплантации печени
- Готье С. В. Ортотопическая трансплантация печени в хирургическом лечении ее диффузных и очаговых заболеваний: Дис.... д-ра мед. наук. -М., 1996.
- EDN: ZJNKKR
- Ерамишанцев А.К., Готье С.В., Цирульникова О.М., Скипенко О.Г. Ортотопическая трансплантация печени //Клиническая медицина. -1991. №10. С. 12-16.
- EDN: YVYOAM
- Константинов Б.А., Дземешкевич С.Л. Введение в клиническую трансплантологию.- 1993. С. 127-160. С. 177-206.
- Шумаков В.И., Мойсюк Я.Г., Козлов И.А. Первый клинический опыт ОТП в клинике //Хирургия. -1991. № 1. С. 98-106.
- Calne R. Y., Williams R., Rolles K. Liver Transplantation in the Adult // World J. of Surgery. -1986. V. 10. № 3. P. 422-443.


