Венозные тромбозы и тромбоэмболия легочных артерий в пластической хирургии: факторы риска, варианты течения и терапевтические стратегии
Автор: Муркамилов И.Т., Ыманкулов Д.С., Райимжанов З.Р., Юсупова З., Юсупова Т., Юсупов Ф.А.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 2 т.10, 2024 года.
Бесплатный доступ
Проведен детальный анализ литературы и представлен разбор собственного клинического случая ведения пациентки с тромбозом вен нижних конечностей и тромбоэмболией легочных артерий, развившийся после процедуры абдоминопластики и липосакции. В литературе существуют ограниченные описания тромбоэмболических событий и их лечения после абдоминопластики и (или) липосакции. В статье обобщаются современные механизмы развития и варианты течения венозных тромбозов, тромбоэмболия легочных артерий и жировой эмболии легких в пластической хирургии, а также подходы к ведению таких пациенток, особое внимание уделяется междисциплинарному подходу.
Абдоминопластика, липосакция, жировая ткань, венозные тромбозы, тромбоэмболия легочных артерий, жировая эмболия легких
Короткий адрес: https://sciup.org/14129849
IDR: 14129849 | УДК: 616-001, | DOI: 10.33619/2414-2948/99/26
Текст научной статьи Венозные тромбозы и тромбоэмболия легочных артерий в пластической хирургии: факторы риска, варианты течения и терапевтические стратегии
Бюллетень науки и практики / Bulletin of Science and Practice
Одним из достижений современной хирургии стало липосакция и абдоминопластика, которые являются самыми востребованными операциями в эстетической медицине [1, 2].
Все больше людей проявляют желание восстановить контуры тела путем уменьшение подкожной жировой ткани в разных частях тела с помощью липосакции. В настоящее время липосакция выполняется в составе других пластических операций, например: гернио-абдоминопластика с липосакцией, абдоминопластика с липосакцией и т. д. [3, 4].
Как и любое хирургическое вмешательство липосакция влечет за собой определенные риски интер- и послеоперационные осложнения [5-8].
В структуре ранних послеоперационных осложнений гернио-абдоминопластики, абдоминопластики и/или липосакции особое место занимают венозные тромбозы и тромбоэмболии легочных артерий (ТЭЛА). Ежегодно 0,1% населения планеты погибает от ТЭЛА. Фактическая частота венозных тромбозов и ТЭЛА в пластической хирургии неизвестна. Тревожным является тот факт, что в большинстве случаев ТЭЛА не диагностируется. По существующим данным, в США ежегодно фиксируется 630 тыс. случаев бессимптомной ТЭЛА [9].
Согласно ранним исследованием, в России только в 1999 году венозные тромбозы и эмболии выявлялась у 240 тыс. человек, из них у 100 тыс. развилась ТЭЛА [10].
По сведениям А. В. Ягода в большинстве случаев тромбоз в системе нижней полой вены (в первую очередь в области подвздошно-бедренного сегмента) служит источником ТЭЛА [11].
У лиц старших возрастных групп, эмболы исходят из венозных сплетений в области простаты и мочевого пузыря. Тромбоз глубоких вен голени представляет меньшую угрозу в отношении развития ТЭЛА. Однако, венозный тромбоз бедренной локализации быстро распространится на малый круг кровообращения. В пластической хирургии чаще отмечается венозные тромбозы, локализующиеся в системе vena cava superior , однако диагностируется редко, так как, быстро подвергается лизису. Венозные тромбозы и ТЭЛА могут приводить даже к смерти. По частоте летальности от острых сердечно-сосудистых заболеваний ТЭЛА занимает третье место после ишемической болезни сердца и инсульта [12].
Как утверждают исследователи, летальность от субмассивной и массивной ТЭЛА достигает 67% и даже в условиях проведения своевременной сердечно-легочной реанимации. Нередко первой и единственной манифестацией ТЭЛА является внезапная смерть [13, 14].
В опубликованном сообщении Journal of the American College of Cardiology отмечено, что смертность пациентов после перенесенной ТЭЛА в течение трех лет составляет 30% [13].
Учитывая растущую популяцию людей, старение населения, которым выполняются хирургические вмешательства с эстетической целью, можно предполагать, что терапевтическое сообщество ожидают определенные трудности при ведении пациентов с различными осложнениями.
Цель данного исследования: проанализировать опубликованные данные по венозным тромбозам и ТЭЛА после гернио-абдоминопластики, абдоминопластики и/или липосакции, а также представить собственный клинический случай развития острого тромбоза вен нижних конечностей осложнившейся ТЭЛА, инфарктом легкого и подострым миокардитом.
Представляем клиническое наблюдение молодой пациентки, у которой венозные тромбозы и ТЭЛА развились после абдоминопластики и липосакции. Так, пациентка Р., 35 лет, обратилась 20.11.2023 г. к пластическим хирургам по поводу эстетической коррекции контуров тела. Из анамнеза: пациентка родилась и выросла в условиях высокогорья, замуж вышла в зрелом возрасте, беременность наступила сразу. Всего беременностей — 5, родила 3 детей — сама, роды естественные, дети здоровые. В настоящее время ведет офисную работу. Не курит, спиртные напитки не употребляет, повышение артериального давления не отмечает. Пациентка до поступления в стационар периодически принимала нестероидные противовоспалительные препараты (НПВП, нимесулид) по поводу люмбалгии и менструальных болей с положительным эффектом. Наряду с этим пациентка на протяжении 6 лет принимала гормональные контрацептивы. Впервые в клинику «Life Hospital» обратилась 20.11.2023 г. по поводу эстетического дискомфорта: неравномерное отложение (аномальное) жировой ткани в области живота (передняя брюшная стенка по типу фартука); спины (овоидное отложение жировой ткани); поясницы (висячее отложение жировой ткани); бедер (медиальная поверхность отложение жировой ткани по типу – бабочки), а также уплотнения кожи и подкожной клетчатки (Рисунок 1).
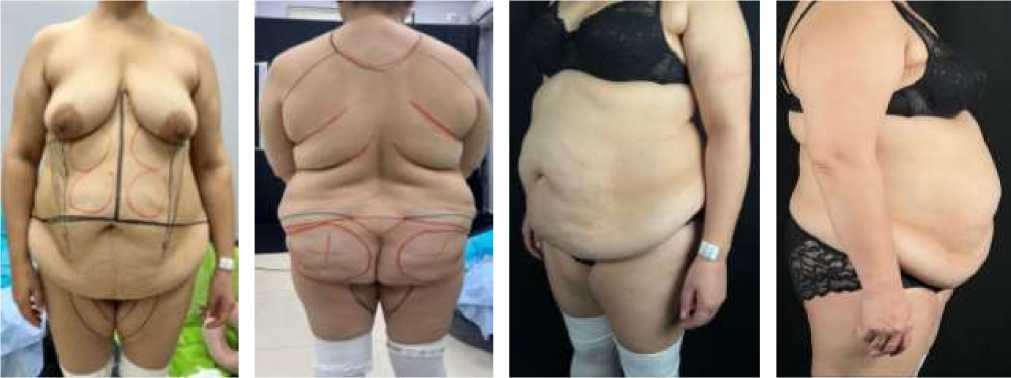
Рисунок 1. Пациентка Р., 35 лет. До абдоминопластики и липосакции (вид спереди, сзади и сбоку)
Пациентка на протяжении последних 10 лет проживает на территории РФ. В середине октября 2023 г. обратилась к гинекологу по месту жительства с подозрением на беременность, где после осмотра был рекомендован медикаментозный аборт в амбулаторнополиклинических условиях. 20.11.2023 г. пациентка проходила плановое обследование в рамках предоперационной подготовки. Результаты объективного осмотра представлены на Рисунке 1.
Лабораторные и инструментальные данные пациентки Р., 35 лет. Общий анализ крови:
эритроциты 3,95×1012/л, гемоглобин 112,0 г/л, гематокрит 34,5%, цветовой показатель 0,85. Лейкоциты 6,38×109/л, нейтрофилы 64,0%, лимфоциты 26,2%, моноциты 8,8%, эозинофилы 1,0%, базофилы 0,0%. Тромбоциты 287,0×109/л, средний объем тромбоцитов 10,8 фл, ширина распределения эритроцитов по объему — 16,0%, Тромбокрит — 0,309%, скорость оседание эритроцитов (СОЭ) — 8 мм/ч. Клинический анализ мочи: количество — 40,0 мл, цвет соломенно-желтый, прозрачность полная, удельный вес 1030 усл ед., pH мочи 5,5. Уробилиноген отрицательный, билирубин отрицательный, Кетоновые тела отрицательный, глюкоза отрицательный, белок не обнаружен, эритроциты измененные и неизмененные не обнаружены. Лейкоциты 5-6-7 в п/з, эпителий плоский в значительном количестве, эпителий переходный – единичные, эпителий почечный не обнаружены, цилиндры не обнаружены, соли не обнаружены, грибки не обнаружены, бактерии не обнаружены, слизь не обнаружена. Биохимические анализы крови: глюкоза 5,26 ммоль/л, общий белок 73,9 г/л, мочевина 4,81 ммоль/л, креатинин 53,9 мкмоль/л, расчетная скорость клубочковой фильтрации по формуле CKD-EPI/Chronic Kidney Disease Epidemiology Collaboration [15] равнялась 118 мл/мин/1,73 м2, кальций 2,36 ммоль/л, натрий 138,0 ммоль/л, калий 3,97 ммоль/л, хлор 105,3 ммоль/л. Активность печеночных трансаминаз была следующим: аспартатаминотрансфераза (АлТ) 24,9 Ед/л, аланинаминотрансфераза (АЛТ) 21,60 Ед/л. Содержание общего билирубина составила 5,99 мкмоль/л, фибриноген крови 3,56 г/л, протромбиновый индекс (ПТИ) 96,9%, протромбиновое время (ПТВ) 13,1 сек, международное нормализованное отношение (МНО) 1,04 Ед. Активированное частичное тромбопластиновое время (АЧТВ) 25,2 секунд. Пациентка носитель A (II) группы крови, резус положительный. Маркеры вирусных гепатитов В и С отрицательный. Human immunodeficiency virus antibodies и реакция Вассермана были отрицательными. Рентгенография органов грудной клетки (Рисунок 2) без особенностей, на электрокардиографии (ЭКГ) отклонений обнаружено не было (Рисунок 3).
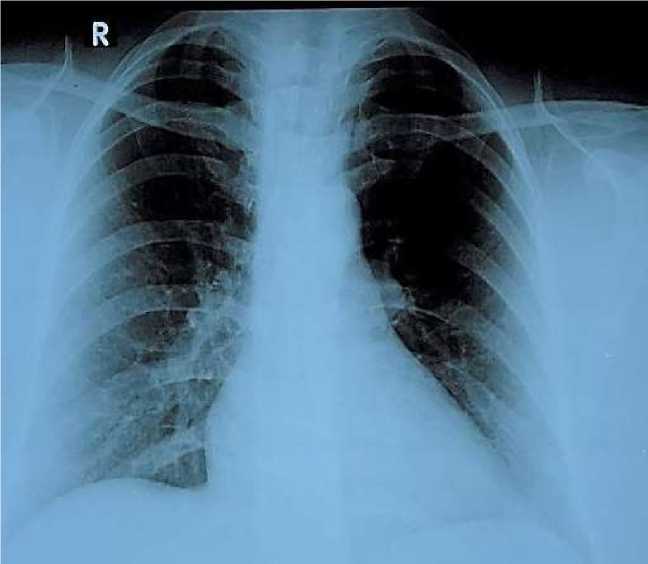
Рисунок 2. Рентгенография легких пациентки Р., 35 лет. До абдоминопластики и липосакции
Рисунок 3. ЭКГ пациентки Р., 35 лет. До процедуры абдоминопластики и липосакции
На ультразвуковом исследовании (УЗИ) внутренних органов отмечалось следующее: печень не увеличена, паренхима умеренно уплотнена, однородна, звукопроводимость умеренно ослаблена, размеры правой доли 135 мм (кранио-каудальный размер), внутрипеченочные протоки и печеночные вены не расширены, портальная вена 8 мм в дм, общий печеночный проток 3,5 мм в дм, очаговой патологии не выявлено. Желчный пузырь обычных размеров и формы, стенки не утолщены, признаков конкрементов не выявлено. Поджелудочная железа не увеличена, паренхима однородна, эхогенность паренхимы повышена, очаговой патологии не найдено. Селезенка 102×36 мм, не увеличена, без очаговой патологии. Правая почка 91×44 мм, паренхима обычной акустической плотности, чашечнолоханочная система не расширена, эхогенность чашечно-лоханочной системы (ЧЛС) умеренно повышена, признаков конкрементов не найдено. Левая почка 98×46 мм, паренхима обычной акустической плотности, ЧЛС не расширена, эхогенность умеренно повышена, признаков конкрементов не найдено. Надпочечники с обеих сторон не визуализируются. Заключение: УЗИ данные за жировой гепатоз. Согласно плану предоперационной подготовки пациентке также выполнялось УЗИ мягких тканей. В мягких тканях передней брюшной стенки кистозных и солидных образований не выявлено. Выше пупочного кольца определяется диастаз листков апоневроза до 24 мм на протяжении 50 мм. В области пупочного кольца определяется грыжевое выпячивание 13×6 мм, грыжевые ворота 6,7 мм, содержимое сальник. Заключение: УЗИ данные за диастаз прямых мышц живота, пупочную грыжу. Учитывая индекса массы тела (рост 163 см, вес 88 кг, индекс массы тела = 33,1 кг/м2, ожирение I степени) пациентке дополнительно было проведено ультразвуковое сканирование артерий нижних конечностей: справа: наружная подвздошная, общая, поверхностная, глубокая бедренная, подколенная артерия, задне- и переднебольшеберцовая, малоберцовая артерии проходимы. Кровоток по ним магистрального неизмененного типа. Скоростные и спектральные характеристики кровотока в пределах нормы. Комплекс интима-медиа на общей бедренной артерии толщиной 0,7 мм, структура его не изменена. Стенки артерий ровные, атеросклеротические бляшки (АСБ) не выявлены. Ультразвуковых признаков гемодинамически значимых стенозов и окклюзий выявлено не было. Слева: наружная подвздошная, общая, поверхностная, глубокая бедренные, подколенная артерия, задне- и переднебольшеберцовая, малоберцовая артерии проходимы. Кровоток по ним магистрального неизмененного типа. Скоростные и спектральные характеристики кровотока в пределах нормы. Комплекс интима-медиа на общей бедренной артерии толщиной 0,7 мм, структура его не изменена. Стенки артерий ровные, АСБ не выявлены. Ультразвуковых признаков гемодинамически значимых стенозов и окклюзий выявлено не было. При УЗИ сосудов вен нижних конечностей каких- либо патологических изменений не отмечалось. После получения результатов клинических, инструментальных и лабораторных данных, а также осмотра терапевта и письменного информированного согласия (23.11.2023 г.) пациентка взята на операцию — абдоминопластика и липосакция. Операционноанестезиологический риск составил II, премедикация с фентанилом 0,005% — 2,0 мл. Интубационная трубка номер 7,0, газовый состав дыхательной смесью — кислород 1 л/мин. В связи с неравномерным отложением жировой ткани оперативное вмешательство длилось более 8 часов в условиях оротрахеального (газового) наркоза с применением 20 мл 1% раствора propofili, под контролем функции витальных органов. Объем кровопотери составил 350 мл, диурез 300 мл. Артериальное давление 130/80 мм рт. ст., частота сердечных сокращений 85 уд/мин, показатели сатурации кислорода периферической крови равнялась 96%. Пробуждение на операционном столе в рамках физиологической реакции. В послеоперационном периоде осуществлялся интенсивный уход: борьба с болевым синдромом, медикаментозное купирование тошноту и рвоту, а также профилактика пролежней и ТЭЛА. Согласно алгоритму ведения пациентов после хирургических вмешательств начат мониторинг клинико-биохимических показателей. Общий анализ крови от 24.11.2023 г.: эритроциты 4,2×1012/л, гемоглобин 101,0 г/л, гематокрит 30,1%, цветовой показатель 0,74. Лейкоциты 7,18×109/л, нейтрофилы 60,8%, лимфоциты 32,4%, моноциты 4,9%, эозинофилы 1,9%, базофилы 0,0%. Тромбоциты 235,0×109/л, средний объем тромбоцитов 9,0 фл, ширина распределения эритроцитов по объему 15,4%, тромбокрит 0,211%. Общий анализ крови от 25.11.2023 г.: эритроциты 3,98×1012/л, гемоглобин 103,0 г/л, гематокрит 32,5%, цветовой показатель 0,78. Лейкоциты 5,85×109/л, нейтрофилы 64,5%, лимфоциты 25,4%, моноциты 8,1%, эозинофилы 2%, базофилы 0,0%. Тромбоциты 303,0×109/л, средний объем тромбоцитов 10,7 фл, ширина распределения эритроцитов по объему 16,0%, тромбокрит 0,323%, СОЭ 20 мм/час. Показатели коагулограммы: ПТИ 84,1%, ПТВ 15,1 секунд, МНО 1,19 Ед. АЧТВ 26,5 секунд, С-реактивный белок 2,54 мг/л, концентрация Д-димера крови составила 1,40 мкгФЭЕ/мл (!). Спустя несколько суток после операции (27.11.2023 г.) у пациентки развилась общая слабость, тошнота, стойкая синусовая тахикардия, головокружение, одышка. На снятой ЭКГ выявлено картина субэндокардиальной повреждении передней стенки левого желудочка (ЛЖ). Учитывая нестабильную сердечную деятельность – упорная синусовая тахикардия с инверсией зубца Т во всех отведениях на ЭКГ (Рисунок 5–7) пациентка переведена в палату интенсивной терапии. При исследовании картины периферического анализа крови: эритроциты 2,62×1012/л (!), гемоглобин 74,0 г/л (!), гематокрит 22,6% (!), цветовой показатель 0,85. Лейкоциты 13,2×109/л (!), нейтрофилы 84,6%, лимфоциты 8,6% (!), моноциты 6,8%, эозинофилы 0,0%, базофилы 0,0%. Тромбоциты 193,0×109/л (!), средний объем тромбоцитов 10,4 фл, ширина распределения эритроцитов по объему 16,3%, тромбокрит 0,200%. Как видно, возникла необходимость коррекции малокровие, проведено тест на совместимость донорспецефических антител — результат совместим-9960123127411. Состояние пациента оставалась тяжелыми, сохранялось одышка (сатурация кислорода периферической крови в пределах 70-89% в покое), сердцебиение, кашель с трудноотделяемой мокротой, мышечная слабость, утомляемость. В связи с подозрением на тромбоэмболические события в экстренном порядке выполнено комплекс инструментальных процедур. На рентгенографии органов грудной клетки отмечалось дисковидные ателектазы и малый гидроторакс справа (Рисунок 4).
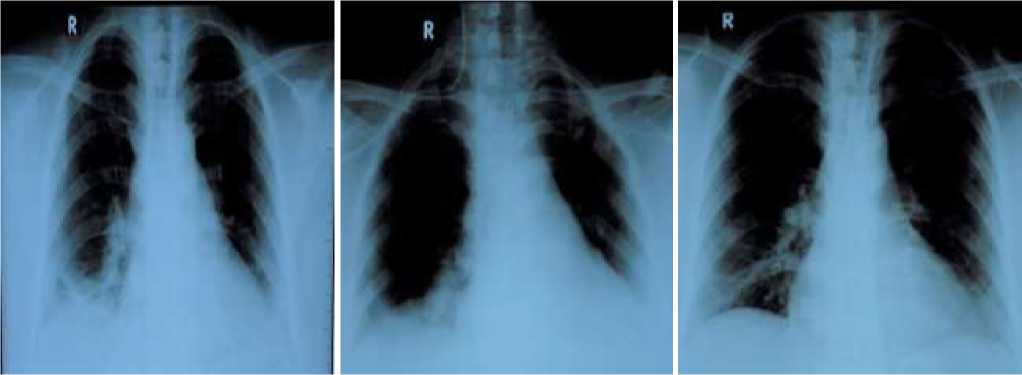
Рисунок 4. Рентгенография легких пациентки Р., 35 лет. В динамике после абдоминопластики и липосакции
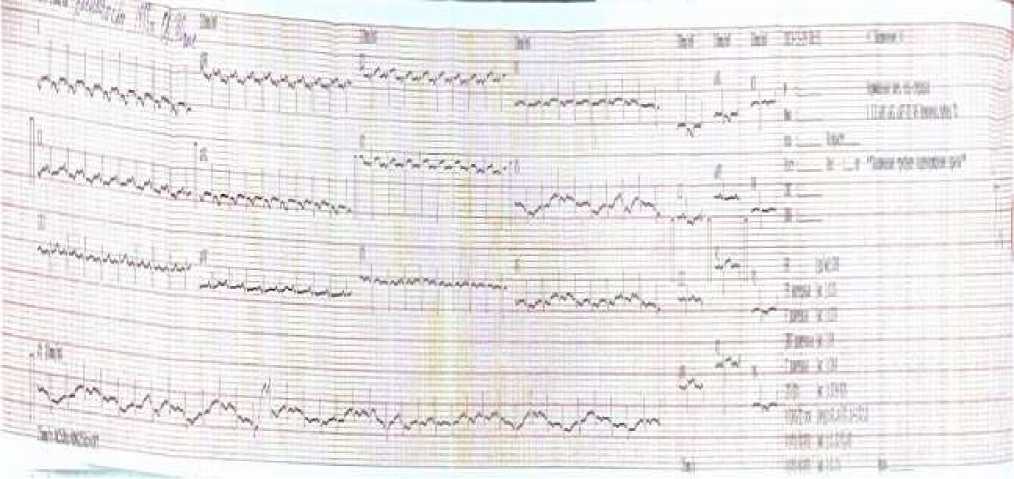
Рисунок 5. ЭКГ пациентки Р., 35 лет. В динамике после абдоминопластики и липосакции
В связи с подозрением на тромбоз вен нижних конечностей проведено ультразвуковое сканирование сосудов нижних конечностей, где справа глубокие вены (общая подвздошная вена, наружная подвздошная вена, общая бедренная вена) проходимы и сжимаемы. В поверхностной бедренной вене, подколенной вене на протяжении в просвете гетерогенные гипоэхогенные тромботические массы с флотирующей головкой, несжимаемы и непроходимы. Прокрашивание поверхностной бедренной и подколенной вен в режиме цветового допплеровского картирование (ЦДК) и энергетического допплеровского картирования (ЭДК) не определяется. Компрессионные пробы отрицательны, клапаны не состоятельны, сафено-феморальное соустье не состоятельны, прокрашивание в режиме ЦДК и ЭДК неполное.
В просвете верхних притоках большой подкожной вены определяются гипоэхогенные, гетерогенные тромботические массы с флотирующей головкой (Рисунок 8, 9).
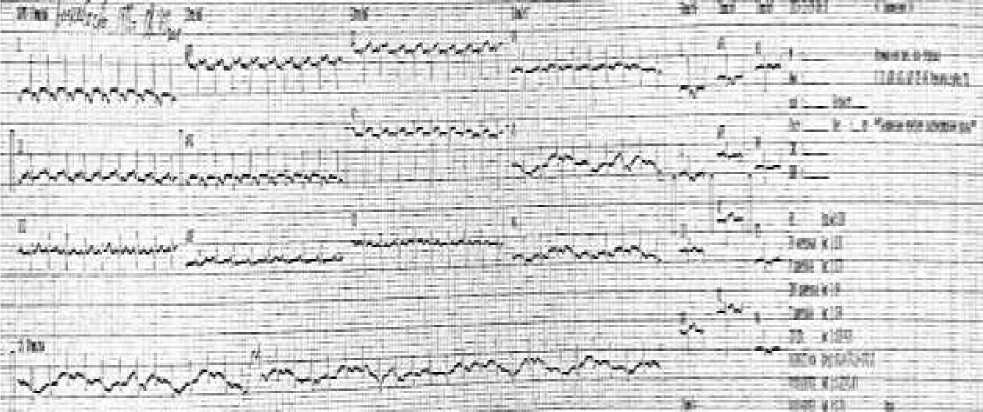
Рисунок 6. ЭКГ пациентки Р., 35 лет. В динамике после абдоминопластики и липосакции
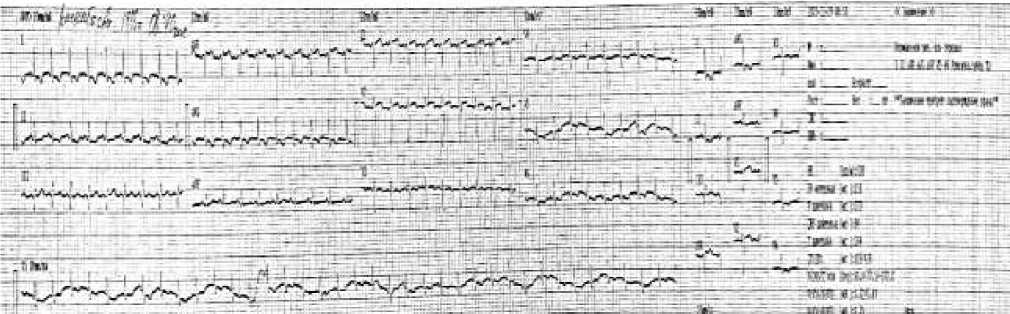
Рисунок 7. ЭКГ пациентки Р., 35 лет. В динамике после абдоминопластики и липосакции
Малая подкожная вена не расширена, проходима, сжимаема. Суральные вены не проходимы, не сжимаемы. Общая бедренная артерия, поверхностная бедренная артерия, подколенная артерия, задняя и передняя тибиальная артерия — кровоток магистральный, неизменен, прослеживается на всем протяжении до стоп. При ультразвуковом сканировании сосудов нижних конечностей слева: проходимость глубоких вен (общая подвздошная вена, наружная подвздошная вена, общая бедренная вена) сохранены, сжимаемы. В просвете поверхностной бедренной и подколенной вен на всем протяжении регистрируется гетерогенные, гипоэхогенные тромботические массы, несжимаемы и не проходимы, прокрашивание в режиме ЦДК и ЭДК не определяется. Компрессионные пробы отрицательны, клапаны не состоятельны, сафено-феморальное соустье не состоятельно, прокрашивание в режиме ЦДК и ЭДК неполное. А также в просвете верхних притоках большой подкожной вены определяются гипоэхогенные, гетерогенные тромботические массы. Малая подкожная вена не расширена, проходима и сжимаема.
Заключение по УЗИ сосудов нижних конечностей — окклизионный тромбоз глубоких вен правой нижней конечности: поверхностной бедренной, подколенной и глубоких вен голени с флотирующей головкой. Окклюзионный тромбоз глубоких вен левой нижней конечности: поверхностной бедренной, подколенной и глубоких вен голени (Рисунок 8, 9).
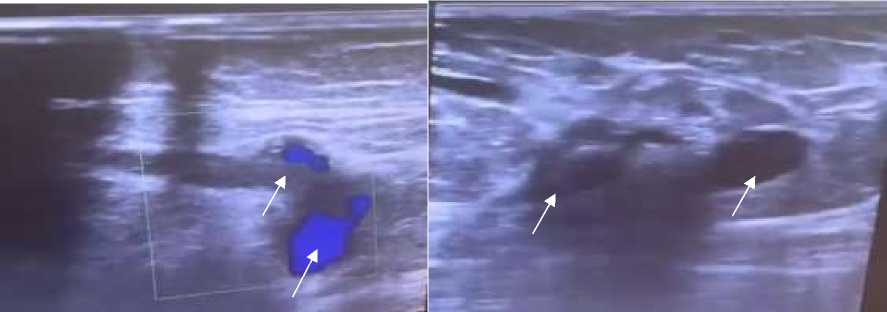
Рисунок 8. Пациентка Р., 35 лет. Ультразвуковое сканирование сосудов нижних конечностей, в динамике после абдоминопластики и липосакции
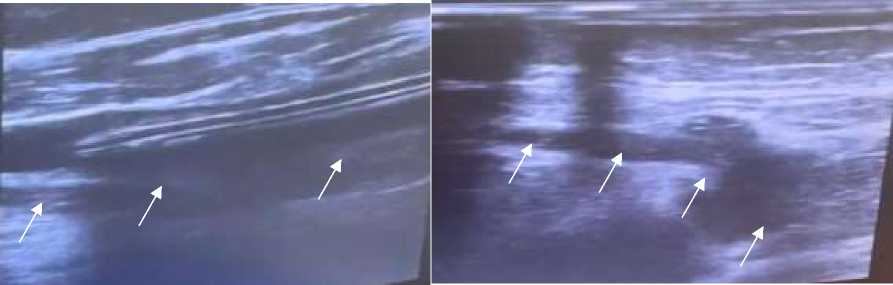
Рисунок 9. Пациентка Р., 35 лет. Ультразвуковое сканирование сосудов нижних конечностей, в динамике после абдоминопластики и липосакции
Учитывая появление синусовой тахикардии на ЭКГ, сочетающегося одышкой и малопродуктивного кашля пациенту выполнена эхокардиография [16], где диаметр выходного тракта аорты составила 3,0–3,2 см, переднезадний размер левого предсердие (ЛП) 3,7 см, объем ЛП 28 мл/м2. Конечный диастолический размер ЛЖ 4,7 см, конечный систолический размер ЛЖ 3,4 см, конечный диастолический объем ЛЖ 79 мл, конечный систолический объем ЛЖ 50 мл, фракция выброса ЛЖ 57% по методике Симпсона, толщина стенок ЛЖ 0,8 см. Нарушение локальной сократимости ЛЖ выявлено не было. Однако, отмечалось расширение правого предсердие и правого желудочка, толщина стенки правого желудочка составила 0,4 см, диаметр легочной артерии 2,3 см, а систолическое легочное давление равнялось 48 мм рт. ст., диаметр v. cava inferior 1,9 см, коллабирует на вдохе более 50%. В полости перикарда за задней стенкой ЛЖ и за правой предсердией определяется жидкость, сепарация листков перикарда в диастолу за задней стенкой ЛЖ составила 0,5 см а за правым предсердием 0,4 см. Заключение по данным эхокардиографии. Тахикардия, дилатация правых отделов сердца. Недостаточность трикуспидального клапана I степени (функционального характера). Нарушения глобальной сократимости правого желудочка. Выпот в перикарде. Легочная гипертензия. Учитывая развитие сердечной недостаточности по правожелудочковому типу пациентке вновь проведено эхокардиография спустя 2 дня, где диаметр выходного тракта аорты составила 3,0–3,1 см, переднезадний размер ЛП 3,6 см, объем ЛП 29 мл/м2. Конечный диастолический размер ЛЖ 5,0 см, конечный систолический размер ЛЖ 3,7 см, конечный диастолический объем ЛЖ 81 мл, конечный систолический объем ЛЖ 58 мл, фракция выброса ЛЖ 60% по методике Симпсона, толщина стенок ЛЖ 0,8 см. Нарушение локальной сократимости ЛЖ выявлено не было. Продольный размер правого желудочка 3,6 см, толщина передней стенки правого желудочка 0,4 см, толщина стенки правого желудочка составила 0,4 см, диаметр легочной артерии 2,3 см, а систолическое легочное давление равнялось 35 мм рт. ст., диаметр v. cava inferior 1,7 см, коллабирует на вдохе более 50%. В полости перикарда за задней стенкой ЛЖ определяется жидкость, сепарация листков перикарда в диастолу за задней стенкой ЛЖ составила 0,6 см а за правым предсердием 0,4 см. Заключение по данным эхокардиографии: тахикардия, дилатация правых отделов сердца. Нарушения глобальной сократимости правого желудочка. Выпот в перикарде. Дилатация правого желудочка. Клапаны не изменены. Нарушения глобальной сократимости ПЖ. Выпот в перикарде.
По результатам УЗИ органов малого таза — сонографические данные за наличие жидкости в заднем своде. В этой связи с учетом анамнеза жизни пациентка была осмотрена гинекологом, где исключены острые патологии органов малого таза. Как сказано, несмотря на активную профилактику тромбоэмболических событий у пациентки в послеоперационном периоде развилась клиника субмассивной ТЭЛА. По линии санитарной авиации в экстренном порядке пациентка осмотрена сосудистым хирургом. В связи с подозрением на ТЭЛА и развитие инфаркта легких было проведено мультиспиральная компьютерная томография органов грудной клетки на аппарате Philips Ingenuity CT 128 slices с применением эффективной дозы лучевой нагрузки 6м3в, где выявлены: в перикарде выпот толщиной 5 мм, в S6 правого легкого визуализируется клиновидной формы субплевральный участок уплотнения. В нижних долях билатерально, средней доле правого легкого, базальном отделе верхней доли левого легкого определяются линейные, неправильной формы участки консолидации (Рисунок 10). Полученные данные при визуализации не исключают картину ТЭЛА.
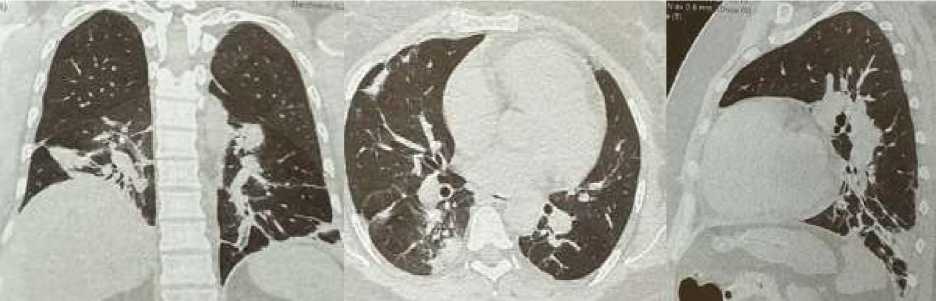
Рисунок 10. Результаты МСКТ пациентка Р., 35 лет. Видны участки консолидации легочной ткани
Консультация сосудистого хирурга. Эмбологенный тромбоз общей бедренной вены справа. Тромбоз подколенной вены слева. Тромбоз притоков большой подколенной вены с обеих сторон. ТЭЛА. Рекомендовано: имплантация противоэмболического кава-фильтра в v.
cava inferior для профилактики рецидива ТЭЛА; антикоагулянтная терапия под контролем свертывающей системы крови; детралекс по 1 табл. 2 раза в день 30 дней; компресс с мазью Вишневского на кожу.
В тот же день (28.11.2023 г. с 21:20 по 21:45) по жизненным показанием пациентке выполнена пункция левой общей бедренной вены в антеградном направлении. Далее диагностический катетер pigtail заведен в нижнюю полую вену. Проведена каваграфия. Определены устья почечных вен. Ниже уровня почечной вены заведена система доставки кава-фильтра. Кава-фильтр установлен в нижнюю полую вену ниже устья почечных вен. Выполнена контрольная каваграфия для определения прилежания фильтра к стенкам vena cava inferior. На месте пункции наложена асептическая повязка. На основании жалоб, анамнеза, клинической картины и результатов обследования пациентке был поставлен клинический диагноз: «Тромбоз вен нижних конечностей, осложненный субмассивной ТЭЛА. Инфаркт легкого. Острая дыхательная недостаточность I-II степени. Подострый миокардит, аритмический вариант. Выпотной перикардит. Сердечная недостаточность функциональный класс II (NYHA/New York Heart Association Functional Classification). Легочная гипертензия. Ожирение I степени.
Пациентка оставалась в палате интенсивной терапии с клинической картиной ТЭЛА. Была начата соответствующая терапия. Наряду с низкопоточной оксигенотерапией (4 л/мин), пациенту были назначены: антикоагулянты (нефракционированный гепарин внутривенно капельно, далее подкожно 2 раза в сутки, под контролем коагулограммы); антиагреганты (ацетилсалициловая кислота 150 мг в сутки вечером); ангиопротекторы (флебодиа 600 мг 2 р в с); цефалоспорины (цефепим 2 г внутривенно); отхаркивающие (амброксол 90 мг в сутки); ингибиторы протоновой помпы (омепразол 40 мг в сутки); ингибиторы ангиотензин-превращающего фермента (иАПФ) (периндоприл 2,5 мг в сутки); антагонисты минералокортикоидных рецепторов альдостерона (спиронолактон 25 мг в сутки); изосорбида динитрат (изокет 0,1%-10 мл внутривенно капельно); сердечные гликозиды (дигоксин 0,25 по ¼ табл утром и вечером). Спустя одной недели пациентке повторно проведено УЗИ сосудов нижних конечностей, где окклюзионный тромбоз глубоких вен правой нижней конечности: поверхностной бедренной, флотирующей головкой с неполной реканализацией.
На ЭКГ картина диффузного изменение конечной части сегмента QRS. Лабораторные данные пациентки Р от 28.11.2023 г. Общий анализ крови от 28.11.2023 г: эритроциты 2,94×1012/л, гемоглобин 84,0 г/л, гематокрит 25,0%, цветовой показатель 0,86. Лейкоциты 13,28×109/л, нейтрофилы 74,7%, лимфоциты 15,3%, моноциты 9,6%, эозинофилы 0,4%, базофилы 0,0%. Тромбоциты 184,0×109/л, средний объем тромбоцитов 11,0 фл, ширина распределения эритроцитов по объему 16,4%, тромбокрит 0,203%, СОЭ 4 мм/час. Показатели коагулограммы: фибриноген 1,87 г/л, ПТИ 76,0%, ПТВ 16,7 секунд, МНО 1,32 Ед. АЧТВ 22,9 секунд. Выросла содержание С-реактивного белка (46,3 мг/л) и Д-димера (12,8 мкгФЭЕ/мл) крови. Концентрация прокальцитонина крови оказалось повышенной (0,2 нг/мл), активность сывороточного амилазы составила 34,0 Е/л, АсТ 48,2 Ед/л, АлТ 44,0 Ед/л, мочевина 8,37 ммоль/л, креатинин 35,3 мкмоль/л, расчетная скорость клубочковой фильтрации по формуле CKD-EPI составила 136 мл/мин/1,73 м2. Электролиты крови: кальций 1,91 ммоль/л, натрий 136,0 ммоль/л, калий 3,49 ммоль/л, магний 0,89 ммоль/л. В связи с изменениям на ЭКГ (инверсия зубца Т во всех грудных отведениях) и наличие симптомов (одышка усиливающиеся при горизонтальном положении тела, сопровождающиеся кашлем и сердцебиением, чувство дискомфорта в груди) решено исследовать маркеры повреждение миокарда, где содержание тропонина I составила 0,42 нг/мл (повышенный).
Лабораторные данные пациентки Р от 2.11.2023 г. Общий анализ крови от 29.11.2023 г.: эритроциты 3,0×1012/л, гемоглобин 84,0 г/л, гематокрит 25,8%, цветовой показатель 0,84. Лейкоциты 12,78×109/л, нейтрофилы 70,5%, лимфоциты 17,4%, моноциты 11,2%, эозинофилы 0,9%, базофилы 0,0%. Тромбоциты 192,0×109/л, средний объем тромбоцитов 11,1 фл, ширина распределения эритроцитов по объему 16,1%, тромбокрит 0,213%, СОЭ 4 мм/час. Показатели коагулограммы: фибриноген 2,5 г/л, ПТИ 69,0%, ПТВ 18,4 секунд, МНО 1,45 Ед. АЧТВ 24,5 секунд, концентрация Д-димера крови 10,0 мкгФЭЕ/мл. Мочевина 5,88 ммоль/л, креатинин 34,4 мкмоль/л, расчетная скорость клубочковой фильтрации по формуле CKD-EPI составила 137 мл/мин/1,73 м2, кальций 1,91 ммоль/л, натрий 137,0 ммоль/л, калий 3,06 ммоль/л. Лабораторные данные пациентки Р от 30.11.2023 г. Общий анализ крови от 30.11.2023 г.: эритроциты 3,38×1012/л, гемоглобин 96,0 г/л, гематокрит 28,9%, цветовой показатель 0,85. Лейкоциты 13,67×109/л, нейтрофилы 72,9%, лимфоциты 17,0%, моноциты 8,2%, эозинофилы 1,9%, базофилы 0,0%. Тромбоциты 201,0×109/л, средний объем тромбоцитов 10,7 фл, ширина распределения эритроцитов по объему 16,3%, тромбокрит 0,215%. Показатели коагулограммы: ПТИ 84,6%, ПТВ 15,0 секунд, МНО 1,18 Ед. АЧТВ 28,3 секунд, концентрация Д-димера крови 14,9 мкгФЭЕ/мл, прокальцитонин крови составила 0,1 нг/мл. Активность печеночных ферментов находилась в пределах референсного уровня: АсТ 18,8 Ед/л, АлТ 33,3 Ед/л, содержание гамма-глютамилтранспептидазы составила 37,4 Е/мл. С-реактивный белок 43,7 мг/л, натрий 137,0 ммоль/л, калий 2,91 ммоль/л, магний 0,81 ммоль/л.
Лабораторные данные пациентки Р от 1.12.2023 г. Общий анализ крови от 1.12.2023 г: эритроциты 2,97×1012/л, гемоглобин 89,0 г/л, гематокрит 25,9%, цветовой показатель 0,90. Лейкоциты 9,79×109/л, нейтрофилы 69,8%, лимфоциты 17,3%, моноциты 10,4%, эозинофилы 2,5%, базофилы 0,0%. Тромбоциты 153,0×109/л, средний объем тромбоцитов 10,7 фл, ширина распределения эритроцитов по объему 15,9%, тромбокрит 0,164%, СОЭ 7 мм/час. Показатели коагулограммы: фибриноген 3,1 г/л, ПТИ 77,0%, ПТВ 16,5 секунд, МНО 1,30 Ед. АЧТВ 21,2 секунд, концентрация Д-димера крови 14,9 мкгФЭЕ/мл, калий 3,0 ммоль/л. Лабораторные данные пациентки Р от 2.12.2023 г. Общий анализ крови от 2.12.2023 г.: эритроциты 3,59×1012/л, гемоглобин 104,0 г/л, гематокрит 30,0%, цветовой показатель 0,87. Лейкоциты 12,6×109/л, нейтрофилы 89,9%, лимфоциты 7,8%, моноциты 2,3%, эозинофилы 0,0%, базофилы 0,0%. Тромбоциты 228,0×109/л, средний объем тромбоцитов 11,3 фл, ширина распределения эритроцитов по объему 15,8%, тромбокрит 0,257%, СОЭ 13 мм/час. В клиническом анализе мочи — протеинурия. Показатели коагулограммы: фибриноген 3,77 г/л, ПТИ 91,3%, ПТВ 13,9 секунд, МНО 1,09 Ед. АЧТВ 22,3 секунд, концентрация Д-димера крови 15,9 мкгФЭЕ/мл, калий 3,91 ммоль/л, натрий 136,0 ммоль/л, альбумин 33,1 г/л, прокальцитонин 0,16 нг/мл, мозговой натрийуретический пептид 177,0 пг/мл (повышенный).
В связи с инфузией нефракционированного гепарина было исследовано показатели коагулограммы два раза в сутки. Так, ПТИ 88,8%, ПТВ 14,3 секунд, МНО 1,13 Ед., длительность АЧТВ равнялась 21,8 секундам. На следующий день (3.12.2023 г.) параметры коагулограммы оказались без существенных изменений: ПТИ 81,9%, ПТВ 15,3 секунд, МНО 1,22 Ед., длительность АЧТВ равнялась 26,1 секундам, фибриноген крови 3,12 г/л. Лабораторные данные пациентки Р от 4.12.2023 г. Общий анализ крови от 4.12.2023 г.: эритроциты 2,92×1012/л, гемоглобин 83,0 г/л, гематокрит 25,1%, цветовой показатель 0,85. Лейкоциты 9,0×109/л, нейтрофилы 82,3%, лимфоциты 8,6%, моноциты 7,8%, эозинофилы 1,3%, базофилы 0,0%. Тромбоциты 220,0×109/л, средний объем тромбоцитов 10,0 фл, ширина распределения эритроцитов по объему 15,6%, тромбокрит 0,221%, СОЭ 17 мм/час.
Показатели коагулограммы: фибриноген 3,77 г/л, ПТИ 91,3%, ПТВ 15,2 секунд, МНО 1,09 Ед. АЧТВ 26,1 секунд, концентрация Д-димера крови 14,72 мкгФЭЕ/мл, калий 3,64 ммоль/л, натрий 135,0 ммоль/л, альбумин 33,1 г/л, прокальцитонин 0,19 нг/мл, С-реактивный белок 36,5 мг/л. 5.12.2023 г. параметры коагулограммы составили: ПТИ 80,8%, ПТВ 15,7 секунд, МНО 1,23 Ед., длительность АЧТВ равнялась 26,2 секундам, фибриноген крови 3,12 г/л, калий 3,59 ммоль/л. На следующий вновь исследовалось картина периферической крови, где эритроциты 3,01×1012/л, гемоглобин 83,0 г/л, гематокрит 26,0%, цветовой показатель 0,83. Лейкоциты 5,48×109/л, нейтрофилы 63,8%, лимфоциты 26,5%, моноциты 6,0%, эозинофилы 3,7%, базофилы 0,0%. Тромбоциты 268,0×109/л, средний объем тромбоцитов 11,1 фл, ширина распределения эритроцитов по объему 15,8%, тромбокрит 0,297%, СОЭ 17 мм/час. В биохимическом анализе крови глюкоза венозной крови составило 4,59 ммоль/л, калий 3,76 ммоль/л. Показатели коагулограммы: фибриноген 3,25 г/л, ПТИ 84,6%, ПТВ 15,0 секунд, МНО 1,18 Ед. АЧТВ 26,5 секунд, концентрация Д-димера крови 15,0 мкгФЭЕ/мл. Примечательно, что уровень С-реактивного белка практически нормализовалось (1,8 мг/л), концентрация сывороточного креатинина был стабильным (40,0 мкмоль/л).
На фоне проводимой терапии общее клиническое состояние пациентки стало улучшаться: одышка в покое не отмечает, сердцебиение нет, гемодинамика стабильная, сон полноценный, периферических отеков нет, над легкими дыхание проводится. Однако, у нашей пациентки сохранялся кашель с трудноотделяемой мокротой. В день выписки из отделение пластической хирургии лабораторные данные были следующими: эритроциты 3,79×1012/л, гемоглобин 101,0 г/л, гематокрит 32,0%, цветовой показатель 0,80. Лейкоциты 5,9×109/л, нейтрофилы 60,3%, лимфоциты 29,6%, моноциты 8,1%, эозинофилы 2,0%, базофилы 0,0%. Тромбоциты 459,0×109/л, средний объем тромбоцитов 10,1 фл, ширина распределения эритроцитов по объему 15,9%, тромбокрит 0,465%, СОЭ 11 мм/час. Показатели коагулограммы: фибриноген 3,45 г/л, ПТИ 84,1%, ПТВ 15,1 секунд, МНО 1,19 Ед. АЧТВ 26,0 секунд, концентрация Д-димера крови 10,2 мкгФЭЕ/мл. В амбулаторнополиклинических условиях пациентка принимала: ривароксабан 20 мг в сутки, ацетилсалициловая кислота 150 мг в сутки, омепразол 40 мг в сутки, монтелукаст 10 мг в сутки.
Лабораторные данные пациентки Р от 25.12.2023 г. Общий анализ крови от 25.12.2023 г.: эритроциты 3,98×1012/л, гемоглобин 103,0 г/л, гематокрит 32,5%, цветовой показатель 0,78. Лейкоциты 5,85×109/л, нейтрофилы 64,5%, лимфоциты 25,4%, моноциты 8,1%, эозинофилы 2,0%, базофилы 0,0%. Тромбоциты 303,0×109/л, средний объем тромбоцитов 10,7 фл, ширина распределения эритроцитов по объему 16,0%, тромбокрит 0,323%, СОЭ 20 мм/час. Показатели коагулограммы: ПТИ 84,1%, ПТВ 15,1 секунд, МНО 1,19 Ед. АЧТВ 26,5 секунд, С-реактивный белок 2,54 мг/л.
В связи с улучшением общего состояние пациентки, решено продолжить лечение в амбулаторно-поликлинических условиях (Рисунок 11). В день выписки из отделения пластической хирургии лабораторные данные были следующими: эритроциты 3,79×1012/л, гемоглобин 101,0 г/л, гематокрит 32,0%, цветовой показатель 0,80. Лейкоциты 5,9×109/л, нейтрофилы 60,3%, лимфоциты 29,6%, моноциты 8,1%, эозинофилы 2,0%, базофилы 0,0%. Тромбоциты 459,0×109/л, средний объем тромбоцитов 10,1 фл, ширина распределения эритроцитов по объему 15,9%, тромбокрит 0,465%, СОЭ 11 мм/час. Показатели коагулограммы: фибриноген 3,45 г/л, ПТИ 84,1%, ПТВ 15,1 секунд, МНО 1,19 Ед. АЧТВ 26,0 секунд, концентрация Д-димера крови 0,58 мкгФЭЕ/мл. В динамике наблюдение и лечения у пациентки кашель прекратилось, сердцебиение не отмечает, на снятой ЭКГ зубцы Р и Т, а также комплекс QRS не были измененными. На эхокардиографии размеры полостей сердца не увеличены, сократительная способность желудочков удовлетворительная, признаки легочной гипертензии и выпотного перикардита выявлено не было.
Рисунок 11. Пациентка Р., 35 лет. После процедуры абдоминопластики и липосакции
8.01.2024 г. пациентке была проведена ультразвуковое сканирование сосудов нижних конечностей, где артериальный кровоток правой и левой нижних конечностей магистрального типа, не изменен, прослеживается на всем протяжении до стоп, гемодинамически значимых нарушений кровотока не выявлено. Поверхностные и глубокие вены проходимы на всем протяжении, сжимаемы, клапаны состоятельны. Признаков тромбоза глубоких и подкожных вен обеих нижних конечностей не выявлено (Рисунок 12).
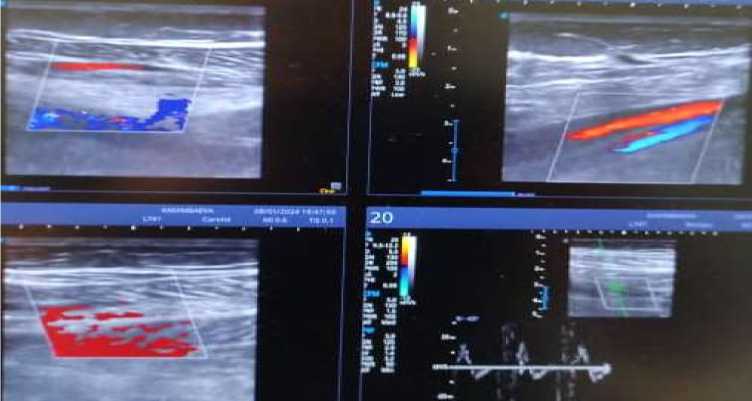
Рисунок 12. Пациентка Р., 35 лет. Ультразвуковое сканирование сосудов нижних конечностей, в динамике после абдоминопластики и липосакции на фоне проведение антикоагулянтной терапии
При объективном осмотре пациента видимых (периферических) отеков на нижней конечности нет. Гемодинамика стабильная, дыхания над легкими проводится, хрипы не выслушиваются. На верхушке тоны сердца сохранены, ритм правильный, частота сердечных сокращений 72 уд/мин, артериальное давление 120/70 мм рт. ст.
Представленное клиническое наблюдение интересно сразу с нескольких сторон. Оно иллюстрирует трудности, с которыми прежде всего сталкиваются пластические хирурги, врачи терапевтического профиля при ведении пациентов с венозными тромбозами, ТЭЛА и миокардитом, сложности своевременной диагностики, а также в выборе терапевтической стратегии. При подготовке данной статьи был проведен поиск и анализ полнотекстовых обзорных и оригинальных статей на русском и английском языках с использованием баз данных eLIBRARY.RU, Scopus, Web of Science, PubMed, Google Scholar. Тромбоэмболия легочной артерии представляет собой мультифакториальное заболевание, часто протекающее бессимптомным течением [17].
ТЭЛА индуцирует гемодинамические нарушения и очаговое поражение легочной ткани в виде инфаркт легкого, инфицирование которого ведет к развитию инфарктной пневмонии, что отмечено у нашей пациентки. Согласно опубликованным данным [18], обструкция более 50% сосудистого русла легких приведет к развитию шока (бледные слизистые, нитевидный пульс, симптомная артериальная гипотензия, возбуждение или заторможенность, адинамия, олигурия и т.д.), что характерно для массивной ТЭЛА. При субмассивной ТЭЛА обструкция сосудистого русла легких составляет 30-50%, у таких пациентов отмечается симптомы правожелудочковой сердечной недостаточности. Для немассивной ТЭЛА характерно менее выраженная обструкция, то есть, эмболия мелких дистальных легочных артерий [17].
Как правило, тромботические массы формируются в венозной системе, правом предсердии, а также правом желудочке. По опубликованным данным, тромботические массы наиболее частой фиксируются в бифуркациях сосудов легких [19].
Инфаркт легкого развившейся при ТЭЛА детально изложены в упомянутой работе [18].
На молекулярно-клеточном уровне, в возникновении ТЭЛА важную роль играют факторы неспецифического воспаления и эндотелиальной дисфункции [20, 21]. Во время хирургических вмешательств свертывающая система крови активизируется, так как, повреждается сосудистая стенка, и в этих местах происходит образование микротромбов. В 2018 г. “American Association for Accreditation of Ambulatory Surgery Facilities” представил отчет, где за период 2001–2011 гг. венозные тромбозы зарегистрированы в 414 случаев, из них 240 случаев составили пациенты, которым выполнялась абдоминопластика [22].
В ранее опубликованном исследовании отмечено, что круговая абдоминопластика ассоциировалась с самой высокой частотой венозной тромбоэмболии по сравнению с традиционной абдоминопластикой [23].
Исследователи К. Н. Золотухин, Ф. Крюгер и А. В. Самородов (2018) проанализировав данные 430 пациентов, госпитализированных в палату интенсивной терапии хирургического профиля, установили наличие взаимосвязи между госпитальными эпизодами тромбоза и следующими факторами: экстренное хирургическое вмешательство, заболевание периферических сосудов, развитие шока в дооперационном периоде, высокие уровни Д-димера и низкое содержание антитромбина III [24].
Многочисленные исследователи утверждают, что в общей популяции значимыми факторами риска венозных тромбозов служит более старший возраст и показатель индекса массы тела [25, 26]. В эстетической медицине дополнительными факторами риска венозных тромбозов и тромбоэмболии являются длительность процедур хирургических вмешательств.
По-видимому, пусковым фактором в развитии венозных тромбозов в пластической хирургии является дисфункция эндотелия. Как паракринный орган, эндотелий отделяет кровоток от более глубоких слоев стенки сосудов. На молекулярном уровне, эндотелий продуцирует ряд биологически активных веществ: оксид азота, эндотелин-1, ангиотензин II, простациклин, тромбоксан А, молекулы клеточной адгезии, факторы роста сосудов, натрийуретический пептид, а также фактор пролиферации сосудов [27].
При эндотелиальной дисфункции отмечается вазоконстрикция и усиливается продукция протромбогенных и провоспалительных факторов, что сопровождаются адгезией тромбоцитов и лейкоцитов с сосудистую стенку [28].
Антитромбин-III. В ряде случаев при венозном тромбозе и ее осложнениях выявляется дефицит естественных антикоагулянтов крови, таких как, антитромбин III, протеин С и протеин S. Основным источникам синтеза антитромбина III являются печень и эндотелий сосудов [29]. Согласно опубликованным данным, антитромбин является ингибитором тромбина, факторы IХа, Ха, ХIIа, калликреина, плазмина и урокиназы, которые вовлечены в процесс свертывания крови [30, 31]. Антикоагулянтное действие антитромбина III главным образом происходит через инактивацию тромбина и фактора Ха. Дефект антитромбина III проявляется при его снижении менее 60% [32, 33].
Отношение шансов венозных тромбозов по сравнению с лицами без тромбофилии составляет 16,3 [34, 35].
По литературным данным существует как качественные дефекты, так и количественные дефициты антитромбина III [32, 33].
В подтверждении этого служит тот факт, что у некоторых пациентов венозные тромбозы и ТЭЛА возникают при уровне активности антитромбина III 70%, а в ряде случаев несмотря на низкий его уровень тромбозы не развиваются [35, 36].
Целесообразно отметить, что лица с дефицитом антитромбина III относятся к группе высокого риска развития венозных тромбозов и тромбоэмболии, даже несмотря на терапевтические дозы современных антикоагулянтов [37].
По-видимому, существует дефект (домен) антитромбина III в гепарин-связывающих участках, что объясняется развитием резистентности к нефракционированным гепаринам. Пациенты, с дефицитом антитромбина III сохраняют свою уязвимость в плане развития и/или прогрессии венозных тромбозов/тромбоэмболии, а также рецидива после прекращение антикоагулянтной терапии [38].
В ранее опубликованном сообщении отмечено, что среди пациентов с венозными тромбозами и ТЭЛА дефицит антитромбина III варьирует от 3 до 8%, и по отдельным данным достигает 10% [37, 39].
Бессимптомная форма дефицита антитромбина III в основном встречается среди лиц мужского пола. Стоит отметить, что дефицит антитромбина III до сих пор остается недооцененным и недоучтенным среди всех возможных причин развития венозных тромбозов и тромбоэмболических осложнений у лиц с социально-значимыми заболеваниями.
В Таблице 1 приведены перечень клинических состояний, при котором концентрация антитромбина III изменяется.
В формировании тромботических состояний нельзя исключить также роль генетических факторов. Исследованиями последних лет установлено, что существует более 80 мутации в гене (1-я хромосома) антитромбина III, из них наиболее изученными являются мутации в гене протромбина и Лейдена [41, 42].
С-реактивный белок . По многочисленным сведениям [43-45], ведущим фактором, определяющим протромбогенный потенциал в общей популяции, является воспаление. Известно, что центральным белком острой фазы воспаления служит С-реактивный белок и ее значимое повышение может играть важную роль в развитии венозных тромбозов и тромбоэмболии. Основным источником синтеза С-реактивного белка является печень, сосудистая стенка, моноциты, макрофаги и адипоциты [46].
Таблица 1
ФАКТОРЫ, ОКАЗЫВАЮЩИЕ ВЛИЯНИЕ НА ПЛАЗМЕННЫЕ УРОВНИ АНТИТРОМБИНА III
|
Клиническое состояние / факторы |
Повышение |
Снижение |
|
Хроническое воспаление |
+ |
|
|
Дефицит витамина K (< 1 мкг на 1 кг массы тела в сутки) [40] |
+ |
|
|
Мультифокальный атеросклероз |
+ |
|
|
Хронические заболевания печени (более 6 месяцев) |
+ |
|
|
Острые заболевания печени (до 3-х месяцев) |
+ |
|
|
Прием контрацептивов и эстрогенов |
+ |
|
|
Рак поджелудочной железы |
+ |
|
|
Беременность (24–27 неделя) |
+ |
|
|
Длительные хирургические вмешательства (более 6 часов) |
+ |
|
|
Нефротический синдром (протеинурия более 3,5 г/сутки) |
+ |
|
|
Острый панкреатит |
+ |
|
|
ДВС-синдром |
+ |
|
|
Старческий возраст (75 лет и старше) |
+ |
|
|
Гепаринотерапия (более 10 суток) |
+ |
|
|
Белково-энергетическая недостаточность (ИМТ < 18,5 кг/м2) |
+ |
|
|
Преэклампсия |
+ |
|
|
Химиотерапия |
+ |
|
|
Плазмаферез |
+ |
|
|
Программный гемодиализ |
+ |
Любое механическое вмешательство в ткань человека сопровождается усилением продукции С-реактивного белка [47].
Повреждение эндотелиоцитов сосудистой стенки, что имеет место при абдоминопластики и/или липосакции провоцирует продукции С-реактивного белка, однако, спустя несколько часов после процедуры уровень данного белка снижается до референсных значений. Причины связи повышенного уровня С-реактивного белка с риском сосудистого тромбоза объясняются его взаимодействием с эндотелиоцитами, иммунными медиаторами, белками комплемента, а также активацией тромбоцитов [48].
В ряде работ были оценены роль С-реактивного белка в возникновении венозных тромбозов [49, 50].
Так, имеется прямая связь между образованием тромбоза в сосудистой стенке и ростом концентрации С-реактивного белка. При этом концентрация С-реактивного белка в сыворотке возрастает очень быстро и предсказывает развитие ТЭЛА [51].
По результатам исследование И. С. Воробьевой и соавторами показано, что С-реактивный белок обладает высокой чувствительностью и специфичностью у пациентов с тотальным эндопротезированием крупных суставов на фоне введения низкомолекулярных гепаринов. Как утверждают исследователи, концентрация С-реактивного белка в сыворотке крови может служить дополнительным показателем фактора риска возможного развития венозных тромбозов [52].
По имеющиеся данным, повышенный уровень С-реактивного белка, интерлейкина-6 и число моноцитов у лиц с избыточной массой тела и дислипидемией является признаком активации системного воспаления [53].
По нашему мнению, в пластической хирургии у пациентов из группы промежуточного и высокого риска венозных тромбозов и ТЭЛА целесообразно оценить концентрации С-реактивного белка на 3 и 7 сутки после операции. Так как, колебание уровня С-реактивного белка не только предсказывает риск венозных тромбозов, но и рецидива болевого синдрома, формирование больших гематом, сером, гигром, а также развитие синдрома острого повреждение почек.
Интерлейкин-6. Повышение сывороточного уровня интерлейкин-6 связан с патогенезом тромбозов различной локализации. Источником продукции интерлейкин-6 являются моноциты, макрофаги, адипоциты и эндотелиоциты [54].
Высвобождающийся интерлейкин-6 дополнительно усиливает активацию моноцитов и лимфоцитов, что приводит к еще большей экспрессии провоспалительных цитокинов [55].
У лиц с избыточной массой тела в условиях хронической гипергликемии регистрируется продукция интерлейкин-6 эндотелиальными клетками сосудистой стенки. С точки зрения венозной тромбоэмболии, интерлейкин-6 усиливает адгезии лейкоцитов в сосудистую стенку, что сопровождаются повышением воспалительных состояний сосудов. При этом, отмечается снижение биодоступности оксид азота и увеличение степени окислительного стресса [56].
В результате чего проницаемость эндотелия сосудов становится больше и усиливается инфильтрация сосудистой стенки циркулирующими лейкоцитами. С другой стороны, интерлейкин-6 запускает синтез ферритина и тромбоксана А2, высокие уровни которых ассоциируется с синдромом активации макрофагов и повышенной свертываемость крови [57].
Кроме того, интерлейкин-6 индуцирует избыточную реактивность тромбоцитов и адгезию их к сосудистую стенки. В формировании сосудистых тромбозов может участвовать ряд механизмов. Так, гиперпродукция активных форм кислорода вызывает окисление макромолекул, вероятно, с этим связан рекрутинг и апоптоз эндотелиальных клеток. Очевидно, что связь между тромботическими событиями и интерлейкин-6 может быть опосредована усилением миграции моноцитов и макрофагов в сосудистую стенку [58].
Это приводит к гиперкоагуляции и тромбоэмболическим осложнениям [59].
Следует отметить, что уровень интерлейкин-6 оказался предпочтительным маркером воспаления в клинических условиях из-за его постоянной связи с атеросклеротическими сердечно-сосудистыми событиями. В 2015 г. О. Ю. Килина, А. Н. Солошенко, С. Н. Иванова и А. А. Таранова представили результаты исследования уровней провоспалительных цитокинов у пациентов с ТЭЛА. Так, цитокиновый профиль пациентов ТЭЛА характеризуется высокими значениями спонтанной и митоген-индуцированной продукции интерлейкинов интерлейкин-6 и интерлейкина-8. Как отмечает исследователи, существуют положительные корреляционные взаимосвязи между уровнем воспалительных цитокинов и содержанием тропонина и натрийуретического пептида [60].
Однако, в пластической хирургии патофизиологическая роль интерлейкин-6 в возникновении нефатальных осложнений до конца не изучена.
Фактор некроза опухоли-альфа. Жировая ткань продуцирует адипонектин, ангиотензиноген, резистин, эстроген и ряд других биологических медиаторов воспаления [61, 62]. В числе воспалительных цитокинов, продуцируемое адипоцитами жировой ткани значится фактор некроза опухоли-альфа (Tumor necrosis factor alpha TNF-α). По мере увеличении индекса массы тела в жировой ткани все больше накапливаются макрофаги, а адипоциты гипертрофируются [63]. Важным является тот факт, что инфильтрированные макрофаги в жировой ткани поддерживают воспаление разной интенсивности. Различают два типа макрофагов в жировой ткани [64].
М1 фенотип представлен активированными макрофагами, которые подавляет рост и дифференцировку адипоцитов. Под влиянием агониста рецептора пероксисомального пролиферативного фактора (peroxisome proliferator activated receptor) γ (PPARγ) из М1 фенотипа макрофагов образуется М2 фенотип (противовоспалительный фенотип макрофагов) [65-67].
В 2013 г в журнале «BioMed Research International» опубликованы результаты хорошо спланированного исследования, продемонстрирующего роль инсулина и лептина в регуляции воспаление. Так, гиперинсулинемия и гиперлептинемия приводит к увеличению экспрессии макрофагами TNF-α и резистина [68].
В другом исследовании показано, что наивысшая продукция TNF-α отмечено в висцеральной жировой ткани [69].
TNF-α обладает способностью взаимодействовать с другими воспалительными цитокинами и стимулировать адгезию лейкоцитов в сосудистую стенку. Установлена роль TNF-α в регуляции липидного обмена: уменьшает распад холестерина и его выведение в составе желчных кислот, а также усиливает синтез триглицеридов [70].
Этим и объясняется присутствие гипертриглицеридемии у лиц с висцеральным ожирением. У пациентов перенесших эпизод ТЭЛА под влиянием TNF-α усиливается дисфункция эндотелия, продукция эндотелина-1 с одной стороны, а также пролиферация гладкомышечных клеток сосудов — с другой [71, 72].
TNF-α индуцирует окислительный стресс и активацию тромбоцитов, тем самым участвует в возникновении и прогрессировании легочной гипертензии [73]. TNF-α как полифункциональный цитокин может оказывать влияние на некоторые факторы риска венозных тромбозов. В частности, TNF-α усиливает синтез фибриногена в печени, индуцирует экспрессию молекул клеточной адгезии и увеличивает проницаемость эндотелия сосудов [74].
Высокие циркулирующие уровни TNF-α после эпизодов ТЭЛА рассматривается как фактор, позволяющий предсказывать развитию правожелудочковой сердечной недостаточности. Д-димер. У каждого пациента, которым выполнялась абдоминопластика и/или липосакция наблюдается увеличение хотя бы одного из следующих показателей: С-реактивный белок, фибриноген, Д-димер, интерлейкин-6, ферритин, лактатдегидрогеназа. Средние значения указанных маркеров воспаления зависит от сопутствующей патологии, способа и длительности воздействия на жировую ткань, объёмом удаленной жировой ткани, а также сроки активизации пациента. В клинической практике для диагностики венозных тромбозов используется уровень Д-димера крови. По современным данным, Д-димер является фрагментом молекулы фибрина [75].
Под действием активного плазмина из фибрина образуются димер и тример [76, 77].
В результате разрушение самого фибриногена образуются мономерные Д и Е домены фибрина. Основное диагностическое значение Д-димера заключается в исключении наличия венозных тромбозов при дифференциальной диагностике тромбоза глубоких вен, ТЭЛА и другой тромботической патологии [78, 79].
Следует отметить, что в ряде случаев, концентрация Д-димера крови может повышаться и в отсутствии венозных тромбозов [79].
В частности, повышенные уровни Д-димера могут отмечаться у лиц после фибринолитической терапии, обширной травме или хирургии, диссеминированном внутрисосудистом свертывании, трансмуральном инфаркте миокарда, в период дестабилизации атеросклероза, тяжелых инфекциях, декомпенсированном циррозе печени, злокачественных опухолях, а также во время беременности и в пожилом возрасте [80, 81].
Повышенные уровни Д-димера крови могут наблюдаться также при снижении экскреторной функции почек, а также при повышение уровня фибриногена крови и т.д. [82].
В ранее опубликованных исследованиях отмечено, что повышения Д-димера у пациентов на ранних сроках после хирургического закрытия перфорации перегородки носа свидетельствует о развитии микротромбозов в сосудах мукоперихондральных (периостальных) лоскутов и требует специфической медикаментозной профилактики низкомолекулярными гепаринами [83].
Необходимо помнить, что пациенты с повышенным уровнем Д-димера нуждаются в тщательном инструментальном обследовании для подтверждения или исключения венозных тромбозов. Таким образом, основное диагностическое значение Д-димера это исключение наличия венозных тромбозов при дифференциальной диагностике тромбоза глубоких вен, ТЭЛА и другой тромботической патологии [84].
Ферритин. По современным данным, ферритин является железосодержащим белком и служит одним из лабораторных маркеров, отражающее запасы общей железы в организме [85]. В физиологических условиях примерно 80% сывороточного ферритина гликозилируется в результате высвобождения из макрофагов и гепатоцитов [86].
Отдельными исследователями установлено, что ферритин секретируется макрофагами [87].
В результате повреждения тканей образуются повышенные уровни негликозилированного ферритина. Имеется свидетельство, что между концентрацией ферритина и уровнем С-реактивного белка обнаружена прямая взаимосвязь [88].
Так, в когортном исследовании продемонстрировано, что высокие сывороточные уровни ферритина ассоциируется с увеличением частоты летальных исходов [89].
Высокий уровень ферритина предсказывает риск сосудистого тромбоза и эмболических осложнений. Сывороточный уровень ферритина > 400 нг/мл рассматривается как гиперферритинемия. У большинства пациентов с венозными тромбоэмболиями наблюдается гиперферритинемия. Как отмечают исследователи, гиперферритинемия запускает избыточную продукцию провоспалительных цитокинов (интерлейкин-6, интерлейкин-2, интерлейкин-12) и повышает риск сосудистых тромбозов [90–92].
Жировая эмболия легких. Адипоциты жировой ткани могут вызвать нетромботическую эмболию легочных артерий [93].
В пластической хирургии риск жировой эмболии легких возрастает при абдоминопластики и (или) липосакции. Факторами, ассоциированные с жировой эмболией легких являются длительность хирургических процедур (≥6 часов), морбидное ожирение, жировая инфильтрация печени умеренной и высокой степени активности, гиперхолестеринемия, гипертриглицеридемия, гипоальбуминемия, повышенные уровни С-реактивного белка, мочевой кислоты и т.д. Важно помнить, что при механической липосакции на ткань оказывает влияние только одна энергия, то есть, энергия рук оперирующего хирурга. Как утверждают исследователи, жировые частицы размером 7–14 микрон могут вызвать закупорку капилляров или мелких артериол [94]. В таких случаях, микроэмболы не всегда могут обнаруживаться при компьютерной томографии легких. Попадание разрушенной жировой ткани в сосудистое русло является одним из важных факторов, способствующие развитию фатальных и нефатальных осложнений после абдоминопластики и/или липосакции. Нужно помнить, частота жировой эмболии легких при стандартной липосакции значимо выше. Тогда как, при тумесцентной и ультразвуковой липосакции вероятность развития жировой эмболии легких довольно низкая. В недавно опубликованной работе, сообщалось случай жировой эмболии у 26-летней женщины проявляющиеся респираторными и церебральными расстройствами после абдоминопластики и липосакции [95].
В 2022 г. известное издание «Plastic and Aesthetic Nursing» опубликовал случай развитие нефатальной жировой эмболии легочной артерии у 37-летней пациентки, которой выполнялась липосакция на груди и брюшной полости. После 6 часовой процедуры липосакции у пациента отмечалось умеренная одышка, снижение уровня сатурации кислорода, чувство стеснения в груди и утомляемость, по поводу чего на 3-е сутки было проведена компьютерная томография, где выявлена картина жировой эмболии сосудов легких [96].
Примечательно, что адекватная антикоагулянтная терапия привело к полному регрессу симптомов жировой эмболии легких практически на 7-е сутки. В литературе имеется свидетельство, что после аутологичной инъекции жира в область мягких тканей лица, пациенты страдали от острой потери зрения или инфаркта головного мозга [97].
Исследователи связывают возникновение таких осложнений с жировой эмболией сосудов глаз и головного мозга [98, 99].
Так как, область лица имеет развитую сосудистую сеть, а также локальное повышение давления в задействованном участке при операции. Частицы жира достигают глазные и мозговые артерии через ветви каротидных артерии после инъекции в лицевые сосуды [97].
Безусловно, для минимизации риска таких осложнений жировые иньекции проводит медленно с максимально низкой возможной силой.
Как отмечено в аналитическом исследовании Н. Т. Ватутина при жировой эмболии вовлечение легких в патологический процесс происходит в результате закупорки сосудистого русла, а также вследствие продукции биологически активных субстанций (тромбопластин, свободные жирные кислоты) [100].
По современным данным, в развитии повреждения легких, то есть, респираторного дистресс синдрома принимают участие воспалительные цитокины, такие как интерлейкин-6, фактор некроза опухолей альфа и интерлейкин-5. Экспрессия воспалительных цитокинов и свободных жирных кислот провоцирует дисфункцию эндотелия сосудов малого круга кровообращения [101].
Клиническое проявление складываются из сердцебиения, чувство дискомфорта и/или боли в грудной клетке без четкой локализации, сухой короткий кашель, одышку, усиливающиеся при горизонтальном положении, умеренный диффузный цианоз, иногда кровохарканье [102].
Развитие синкопальных состояний свидетельствуют об закупорке крупных легочных артерий. При типичном течении жировой эмболии легочной артерии через 8 - 12 ч после абдоминопластики и/или липосакции наблюдается изменение периодичности дыхания (возможно гиперсатурация), сердцебиение, сухой короткий кашель, когнитивное расстройство, мелкоточечные (петехиальная) высыпание на коже, особенно на спине [103, 104].
На ЭКГ признаки нарушение проводимости по ветвям правой ножки пучка Гиса, наджелудочковые экстрасистолии, перегрузка правых отделов сердца, умеренное повышение давления в легочной артерии в покое. На рентгенографии при жировой эмболии мелких артерий выявляется инфаркт легкого. Необходимо отметить, что при закупорке крупных артерий инфаркты легких может не развиваться из-за существующих бронхиальных анастомозов. При жировой эмболии легких, особенно субмассивном течении в результате пропитывание форменных элементов крови из бронхиальных артерий формируется развитие клиновидной консолидации. Участки консолидации легочной ткани, изменение по типу матовой стекло хорошо обнаруживается на компьютерной томографии. В продвинутых стадиях жировой эмболии легких после процедур липосакции (через 24-48 ч) на компьютерной томографии можно увидеть мелкие, невыраженные центролобулярные очаги [105, 106].
Появление кальцификации ветвей легочной артерии отмечается как правило, на поздних стадиях жировой эмболии. В периферическом анализе крови эозинофилия, умеренное снижение числа лимфоцитов, а также повышение активности сывороточного уровня лактатдегидрогеназы (преимущественно 3 класс), фактора роста эндотелия сосудов. Возможно, жировые частички могут быть обнаружены бронхоальвеолярном лаваже, и спинномозговой жидкости [107].
Согласно опубликованным данным зарубежных исследователей [108], для диагностики жировой эмболии потребуется сочетание один из трех больших критериев: респираторный дистресс синдром; мозговые нарушения (не связанные с травмой); петехиальная сыпь на передней поверхности шеи, груди или слизистых оболочках. В ряде случаев, петехиальная сыпь наблюдается в подмышечных впадинах, на конъюнктиве, в ротовой полости. Как правило, петехиальная сыпь проходит в течение одной недели. В качестве малых критериев жировой эмболии используется показатель частоты сердечных сокращений более 80 в минуту в покое, повышение температуры тела (более 38,01о С), изменения в глазном дне, уменьшение объема выделяемой мочи менее 800 мл за последние сутки, обнаружение жировых капель в моче. У таких пациентов в периферическом анализе крови отмечается значимое снижение концентрации гемоглобина, числа тромбоцитов, повышение скорости оседание эритроцитов. Таким образом, абдоминопластика и липосакция являются не безопасным методом воздействия на ткань человека [109, 110].
В определенных клинических ситуациях у пациента после абдоминопластики и липосакции возникает жировая эмболия легких, которая может оставаться незамеченной, а клинические проявления могут быть неправильно интерпретированы.
Терапевтические стратегии и подходы к профилактике венозных тромбозов и ТЭЛА.
Эксперты European Society of Cardiology рекомендуют ориентироваться на следующие маркеры венозных тромбозов и ТЭЛА: клинические маркеры; маркеры дисфункции правого желудочка; маркёры повреждения миокарда [111].
Таким образом, уже при быстром обследовании у постели пациента можно определить, относится пациент к группе высокого риска ранней смерти или нет [60, 112, 113].
Существующие к настоящему времени различные шкалы для оценки риска венозных тромбозов и ТЭЛА в пластической хирургии нуждаются в дополнении с учетом особенности места проживания пациента, типа нарушения жирового обмена, характером сопутствующих заболеваний, а также фенотипом воспаление при избыточной массе тела и ожирении. Ранее исследователи C. J. Pannucci и соавторы проводили оценку прогностической значимости моделей риска Caprini Risk Score 2005 (Таблица.2) и 2010 гг. в возникновении венозных тромбозов и ТЭЛА. Установлено, что модель оценки Caprini Risk Score 2005 г является более подходящим в стратификации риска периоперационной венозной тромбоэмболии у пациентов пластической хирургии [114].
Таблица 2
ШКАЛА РИСКА ВЕНОЗНОЙ ТРОМБОЭМБОЛИИ [114]
|
Группа риска |
Баллы |
Частота, % |
Факторы |
|
Низкий |
≤ 2 |
36,8 |
|
|
Умеренный |
3–4 |
47,2 |
Возраст старше 40 и 60 лет, избыточный вес, ожирение, |
|
Высокий |
5–6 |
14,4 |
заместительная гормональная терапия или прием оральных гормональных контрацептивов, варикозное расширение вен нижних конечностей, длительность операций и постельный режим в течение суток после омолаживающих операций на лице или после абдоминопластики. |
|
Очень |
> 8 |
1,6 |
Реконструкция молочной железы после мастэктомии, а также |
|
высокий |
комбинированные пластические и лапароскопические (хирургия, гинекология) операции, или пластические и ортопедические (реконструкция стоп) операции. |
В большинстве случаев профилактика венозных тромбозов ограничиваются механическими способами. В частности, интер- и послеоперационном периоде используется пневмокомпрессия и компрессионные чулки, а также венозные ножные насосы. Указанные меры профилактики считается оправданным проводит лицам с высоким риском развития кровотечений. У лиц из группы умеренного и высокого риска венозных тромбозов до операции и в раннем послеоперационном периоде использование низкомолекулярных гепаринов (эноксапарин натрия 40 мг в сутки) в качестве профилактики считается оправданным. Нужно отметить, что низкомолекулярным гепаринам свойственно выраженный антикоагулянтный и противовоспалительный эффект. Последний объясняется снижением продукции фактора Виллебранда из эндотелия сосудов в системный кровоток, а также быстрым снижением концентрации С-реактивного белка. Как указано в публикациях [115–118], низкомолекулярные гепарины обладают противовоспалительным эффектом и способны подавлять экспрессию воспалительных цитокинов. В ряде работ исследователи применили допустимую профилактическую дозу низкомолекулярного гепарина 1 раз в сутки подкожно, за 2 часа до оперативного вмешательства. Примечательно, что не отмечена повышенная кровоточивость тканей как во время операции, так и на дальнейших этапах проводимого лечения [83].
Во многих исследованиях были оценены безопасность и эффективность применения низкомолекулярных гепаринов (надропарин кальция 1,0 = 9500 МЕ анти-Ха, дальтепарин натрия 0,2 = 2500 анти-Ха МЕ, эноксапарин натрия 10 тыс анти-Xa МЕ, 100 мг) для профилактики послеоперационного тромбоэмболического осложнения. Стоит отметит, что в клинической практике без каких-либо лабораторного контроля с профилактической целью можно использовать низкомолекулярные гепарины, в среднем 7–10 дней. Низкомолекулярные гепарины имеют более длительный биологический период полураспада. Наряду с этим, при использовании низкомолекулярных гепаринов отмечается наименьший риск кровотечение и тромбоцитопения по сравнению с нефракционированным гепарином [119, 120].
Антитромботический эффект низкомолекулярных гепаринов прежде всего зависит от их влияния на фактор Х [83].
С практической точки зрения следует подчеркнуть, что к низкомолекулярным гепаринам свойственны выраженная антитромботическая активность, а также представители этой группы препаратов не вызывает антитромбиновый эффект, следовательно, риск гипокоагуляции минимален. Тогда как, при использовании нефракционированного гепарина часто регистрируется зуд, высокий риск тромбоцитопении и геморрагических осложнений, судороги и остеопороз [83].
Профилактика венозных тромбозов и ТЭЛА осложнений проводится на разных этапах хирургического лечения. Отдельные исследователи подчеркивают, что для пациентов пластической хирургии рекомендуются при проведении любой процедуры, которая длится более 1 часа, а также для всех больных, получающих общую анестезию. Использование низкомолекулярных гепаринов должно начинаться за 30–60 минут до операции [97].
При этом, использование антикоагулятных препаратов, препятствующих формированию нерастворимых тромбов, сопряжено с высоким риском геморрагических осложнений. Способность удержать баланс между полезными и побочными эффектами антитромботических препаратов зависит преимущественно от искусства врача, его умения управлять действием этих лекарственных средств [83].
Заместительная гормональная терапия у женщин, снижение мышечного тонуса, гиподинамия, хроническая гипергомоцистеинемия, повышенные уровни фибриногена, фактора VII и фактора VIII являются значимыми факторами риска венозных тромбозов. Важно помнить, что в ответ на тканевую травму у человека ангиогенез начинается на 4-е сутки после повреждения [121].
В реконструктивно-пластической хирургии сосудистые тромбозы подразделяются на ранние (2-3-е сутки после операции) и поздние (4-11-е сутки после операции) [121].
По данным литературы, длительное увеличение концентрации фибриногена, С-реактивного белка и Д-димера крови, свидетельствует о наличии воспалительно-гиперкоагуляционного процесса, приводящего к тромбообразованию [83].
В клинической медицине исследование уровня Д-димера используется для оценки терапевтической эффективности антикоагулянтной терапии [122].
Так, повышенный уровень Д-димера у пациентов после прекращения антикоагулянтной терапии связан с высоким риском рецидивов венозной тромбоэмболии. Пациенты с устойчиво негативным Д-димером при серийных измерениях после прекращения стандартной терапии имеют низкий риск рецидивов и для них антикоагулянтная терапия может быть отменена [84].
Встреча пациента с врачом-анестезиологом перед процедурой касается не только согласования метода обезболивания, обоснование необходимости нормоволемической гемодилюции, назначения нефракционированного гепарина, но и разъяснений необходимости инвазивного мониторинга центрального венозного давления, оставления на послеоперационный период катетеров для внутривенных инфузий растворов и послеоперационного пролонгированного проводникового обезболивания. Удалить, создавать, формировать и восстанавливать эти главные компетенции пластических хирургов нередко порождает неоднократное тяжелые душевные переживания в связи с возможными послеоперационными осложнениями. Пациенты пластических хирургов представляют различные возрастные, половые и психологические группы. Такие факторы, как старение населения, наличие сопутствующих (коморбидных) заболеваний и избыточный вес существенно повышают риски венозных тромбозов и ТЭЛА. Именно поэтому в пластической хирургии важен тщательный отбор пациентов с учетом комплексной оценки их состояния здоровья, а также необходимы глубокие знания по вопросам нехирургических и хирургических процедур коррекции нефатальных осложнений.
Общеизвестно, что законы раневого процесса в большинстве случаев носят универсальный характер и не всегда можно добиться качественной тканевой репарации [83, 123, 124].
Искусство выполнения абдоминопластики и/или липосакции базируется на многолетнем опыте хирурга и подкрепленном знанием пластической хирургии. Но результат хирургического вмешательство напрямую зависит не только от возможности регулирования заживления, но и устранения нефатальных и фатальных осложнений. Важным аспектом успешной эстетической операции являются подробно оговоренные с пациентом особенности оперативного вмешательства и послеоперационного ухода [121].
Выводы. Венозные тромбозы и ТЭЛА развившегося после абдоминопластики и/или липосакции носит жизнеугрожающий характер и протекает системным воспалением. В пластической хирургии способствующими факторами венозных тромбозов и ТЭЛА являются, длительность оперативного вмешательства, объём удаленного жира, поздняя активация пациента, гипогидратация и снижение сатурации кислорода периферической крови (<90% в покое), ожирение. Целесообразным является тот факт, что всех пациентов, которым планируется процедура эстетической хирургии следует тщательно собрать анамнез (курение в прошлом или в настоящее время, прием нестероидных противовоспалительных препаратов, гормональных контрацептивов и эстрогенов, а также направлять на исследование сывороточного уровня антитромбина-III, С-реактивного белка, интерлейкина-6, фактор некроза опухолей — альфа, ферритина, фибриногена, цистатина С, волчаночного антикоагулянта и антикардиолипиновые антитела (у женщин с отягощенным акушерским анамнезом). Только индивидуальный подход, тщательное мониторирование свертывающей системы крови, Д-димера, С-реактивного белка у пациентов с венозными тромбозами и эмболическими событиями, своевременное и грамотное проведение антикоагулянтной терапии позволяет существенно улучшить исходы абдоминопластики/липосакции и избежать фатальных последствий. Информированное согласие. От пациента было получено письменное добровольное информированное согласие на публикацию описания клинического случая, результатов его обследования и лечения, а также ее изображений в медицинском журнале, включая его электронную версию (дата подписания 8.01.2024 г.).
Вклад авторов. И. Т. Муркамилов – написание текста статьи; Д. С. Ыманкулов – пластический хирург, курация пациента, обзор литературы; З. Р. Райимжанов, З. Ф. Юсупова, Т. Ф. Юсупова – обзор литературы; И. Т. Муркамилов, Ф. А. Юсупов – исправление текста рукописи; утверждение окончательного варианта статьи – все авторы.
Авторский коллектив выражает особую благодарность Хакимову Шавкату Шукурбековичу, заведующему отделением анестезиологии и реанимации многопрофильного медицинского центра «Life Hospital» и Конокбекову Мамбету Нурлановичу, клиническому ординатору 3-го года обучения кафедры пластической и реконструктивной микрохирургии имени М.А. Матеева Кыргызской государственной медицинской академии имени И.К. Ахунбаева, за их нелегкий труд и плодотворное сотрудничество, в результате которого были созданы предпосылки для появления на свет настоящей работы.
Список литературы Венозные тромбозы и тромбоэмболия легочных артерий в пластической хирургии: факторы риска, варианты течения и терапевтические стратегии
- Wo L. M., Garcia O. Ultrasound-Assisted Lipoplasty // Clinics in Plastic Surgery. 2024. V. 51. №1. P. 13-28. https://doi.org/10.1016/j.cps.2023.07.005
- De La Cruz E. Lipoplasty in the Overweight Patient // Clinics in Plastic Surgery. 2024. V. 51. №1. P. 29-43. https://doi.org/10.1016/j.cps.2023.06.010
- Saldanha O., Saldanha Filho O., Saldanha C. B., Mokarzel K. L., Borges A. C. M., Bonilla E. A. M. Lipoabdominoplasty with Anatomical Definition: Update //Clinics in Plastic Surgery. 2024. V. 51. №1. P. 45-57. https://doi.org/10.1016/j.cps.2023.06.011
- Han C. H., Li J., Lin X., Park J. H. Comprehensive Assessment of Lower-Face Volume Reduction Using Laser-Assisted Liposuction as an Additive Procedure in Asian Rhytidectomy // Facial Plastic Surgery. 2023. https://doi.org/10.1055/s-0043-1761272
- Illouz Y. G. Complications of liposuction // Clinics in plastic surgery. 2006. V. 33. №1. P. 129-163. https://doi.org/10.1016/j.cps.2005.10.001
- ElAbd R., AlMojel M., AlSabah S., AlRashid A., AlNesf M., Alhallabi B., Burezq H. Complications post abdominoplasty after surgical versus non-surgical massive weight loss: a comparative study // Obesity Surgery. 2022. V. 32. №12. P. 3847-3853. https://doi.org/10.1007/s11695-022-06309-0
- Kalmar C. L., Park B. C., Kassis S., Higdon K. K., Perdikis G. Functional panniculectomy vs cosmetic abdominoplasty: Multicenter analysis of risk factors and complications // Journal of Plastic, Reconstructive & Aesthetic Surgery. 2022. V. 75. №9. P. 3541-3550. https://doi.org/10.1016/j.bjps.2022.04.057
- Матафонова В. А., Школа В. А. Эстетическая хирургия: ошибки, опасности, осложнения // Молодежь XXI века: шаг в будущее. 2018. С. 182-184.
- Fedullo P. F., Tapson V. F. The evaluation of suspected pulmonary embolism // New England Journal of Medicine. 2003. V. 349. №13. P. 1247-1256. https://doi.org/10.1056/NEJMcp035442
- Савельев В. С. Роль хирурга в профилактике и лечении венозного тромбоза и легочной эмболии. 50 лекций по хирургии. М.: Медиа Медика. 2003. С. 92-99.
- Ягода А. В. Тромбоэмболия легочной артерии // Медицинский вестник Северного Кавказа. 2006. Т. 2. №2. С. 62-75.
- Goldhaber S. Z., Visani L., De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER) // The Lancet. 1999. V. 353. №9162. P. 1386-1389. https://doi.org/10.1016/s0140-6736(98)07534-5
- Konstantinides S. V. et al. Management of pulmonary embolism: an update // Journal of the American College of Cardiology. 2016. V. 67. №8. P. 976-990.. doi:org/10.1016/j.jacc.2015.11.061
- Малышенко Е. С., Попов В. А., Хаес Б. Л., Шукевич Д. Л., Плотников Г. П., Херасков В. Ю., Барбараш Л. С. Алгоритм интенсивного лечения острых тромбоэмболий легочной артерии: акцент на инвазивность // Комплексные проблемы сердечно-сосудистых заболеваний. 2015. №1. С. 71-77.
- Eknoyan G., Lameire N., Eckardt K., Kasiske B., Wheeler D., Levin A., Coresh J. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease // Kidney int. 2013. V. 3. №1. P. 5-14.
- Lang R. M., Bierig M., Devereux R. B., Flachskampf F. A., Foster E., Pellikka P. A., Stewart W. J.Recommendations for chamber quantification: a report from the American Society of Echocardiography’s Guidelines and Standards Committee and the Chamber Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology // Journal of the American society of echocardiography. 2005. V. 18. №12. P. 1440-1463. https://doi.org/10.1016/j.echo.2005.10.005
- Tapson V. F. Acute pulmonary embolism // Cardiology clinics. 2004. V. 22. №3. P. 353-365. https://doi.org/10.1016/j.ccl.2004.04.002
- Бачурина М. А., Мазур В. В., Мазур Е. С. Уровень обструкции сосудистого русла при тромбоэмболии легочной артерии и риск развития инфаркта легкого // Пульмонология. 2019. Т. 29. №6. С. 673-678. https://doi.org/10.18093/0869-0189-2019-29-6-673-678
- Чуянова А. А., Понасенко А. В. Ассоциация полиморфизмов генов селектинов и эндотелина-1 с развитием тромбоэмболии легочной артерии // Сибирское медицинское обозрение. 2018. №4 (112). С. 5-12. https://doi.org/10.20333/2500136-2018-4-5-12
- Yang J., Xu J., Xu S., Fan Z., Zhu C., Wan J., Xing X. Oxidative stress in acute pulmonary embolism: emerging roles and therapeutic implications // Thrombosis Journal. 2024. V. 22. №1. P. 9. https://doi.org/10.1186/s12959-023-00577
- Sun L. L., Liu Z., Ran F., Huang D., Zhang M., Li X. Q., Li W. D. Non-coding RNAs regulating endothelial progenitor cells for venous thrombosis: promising therapy and innovation // Stem Cell Research & Therapy. 2024. V. 15. №1. P. 7. https://doi.org/10.1186/s13287-023-03621-z
- Keyes G. R., Singer R., Iverson R. E., Nahai F. Incidence and predictors of venous thromboembolism in abdominoplasty // Aesthetic surgery journal. 2018. V. 38. №2. P. 162-173.https://doi.org/10.1093/asj/sjx154
- Hatef D. A., Trussler A. P., Kenkel J. M. Procedural risk for venous thromboembolism in abdominal contouring surgery: a systematic review of the literature // Plastic and reconstructive surgery. 2010. V. 125. №1. P. 352-362. https://doi.org/10.1097/PRS.0b013e3181c2a3b4
- Золотухин К. Н., Крюгер Ф., Самородов А. В. Низкий уровень антитромбина III как предиктор развития тромботических осложнений у пациентов хирургического профиля // Креативная хирургия и онкология. 2018. №1. С. 52-56. https://doi.org/10.24060/2076-3093-2018-8-1-52-56
- Khan F., Tritschler T., Kahn S. R., Rodger M. A. Venous thromboembolism // The lancet. 2021. V. 398. №10294. P. 64-77. https://doi.org/10.1016/S0140-6736(20)32658-1
- Pastori D., Cormaci V. M., Marucci S., Franchino G., Del Sole F., Capozza A., Pignatelli P. A comprehensive review of risk factors for venous thromboembolism: from epidemiology to pathophysiology // International Journal of Molecular Sciences. 2023. V. 24. №4. P. 3169. https://doi.org/10.3390/ijms24043169
- Godo S., Shimokawa H. Endothelial functions // Arteriosclerosis, thrombosis, and vascular biology. 2017. V. 37. №9. P. e108-e114. https://doi.org/10.1161/ATVBAHA.117.309813
- Wu Z. et al. Rhogef17: A novel target for endothelial barrier function //Biomedicine & Pharmacotherapy. 2024. V. 170. P. 115983. https://doi.org/10.1016/j.biopha.2023.115983
- Green R. A. Pathophysiology of antithrombin III deficiency // Veterinary Clinics of North America: Small Animal Practice. 1988. V. 18. №1. P. 95-104.https://doi.org/10.1016/s0195-5616(88)50010-4
- Морозов Ю. А. Антитромбин III и эффективность традиционной антитромботической терапии // Тромбоз, гемостаз и реология. 2012. №4. С. 28-32.
- Sungurlu S., Kuppy J., Balk R. A. Role of antithrombin III and tissue factor pathway in the pathogenesis of sepsis // Critical care clinics. 2020. V. 36. №2. P. 255-265. https://doi.org/10.1016/j.ccc.2019.12.002
- Baiges A., de la Morena-Barrio M. E., Turon F., Miñano A., Alberto Ferrusquía J., Magaz M., García-Pagán J. C. Congenital antithrombin deficiency in patients with splanchnic vein thrombosis // Liver International. 2020. V. 40. №5. P. 1168-1177.https://doi.org/10.1111/liv.14342
- Smith N. Antithrombin deficiency: a pediatric disorder // Thrombosis Research. 2021. V. 202. P. 45-51. https://doi.org/10.1016/j.thromres.2021.02.029
- Di Minno M. N. D. et al. Natural anticoagulants deficiency and the risk of venous thromboembolism: a meta-analysis of observational studies // Thrombosis research. 2015. V. 135. №5. P. 923-932.https://doi.org/10.1016/j.thromres.2015.03.010
- Долгушина В. Ф., Вереина Н. К., Чулков В. С. Диагностическая и лечебная тактика при акушерских осложнениях, ассоциированных с тромбофилией. Челябинск, 2015.
- Бузян Л. О., Чулков В. С. Транзиторный дефицит антитромбина во время беременности у женщины с репродуктивными потерями в анамнезе // Акушерство, гинекология и репродукция. 2018. Т. 12. №2. С. 62-67. https://doi.org/10.17749/2313-7347.2018.12.2.062-067
- Акиньшина С. В., Генина П. К., Бицадзе В. О. Ведение беременности при дефиците антитромбина III: обзор литературы и описание клинического случая // Акушерство, Гинекология и Репродукция. 2021. V. 15. №4. C. 441-450. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.230
- Кирсанова Т. В., Виноградова М. А., Клименченко Н. И. Врожденный дефицит антитромбина III и беременность: описание различных вариантов ведения беременностей согласно международным данным // Акушерство и гинекология. 2019. №1. С. 171-177. https://doi.org/10.18565/aig.2019.1.171-177
- James A. H., Jamison M. G., Brancazio L. R., Myers E. R. Venous thromboembolism during pregnancy and the postpartum period: incidence, risk factors, and mortality // American journal of obstetrics and gynecology. 2006. V. 194. №5. P. 1311-1315. https://doi.org/10.1016/j.ajog.2005.11.008
- Елисеева Т., Мироненко А. Витамин К–описание, польза, влияние на организм и лучшие источники // Журнал здорового питания и диетологии. 2019. Т. 3. №9. С. 68-79.
- Li M., Jiang S., Liu S., Jin Y., Wang M. Analysis of phenotype and gene mutation in three pedigrees with inherited antithrombin deficiency // Journal of Clinical Laboratory Analysis. 2022. V. 36. №11. P. e24732. https://doi.org/10.1002/jcla.24732
- Crunkhorn S. Gene editing addresses antithrombin deficiency // Nature reviews. Drug Discovery. 2023. https://doi.org/10.1038/d41573-023-00008-w
- Dix C., Zeller J., Stevens H., Eisenhardt S. U., Shing K. S., Nero T. L., McFadyen J. D. Creactive protein, immunothrombosis and venous thromboembolism // Frontiers in immunology. 2022. V. 13. P. 1002652. https://doi.org/10.3389/fimmu.2022.1002652
- Horvei L. D., Grimnes G., Hindberg K., Mathiesen E. B., Njølstad I., Wilsgaard T., Hansen J. B. C‐reactive protein, obesity, and the risk of arterial and venous thrombosis // Journal of Thrombosis and Haemostasis. 2016. V. 14. №8. P. 1561-1571.https://doi.org/10.1111/jth.13369
- Pandolfi A. C-reactive protein: A potential new molecular link between inflammation, thrombosis and vascular cell proliferation? // Cardiovascular research. 2005. V. 68. №1. P. 3-4. https://doi.org/10.1016/j.cardiores.2005.07.019
- Gui X. Y., Rabkin S. W. C-Reactive Protein, Interleukin-6, Trimethylamine-N-Oxide, Syndecan-1, Nitric Oxide, and Tumor Necrosis Factor Receptor-1 in Heart Failure with Preserved Versus Reduced Ejection Fraction: a Meta-Analysis // Current Heart Failure Reports. 2023. V. 20. №1. P. 1-11. https://doi.org/10.1007/s11897-022-00584-9
- Villard M. A., Helm M. C., Kindel T. L., Goldblatt M. I., Gould J. C., Higgins R. M. C-Reactive protein as a predictor of post-operative complications in bariatric surgery patients // Surgical Endoscopy. 2019. V. 33. P. 2479-2484. https://doi.org/10.1007/s00464-018-6534-0
- Eisenhardt S. U., Habersberger J., Murphy A., Chen Y. C., Woollard K. J., Bassler N., Peter K. Dissociation of pentameric to monomeric C-reactive protein on activated platelets localizes inflammation to atherosclerotic plaques // Circulation research. 2009. V. 105. №2. P. 128-137. https://doi.org/10.1161/CIRCRESAHA.108.190611
- Huang Y., Li L. C., Li Y. X., Yang L. H., Gui C. Development and validation of a risk model for intracardiac thrombosis in patients with dilated cardiomyopathy: a retrospective study // Scientific Reports. 2024. V. 14. №1. P. 1431. https://doi.org/10.1038/s41598-024-51745-w
- Zanetto A., Pelizzaro F., Campello E., Bulato C., Balcar L., Gu W., Senzolo M. Severity of systemic inflammation is the main predictor of ACLF and bleeding in individuals with acutely decompensated cirrhosis // Journal of Hepatology. 2023. V. 78. №2. P. 301-311. https://doi.org/10.1016/j.jhep.2022.09.005.
- Вельков В. В. С-реактивный белок-структура, функция, методы определения, клиническая значимость // Лабораторная медицина. 2006. Т. 8. С. 48-54.
- Воробьева И. С. Информативность С-реактивного белка сыворотки крови у больных травматолого-ортопедического профиля на фоне введения низкомолекулярных гепаринов // Врач-аспирант. 2015. Т. 69. №2.1. С. 182-187.
- Хайбуллина З. Р. и др. Биомаркеры системного воспаления и динамика липидного профиля при различной степени ожирения // Universum: медицина и фармакология. 2015. №12 (23).
- Sehgal P. B. Interleukin-6: molecular pathophysiology // Journal of Investigative Dermatology. 1990. V. 94. №6. P. s2-s6.https://doi.org/10.1111/1523-1747.ep12874963
- Papastamos C., Antonopoulos A. S., Simantiris S., Koumallos N., Sagris M., Theofilis P., Tousoulis D. Interleukin-6 signaling in atherosclerosis: from molecular mechanisms to clinical outcomes // Current Topics in Medicinal Chemistry. 2023. V. 23. №22. P. 2172-2183. https://doi.org/10.2174/1568026623666230718141235
- Han F., Li S., Yang Y., Bai Z. Interleukin-6 promotes ferroptosis in bronchial epithelial cells by inducing reactive oxygen species-dependent lipid peroxidation and disrupting iron homeostasis // Bioengineered. 2021. V. 12. №1. P. 5279-5288.. https://doi.org/10.1080/21655979.2021.1964158
- Шатохин Ю. В., Снежко И. В., Рябикина Е. В. Нарушение гемостаза при коронавирусной инфекции // Южно-Российский журнал терапевтической практики. 2021. Т. 2. №2. С. 6-15. https://doi.org/10.21886/2712-8156-2021-2-2-6-15
- Адашева Т. В., Саморукова Е.И., Губернаторова Е.Е. Синдром длительного COVID- 19 и эндотелиопатия: патофизиологические механизмы и терапевтические стратегии // Терапия. 2022. Т. 3. №55. С.:101-108. https://doi.org/10.18565/therapy.2022.3.101-108
- Salemi R., Gattuso G., Tomasello B., Lavoro A., Gaudio A., Libra M., Candido S. Cooccurrence of interleukin-6 receptor Asp358Ala variant and high plasma levels of IL-6: an evidence of IL-6 trans-signaling activation in deep vein thrombosis (DVT) patients // Biomolecules. 2022. V. 12. №5. P. 681. https://doi.org/10.3390/biom12050681
- Килина О. Ю., Солошенко А. Н., Иванова С. Н., Таранова А. А. Цитокиновый профиль у пациентов с тромбоэмболией лёгочной артерии // Вестник Хакасского государственного университета им. НФ Катанова. 2015. №12. С. 45-50.
- Kawai T., Autieri M. V., Scalia R. Adipose tissue inflammation and metabolic dysfunction in obesity // American Journal of Physiology-Cell Physiology. 2021. V. 320. №3. P. C375-C391. https://doi.org/10.1152/ajpcell.00379.2020.
- Kojta I., Chacińska M., Błachnio-Zabielska A. Obesity, bioactive lipids, and adipose tissue inflammation in insulin resistance // Nutrients. 2020. V. 12. №5. P. 1305. https://doi.org/10.3390/nu12051305
- De Baat A., Trinh B., Ellingsgaard H., Donath M. Y. Physiological role of cytokines in the regulation of mammalian metabolism // Trends in Immunology. 2023. https://doi.org/10.1016/j.it.2023.06.002
- Li X., Ren Y., Chang K., Wu W., Griffiths H. R., Lu S., Gao D. Adipose tissue macrophages as potential targets for obesity and metabolic diseases // Frontiers in Immunology. 2023. V. 14. P. 1153915. https://doi.org/10.3389/fimmu.2023.1153915
- Russo L., Lumeng C. N. Properties and functions of adipose tissue macrophages in obesity // Immunology. 2018. V. 155. №4. P. 407-417. https://doi.org/10.1111/imm.13002
- Cipolletta D., Feuerer M., Li A., Kamei N., Lee J., Shoelson S. E., Mathis D. PPAR-γ is a major driver of the accumulation and phenotype of adipose tissue Treg cells // Nature. 2012. V. 486. №7404. P. 549-553. https://doi.org/10.1038/nature11132
- Cheng P., Xie X., Hu L., Zhou W., Mi B., Xiong Y., Zhang Y. Hypoxia endothelial cellsderived exosomes facilitate diabetic wound healing through improving endothelial cell function and promoting M2 macrophages polarization // Bioactive Materials. 2024. V. 33. P. 157-173.. https://doi.org/10.1016/j.bioactmat.2023.10.020
- Tsiotra P. C., Boutati E., Dimitriadis G., Raptis S. A. High insulin and leptin increase resistin and inflammatory cytokine production from human mononuclear cells // BioMed research international. 2013. V. 2013. https://doi.org/10.1155/2013/487081
- Bastard J. P., Maachi M., Lagathu C., Kim M. J., Caron M., Vidal H., Feve B. Recent advances in the relationship between obesity, inflammation, and insulin resistance // European cytokine network. 2006. V. 17. №1. P. 4-12.
- Терещенко И. В., Каюшев П. Е. Фактор некроза опухоли α и его роль в патологии // РМЖ. Медицинское обозрение. 2022. Т. 6. №9. С. 523-527. https://doi.org/10.32364/2587-6821-2022-6-9-523-527
- Rolski F., Błyszczuk P. Complexity of TNF-α signaling in heart disease // Journal of clinical medicine. 2020. V. 9. №10. P. 3267. https://doi.org/10.3390/jcm9103267
- Farahi L., Sinha S. K., Lusis A. J. Roles of macrophages in atherogenesis // Frontiers in Pharmacology. 2021. V. 12. P. 785220. https://doi.org/10.3389/fphar.2021.785220
- Huang H., Yang L. Research Progress of Inflammatory Factors in Chronic Obstructive Pulmonary Disease with Pulmonary Hypertension at High Altitude //Alternative Therapies in Health and Medicine. 2023. V. 29. №8. P. 689-693.
- Atsou S. et al. Thrombin generation on vascular cells in the presence of factor VIII and/or emicizumab // Journal of Thrombosis and Haemostasis. 2024. V. 22. №1. P. 112-125.. https://doi.org/10.1016/j.jtha.2023.09.017
- Chen W. J., Du H., Hu H. F., Lian J. Q., Jiang H., Li J., Wang P. Z. Levels of peripheral blood routine, biochemical and coagulation parameters in patients with hemorrhagic fever with renal syndrome and their relationship with prognosis: an observational cohort study // BMC Infectious Diseases. 2024. V. 24. №1. P. 75. https://doi.org/10.1186/s12879-023-08777-w
- Dindo D., Breitenstein S., Hahnloser D., Seifert B., Yakarisik S., Asmis L. M., Clavien P. A.Kinetics of D-dimer after general surgery // Blood coagulation & fibrinolysis. 2009. V. 20. №5. P. 347-352. https://doi.org/10.1097/MBC.0b013e32832a5fe6
- Воробьева Н. А., Воробьева А. И. Прогностическая значимость д-димера при COVID-19 // Проблемы стандартизации в здравоохранении. 2021. №5-6. С. 36-42.
- Муркамилов И. Т., Айтбаев К. А., Фомин В. В., Муркамилова Ж. А., Юсупов Ф. А., Айдаров З. А., Байжигитова А. А. Клиническая эффективность применения ривароксабана у пациента с идиопатическим легочным фиброзом и тромбозом правого желудочка // Бюллетень науки и практики. 2021. Т. 7. №1. С. 132-157. https://doi.org/10.33619/2414-2948/62/15
- Сабиров И. С. Кавасаки-подобный синдром при новой коронавирусной инфекции (COVID-19) // Вестник Кыргызско-Российского Славянского университета. 2021. Т. 21. №1. С. 74-81.
- Mukaz D. K., Guo B., Long D. L., Judd S. E., Plante T. B., McClure L. A., Cushman M. D-dimer and the risk of hypertension: The REasons for Geographic And Racial Differences in Stroke Cohort Study //Research and Practice in Thrombosis and Haemostasis. 2023. V. 7. №1. P. 100016. https://doi.org/10.1016/j.rpth.2022.100016
- Соловьева И. В. Д-димер: клиническое значение для пожилых пациентов // Ремедиум Приволжье. 2017. №8 (158). С. 28-28.
- Wang C. Association of D-dimer and acute kidney injury associated with rhabdomyolysis in patients with exertional heatstroke: an over 10-year intensive care survey // Renal Failure. 2021. V. 43. №1. P. 1561-1568. https://doi.org/10.1080/0886022X.2021.2008975
- Кунельская Н. Л., Царапкин Г. Ю., Марголин О. В., Артемьев М. Е., Поляева М. Ю., Васильев С. А. Оценка уровня Д-димера при хиругическом закрытии стойких дефектов перегородки носа // Российская оториноларингология. 2013. №4 (65). С. 73-78.
- Соловьева И. В. Д-димер: клиническое значение для пожилых пациентов // Ремедиум Приволжье. 2017. №8 (158). С. 28-28.
- Armandi A., Sanavia T., Younes R., Caviglia G. P., Rosso C., Govaere O., Bugianesi E. Serum ferritin levels can predict long-term outcomes in patients with metabolic dysfunctionassociated steatotic liver disease // Gut. 2024. https://doi.org/10.1136/gutjnl-2023-330815
- Каледа М. И., Федоров Е. С. Значение гиперферритинемии как диагностического и прогностического биомаркера // Современная ревматология. 2022. Т. 16. №2. С. 74-80. https://doi.org/10.14412/1996-7012-2022-2-74-80
- Truman-Rosentsvit M., Berenbaum D., Spektor L., Cohen L. A., Belizowsky-Moshe S., Lifshitz, L., Meyron-Holtz E. G. Ferritin is secreted via 2 distinct nonclassical vesicular pathways // Blood, The Journal of the American Society of Hematology. 2018. V. 131. №3. P. 342-352. https://doi.org/10.1182/blood-2017-02-768580
- Horvat C. M., Bell J., Kantawala S., Au A. K., Clark R. S., Carcillo J. A. C-reactive protein and ferritin are associated with organ dysfunction and mortality in hospitalized children // Clinical pediatrics. 2019. V. 58. №7. P. 752-760.https://doi.org/10.1177/0009922819837352
- Di Benedetto P., Cipriani P., Iacono D., Pantano I., Caso F., Emmi G., Ruscitti P. Ferritin and C-reactive protein are predictive biomarkers of mortality and macrophage activation syndrome in adult onset Still’s disease. Analysis of the multicentre Gruppo Italiano di Ricerca in Reumatologia Clinica e Sperimentale (GIRRCS) cohort // PLoS One. 2020. V. 15. №7. P. e0235326. https://doi.org/10.1371/journal.pone.0235326
- Сабиров И. С. Атеросклероз и новая коронавирусная инфекция (COVID-19): в фокусе печень // Вестник Кыргызско-Российского Славянского университета. 2020. Т. 20. №9. С. 75-82.
- Onuora S. Ferritin-induced NETs lead to cytokine storm in AOSD // Nature Reviews Rheumatology. 2023. V. 19. №2. P. 61-61. https://doi.org/10.1038/s41584-022-00899-w
- Brosnahan S. B., Smilowitz N. R., Amoroso N. E., Barfield M., Berger J. S., Goldenberg R., Maldonado T. S. Thrombosis at hospital presentation in patients with and without coronavirus disease 2019 // Journal of Vascular Surgery: Venous and Lymphatic Disorders. 2021. V. 9. №4. P. 845-852. https://doi.org/10.1016/j.jvsv.2020.11.004
- Moellhoff N., Kuhlmann C., Frank K., Kim B. S., Conte F., Cotofana S., Pallua N.Arterial Embolism After Facial Fat Grafting: A Systematic Literature Review // Aesthetic Plastic Surgery. 2023. V. 47. №6. P. 2771-2787.https://doi.org/10.1007/s00266-023-03511-y
- Берлев О.В., Столярж А.Б., Галина Е.В. Осложнения при липосакции // Анналы пластической, реконструктивной и эстетической хирургии. 2006. №4. С. 51-52.
- Kadar A., Shah V. S., Mendoza D. P., Lai P. S., Aghajan Y., Piazza G., Viswanathan K.Case 39-2021: A 26-year-old woman with respiratory failure and altered mental status // New England Journal of Medicine. 2021. V. 385. №26. P. 2464-2474. https://doi.org/10.1056/NEJMcpc2107355
- Pham M. Q. Fat Embolism after Plastic Surgery: A Case Report // Plastic and Aesthetic Nursing. 2022. V. 42. №1. P. 27-30. https://doi.org/10.1097/PSN.0000000000000414
- Барышников И. В. Разработка подходов к ведению пациентов с рисками сосудистого генезав пластической хирургии // Медицинские новости. 2017. №5. С. 35-38.
- Liu C., Cai Z., Zhang L., Zhou M., He L. Case report and literature review: catastrophic embolism following cosmetic injection of autologous fat in the face // Frontiers in Medicine. 2021. V. 8. P. 646657. https://doi.org/10.3389/fmed.2021.646657
- Wang H. C., Yu N., Wang X., Dong R., Long X., Feng X., Wu W. T. Cerebral embolism as a result of facial filler injections: a literature review // Aesthetic Surgery Journal. 2022. V. 42. №3. P. NP162-NP175. https://doi.org/10.1093/asj/sjab193
- Ватутин Н. Т., Склянная Е. В., Ещенко Е. В. Тромбоэмболия легочной артерии. Обзор рекомендаций Европейского общества кардиологов по диагностике и лечению. 2014 // Практична ангіологія. 2015. Т. 2. №69. С. 5-20.
- Pan D., Li G., Jiang C., Hu J., Hu X. Regulatory mechanisms of macrophage polarization in adipose tissue // Frontiers in Immunology. 2023. V. 14. P. 1149366.https://doi.org/10.3389/fimmu.2023.1149366
- Timon C., Keady C., Murphy C. G. Fat embolism syndrome–a qualitative review of its incidence, presentation, pathogenesis and management // Malaysian Orthopaedic Journal. 2021. V. 15. №1. P. 1. https://doi.org/10.5704/MOJ.2103.001
- Adeyinka A., Bailey K., Pierre L., Kondamudi N. COVID 19 infection: pediatric perspectives // Journal of the American College of Emergency Physicians Open. 2021. V. 2. №1. P. e12375. https://doi.org/10.1002/emp2.12375
- Milroy C. M., Parai J. L. Fat embolism, fat embolism syndrome and the autopsy // Academic forensic pathology. 2019. V. 9. №3-4. P. 136-154. https://doi.org/10.1177/1925362119896351
- Alfudhili K. Pearls in pulmonary computed tomography findings in patients with fat embolism syndrome // Canadian Association of Radiologists Journal. 2018. V. 69. №4. P. 479-488.https://doi.org/10.1016/j.carj.2018.07.002
- Qi M., Zhou H., Yi Q., Wang M., Tang Y. Pulmonary CT imaging findings in fat embolism syndrome: case series and literature review // Clinical Medicine. 2023. V. 23. №1. P. 88-93. https://doi.org/10.7861/clinmed.2022-0428
- Kao Y. M., Chen K. T., Lee K. C., Hsu C. C., Chien Y. C. Pulmonary Fat Embolism Following Liposuction and Fat Grafting: A Review of Published Cases // Healthcare. MDPI, 2023. V. 11. №10. P. 1391. https://doi.org/10.3390/healthcare11101391
- Jorens P. G., Van Marck E., Snoeckx A., Parizel P. M. Nonthrombotic pulmonary embolism // European Respiratory Journal. 2009. V. 34. №2. P. 452-474. https://doi.org/10.1183/09031936.00141708
- Hwang S. M., Lee J. S., Kim H. I., Jung Y. H., Kim H. D. Transposition of intravascular lipid in experimentally induced fat embolism: A preliminary study // Archives of Plastic Surgery. 2014. V. 41. №04. P. 325-329. https://doi.org/10.5999/aps.2014.41.4.325
- Кораблева Н. П., Романенков Н. С., Божок А. А. Осложнения липосакции и липофилинга: диагностика, лечение и профилактика. СПб: СПбГПМУ, 2020.
- Konstantinides S. V., Meyer G., Becattini C., Bueno H., Geersing G. J., Harjola V. P., Meneveau N. ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS) // Eur Heart J. 2020. V. 41. №4. P. 543-603. https://doi.org/10.1093/eurheartj/ehz405
- Stein M. J., Weissman J. P., Harrast J., Rubin J. P., Gosain A. K., Matarasso A. Clinical Practice Patterns in Abdominoplasty: 16-Year Analysis of Continuous Certification Data from the American Board of Plastic Surgery // Plastic and reconstructive surgery. 2024. V. 153. №1. P. 66-74. https://doi.org/10.1097/PRS.0000000000010500
- 2022 ASPS Procedural Statistics Release // Plast Reconstr Surg. 2024. V. 1. №153(1S), P. 1-24. https://doi.org/10.1097/PRS.0000000000011235
- Pannucci C. J., Barta R. J., Portschy P. R., Dreszer G., Hoxworth R. E., Kalliainen L. K., Wilkins E. G. Assessment of post-operative venous thromboembolism risk in plastic surgery patients using the 2005 and 2010 Caprini Risk Score // Plastic and reconstructive surgery. 2012. V. 130. №2. P. 343.https://doi.org/10.1097/PRS.0b013e3182589e49
- Nguyen T. H., Xu Y., Brandt S., Mandelkow M., Raschke R., Strobel U., Greinacher A. Characterization of the interaction between platelet factor 4 and homogeneous synthetic low molecular weight heparins // Journal of Thrombosis and Haemostasis. 2020. V. 18. №2. P. 390-398. https://doi.org/10.1111/jth.14657
- Середа А. П. Профилактика тромбоэмболических осложнений-низкомолекулярные гепарины или нефракционированный гепарин? // Медицина экстремальных ситуаций. 2018. V. 20. №1. P. 121-123.
- Середавкина Н. В., Чельдиева Ф. А., Шумилова А. А., Решетняк Т. М. Эффективность и безопасность длительного применения низкомолекулярных гепаринов у пациентов с системной красной волчанкой и антифосфолипидным синдромом // Современная ревматология. 2023. V. 17. №5. P. 15-21. https://doi.org/10.14412/1996-7012-2023-5-15-21
- Косач Г. А. Использование низкомолекулярных гепаринов в качестве вторичной профилактики тромбозов в медикаментозно-ассоциированных остеонекрозах челюстей в эксперименте // Актуальные вопросы экспериментальной и клинической медицины-2023. 2023. С. 378-378.
- Tang N., Bai H., Chen X., Gong J., Li D., Sun Z. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy //Journal of thrombosis and haemostasis. 2020. V. 18. №5. P. 1094-1099. https://doi.org/10.1111/jth.14817
- Калинин Р. Е., Сучков И., Филимонов В., Мжаванадзе Н., Агапов А., Головченко А. Венозные тромбоэмболические осложнения у пациентов с COVID-19 во время первой и второй волн пандемии: данные реальной клинической практики // Flebologia. 2022. Т. 16. №2.
- Байтингер В. Ф., Селянинов К. В. Фатальные осложнения в реконструктивно-пластической хирургии и пути их профилактики // Вопросы реконструктивной и пластической хирургии. 2022. Т. 24. №3-4. С. 7-29. https://doi.org/10.52581/1814-1471/78-79/01
- Крылов А. Ю., Шулутко А. М., Серебрийский И. И., Верхоломова Ф. Ю., Хмырова, С. Е., Манукян И. Г., Кошатников К. В. Пути повышения эффективности и безопасности антикоагулянтной терапии у больных тромбозами глубоких вен нижних конечностей // Московский хирургический журнал. 2013. №5. С. 4-13.
- Stein M. J., Theodorou S., Chia C. T. Two-stage Radiofrequency-assisted Lipoabdominoplasty // Plastic and Reconstructive Surgery Global Open. 2022. V. 10. №4. https://doi.org/10.1097/GOX.0000000000004212
- Ren G., Peng Q., Fink T., Zachar V., Porsborg S. R. Potency assays for human adiposederived stem cells as a medicinal product toward wound healing // Stem cell research & therapy. 2022. V. 13. №1. P. 249. https://doi.org/10.1186/s13287-022-02928-7


