Верификация стромального клеточного фактора SDF-1 в гравидарном эндометрии при неразвивающейся беременности после применения технологий экстракорпорального оплодотворения
Автор: Траль Татьяна Георгиевна, Толибова Гулрухсор Хайбуллоевна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.30, 2022 года.
Бесплатный доступ
Иммунологический фактор в генезе репродуктивных потерь, в том числе при использовании технологий экстракорпорального оплодотворения, остается не до конца ясным в связи с множественными патогенетическими механизмами иммунологических взаимодействий в системе мать-плацента-плод. Цель настоящего исследования заключается в изучении особенности экспрессии стромального клеточного фактора SDF-1 (stromal cell-derived factor) в гравидарном эндометрии при неразвивающейся беременности при использовании технологий экстракорпорального оплодотворения. Исследовали абортивный материал 5-8 недель при использовании технологий экстракорпорального оплодотворения с разными вариантами гравидарной трансформации. Всего исследовано 92 образца, из них 77 - абортивный материал неразвивающейся беременности после использования технологий экстракорпорального оплодотворения и 15 - образцы абортивного материала при беременности, прерванной по желанию женщины хирургическим путем. Выполнено гистологическое исследование окраской гематоксилином и эозином с описанием вариантов гравидарной трансформации стромы и желез эндометрия и иммуногистохимическое исследование фактора SDF-1 в гравидарном эндометрии обследованных групп. Исходя из гистологической картины, в зависимости от морфологического варианта гравидарной трансформации эндометрия было сформировано 5 групп случаев: полноценная гравидарная трансформация стромы и желез эндометрия и стромы с железами секреторного типа; неполноценная гравидарная трансформация стромы с железами секреторного типа, пролиферативного типа, с обоими типами и контрольная группа наблюдений. Методом морфометрии определяли площадь экспрессии маркера в гравидарном эндометрии (железах и строме). Результаты исследования показали достоверное снижение экспрессии SDF-1 в железах компактного слоя гравидарного эндометрия независимо от вариантов его трансформации после использования технологий экстракорпорального оплодотворения, что вероятно связано с нарушением синтеза хемокина SDF-1 гландулоцитами еще на этапе циклической трансформации эндометрия. Достоверное повышение экспрессии SDF-1 в строме гравидарного эндометрия обусловлено исходным нарушением морфофункционального состояния эндометрия у пациенток с бесплодием. Верификация стромального клеточного фактора в эндометрии на этапе прегравидарной подготовки позволит скорректировать подготовительный этап применения технологий экстракорпорального оплодотворения для пациенток с эндометриальной дисфункцией.
Эндометрий, стромальный клеточный фактор, sdf-1, неразвивающаяся беременность, экстракорпоральное оплодотворение
Короткий адрес: https://sciup.org/143178623
IDR: 143178623
Текст научной статьи Верификация стромального клеточного фактора SDF-1 в гравидарном эндометрии при неразвивающейся беременности после применения технологий экстракорпорального оплодотворения
Введение . Репродуктивные потери первого триместра остаются актуальной проблемой современного общества. К сожалению, следует признать, что, несмотря на определенные успехи и внедрение новых технологий в репродуктивную медицину, частота репродуктивных потерь достигает 20% с преобладанием неразвивающейся беременности, как при естественно наступившей беременности, так и при беременности после экстракорпорального оплодотворения (далее – ЭКО), не имея тенденции к снижению [1-4]. Полиэтиологичность ранних самопроизвольных выкидышей не вызывает сомнений [5-6] и большая часть их этиологических аспектов хорошо изучена, однако влияние иммунологического фактора в генезе репродуктивных потерь остается не до конца ясным в связи с множественными патогенетическими механизмами иммунологических взаимодействий в системе мать-плацента-плод [7-11].
Последние годы особую роль в патогенезе репродуктивных потерь отводят хе-мокинам. В эксперименте как in vitro, так и in vivo показано, что хемокины участвуют в гра-видарной трансформации эндометрия и успешной инвазии трофобласта в комплексе с другими медиаторами [12-13]. Показано, что процесс инвазии трофобласта, обусловленный полноценным взаимодействием бластоцисты и эндометрия, является приоритетным моментом последующего развития беременности и особая роль отводится молекулам фактора CXCL12 (SDF-1 - Stromal cell-derived factor-1), синтезируемому клетками трофобласта и эндометрия, как фактору, потенцирующему восприимчивость эндометрия к наступлению и развитию беременности [1417]. В эксперименте на модели животных также продемонстрирована значимость CXCL12, как фактора, принимающего непосредственное участие в прегравидарной подготовке эндометрия и процессов нидации эмбриона [18].
Цель исследования: изучить особенности экспрессии стромального клеточного фактора SDF-1 в гравидарном эндометрии при неразвивающейся беременности после применения технологий экстракорпорального оплодотворения.
Материалы и методы исследования. Гистологическое и иммуногистохимическое исследование проведено на отобранных к исследованию 92 образцах абортивного материала, поступившего в патологоанатомическое отделение Научно-исследовательского института акушерства, гинекологии и репро-дуктологии имени Д.О. Отта, 77 образцах абортивного материала после неразвиваю-щейся беременности наступившей после применения ЭКО (5-8 недель) и 15 образцах абортивного материала развивающейся беременности, прерванной хирургическим путем (5-8 недель). Операционный материал фиксировали в 10% нейтральном формалине, далее обезвоживали в гистологическом процессоре в спиртах нарастающей концентрации, заливали в парафин и изготавливали срезы толщиной 3-4 мкм. После депарафинирования окрашивали препараты гематоксилином и эозином. При световой микроскопии (увеличениях ×100, ×200, ×400) оценивали полноценность изменений стромы и желез эндометрия (компактного и спонгиоз-ного слоев), состояние клубков спиральных артерий, степени трофобластической инвазии в зоне плацентарного ложа. Иммуногистохимическое исследование проводили на парафиновых срезах. В качестве системы визуализации использовали Abcam Mouse and Rabbit Specific HRP Plus (ABC) Detection IHC Kit (RTU)[ab93697], (Abcam, Великобритания). Для проведения иммуногистохимической реакции использовали одноэтапный протокол с демаскировкой антигена. Оценку экспрессии клеточного стромального фактора проводили с использованием первичных поликлональных кроличьих антител к Anti-SDF1 [клон ab 9797] в стандартном разведении (1:100) производства Abcam (Великобри- тания). Визуализацию экспрессии SDF 1 проводили на микроскопе Olympus BX46 и программного обеспечения «CellSens 47 Entry». Экспрессию изучаемого маркера рассчитывали с помощью программы ВидеоТест-Морфология 5.2 (Россия) на 5 микрофотографиях с каждого микропрепарата. Параметры распределения в выборках оценивали с помощью критерия Колмогорова– Смирнова. Данные представлены в виде среднего и 95% доверительного интервала -М (95% ДИ). Для определения статистически значимых различий между количественными параметрами нормально распределенных данных исследуемых групп использовали однофакторный дисперсионный анализ (ANOVA) с расчетом 95% доверительного интервала. Различия считали значимыми при p<0,05.
Результаты исследования и обсуждение. Результаты гистологического исследования показали, что гравидарная трансформация эндометрия неразвивающейся беременности после применения ЭКО характеризуется полиморфными вариантами. Исходя из гистологической картины, в зависимости от морфологического варианта гравидарной трансформации эндометрия было сформировано 5 групп: I группа - полноценная гра-видарная трансформация стромы и желез эндометрия (n=20); II группа - полноценная гравидарная трансформация стромы с железами секреторного типа (n=15); III группа -неполноценная гравидарная трансформация стромы с железами секреторного типа (n=15); IV группа - неполноценная гравидарная трансформация стромы с железами пролиферативного типа (n=15); V группа - неполноценная секреторная трансформация с железами секреторного и пролиферативного типа (n =12) и контрольная группа (n =15).
Полноценная гравидарная трансформация эндометрия контрольной группы и I группы имела сходные и черты и была представлена зрелыми децидуоцитами, формирующими эпителиальный пласт и щелевидными железами с низким кубическим эпителием. Клубки спиральных артерий крупные, толстостенные, инвазия трофобласта в зоне плацентарного ложа была умеренной.
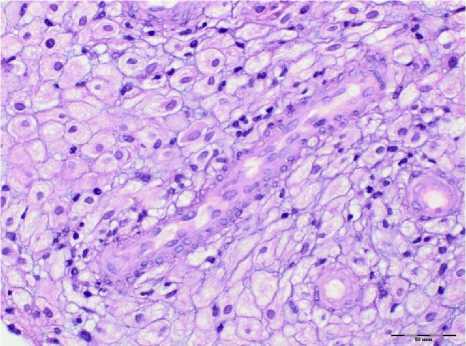
Рис. 1. Полноценная трансформация желез и стромы эндометрия при неразвива-ющейся беременности. Окр.: гематокси-лином-эозином. Ув.: х400.
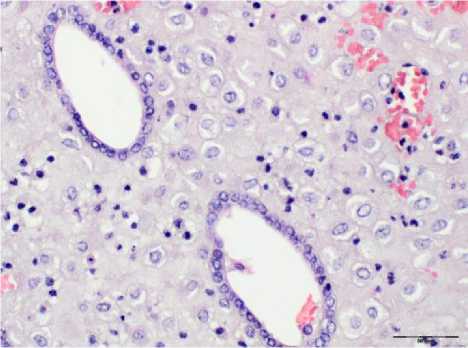
Рис. 2. Полноценная трансформация желез и стромы эндометрия при неразвива-ющейся беременности после ЭКО. Окр.: гематоксилином-эозином. Ув.: х400.
Гравидарный эндометрий II группы также характеризовался полноценной трансформацией, однако железы соответствовали секреторной фазе цикла с пузырьковидными ядрами, высоким призматическим эпителием и апокриновой секрецией. Изменений со стороны клубков спиральных артерий и инвазии трофобласта не выявлено. Неполноценная гравидарная трансформация эндометрия III группы была представлена незрелыми деци-дуоцитами звездчатой формы, расположенными разрозненно в отечной строме с наличием плазмоцитарно-моноцитарной инфильтрации разной степени выраженности. Железы эндометрия имели черты секреторной фазы цикла. Клубки спиральных артерий были развиты слабо, наблюдалась умеренная или слабая инвазия трофобласта в зоне плацентарного ложа.
В IV группе исследования строма состояла из предецидуальных клеток и незрелых децидуоцитов с отеком и инфильтрацией клетки мононуклеарной ряда. Железы эндометрия были тубулярного или слабо извитого строения с пикнотическим ядром, слабо раз- витой цитоплазмой с ровным апикальным краем, клубки спиральных артерий недоразвиты, инвазия трофобласта слабая. В V группе в отечной неполноценной гравидарно измененной строме определялись железы, соответствующие секреторной и пролиферативной фазе цикла с тонкостенными мелкими клубками спиральных артерий и слабой инвазией трофобласта в зоне плацентарного ложа.
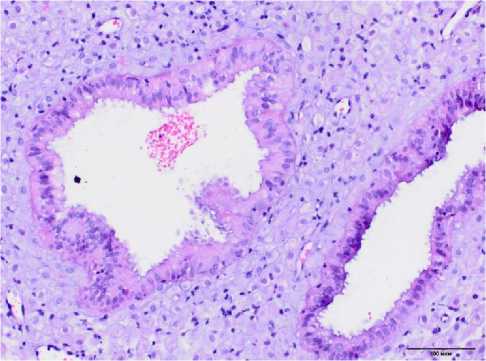
Рис. 3. Полноценная трансформация стромы эндометрия с железами секреторного типа при неразвивающейся беременности после ЭКО. Окр.: гематоксилином-эозином. Ув.: х400.
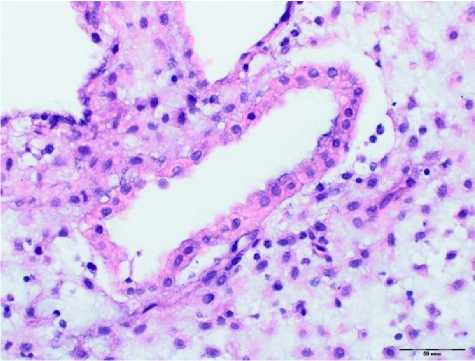
Рис. 4. Неполноценная трансформация стромы эндометрия с железами секреторного типа при неразвивающейся беременности после ЭКО. Окр.: гематоксилином-эозином. Ув.: х400.
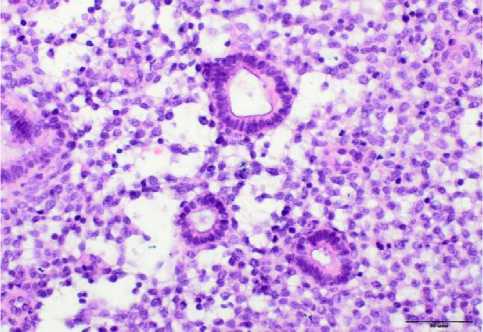
Рис. 5. Неполноценная трансформация стромы эндометрия с железами пролиферативного типа при неразвивающейся беременности после ЭКО. Окр.: гематоксили-ном-эозином. Ув.: х400.
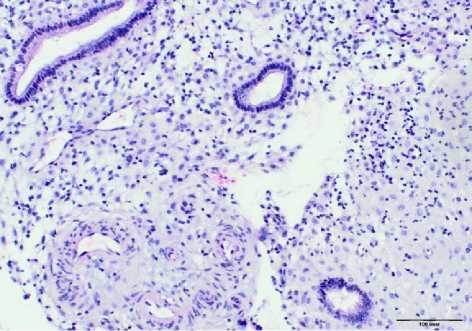
Рис. 6. Неполноценная трансформация стромы эндометрия с железами секреторного и пролиферативного типа при нераз-вивающейся беременности после ЭКО. Окр.: гематоксилином-эозином. Ув.: х400.
Результаты иммуногистохимического исследования показали снижение экспрессии SDF-1 в железах гравидарного эндометрия при неразвивающейся беременно- сти после ЭКО по сравнению с контрольной группой (табл. 1).
Достоверное снижение экспрессии SDF-1 в железах гравидарного эндометрия при неразвивающейся беременности после ЭКО по сравнению с контрольной группой верифицировано во II группе при полноценной гравидарной трансформации стромы с железами секреторного типа (p<0,001), IV группе при неполноценной гравидарной трансформации стромы с железами пролиферативного типа (p<0,001) и V группе с неполноценной гравидарной трансформации с железами секреторного и пролиферативного типа (p<0,001).
Сравнение внутри групп показало, что в эндометрии IV группы (неполноценная гравидарная трансформация стромы и
Таблица 1
Экспрессия стромального клеточного фактора в железах гравидарного эндометрия M(95% ДИ)/M(95% CI)
|
Группы/Groups |
Среднее значение/ Average meaning |
95% доверительный интервал для среднего значения/95% confidence interval for mean |
F-statistics ANOVA |
|
|
Нижняя граница/ Lower bound |
Верхняя граница / Upper bound |
|||
|
Контрольная (n=15) |
22,43 |
20,99 |
23,87 |
14,455 |
|
I группа (n=20) |
20,32 |
16,97 |
23,66 |
|
|
II группа (n=15) |
15,17 |
13,64 |
16,70 |
|
|
III группа (n=15) |
18,57 |
16,06 |
21,07 |
|
|
IV группа (n=15) |
10,43 |
9,35 |
11,52 |
|
|
V группа (n=12) |
16,11 |
14,71 |
17,52 |
|
Примечание: k - контрольная группа; pk-1=1,000; pk-2<0,001; pk-3=0,381; pk-4<0,001; pk-5<0,001; p1- 2 =0,034; p 1-3 =1,000; p1 ~ 4 ~ <0,001; p 1- 5=0,143; p2 ~ 3=1,000; p2 — 4=0,028; p2 — 5=1,000; p3 — 4<0,001; p3 — 5=1,000; p4 - 5=0,020.
При оценке экспрессии маркера в стромальном компоненте гравидарного эндометрия верифицировано достоверное повышение в I группе при полноценной гравидарной трансформации желез и стромы эндометрия (p<0,001), а также достоверное снижение экспрессии во II группе при наличии желез секреторного типа (p<0,055) по сравнению с контрольной группой (табл. 2).
Экспрессия SDF-1 в полноценном гравидарном эндометрии была достоверно выше в I группе по сравнению с II, III и V группами (p<0,001). Во II группе с полноценной гравидарной трансформацией стромы и железами секреторного типа экспрессия данного маркера была достоверно железы пролиферативного типа) отмечается достоверное снижение экспрессии маркера (p<0,001) по сравнению с I группой (полноценная гравидарная трансформация стромы и желез). Аналогичные данные получены при сопоставлении III и IV групп. Снижение экспрессии SDF-1 в железах гравидарного эндометрия после ЭКО, вероятно, связано с нарушением его синтеза гранулоцитами еще на этапе циклической трансформации эндометрия, что согласуется с данными Tsutsumi et al [19].
ниже по сравнению с III и IV группой (р<0,001).
Полученные результаты сравнения внутри групп позволяют сделать вывод о том, что достоверное повышение экспрессии SDF-1 в абортивном материале после ЭКО связано с неполноценной гравидар-ной трансформацией желез и стромы, а также слабым развитием клубков спиральных артерий и нарушением процессов инвазии трофобласта в зоне плацентарного ложа. Несмотря на полноценность грави-дарных изменений в I группе, также выявлено достоверно повышение экспрессии при сравнении с контрольной группой, что свидетельствует о нарушениях рецепторного профиля в эндометрии [20].
Таблица 2
Экспрессия стромального клеточного фактора в строме гравидарного эндометрия M(95% ДИ)/M(95% CI)
|
Группы/Groups |
Среднее значение/ Average meaning |
95% доверительный интервал для среднего значения/95% confidence interval for mean |
F-statistics ANOVA |
|
|
Нижняя граница/ Lower bound |
Верхняя граница / Upper bound |
|||
|
Контрольная (n=15) |
26,19 |
24,13 |
28,25 |
14,455 |
|
I группа (n=20) |
40,05 |
35,79 |
44,31 |
|
|
II группа (n=15) |
21,30 |
18,91 |
22,77 |
|
|
III группа (n=15) |
29,39 |
26,61 |
32,17 |
|
|
IV группа (n=15) |
33,18 |
30,72 |
35,64 |
|
|
V группа (n=12) |
28,27 |
26,61 |
30,89 |
|
Примечание: k - контрольная группа; pk - 1<0,001; pk-2<0,055; pk-3=1,000; pk-4=0,025; pk-5=1,000; p1-2<0,001; p 1- 3<0,001; p 1- 4=0,031; p 1- 5<0,001; p2 -3 <0,001; p2 - 4<0,001; p2 - 5=0,003; p 3- 4=1,000; p 3- 5=1,000; p4 -5 =0,619.
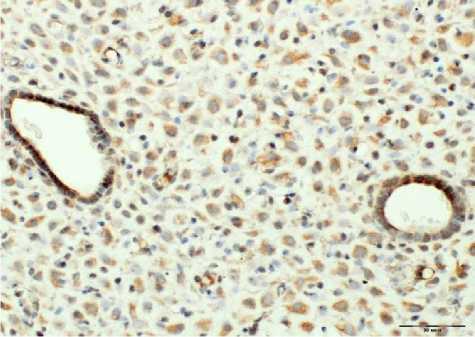
Рис. 11. Экспрессия SDF-1 в неполноценной трансформированной строме с железами пролиферативного типа при нераз-вивающейся беременности после ЭКО. Ув.: х400.
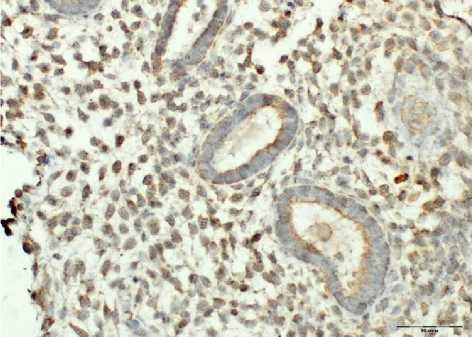
Рис. 12. Экспрессия SDF-1 в не полноценной трансформированной строме с железами секреторного и пролиферативного типа при неразвивающейся беременности после ЭКО. Ув.: х400.
Гинекологический статус пациенток, планирующих протокол ЭКО, указывает на высокую частоту воспалительных заболеваний полости матки с развитием гипоксии эндометрия, активацией патологического неоангиогенеза и последующим формированием эндометриальной дисфункции [21-24].
Стромальный клеточный фактор кроме непосредственно контроля инвазии трофобласта сопровождает и моделирует процессы ангиогенеза в эндометрии. Повышенная секреция SDF-1 связана с повреждением тканей, в том числе, обусловленном гипоксией с последующим замедлением роста и дифференцировки клеток [25]. Полученные нами результаты подтверждают данные исследования и позволяют рассматривать SDF-1 не только как фактор, связанный с нарушением гравидарной трансформации, сосудистой патологией и
Список литературы Верификация стромального клеточного фактора SDF-1 в гравидарном эндометрии при неразвивающейся беременности после применения технологий экстракорпорального оплодотворения
- Adamyan LV, Artymuk AV, Belokrinitskaya TE i dr. Vykidysh v rannie sroki beremennosti: diagnostika i taktika vedeniya. Klinicheskie reko-mendatsii (protokol lecheniya). M., 2016.- 34pp. URL: http://www.consultant.ru/document/cons_doc_LAW_319533/240913a69b434b476239176ef4c4f02fbc6ebcac/ In Russian
- Early Pregnancy Loss. ACOG. Practice Bulletin Number 150, Obstetrics end Gynecology. 2015;125(5):1258-1267. DOI: 10.1097/01.AOG.0000465191.27155.25.
- Molchanova OK, Ordiyants IM, Lutsenko IV, Podstavkina VA. Sovremennye predstavleniya o mole-kulyarnykh mekhanizmakh regulyatsii implantatsii. Akusherstvo i ginekologiya: Novosti. Mneniya. Obuchenie. 2020;8(3-29):106-111. In Russian
- Radzinsky VE, Solovyova AV, Dimitrova VI i dr. Nerazvivayushchayasya beremennost’. 3-e izd. Pod red. V.E. Radzinskogo. M.: GEOTAR-Media, 2019.- 184pp. In Russian
- Klinicheskie rekomendatsii. Akusherstvo i ginekologiya. Izd. 4, pererab. i dop. Pod red. V.N. Serova, G.T. Sukhikh. M.: GEOTAR-Media, 2014.- 1024pp. In Russian
- Carr BR, Blackwell RE. Textbook of Reproductive Medicine. 2nd ed., translated to Russian under the general editorship of I.V. Kuznetsova. M.: Praktika; 2015.- 832pp. In Russian
- Gilbert-Barness E and Debich-Spicer D. Embryo and Fetal Pathology: Color Atlas with Ultrasound Cor-relation. Cambridge, United Kingdom: Cambridge University Press, 2004. 711pp
- Feldt-Rasmussen U, Mathiesen ER. Endocrine disorders in pregnancy: Physiological and hormonal as-pects of pregnancy. Best Pract Res Clin Endocrinol Metab 2011;25:875-84. DOI: 10.1016/j.beem.2011.07.004
- Wang, NF, Kolte AM, Larsen EC et al. Immunologic Abnormalities, Treatments, and Recurrent Preg-nancy Loss: What Is Real and What Is Not? Clin. Obstet Gynecol. 2016;59:509-523. DOI: 10.1097/GRF.0000000000000215
- Kaur R, Gupta K. Endocrine dysfunction and recurrent spontaneous abortion: An overview. Int J Appl Basic Med Res. 2016;6(2):79-83. DOI: 10.4103/2229-516X.179024
- Park SY, Yun S, Ryu BJ, et al. Trophoblasts regulate natural killer cells via control of interleukin-15 receptor signaling. Am J Reprod Immunol. 2017;78(2). DOI: 10.1111/aji.12628
- Mathew DJ, Lucy MC, Geisert D. Interleukins, interferons, and establishment of pregnancy in pigs. Re-production. 2016;151(6):111-122. DOI: 10.1530/REP-16-0047
- Salamonsen LA, Hannan NJ, Dimitriadis E. Cytokines and chemokines during human embryo implan-tation: roles in implantation and early placentation. Semin Reprod Med. 2007;25:437–444. DOI: 10.1055/s-2007-991041
- Milovanov AP. Tsitotrofoblasticheskaya invaziya — vazhneyshiy mekhanizm platsentatsii i progressii beremennosti. Archiv Patologii. 2019;81(4):5-10. DOI:10.17116/patol2019810415. In Russian
- Milovanov AP, Ozhiganova IN. Embriokhorial'naya nedostatochnost': anatomofiziologicheskie predpo-sylki, obosnovanie, definitsii i patogeneticheskie mekhanizmy. Arkhiv patologii. 2014;76(3):4-8. In Rus-sian
- Jaleel MA, Tsai AC, Sarkar S, et al. Stromal cell-derived factor-1 (SDF-1) signalling regulates human placental trophoblast cell survival. Mol Hum Reprod. 2004;10(12):901-909. DOI: 10.1093/molehr/gah118
- Zheng J, Wang H, Zhou W. Modulatory effects of trophoblast-secreted CXCL12 on the migration and invasion of human first-trimester decidual epithelial cells are mediated by CXCR4 rather than CXCR7. Reprod Biol Endocrinol. 2018;16(1):17. DOI: 10.1186/s12958-018-0333-2
- Złotkowska A, Andronowska A. Chemokines as the modulators of endometrial epithelial cells remodel-ing. Sci Rep. 2019;9:12968. DOI: 10.1038/s 41598-019-49502-5
- Tsutsumi A, Okada H, Nakamoto T, et al. Еstrogen induces stromal cell-derived factor 1 (SDF-1/CXCL12) production in human endometrial stromal cells: a possible role of endometrial epithelial cell growth. Fertil Steril. 2011;95(1):444-447. DOI: 10.1016/j.fertnstert.2010.08.037
- Tolibova GH, Tral’ TG, Aylamazyan EK, Kogan IY. Molecularnye mechanismy tsiklicheskoy transfor-matsii endometriya. Zhurnal akusherstva i zhenskikh bolezney. 2019;68(1):5-12. DOI: 10.17816/ JOWD6815-12. In Russian
- Bazina MI, Egorova AT, Khodorovich NA i dr. Khronicheskij endometrit: skrytaya ugroza reproduktsii. Doktor.Ru. Ginekologiya Endokrinologiya. 2015;14:20-27. In Russian
- Sukhikh, GT, Shurshalina AV. Khronicheskij endometrit: rukovodstvo. M.: GEOTAR-Media, 2013.- 64pp. In Russian
- Shurshalina AV. Khronicheskij endometrit kak prichina narushenij reproductivnoj funktsii. Gynecologi-ya. 2014;4:4-6. In Russian
- Tolibova GH, Tral TG, Kleshchev MA. Endometrial’naya disfuktsiya: algoritm klinicheskikh i morfolo-gicheskikh issledovanij: rukovodstvo dlya vrachey. S-Pb., 2016.- 44pp. In Russian
- Zheng N, Chen J, Liu W, et al. Mifepristone Inhibits Ovarian Cancer Metastasis by Intervening in SDF-1/CXCR4 Chemokine Axis. Oncotarget. 2017;8(35):59123-59135. DOI: 10.18632/oncotarget.19289


