Версия дооперационной 3D реконструкции мезогастрального слоя при местно-распространенном раке кардио-эзофагеального перехода. Клинический случай
Автор: Хоробрых Т.В., Агаджанов В.Г., Грачалов А.В., Ивашов И.В., Спартак А.А., Хусаинова Н.Р., Кандалова В.В.
Журнал: Московский хирургический журнал @mossj
Рубрика: Клинические случаи
Статья в выпуске: 2 (84), 2023 года.
Бесплатный доступ
Введение. Для правильного стадирования рака желудка важна качественная и достоверная визуализация, в том числе с использованием лучевых методов диагностики. Чаще всего информацию о стадии заболевания и морфологическом типе опухоли возможно получить только путем патологоанатомического исследования после выполненной хирургической операции. Поэтому изучение возможностей лучевых методов диагностики, в частности, компьютерной томографии (КТ), имеет большой потенциал для определения тактики лечения. Цель работы. Показать возможность и оценить перспективность 3D-реконструкции мезогастрального слоя при местно-распространенном раке кардио-эзофагеального перехода. Материалы и методы. Проведен анализ МСКТ больной местно-распространенным раком кардио-эзофагеального перехода, с оценкой денситометрической плотности окружающей перигастральной клетчатки, пораженных и здоровых лимфоузлов. На основании этого построена 3D модель желудка с измененной перигастральной клетчаткой, предпринята попытка оценки степени «заинтересованности» мезогастрального слоя с целью предоставления хирургам наглядной картины объема предстоящей операции. Эти данные сопоставлены с интраоперационной картиной (в том числе маркировка ICG) и результатами гистологического исследования. Результаты. В участке удаленного мезогастрального слоя, плотность которого по данным компьютерной томографии была выше остальных, найдены свободные опухолевые депозиты и описаны участки лимфоваскулярной опухолевой инвазии, а также метастатические лимфоузлы.
Мезогастрий, кардиоэзофагеальный рак, 3d реконструкция
Короткий адрес: https://sciup.org/142238579
IDR: 142238579 | УДК: 617 | DOI: 10.17238/2072-3180-2023-2-98-103
Текст научной статьи Версия дооперационной 3D реконструкции мезогастрального слоя при местно-распространенном раке кардио-эзофагеального перехода. Клинический случай
Рак желудка (РЖ) является одной из самых распространенных злокачественных опухолей человека, занимает 3-е место в структуре смертности от злокачественных новообразований [1].
Поздняя диагностика и верификация диагноза, неправильное стадирование опухоли в совокупности с последующим неправильным выбором тактики лечения ведет к неудовлетворительным результатам [2].
Качественное хирургическое пособие оказывает огромное влияние на результаты лечения рака желудка [3].
Для правильного стадирования РЖ важна качественная и достоверная визуализация, в том числе с использованием лучевых методов диагностики [4].
Чаще всего информацию о стадии заболевания и морфологическом типе опухоли возможно получить только путем патологоанатомического исследования после выполненной хирургической операции. Поэтому изучение возможностей лучевых методов диагностики, в частности, компьютерной томографии (КТ), имеет большой потенциал для определения тактики лечения.
Цель работы. Показать возможность и оценить перспективность 3D-реконструкции мезогастрального слоя при местно-распространенном раке кардио-эзофагеального перехода.
Материалы и методы
Проведен анализ МСКТ больной местно-распространенным раком кардио-эзофагеального перехода, с оценкой денситоме-трической плотности окружающей перигастральной клетчатки, пораженных и здоровых лимфоузлов. На основании этого построена 3D модель желудка с измененной парагастральной клетчаткой, с попыткой оценить степень «заинтересованности» мезогастрального слоя и предоставить хирургам наглядную картину объема предстоящей операции. Эти данные сопоставлены с интраоперационной картиной, в том числе с использованием ICG-флуоресцентной навигацией и результатами гистологического исследования.
Больная Б, 33 лет обратилась за консультацией в клинический центр Университетской клинической больницы № 4 ПМГМУ им. И.М. Сеченова с жалобами на изжогу, не связанную с приемом пищи и сменой положения тела, не купирующуюся при- емом антисекреторных препаратов. Вышеуказанные жалобы отмечает в течение 2-х лет.
Из анамнеза известно: ранее обращалась к гастроэнтерологу, проводились плановые гастроскопии один раз в 6 месяцев, по результатам которых выставлен диагноз: «Поверхностный гастрит». Консервативное лечение анти-секреторными, спазмолитическими препаратами с переменным успехом.
В условиях стационара университетской клинической больницы № 4 Сеченовского Университета проведено комплексное обследование пациентки.
Физический статус функционирования согласно Eastern Cooperative Oncology Group (ECOG) – 0.
Объективно: нормостеник, кожный покров обычной окраски; доступные пальпации лимфатические узлы без особенностей. Гемодинамические показатели стабильные. Живот правильной формы, не вздут, при пальпации мягкий, безболезненный, без пальпируемых объемных образований.
При ЭГДС выявлено утолщение складок слизистой оболочки желудка по малой кривизне, в области кардио-эзофа-геального перехода. По данным эзофагогастродуоденоскопии возле Z-линии в проксимальном направлении на протяжении до 4,0 см (36–37 см от резцов) на левой, передней и задней стенках абдоминального отдела пищевода определяются образования в виде цепочек на широких основаниях, частично сливающиеся 0,6х0,4х0,2 см. (признаки лимфангоита). В кардиальном отделе желудка, по задней стенке, определяется площадка неправильной формы с инфильтрированной слизистой (рис. 1).
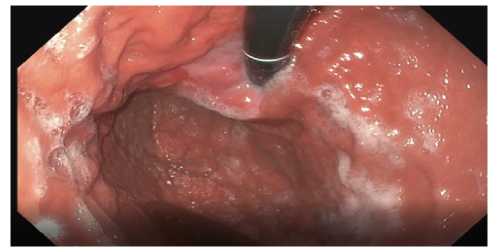
Рис. 1. Эндоскопическая картина опухоли
Fig. 1. Endoscopic picture
По данным МСКТ грудной и брюшной полостей: в обоих легких единичные мелкие солидные очаги, утолщение кардио-эзофагельного перехода до 37 мм с распространением на малую кривизну кардии, тесным прилежанием к первому сегменту печени и ножкам диафрагмы (экзофитный компонент). Пери-гастральная клетчатка в этой зоне уплотнена, лимфатические узлы до 10 мм.
На основании проведенного обследования, пациентке выставлен диагноз: рак кардиоэзофагеального перехода, III тип по Siewert, сТ3N1M0. Гистологически –аденокарцинома с перстневидноклеточным компонентом.
Проведен мультидисциплинарный онкологический консилиум – первым этапом пациентке рекомендована химиотерапия в объеме 8 курсов по схеме FLОТ.
Проведено 4 курса НПХТ по схеме FLOT. Динамика разнонаправленная: уменьшение размера опухоли по данным КТ, в то же время, наблюдалась прогрессия заболевания в виде отдаленного метастазирования в правый яичник (увеличение размеров, неоднородная структура по КТ) в связи с чем была скорректирована схема химиопрепаратов– назначено 4 курса FOLFOX.
Таким образом, после прохождения химиотерапии пациентке выставлен предоперационный диагноз: рак кар-диоэзофагеального перехода, III тип по Siewert, уТ3N2M1 (яичник), IV стадия (UICCTNM Classification). Гистологически – аденокарцинома с перстневидноклеточным компонентом. Состояние после НПХТ: 4 курса по схеме FLOT и 4 курса по схеме FOLFOX.
Для оценки степени опухолевого поражения мезога-стрального слоя, совместно со специалистами лучевой диагностики университетской клинической больницы № 4, выполнено предоперационное 3D моделирование мезогастрального слоя желудка. Идея оценки поражения мезогастрального слоя основывалась на различии ден-ситометрической плотности перигастральной клетчатки (HU) (рис. 2).
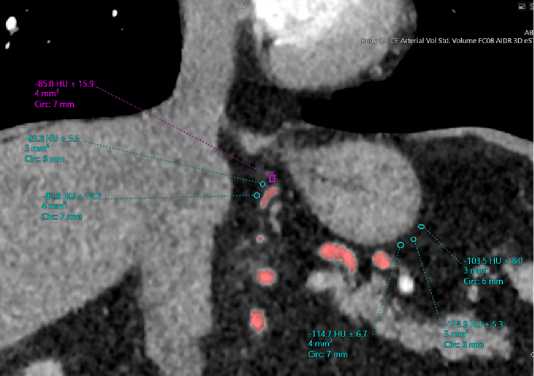
Рис. 2. Разница денсинометрической плотности различных участков перигастральной клетчатки Fig. 2. The difference in densinometric density of different parts of the perigastric tissue
Пример этапа разметки (1 срез) представлен в таблице 1. После разметки границ была осуществлена реконструкция желудка, артерий бассейна чревного ствола, а также измененного по плотности мезогастрального слоя (рис. 3).
Таблица 1
Разметка одного из срезов границ пораженного мезогастрального слоя на основании разницы Денситометрической перигастральной плотности клетчатки
Table 1
Marking one of the slices of the bound aries of the affected mesogastric layer base don’t he differencein densinometricperigastric fiberdensity
|
Точки денситоме-трической плотности Densitometric density points |
Мезогастральный слой вдоль левой желудочной артерии (HU) Mesogastric layer along the left gastric artery (HU) |
Мезогастральный слой в области ретрогастральной клетчатки (HU) Mesogastric layer in the region of retrogastric tissue (HU) |
|
1 |
–83.2 |
–103.5 |
|
2 |
–85.8 |
–114.6 |
|
3 |
–82.9 |
–115.7 |
Методика построения 3D модели была следующей: на компьютерных томограммах в артериальную фазу окрашивали артерии бассейна чревного ствола, в т.ч. левую желудочную артерию. Далее отмечались точки вдоль левой желудочной артерии в субъективных границах измененной жировой клетчатки (данные границы размечались тремя КТ-специалистами с опытом работы более 10 лет). Аналогичным образом отмечались точки в области ретрогастральной клетчатки, сальниковой сумки (поражение этих областей не характерно для ранних стадий КЭР) (рис. 3).
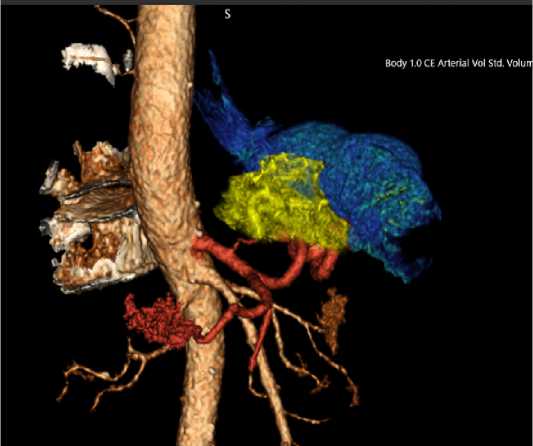
Рис. 3. 3D-модель пораженного мезогастрального слоя у пациентки с местнораспространенным кардиоэзофагеальным раком
Fig. 3. 3D model of the affected mesogastric layer in a patient with locally advanced cardioesophageal cancer
В октябре 2022 года пациентка выполнена операция: лапароскопически- ассистированная проксимальная резекция желудка с резекцией абдоминального отдела пищевода, лимфодиссек-ция D2, правосторонняя аднексэктомия. Интраоперационно использовалась ICG-навигация (рис. 4).
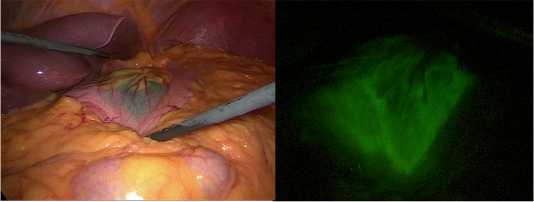
Рис. 4. Интраоперационная ICG-навигация
Fig. 4. Intraoperative ICG navigation
По данным гистологического исследования макропрепарата (рис. 5) – в кардиальном отделе желудка, по задней стенке опухоль – аденокарцинома, представленная клетками, цепочками и гнездами клеток с отдельными перстневидными клетками, распространяющаяся на всю толщу стенки желудка, клетчатку малого сальника.
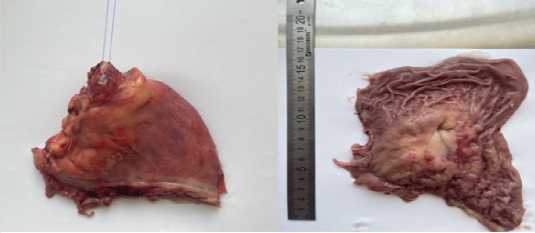
Рис. 5. Фотография макропрепарата
Fig. 5. Photo of macropreparation
Определяются мелкие фокусы лимфо-сосудистой, периваскулярной, а также пери- и интраневральной инвазии. Достоверных признаков роста опухоли в краях резекции не определяется. В 4 лимфатических узлах (из 26 исследованных) обнаружены метастазы опухоли. В ткани яичника группы опухолевых клеток. урТ3N2M1L1, V1, Pn1.
Обсуждение
Мультиспиральная КТ грудной и брюшной полостей на сегодняшний день является основным способом анализа распространения рака, оценки метастазирования и дальнейшего анализа «отклика» опухоли на выполняемую химио-лучевую терапию [5], а хирургический метод является основным в лечении большинства злокачественных новообразований [6].
Основой современного подхода к техническим стандартам оперативного лечения явился пересмотр фундаментальных взглядов на топографическую анатомию и эмбриологию органов брюшной полости и забрюшинного пространства [7, 8, 9].
Хороший результат хирургического лечения связан с резекцией в объеме R0, что подразумевает удаление органа в пределах эмбрионального слоя зародышевой брыжейки вместе с лимфатическими коллекторами, сосудами и мезенхимальными тканями, которые могут содержать свободные опухолевые клетки.
Хирургия рака желудка в пределах мезогастрального слоя, полное его иссечение остается сложной задачей. Вопрос об истинных его границах остается малоизученным и дискута-бельным [1, 2].
В нашем примере 3D модель перигастральной клетчатки (мезогастрального слоя) создавалась на основании разности денситометрических плотностей. Основная гипотеза определения границ пораженного мезослоя заключалась в выявлении разницы между денситометрической плотностью нормальной и пораженной (вследствие лимфатического отека, увеличенных лимфоузлов, опухолевых депозитов) клетчаткой после контрастного усиления (87+23 и 110 + 25 HU), что, вероятно, может позволить выявить пораженные группы лимфоузлов и наглядно представить объем поражения в виде 3D-модели.
Метод ICG-флуоресцентной навигации, с учетом изученных данных [10, 11], позволил выполнить более адекватную и безопасную лимфодиссекцию в объеме D2.
В приведенном клиническом случае предпринята попытка компьютерной реконструкции пораженного мезогастрального слоя с её интраоперационным интерполированием и с учетом результата гистологического заключения.
Заключение
Таким образом, дальнейшая разработка дооперационного 3D моделирования мезогастрального слоя, на основании предложенной гипотезы, может дать возможность предположить опухолевое поражение участков с большей денситометриче-ской плотностью.
Получение на дооперационном этапе подобных данных, подразумевает большее понимание особенностей мезогастраль-ного слоя и может позволить детальнее планировать операцию, придерживаясь принципов безопасной хирургии.
Можно также думать, что аналогичные модели позволят наглядно демонстрировать динамику онкопроцесса в ходе химиотерапии.
Данное направление представляется перспективным и, конечно, требует дальнейшего изучения.
Список литературы Версия дооперационной 3D реконструкции мезогастрального слоя при местно-распространенном раке кардио-эзофагеального перехода. Клинический случай
- А. М. Карачун, А. М. Беляев, Ю. В. Пелипась и соавт. Взгляд на навигационную хирургию рака желудка: современное состояние проблемы и собственный опыт. Вопросы онкологии, 2019. Т. 65. № 6.
- Карачун А. М. Самсонов Д. В. Современные походы к хирургическому лечению местнораспространенного и метастатического рака. Вестник Российской Военно-медицинской академии, 2009. Т. 25, № 1. С. 168-171.
- Freddie Bray, Jacques Ferlay, Isabelle Soerjomataram, Rebecca L Siegel, Lindsey A Torre, Ahmedin Jemal. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin., 2020, Jul; № 70 (4), рр. 313. Epub 2020 Apr 6.
- Клинические рекомендации Минздрава РФ: "Рак желудка", 2018.
- Shinohara H. Anatomy of the Stomach and Surrounding Structures, Part II: For Those Who Value Practical Knowledge. Illustrated Abdominal Surgery, 2020, pp. 21-32.
- Клименко А. О., Синицын В. Е., Лядов В. К. Современные методы лучевой диагностики рака желудка. Лучевая диагностика и терапия, 2020. Т. 11, № 1.
- Агабабян Т. А., Силантьева Н. К., Скоропад В. Ю. Диагностика внеорганного распространения рака желудка методом мультиспиральной компьютерной томографии. Медицинская визуализация. 2011. № 6. С. 21-29.
- Carol E. De Santis MPH, Chun Chieh Lin PhD, MBA, Angela B. Mariotto PhD, RebeccaL. Siegel MPH., Kevin D. Stein PhD, Joan L. Kramer MD, Rick Alteri MD, Anthony S. Robbins MD, PhD, Ahmedin Jemal D. V. M, PhD Cancer treatment and survivorship statistics. СA: A Cancer Journal for Clinicians, 2014, Vol. 64 (4), рр. 252-271.
- Черниковский И. Л., Саванович Н. В., Смирнов А. А., Гаврилюков А. В., Оганесян О. В.Топографическая анатомия и онкологическая хирургия ободочной кишки: новое или хорошо забытое старое? Тазовая хирургия и онкология, 2017. Т. 7. № 3.
- Кащенко А. В., Глузман М. И. Применение ICG-флуоресцентной навигации в хирургии рака желудка. ICG-флуоресцентная навигация в абдоминальной хирургии. Учебно-методическое пособие. Сн-Пт, 2019.


