Вертикальное распределение инфузорий планктона в небольшом меромиктическом водоеме в летний период
Автор: Быкова С.В., Жариков В.В.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Водные экосистемы
Статья в выпуске: 4 т.9, 2007 года.
Бесплатный доступ
Приводятся первые данные по вертикальному распределению инфузорий планктона летом в неболь- шом эвтрофном меромиктическом пруду (пруд Нижний Самарского Ботанического сада). Анализиру- ются изменения видовой, таксономической и трофической структур сообщества инфузорий по глуби- не. Рассматриваются особенности формирования максимумов численности инфузорий относитель- но пиков численности других гидробионтов (коловраток, цианобактерий, фототрофных бактерий и т. д.).
Короткий адрес: https://sciup.org/148198052
IDR: 148198052 | УДК: 574.583+593.17
Текст научной статьи Вертикальное распределение инфузорий планктона в небольшом меромиктическом водоеме в летний период
Институт экологии Волжского бассейна РАН, г. Тольятти
Приводятся первые данные по вертикальному распределению инфузорий планктона летом в небольшом эвтрофном меромиктическом пруду (пруд Нижний Самарского Ботанического сада). Анализируются изменения видовой, таксономической и трофической структур сообщества инфузорий по глубине. Рассматриваются особенности формирования максимумов численности инфузорий относительно пиков численности других гидробионтов (коловраток, цианобактерий, фототрофных бактерий и т. д.).
Многие работы по изучению вертикального распределения инфузорий в стратифицированных водоемах посвящены исследованию таксономической и видовой структуры сообществ инфузорий границы аэробной и анаэробной зон, анаэробного гиполимниона [4, 8, 9, 15-17, 19, 21, 22]. Это касается, в основном, полимиктических озер, где стратификация водной толщи чередуется с периодами полного перемешивания. Очень редко в литературе встречаются данные по характеру распределения инфузорий в меромиктических водоемах. В данной работе представлены первые данные по вертикальному распределению инфузорий в меромиктическом пруду Нижнем Ботанического сада СамГУ.
Цель работы – исследование закономерностей формирования видовой, трофической структуры сообщества инфузорий в толще воды меромиктического пруда в период летней термической стратификации1 . Кроме того, предполагается выяснить, влияет ли на структуру сообщества инфузорий планктона наличие неперемешиваемого в течение всего года слоя.
Материалы и методы исследования
Исследования проводили ежемесячно с мая по август 2004 г. в составе комплексной экспедиции Института экологии Волжского бассейна РАН. Пробы отбирали батометром через 0,5-1 м от поверхности до глубины 4,5 м синхронно с отбором проб на химический состав и гидробиологические показатели. Точка отбора проб располагалась в месте максимальной для данного водоема глубины (в 20 м от нижней плотины).
Подсчет численности микрозоопланктона (инфузорий и коловраток) производили после концентрирования 300 мл воды пробы без применения вакуума и после фиксирования насыщенным раствором сулемы, на глицериновых препаратах. Видовое определение инфузорий проводили в живом виде, а также фиксированных сулемой и на препаратах, им-прегнированных серебром [12]. Ядра выявляли окраской по Фельгену на тотальных препаратах. Для идентификации видов использовали определитель Каля [18] с учетом новых данных современных публикаций разных авторов. Коловраток определяли до рода по работам [3, 5]. При определении биомассы инфузорий индивидуальные веса рассчитывали методом подобия инфузорий геометрическим фигурам, плотность принимали равной единице.
Первичные данные по гидрохимическим и гидрофизическим показателям, используемые в данной работе, любезно предоставлены М.Ю. Горбуновым и М.В. Уманской.
Результаты
Подробное описание морфометрии, термического, газового режимов, химического состава и особенностей стратификации водной толщи в исследуемом водоеме было опубликовано ранее [2]. Напомним, что максимальная глубина водоема – 5,6-5,8 м, прозрачность воды по диску Секки за период исследований колебалась около 1,5 м. Температурная стратификация устанавливается к третьей декаде мая. В исследованный период температура поверхностного слоя колебалась, в основном, в пределах 19-22оС, а придонного – 9-11оС; лишь в июле она поднималась до 25,5оС и 13,8оС, соответственно. Зона температурного скачка захватывала значительную часть водного столба и увеличивалась от 2 м в мае до 2,5-3 м в июле-августе. Зона оксиклина была уже термоклина, но всегда располагалась в его пределах: в начале стратификации она находилась в середине слоя температурного скачка, в июле-августе – ближе к верхней границе термоклина. Отсутствие кислорода в первые два месяца зафиксировано начиная с 2,5 м и до дна, в остальные – с 2 м. Наряду с градиентами кислорода и температуры, существует мощный градиент минерализации. Высокая минерализация, малая проточность, небольшая площадь и достаточная глубина водоема обусловливают отсутствие полного перемешивания воды в данном меромиктическом водоеме. Даже в период осенней и весенней гомотермии остается слой (4-4,5 м и до дна) с повышенной плотностью, никогда (во всяком случае за 2003-2006 гг. [2]) не перемешиваемый с поверхностной водной массой. Эти особенности распределения абиотических факторов определяют и специфику пространственного распределения в толще воды гидробионтов, в том числе и представителей микрозоопланктона – инфузорий и коловраток.
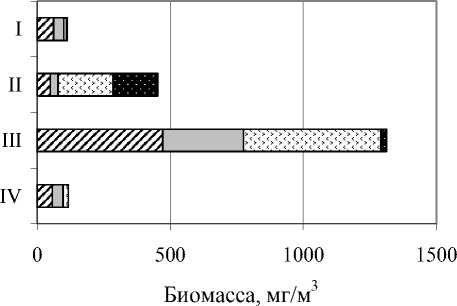
Для удобства мы анализировали структуру сообщества инфузорий по вертикали по 4 условно выделенным слоям (зонам), характеризующимся более менее однородными внутри зоны условиями, оцениваемыми по 4 критериям (tоС, содержание O2и H2S, перемешивание). Это деление в разные месяцы затрагивает разные горизонты:
-
I. Поверхностный слой (0-1 м) характеризуется относительно постоянными температурой и содержанием кислорода; сероводород отсутствует; всегда перемешивается;
-
II. Слой над границей кислородной и бескислородной зон (переходная зона): характеризуется ярко выраженными градиентами температуры, кислорода (оксиклин); появляются следы сероводорода; перемешиваемый во время весенней и осенней гомотермии и не перемешиваемый во время летней термической стратификации. В разные месяцы захватывает разные горизонты (от 1 до 2-2,5 м), поскольку граница кислородной и бескислородной зон поднимается с 2,5 м в мае-июне до 2 м в июле-августе.
-
III. Анаэробный слой (от 2-2,5 до 4-4,5 м): характеризуется полным отсутствием кислорода, наличием сероводорода; возможен градиент температуры; не перемешивается во время летней термической стратификации;
-
IV. Неперемешиваемый слой (4-4,5 м); так же, как и III, характеризуется полным отсутствием кислорода, высоким содержанием сероводорода, но, в отличие от предыдущей зоны, вода в придонном слое не перемешивается в течение всего года.
Таксономическая структура. Всего в пелагической части озера было обнаружено 62 вида инфузорий, относящихся по системе Small & Lynn [20] к 10 классам, 10 подклассам, 25 отрядам, 41 семейству, 49 родам.
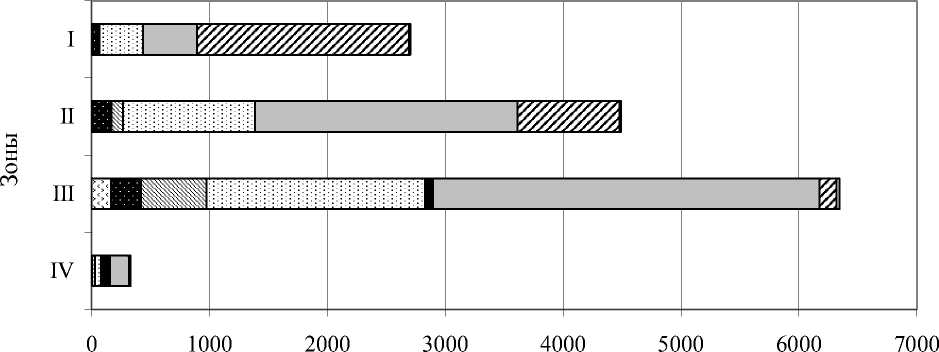
Oт поверхностных к придонным слоям меняется таксономическая структура сообщества планктонных инфузорий (рис. 1). На поверхности (аэробная зона I) преобладают представители кл. Spirotrichea, в зоне II – кл. Prostomatea, Oligohymenophorea, в зоне III увеличивается вклад Oligohymenophorea и Heterotrichea, а в придонных слоях (зона IV), помимо перечисленных классов, существенен вклад в численность инфузорий кл. Plagiopylea и отр. Armophorida.
Доминирующими по численности в разных зонах могут быть представители разных подклассов. Так, в поверхностных слоях из кл. Spirotrichea доминируют представители п/ кл. Oligotrichia и п/кл.: Choreotrichia Strombidium
0 KARYORELICTEA
^ HETEROTRICHEA
■ PLAGIOPYLEA и SPIROTRICHEA
Численность, тыс. экз./м3
-
■ LITOSTOMATEA
-
□ OLIGOHYMENOPHOREA
-
□ PROSTOMATEA
ПЛ прочие
Рис. 1. Соотношение основных таксономических групп (классов) инфузорий в толще воды пруда Нижнего летом 2004 г.
sulcatum Clap. et L., 1859, S. conicoides Leegard, 1915, Halteria grandinella (O.F. Mu..ller, 1773, S. caudatum (Fromentel, 1876), а в анаэробных зонах III и IV – представители п/кл. Hypotrichia, Euplotes diadaleos Diller & Kounarius, 1966. Из кл. Oligohymenophorea у поверхности (зона I) доминировала Vorticella natans (F.Fremiet, 1924) (п/кл. Peritrichia), Cyclidium sp. (п/класс Scuticociliatia), а в непе-ремешиваемых летом II–IV зонах – Histio-balantium natans Clap. & Lachm., 1858 (п/класс Scuticociliatia), Lembadion bullinum Perty, 1852, Paramecium aurelia (Ehrb., 1838) complex (п/кл. Peniculia). Из кл. Prostomatea в аэробной зоне (I) доминировал Coleps hirtus viridis Ehrenberg, 1831, который далее уступал место Prorodon viridis Kahl, 1927 и Prorodon sp . Из Heterotrichea в зоне оксиклина и термоклина преобладает Stentor roeseli Ehrb., 1835, а ближе к придонным слоям – Spirostomum teres Cl.. et L., 1859
Таким образом, в столбе воды от поверхностных к придонным слоям происходит постепенное изменение соотношения вклада в общую численность классов, внутри которых происходит смена доминирующих таксонов.
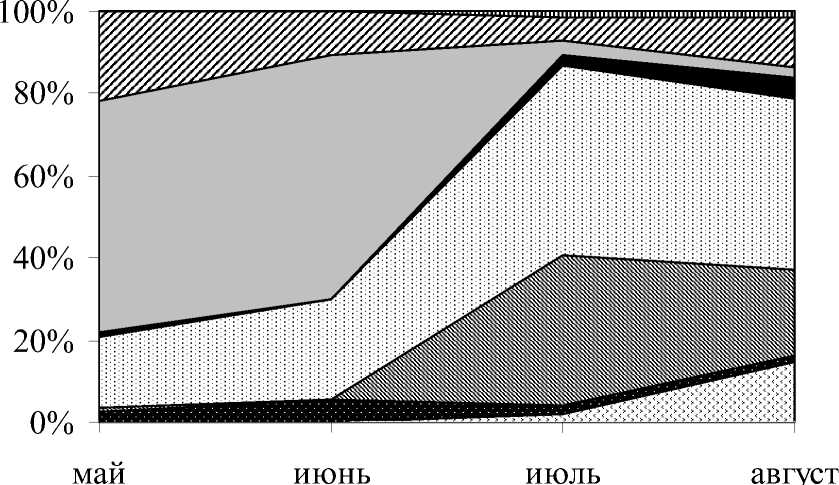
Сезонные изменения таксономической структуры касаются лишь сообщества, начиная со II зоны и ниже: к июлю и августу в них уменьшается вклад Prostomatea, увеличивается вклад Oligohymenophorea и Heterotrichea, Plagiopylea, Karyolictea. Это нашло отражение и на усредненных по вертикали количественных показателях развития сообщества инфузорий (рис. 2). В поверхностных же слоях на протяжении всего исследованного периода преобладают представители кл. Spirotrichea.
Количественное развитие. С возникновением температурной стратификации (май) инфузории распределены по всей толще, образуя синхронные максимумы численности и биомассы в кислородной и анаэробной зонах (рис. 3). С установлением явной температурной стратификации в июне и июле максимумы формируются в верхней части анаэробной зоны, под оксиклином. По мере увеличения периода расслоения водной толщи по температуре численность инфузорий уменьшается, а биомасса возрастает, что свидетельствует о видовой перестройке внутри сообщества. Максимумы общей численности коловраток (6795-19 232 тыс. экз./м3) всегда лежат на границе кислородной и бескислородной зон (рис. 3).
0 Кл. KARYORELICTEA ■ Кл. LITOSTOMATEA
^ Кл. HETEROTRICHEA 0 Кл. OLIGOHYMENOPHOREA
■ Кл. PLAGIOPYLEA 0 Кл. PROSTOMATEA
и Кл. SPIROTRICHEA
ш прочие
Рис. 2. Изменение соотношения основных таксономических групп (по численности) за период с мая по август 2004 г.
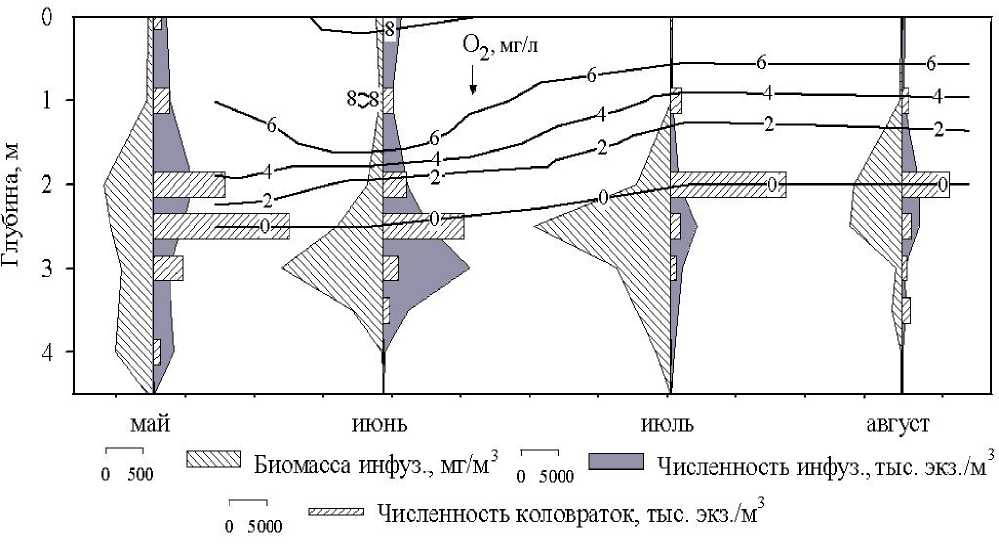
Рис. 3. Изменение количественных показателей (N и В) микрозоопланктона (инфузорий и коловраток) по вертикали в пруду Нижнем (май-август 2004 г.)
Максимальные показатели количественного развития инфузорий зарегистрированы: по численности – в июне на глубине 3 м (23 040,6 тыс. экз./м3), по биомассе – в июле на глубине 2,5 м (3710,9 мг/м3). Количество видов было максимальным (23-33) в течение всех четырех месяцев на глубине 2 м, что совпадало с серединой (в мае-июне) и нижней частью (в июле-августе) хемоклина. В июне-августе на глубинах (2,5-3 м), где сообщество достигает максимальной численности и уровня доминирования, число видов уменьшается до 16-26. На глубине 3-3,5 м наблюдается небольшое увеличение количества видов, обусловленное, возможно, видовой перестройкой. Минимален видовой состав (47) в придонном сообществе.
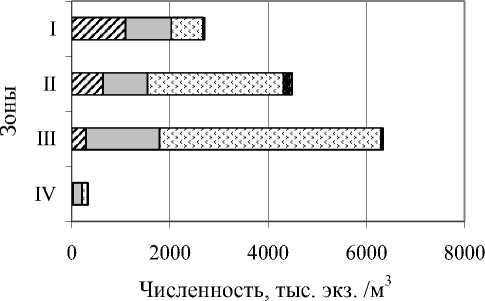
Трофическая структура . Преобладающими трофическими группами на всех глубинах в водоеме являются миксотрофы, бактерио-детритофаги, альгофаги.
На поверхности (I зона), за редким исключением, преобладают альгофаги (рис. 4). С глубиной заметно уменьшается их численность, но увеличивается биомасса, поскольку доминирующие в поверхностных слоях мелкие инфузории (родов Strombidium, Strobilidium) в зоне под оксиклином сменяются крупным альгофагом (Frontonia leucas). За период наблюдений F. leucas была без симбионтов, лишь в августе появлялись немногочисленные особи, содержащие зоохлореллы. Бактерифаги представлены в I зоне Vorticella natans и Halteria grandinella.
Более разнообразна трофическая структура переходной II зоны. Помимо перечисленных групп, здесь значителен вклад в численность, и особенно, в биомассу, неселективных всеядов (за счет крупных Stentor roeseli ). Видимо, это не случайно, поскольку именно в этой зоне у инфузорий наблюдается смена питания с водорослей на бактерии. При этом S. roeseli , обладающий более широкими пищевыми предпочтениями, получает здесь преимущество.
иА □ Б-Д ■ Г □М ■ Н
Рис. 4. Соотношение средней (за исследованный период) численности и биомассы трофических групп инфузорий: А - альгофаги, Б-Д - бактерио-детритофаги, Г - гистофаги, М - миксотрофы, Н - неселективные всеяды, Х - хищники
С увеличением глубины возрастают численность и вклад в общую численность мик-сотрофов, бактериофагов. Во II и III зонах по численности миксотрофы преобладают над бактериофагами, а в придонной (IV) – наоборот. Здесь сказывается прежде всего влияние грунтов: встречаются бентосные виды, в частности сапропельные формы (рр. Metopus,
Caenomorpha, Plagiopyla ).
Характерной особенностью малых эвтрофных водоемов является массовое развитие в них миксотрофных инфузорий. На наш взгляд, миксотрофов следует считать специфической экологической группой, хотя мы рассматриваем их в виде отдельной группы в составе трофической структуры. В определенных ус- ловиях миксотрофия может рассматриваться и как специфический способ питания, и как механизм адаптации к неблагоприятным условиям (к отсутствию кислорода, например), который, в свою очередь, определяет доступ к пищевым ресурсам. Поэтому очень часто данную группу составляют виды, являющиеся бактерио-детритофагами, альгофагами, хищниками.
На поверхности часто встречаются именно такие виды. Так, c симбионтами обнаружены инфузории родов Halteria, Askenasia, Enchelys, Monodinium, Didinium . В зоне оксиклина, помимо широко распространенного миксотрофа Prorodon viridis Kahl, 1927, доминирует Coleps hirtus viridis. Интересно, что в первые 2 месяца (рис. 4) во всей толще под оксиклином преобладали миксотрофы, представленные Prorodon viridis , Histiobalantium natans , в меньшей степени – Euplotes diadaleos . В мае инфузории образуют 2 пика численности (рис. 3): один расположен на 2 м и обусловлен доминированием Prorodon viridis (31%) и Coleps hirtus (23%), второй расположен на 4 м и характеризуется явным преобладанием P. viridis (72%). Coleps hirtus предпочитает микроаэробные условия, но не выдерживает полностью анаэробные с высоким содержанием сероводорода. Поэтому сформировавшийся максимум в июне состоит уже в основном из P. viridis (70%) и другого миксотрофа – Histiobalantium natans (18%).
В июле-августе в анаэробной зоне миксот-рофы постепенно вытеснялись так называемыми «бентосными мигрантами»: Paramecium sp., Loxodes magnus Stokes, 1887, L. rostrum (O.F. Mu..ller, 1773), Plagiopyla nasuta Stein, 1860, Spirostomum teres , Metopus es (O.F. Muller, 1776). Именно поэтому в августе эти бактериодетритофаги преобладали над мик-сотрофами в третьей и четвертой зонах.
Вертикальное распределение отдельных видов. В таблице представлены частота встречаемости и вклад в общую численность отдельных видов инфузорий на разных горизонтах в толще воды. Наблюдается интересная особенность: в поверхностных слоях зарегистрировано 2 вида (Strombidium sulcatum и Halteria grandinella) со 100% встречаемос- тью и максимальным вкладом в общую численность, в зоне оксиклина и под ним – по 1 виду (Coleps hirtus viridis и Prorodon viridis), в придонных слоях нет вида с максимальной долей по численности, который присутствовал бы всегда на данном горизонте. Несмотря на то, что последний слой не перемешивается в течение всего года, видимо, возможна миграция видов из грунтов, с одной стороны, и вышележащих слоев – с другой.
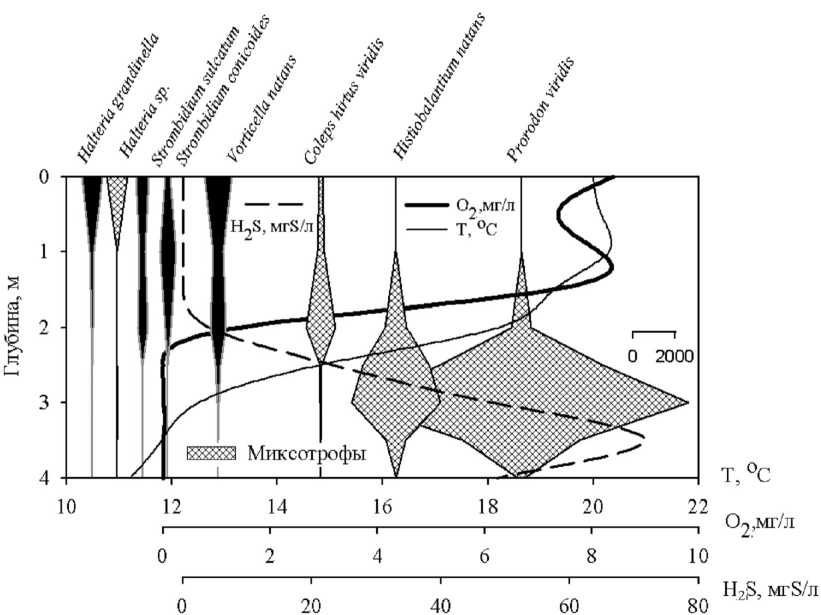
В ходе исследований было выявлено следующее вертикальное распределение инфузорий (рис. 5). На поверхности образуют максимумы виды: Halteria grandinella и H. sp. с зоохлореллами , Strobilidium caudatum. В подповерхностных слоях и зоне оксиклина – Strombidium sulcatum, S. сonicoides, Vorticella natans. Миксотроф Coleps hirtus viridis достигает максимума исключительно в зоне оксиклина (рис. 5), другой миксотроф Didinium chlorelligerum – на границе аэробной и анаэробной зон. Под ней располагаются максимумы миксотрофов Prorodon viridis, Euplotes diadaleos, Histiobalantium natans и видов, характерных для придонных слоев и бентоса – Spirostomum teres, Frontonia leucas, Paramecium sp.
Как уже отмечалось, с увеличением продолжительности температурной стратификации меняется и распределение видов в толще воды. Так, в июне в анаэробных слоях (зоны III и IV) преобладают миксотрофы Prorodon viridis, Histiobalantium natans (рис. 5А), а в июле – «бентосные мигранты» Spirostomum teres, Plagiopyla nasuta (рис. 5Б).
Обсуждение
Полученные нами данные во многом являются подтверждением уже известных закономерностей вертикального распределения инфузорий в эвтрофных озерах с анаэробным гиполимнионом. Некоторые исследователи привязывают распределение инфузорий к изменению концентраций кислорода [8, 15], другие – только к изменению температуры [21, 22]. На наш взгляд, более правомерно рассматривать распределение инфузорий относительно оксиклина. В нашем случае в пруду Нижнем при относительно небольших глу-
Таблица. Частота встречаемости и вклад (по N) отдельных видов инфузорий
|
Виды |
Зоны |
|||||||
|
I |
II |
III |
IV |
|||||
|
частота |
% |
частота |
% |
частота |
% |
частота |
% |
|
|
Askenasia volvox |
67 |
1,1 |
75 |
0,1 |
- |
- |
- |
- |
|
Askenasia sp. |
- |
- |
- |
- |
8 |
0,004 |
- |
- |
|
Coleps hirtus |
17 |
0,04 |
- |
- |
8 |
0,004 |
- |
- |
|
Coleps hirtus viridis |
50 |
16,4 |
100 |
21,6 |
54 |
0,5 |
- |
- |
|
Linostoma vorticella |
- |
- |
25 |
0,3 |
15 |
0,02 |
- |
- |
|
Didinium chlorelligerum |
17 |
0,1 |
50 |
0,1 |
46 |
0,3 |
17 |
0,3 |
|
Didinium nasutum |
17 |
0,2 |
25 |
0,04 |
15 |
0,01 |
- |
- |
|
Euplotes diadaleos. |
- |
- |
75 |
1,1 |
100 |
1,9 |
83 |
3,0 |
|
Frontonia leucas |
- |
- |
25 |
0,1 |
100 |
4,4 |
33 |
10,2 |
|
Frontonia sp. |
- |
- |
- |
- |
8 |
0,02 |
17 |
1,0 |
|
Halteria grandinella |
100 |
19,0 |
100 |
0,7 |
46 |
0,1 |
- |
- |
|
Haltetia sp. |
50 |
7,2 |
50 |
3,8 |
31 |
0,1 |
- |
- |
|
Histiobalantium natans |
17 |
0,02 |
50 |
5,7 |
92 |
17,6 |
50 |
3,3 |
|
Lembadion bullinum |
33 |
0,1 |
50 |
1,3 |
100 |
1,4 |
17 |
0,3 |
|
Loxodea magnum |
- |
- |
- |
- |
38 |
0,1 |
- |
- |
|
Loxodes rostrum |
- |
- |
- |
- |
46 |
2,4 |
17 |
0,7 |
|
Paramecium aurelia complex |
17 |
0,02 |
50 |
0,3 |
69 |
4,4 |
17 |
0,3 |
|
P. bursaria |
- |
- |
25 |
0,04 |
8 |
0,02 |
- |
- |
|
Plagiopyla nasuta |
17 |
0,02 |
- |
- |
69 |
1,1 |
67 |
23,1 |
|
Prorodon sp. |
17 |
0,02 |
25 |
0,02 |
62 |
3,8 |
17 |
18,8 |
|
P. viridis |
- |
- |
50 |
27,1 |
100 |
46,9 |
83 |
25,8 |
|
Spirostomum teres |
33 |
0,2 |
25 |
0,02 |
62 |
8,6 |
50 |
7,6 |
|
Stentor roeseli |
- |
- |
25 |
1,8 |
23 |
0,1 |
- |
- |
|
Strombidium caudatum |
33 |
0,9 |
75 |
1,9 |
15 |
0,1 |
- |
- |
|
S. conicoides |
67 |
6,7 |
75 |
2,1 |
8 |
0,00 |
- |
- |
|
S. sulcatum |
100 |
28,1 |
100 |
7,8 |
31 |
0,1 |
- |
- |
|
Vorticella natans |
67 |
11,4 |
50 |
4,3 |
31 |
0,4 |
- |
- |
Примечание. Жирным шрифтом выделены виды со 100% встречаемостью и наибольшими значениями вклада вида в общую численность инфузорий; «-» – отсутствие вида.
бинах узкий оксиклин лежит внутри достаточно широкого термоклина, захватывающего большую часть водного столба. Максимум распределения инфузорий всегда приходится на металимнион, в котором он связан с градиентом кислорода, определяющим в первую очередь распределение пищевых объектов для инфузорий. Наличие неперемешива-ющегося слоя, вероятно, тоже накладывает отпечаток на распределение инфузорий. Поэтому для характеристики сообщества инфузорий планктона меромиктического водоема было выделено по глубине 4 основные зоны.
Нами показано, что в зоне оксиклина (II зона) сообщество инфузорий характеризуется более богатым видовым составом. Обусловлено это разнообразием пищевых объек- тов для инфузорий в этом узком слое и разнообразием экологических ниш, связанных с градиентом абиотических факторов.
Максимума развития (численности и биомассы) инфузории достигают не только в микроаэробной зоне или на границе аэробной и анаэробной зон, как указывалось во многих работах [8, 11, 13, 19], но и под оксиклином (III зона). В зоне оксиклина формируется общий максимум биомассы всех фо-тотрофных организмов (фитопланктона и аноксигенных бактерий), который образуется из пересекающихся достаточно узких зон высокой численности тех или иных видов [1]. Аналогичная картина происходит и с микрозоопланктоном: инфузории и коловратки образуют близко расположенные максимумы
А
Б
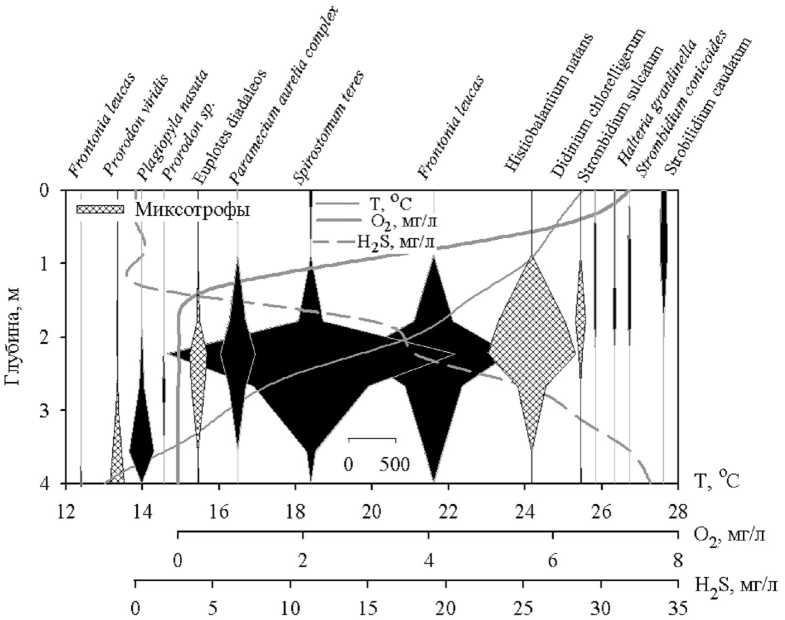
Рис. 5. Вертикальное распределение численности видов-доминантов инфузорий в Нижнем пруду и абиотических факторов среды 11.06.2004 (А) и 14.07.2004 (Б)
численности. Их близость к оксиклину обусловлена богатством пищевых ресурсов, где доминируют миксотрофные жгутиконосцы (криптофитовые, золотистые, эвгленовые), цианобактерии и фототофные (пурпурные серные) бактерии. «Почти все коловратки требовательны к содержанию растворенного в воде кислорода» [3], и отсутствие механизма защиты от действия бескислородных условий не позволяет коловраткам опускаться в анаэробные слои. Напротив, инфузории, в основном миксотрофные, получают преимущество перед коловратками, используя кислород зоохлорелл, и осваивают анаэробные условия. Кроме того, инфузории находятся с коловратками в отношениях пищевой конкуренции, с одной стороны, и хищничества – с другой. Видимо, обилие пищевых ресурсов в оксиклине, мощное развитие коловраток (рис. 3), вытесняющих инфузории в более низкие слои, и защитный механизм последних от бескислородных условий в виде симбиоза с водорослями – все вместе способствует образованию максимумов численности и биомассы миксотрофных инфузорий в анаэробной зоне (III), но близко к границе богатой кислородом и анаэробной водных масс.
Интересны взаимоотношения инфузорий с другими группами организмов в этой зоне. Так, в июне 2004 г. на 2,5 м располагались максимумы цианобактерий; на 3 м – пурпурных серных бактерий; на 3,5 м и 4 м – зеленых серных бактерий [1]. Таким образом, максимум численности инфузорий находился между пиками развития цианобактерий и зеленых серных бактерий и совпадал с максимумом численности пурпурных серных бактерий. Фототрофные бактерии потребляются многими инфузориями, развивающимися в анаэробной зоне. Пурпурными серными бактериями питаются Prorodon viridis , Histiobalantium natans, Spiristomum teres и др., [10, 16], зелеными серными бактериями – Loxodes magnus [6].
Пока остаются неясными причины резкого изменения видового состава и соответственно таксономической и трофической структур сообщества инфузорий в анаэробной зоне (III) от начала к моменту установления устойчивой термической стратификации. При осенней гомотермии хемоклин может опускаться до 3,5-4 м [1]. Вероятно, с установлением термической стратификации в слое от 2 м до этих глубин формируется сообщество, состоящее в основном из миксот-рофов. При более длительной термической стратификации оно замещается сообществом «бентосных мигрантов» (Metopus es, Spirosto-mum teres, Caenomorpha sp., Plagiopyla nasu-ta), не только способных выживать в бескислородных условиях, но и имеющих механизм защиты от токсичного действия сероводорода. Так, некоторые из перечисленных инфузорий содержат в цитоплазме «метанобразу-ющие бактерии, которые могут превращать поступающие из среды и, вероятно, токсичные для клетки ионы водорода в метан» [7]. Другой бентосный мигрант р. Loxodes способен к нитратному дыханию [14]. Возможно, эти изменения как-то связаны и с развитием только к августу в заметных количествах цианобактерии (Planktothrix sp.) [1].
Сообщество инфузорий в неперемешива-емой IV зоне тоже не остается неизменным даже за короткий период исследования. Если в начале термической стратификации в придонном слое встречались виды, характерные для III зоны ( Prorodon viridis, Paramecium aurelia complex, Urotricha sp., Lembadion bullinum ), то в июле-августе – в основном, сапропельные виды ( Brachonella spiralis, Plagiopyla nasuta, Spirostomum teres ) . Численность Prorodon viridis в придонном слое уменьшилась от мая к августу от 2124 до 6,6 тыс. экз./м3. Такое непостоянство состава (о чем свидетельствует и отсутствие видов со 100% встречаемостью) указывает на постоянную связь неперемешиваемого придонного слоя с грунтами и вышележащими слоями и на возможные миграции из них инфузорий. Таким образом, в короткий период летней стратификации влияние неперемешиваемо-го слоя на структуру сообщества инфузорий пока не выявлено.
Заключение
В целом проведенные в пруду Нижнем первые исследования инфузорий уже на данном этапе изучения показали, что в столбе воды от поверхностных слоев к придонным постепенно меняется соотношение вклада представителей разных классов, трофических и экологических групп в количественные характеристики сообщества планктонных инфузорий. Установлено, что летом видовое разнообразие сообщества инфузорий выше в зоне оксиклина. Максимумы численности инфузорий формируются в зоне под оксиклином (между максимумами коловраток и фототрофных бактерий), дополняя общую
Список литературы Вертикальное распределение инфузорий планктона в небольшом меромиктическом водоеме в летний период
- Горбунов М.Ю., Уманская М.В. К вертикальному распределению прокариотического фототрофного планктона в Нижнем пруду Самарского Ботанического сада//Самарская Лука: Бюл. 2007. № 19.
- Горбунов М.Ю., Уманская М.В., Краснова Е.С. Характеристика абиотических условий в экосистеме Нижнего пруда ботанического сада Самарского университета//Самарская Лука: Бюл. 2007. № 19.
- Кутикова Л.А. Коловратки фауны СССР (Rotatoria). Л.: Наука, 1970.
- Лаврентьев П.Я., Маслевцов В.В. Протозойный планктон разнотипных озер//Изменение структуры экосистем озер в условиях возрастающей биогенной нагрузки. Л.: Наука, 1988.
- Стойко Т.Г., Мазей Ю.А. Планктонные коловратки пензенских водоемов. Пенза: Изд-во ПГПУ, 2006.
- Уморин П.П., Лаптева Н.А. Изучение взаимоотношений фототрофных бактерий и инфузорий в экспериментальных условиях//Биол. внутр. вод. 2006. № 4.
- Хаусман К. Протозоология. М.: Мир, 1988.
- Bark A.W. Studies on ciliated protozoa in eutrophic lakes: 1. Seasonal distribution in relation to thermal stratification and hypolimnetic anoxia//Hydrobiol. 1985. V. 124.
- Bark A.W., Goodfellow J.G. Studies on ciliated protozoa in eutrophic lakes: 2. Field and laboratory studies on the effects of oxygen and other chemical gradients on ciliate distribution//Hydrobiol. 1985. V. 124.
- Bark A.W., Watts J.M. A comparison of the growth characteristics and spatial distribution of the hypolimnetic ciliates in a small lake and an artificial lake ecosystem//J. Gen. Microbiol. 1984. V. 130.
- Berninger U.G., Finlay B.J., Canter H.M. The Spatial Distribution and Ecology of Zoochlorellae-Bearing Ciliates in a Productive Pond//J. Protozool. 1986. V. 33, № 4.
- Chatton E., Lwoff A. Techniques pour l'etude des Protozoaires, specialement de leurs structures superficielles (cinetome et argyrome)//Bull. Soc. France Microsc. 1936. V. 5.
- Esteban G.F., Finlay B.J. Morphology and Ecology of the Cosmopolitan Ciliate Prorodon viridis//Archiv fu..r Protistenkunde. 1996. Bd. 147.
- Finlay B.J. Nitrate respiration by protozoa (Loxodes spp.) in the hypolimnetic nitrate maximum of productive freshwater pond//Freshwater Biol. 1985. V. 15.
- Finlay B.J. Protist taxonomy: an ecological perspective//Phil. Trans. R. Soc. Lond. 2004.
- Gomes Eli A.T., Godinho Mirna J.L. Structure of the protozooplankton community in a tropical shallow and eutrophic lake in Brasil//Acta Oecologica. 2003. V. 24.
- Guhl B.E., Finlay B.J., Schink B. Seasonal development of hypolimnetic ciliate communities in a eutrophic pond//FEMS Microbiol. Ecology. 1994. V. 14, I. 4.
- Kahl A. Urtiere oder Protozoa. 1. Wimpertiere oder Ciliata (Infusoria)//Die Tierwelt Deutschlands. Teil. 18, 21, 25, 30. Jena, 1930-1935.
- Kalytyte S D., Z y vikas A., Pas ykauskas R. Spatial and temporal changes of microplankton structure in North Lithuanian karst lakes//Botanica Lithuanica. 2002. V. 8 (4).
- Small, Lynn Phylum Ciliophora Doflein,1901//Lee J.J., Leedale G.F., Bradbury Ph. (eds.), An Illustrated guide to the protozoa second edition. Society of Protozoologists, Lawrence, Kansas: Allen Press, 2000.
- Zingel P. Vertical and seasonal dynamics of planktonic ciliates in a strongly stratified hypertrophic lake//Hydrobiol. 2005. V. 547.
- Zingel P., Ott I. Vertical distribution of planktonic ciliates in a strongly stratified temperate lakes//Hydrobiol. 2000. V. 435.


