Видовой состав и структура комплекса членистоногих-некробионтов Южной Карелии
Автор: Лябзина Светлана Николаевна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 4 (117), 2011 года.
Бесплатный доступ
Членистоногие-некробинты, некрофаги, трупы, редуценты, карелия
Короткий адрес: https://sciup.org/14749902
IDR: 14749902
Текст статьи Видовой состав и структура комплекса членистоногих-некробионтов Южной Карелии
Среди огромного числа членистоногих существует группа некробионтов, связанная с трупами. В процессе их деятельности происходит разложение мертвой органики до простых минеральных веществ, которые становятся доступными для других организмов. Кроме того, утилизируя гнилостные ткани, некробионты выполняют санитарную функцию. Полное разложение трупов в природных условиях происходит за счет деятельности целого комплекса организмов: микроорганизмов, плесневых грибов, водорослей, членистоногих и позвоночных-мусорщиков, но членистоногие являются самыми эффективными утилизаторами тканей.
Видовой состав членистоногих-некробион-тов на трупах животных подробно рассмотрен в работах ряда авторов [14], [23], [33]. На севере Европейской части России изучение в целом комплекса некробионтов в наземных экосистемах ранее не проводилось. Имеются данные по энтомофауне трупов животных в Ленинградской области [11]; эти сведения касаются преимущественно отдельных групп насекомых и предназначены для практического применения в судебной медицине [17].
Цель работы состояла в изучении членисто-ногих-некробионтов Южной Карелии.
МАТЕРИАЛ И МЕТОДИКА
Место исследований
Работа проводится в весенне-осенние периоды с 2000 года в южных районах Карелии: Кондопожский район (биологическая станция ПетрГУ в с. Кончезеро, заповедник «Кивач»), Прионежский район (с. Лососинное), Сортавальский район (о. Валаам) и окрестности г. Петрозаводска.
Исследования некрофильного комплекса проводили по общепринятым методикам, выкладывая трупы на поверхность почвы или помещая их в почвенные ловушки Барбера. В качестве ло © Лябзина С. Н., 2011
вушек использовали банки объемом 0,5 л, дно которых присыпали землей и сверху укладывали трупы мелких животных (лягушки, птицы, землеройки). Это позволяло проследить весь цикл разложения и ограничивало вероятность утаскивания позвоночными. Приманки средних и крупных размеров позвоночных животных (массой до 20 кг) выкладывались на поверхность почвы, предварительно очищенной от растительности и дерна. Для снижения влияния приманок друг на друга их размещали на расстоянии более 100 м. Некрофильные насекомые имеют очень хорошо развитое обоняние: ориентируясь по запаху, жуки-некрофаги способны находить труп в радиусе до 90 м, а падальные мухи в лиственном лесу - на расстоянии 80 м [28]. Д. Вилсон и Дж. Фудже [36] рекомендуют располагать приманки на расстоянии не менее 90 м, а при использовании банки-ловушки с приманками - более 100 м.
Материал раскладывался в различных типах лесных (сосняки, ельники, березняки), открытых (влажноразнотравные, суходольные луга) биогеоценозов и в агроценозах.
Сбор насекомых производился общепринятыми методами: энтомологическим сачком, пробиркой и эксгаустером. Обследование и сбор материала осуществляли ежедневно в течение всего периода разложения. С крупной падали на последних стадиях до полной утилизации мягких тканей сбор проводился раз в неделю. Все наблюдения проводились в дневное время, когда отмечался наибольший пик активности животных.
Для идентификации видов двукрылых и жесткокрылых, связанных с трупом личинок их собирали и выращивали в лабораторных условиях по методике Е. Б. Виноградовой [4] на кусочках сырого мяса, печени или фрагментах тканей, взятых вместе с ними. Личинок собирали с различных участков трупа и почвенного слоя под ним.
При изучении разложения трупов в естественных условиях были проведены исследования по выявлению роли муравьев в утилизации мертвой органики. Трупы животных (рыжей полевки массой 35-40 г) выкладывали на различных участках: на верхушку наружного купола муравейника, самую оживленную тропу и вдалеке от муравейника. В этих экспериментах использовали как «свежие» трупы (менее 1 дня разложения), так и протухшие (с 9-дневным сроком) с сильным запахом.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Видовой состав некрофильных членистоногих
В наземных биоценозах на трупных приманках зарегистрированы 136 видов членистоногих из 9 отрядов 2 классов (табл. 1). Основу комплекса составляют отряд Жесткокрылые (78 видов) и отряд Двукрылые (43 вида). Численное преобладание двукрылых и жесткокрылых в комплексе отмечено во всех работах, рассматривающих комплекс, но в разных районах их роль как утилизаторов неодинакова. В засушливых местах и аридных районах основная роль принадлежит жесткокрылым и их личинкам [14], [16]. Напротив, в районах с избыточной влажностью (Европейская часть России, Дальний Восток) процесс разложения осуществляется главным образом за счет личинок двукрылых [11], [12].
Таблица 1
Состав некрофильных членистоногих
|
отр. Тараканы (Blattodea) |
1 |
1 |
|
отр. Клопы (Hemiptera) |
1 |
1 |
|
отр. Жесткокрылые (Coleoptera) |
13 |
78 |
|
отр. Перепончатокрылые (Hymenoptera) |
3 |
6 |
|
отр. Скорпионовые мухи (Mecoptera) |
1 |
1 |
|
отр. Чешуекрылые (Lepidoptera) |
3 |
4 |
|
отр. Двукрылые (Diptera) |
13 |
43 |
|
Всего |
37 |
136 |
Среди жесткокрылых наибольшее число видов представлено сем. Коротконадкрылые жуки (Staphylinidae) - 29 видов (табл. 2). На трупах Staphylinidae преобладает не только по видовому составу, но и по численности. В большом количестве встречаются хищные виды Philonthus succicola, Ph.marginatus, Ontholestes tessulatus. Их численность зависит от обилия личинок дву крылых, которыми они питаются. Крупные виды (Ontholestes spp.) способны нападать на мелких падальных жуков и имаго двукрылых. В почве, пропитанной трупным соком, обильны мелкие сапрофаги Omalium septentrionis, Megarthrus denticollis, Proteinus brachypterus и др.
Среди жесткокрылых имеется и специализированная группа некрофагов - семейство Мертвоеды (Silphidae). На трупных приманках отмечено 11 видов. Виды Nicrophorus vespilloides , N. vespillo , N. invetstigator, Necrodes littoralis , Thanatophilus sinuatus , Th. rugosus , Oiceoptoma thoracica распространены очень широко и зарегистрированы на всех приманках, другие - Silpha carinata и S. tristis - приурочены к открытым хорошо инсолированным участкам, но на падали отмечаются редко.
Жуки-могильщики активно питаются на трупах, здесь также проходит размножение жуков и развитие их личинок. Представители р. Nicrop-horus обнаруживают трупы быстро, и в первые сутки на приманках мышей можно отловить в среднем до 10 особей, но из-за жесткой конкуренции остается только одна пара (более сильные самец и самка). Чтобы отложить яйца и ухаживать за своими личинками, могильщики могут зарывать небольшие трупы массой до 80 г и оставаться на них до окукливания личинок. Такое субсоциальное поведение характерно только для жуков-могильщиков и не отмечено у поверхностно-падальных мертвоедов этого семейства (родов Necrodes , Thanatophilus , Oiceo-ptoma , Silpha ).
Семейство Карапузиков (Нisteridae) представлено 9 видами (табл. 2). На падали в большом числе встречаются имаго Margarinotus cadaverinus , Saprinus semistriatus , S. immundus и S. planiusculus . В районах исследования эти виды составляют основу некрофильных гистерид и обильны на всех трупах животных. Реже встречаются виды, которые отмечены как обитатели других эфемерных субстратов, такие как Hister unicolor, Margarinotus ventralis , обычные в навозе, M. striola - в грибах, и нидикольный вид Gnathoncus nanus .
В течение всего периода разложения мягких тканей многочисленны мелкие падальные жуки семейства Leiodidae. Catops nigrita доминирует в еловых лесах, а Sciodrepoides vatsoni - в сосновых и лиственных. Жуки, как правило, избегают открытых пространств, но последний вид может встречаться на низинных участках лугов . Жуки в массе присутствуют как на крупной, так и на мелкой падали, при этом больше предпочитают трупы с волосяным покровом.
Фауна Кожеедов семейства Dermestidae небогата, на приманках отмечены три вида (табл. 2). Их присутствие зависит от влажности воздуха: в сухую погоду жуки могут встречаться как на «свежем» трупе, так и на последних стадиях его разложения, а при избыточной влажности они исчезают.
Таблица 2
Видовой состав и тип питания членистоногих, связанных с трупом
Царство Животные (Zoa)
Раздел Билатеральные (Bilateria)
П/раздел Первичноротые (Protostomia)
тип Члинистоногие (Artһroрoda)
|
Carabidae |
Pterostichus niger (Scһaller, 1783) |
зоофаг |
|
Hydroрһilidae |
Cercyon crenatum (Kugelann, 1794) |
сапрофаг |
|
C. impressus (Sturm, 1807) |
сапрофаг |
|
|
C. lateralis (Marsһam, 1802) |
сапрофаг |
|
|
C. unipunctatus (Linnaeus, 1758) |
сапрофаг |
|
|
Cryptopleurum minutum (Fabricius, 1775) |
сапрофаг |
|
|
Megasternum obscurum (Marsһam, 1802) |
сапрофаг |
|
|
Histeridae |
Gnathoncus nanus (Scriba, 1790) |
зоофаг |
|
Hister unicolor (Linnaeus, 1758) |
зоофаг |
|
|
Margarinotus cadaverinus (Hoffmann, 1803) |
зоофаг |
|
|
M. striola (Saһlberg, 1834) |
зоофаг |
|
|
M. ventralis (Marseul, 1854) |
зоофаг |
|
|
Saprinus aeneus (Fabricius, 1775) |
зоофаг |
|
|
S. immundus (Gyllenһal, 1808) |
зоофаг |
|
|
S. planiusculus (Motscһulsky, 1849) |
зоофаг |
|
|
S. semistriatus (Scriba, 1790) |
зоофаг |
|
|
Leiodidae |
Anisotoma humeralis (Fabricius, 1792) |
сапрофаг / некрофаг |
|
Catops coracinus (Kellner, 1846) |
сапрофаг / некрофаг |
|
|
Catops neglectus (Kraatz, 1852) |
сапрофаг / некрофаг |
|
|
Catops picipes (Fabricius, 1792) |
сапрофаг / некрофаг |
|
|
Sciodrepoides watsoni (Sрence, 1815) |
сапрофаг / некрофаг |
|
|
Silрһidae |
Necrodes littoralis * (Linnaeus, 1758) |
некрофаг |
|
Nicrophorus invetstigator * (Zetterstedt, 1824) |
некрофаг |
|
|
N. vespillo * (Linnaeus, 1758) |
некрофаг |
|
|
N. vespilloides * (Herbst, 1783) |
некрофаг |
|
|
Oiceoptoma thoracica * (Linnaeus, 1758) |
некрофаг |
|
|
Silpha carinata * (Herbst, 1783) |
сапрофаг / некрофаг |
|
|
S. obscura (Linnaeus, 1758) |
сапрофаг / некрофаг |
|
|
S. tristis (Illiger, 1798) |
сапрофаг / некрофаг |
|
|
Thanatophilus dispar * (Herbst, 1793) |
некрофаг |
|
|
Th. rugosus * (Linnaeus, 1758) |
некрофаг |
|
|
Th. sinuatus * (Fabricius, 1775) |
некрофаг |
|
|
Staрһylinidae |
Aleochara curtula (Goeze, 1777) |
паразитоид |
|
Atheta cadaverina (Brisout, 1860) |
сапрофаг |
|
|
A. crassicornis (Fabricius, 1792) |
сапрофаг |
|
|
A. subtilis (Scriba, 1866) |
сапрофаг |
|
|
A. trinotata (K raatz, 1856) |
сапрофаг |
|
|
Creophilus maxillosus * (Linnaeus, 1758) |
зоофаг / некрофаг |
|
|
Deliphrum tectum (Payk ull, 1789) |
сапрофаг |
|
|
Gyrohypnus fracticornis (Miiller, 1776) |
зоофаг |
|
|
Megarthrus denticollis (Beck, 1817) |
сапрофаг |
|
|
M. nitidulus (K raatz, 1858) |
сапрофаг |
|
Продолжение табл. 2 |
||
|
Omalium rivulare (Paykull, 1789) |
сапрофаг |
|
|
O. septentrionis (Tһomson, 1857) |
сапрофаг |
|
|
Ontholestes murinus (Linnaeus, 1758) |
зоофаг |
|
|
O. tessulatus (Geoffroy, 1785) |
зоофаг |
|
|
Oxytelus rugosus (Fabricius, 1775) |
зоофаг |
|
|
Proteinus brachypterus (Fabricius, 1792) |
сапрофаг |
|
|
Philonthus aeneus (Rossi, 1790) |
зоофаг |
|
|
Ph. addendus (Sһarр, 1867) |
зоофаг |
|
|
Ph. albipes * (Gravenһorst, 1802) |
зоофаг |
|
|
Ph. rotundicollis (Menetries, 1832) |
зоофаг |
|
|
Ph. carbonarius (Gravenһorst, 1802) |
зоофаг |
|
|
Ph. fi metarius * (Gravenһorst, 1802) |
зоофаг |
|
|
Ph. marginatus (Stroem, 1768) |
зоофаг |
|
|
Ph. nitidus (Gravenһorst, 1802) |
зоофаг |
|
|
Ph. sanguinolentus (Gravenһorst, 1802) |
зоофаг |
|
|
Ph. succicola * (Tһomson, 1860) |
зоофаг |
|
|
Ph. varians (Paykull, 1789) |
зоофаг |
|
|
Tachinus laticollis (Gravenһorst, 1802) |
сапрофаг |
|
|
T. lignorum (Linnaeus, 1758) |
сапрофаг |
|
|
T. marginellus (Fabricius, 1792) |
сапрофаг |
|
|
T. pallipes (Gravenһorst, 1806) |
сапрофаг |
|
|
T. signatus (Gravenһorst, 1802) |
сапрофаг |
|
|
Ptiliidae |
Acrotrichis parva (Rosskotһen, 1935) |
сапрофаг |
|
Scarabaeidae |
Aphodius rufi pes (Linnaeus, 1758) |
сапрофаг / некрофаг |
|
Geotrupes stercorarius (Linnaeus, 1758) |
сапрофаг / некрофаг |
|
|
G. stercorosus ( Scriba, 1791) |
сапрофаг / некрофаг |
|
|
Dermestidae |
Anthrenus scrophulariae (Linnaeus, 1758) |
кератофаг |
|
Dermestes ater (Degeer, 1774) |
кератофаг |
|
|
D. murinus (Linnaeus, 1758) |
кератофаг |
|
|
Cleridae |
Necrobia violacea (Linnaeus, 1758) |
кератофаг |
|
Elateridae |
Prosternon tessellatum (Linnaeus, 1758) |
некрофаг |
|
Nitidulidae |
Omosita depressa * (Linnaeus, 1758) |
кератофаг |
|
O. colon (Linnaeus, 1758) |
кератофаг |
|
|
Nitidula bipunctata * (Linnaeus, 1758) |
кератофаг |
|
|
Cryрtoрһagidae |
Atomaria sp . |
мицетофаг |
|
отр. Перепончатокрылые (Hymenoptera) |
||
|
Aрidae |
Vespula vulgaris (Linnaeus, 1758) |
зоофаг |
|
Formicidae |
Formica polyctena (Forster, 1850) |
зоофаг / некрофаг |
|
Lasius niger (Linnaeus, 1758) |
зоофаг / некрофаг |
|
|
Myrmica rubra (Linnaeus, 1758) |
зоофаг / некрофаг |
|
|
Braconidae |
Alysia manducator * (Panzer, 1799) |
паразитоид |
|
отр. Скорпионовые мухи (Mecoptera) |
||
|
Panorрidae |
Panorpa communis (Imһoff, Labram, 1845) |
некрофаг |
|
отр. Чешеукрылые (Lepidoptera) |
||
|
Tineidae |
sр. |
кератофаг |
|
Nymрһalidae |
Argynnis aglaja (Linnaeus, 1758) |
** |
|
Limenitis populi (Linnaeus, 1758) |
** |
|
|
Satyridae |
Erebia ligea (Linnaeus, 1758) |
** |
|
отр. Двукрылые (Diptera) |
||
|
Pһoridae |
Aneurinae unispinosa * (Zetterstedt, 1838) |
некрофаг |
|
Megaselia sp. |
некрофаг |
|
|
Dryomyzidae |
Neuroctena anilis * (Fallén, 1820) |
некрофаг |
|
Seрsidae |
Nemopoda nitidula * (Fallén, 1820) |
некрофаг |
|
Pioрһilidae |
Mycetaulus bipustulatus (Fallén, 1823 ) |
некрофаг |
|
Parapiophila vulgaris * (Fallén, 1820) |
некрофаг |
|
|
Helomyzidae |
Helomyza serrata (Linnaeus, 1758) |
некрофаг |
|
Suillia inornata (Loew, 1862) |
некрофаг |
|
Окончание табл. 2
|
Sрһaeroсeridae |
Copromyza sp. |
некрофаг |
|
Leptocera sp. |
некрофаг |
|
|
Sphaerocera sp. |
некрофаг |
|
|
Drosoрһilidae |
Drosophila busckii * (Coquillett, 1901) |
некрофаг |
|
Cһloroрidae |
Stearibia nigriceps * (Meigen, 1826) |
некрофаг |
|
Antһomyiidae |
Antomyia procellaris (Rondani, 1866) |
некрофаг |
|
Fanniidae |
Fannia canicularis * (Linnaeus, 1761) |
некрофаг / зоофаг |
|
F. coracina * (Loew, 1873) |
некрофаг/ зоофаг |
|
|
F. manicata * (Meigen, 1826) |
некрофаг / зоофаг |
|
|
F. scalaris * (Fabricius, 1794) |
некрофаг / зоофаг |
|
|
F. serena * (Fallén, 1825) |
некрофаг / зоофаг |
|
|
Muscidae |
Hydrotaea borussica (Stem, 1899) |
некрофаг / зоофаг |
|
H. dentipes * (Fabricius, 1805) |
некрофаг / зоофаг |
|
|
Graphomyia maculata * (Scoрoli, 1763) |
некрофаг / зоофаг |
|
|
Muscina assimilis *(Fallén, 1823) |
некрофаг / зоофаг |
|
|
M. pabulorum * (Fallén, 1817) |
некрофаг / зоофаг |
|
|
Mydaea urbana (Meigen, 1826) |
некрофаг/ зоофаг |
|
|
Оphyra leucostoma * (Wiedemann, 1817) |
некрофаг / зоофаг |
|
|
Orthellia caesarion (Meigen, 1826) |
некрофаг |
|
|
Calliрһoridae |
Lucilia caesar * (Linnaeus, 1758) |
некрофаг |
|
L. illustris * (Meigen, 1826) |
некрофаг |
|
|
L. silvarum * (Meigen, 1826) |
некрофаг |
|
|
Calliphora loewi (Enderlein, 1903) |
некрофаг |
|
|
C. subalpina (Ringdaһl, 1931) |
некрофаг |
|
|
C. uralensis * (Villeneuve, 1922) |
некрофаг |
|
|
C. vomitoria (Linnaeus, 1758) |
некрофаг |
|
|
C. vicina * (Robineau‒Desvoidy, 1830) |
некрофаг |
|
|
Cynomya mortuorum * (Linnaeus, 1761) |
некрофаг |
|
|
Protophormia terraenovae * (Robineau‒Desvoidy, 1830) |
некрофаг |
|
|
Sarcoрһagidae |
Helicophagella melanura * (Meigen, 1826) |
некрофаг |
|
Parasarcophaga albiceps * (Meigen, 1826) |
некрофаг / зоофаг |
|
|
P. caerulescens * (Zetterstedt, 1838) |
некрофаг / зоофаг |
|
|
P. portchinskyi * (Roһdendorf, 1937) |
некрофаг / зоофаг |
|
|
P. similis * (Meade, 1876) |
некрофаг / зоофаг |
|
|
Pierretia socrus (Rondani, 1860) |
некрофаг |
Примечание. * ‒ личинки, выведенные с трупов в лабораторных условиях.
** ‒ отмечено питание трупным соком.
Наоборот, в аридных условиях кожееды являются основными утилизаторами трупов и занимают доминирующее положение среди некроби-онтов [14]. Сухожилия и останки трупов перерабатываются кератофагами (семейства Cleridae, Nitidulidae). На приманках встречаются как взрослые жуки, так и их личинки ( Omosita depressa , O. colon , Nitidula bipunctata , Necrobia violacea ).
На крупной падали всегда присутствуют коп-робионты из скарабеид Aphodius rufi pes , навозники Geotrupes stercorosus , G. stercorarius . Навозники делают неглубокие норки вблизи трупа или под ним, затаскивая туда части тканей или шерсть. По мнению Ю. Л. Абрамова [1], копрофагия у личинок и имаго некоторых видов навозников не является облигатным типом питания, и в определенных условиях они могут переходить к некрофагии. В лесах они также встречаются в гниющих плодовых телах грибов.
Довольно часто при избытке влажности трупы покрываются плесневыми грибками, что привлекает большое число мелких жуков мице-то- и сапрофагов из семейств Cryрtoрһagidae, Ptilidae, Hydroрһilidae (табл. 2).
Основную роль в процессе деструкции органического вещества выполняют двукрылые и их личинки. В различных типах биоценозов зарегистрированы 43 вида некрофильных двукрылых из 13 семейств (табл. 2). Большая часть принадлежит семействам Calliрһoridae (10 видов), Muscidae (8 видов) и Sarcoрһagidae (6 видов). Аналогичная картина некрофильного состава двукрылых отмечена для Средней и Северной Финляндии [25], [29]. Преобладание каллифо-рид в некрофильных комплексах характерно для зоны тайги и лесотундры. Например, на Южном Ямале основу некрофильного диптероидного комплекса составляют два семейства ‒ Cal-liрһoridae и Muscidae [2].
Комплекс некрофильных двукрылых в каждом биоценозе складывается соответственно условиям, характерным для данного биотопа. Повышенная инсоляция на открытых пространствах в летний период приводит к высыханию трупа и обеднению видового состава некробионтов. Высокая затененность в мелколиственном лесу не позволяет светолюбивым видам (Graphomyia maculata , Muscina assimilis ) активно колонизировать трупы. Такие эврибионтные и обладающие высокой плодовитостью виды, как Hydrotaea dentipes , Protophormia terraenovae , Parapiophila vulgaris , Nemopoda nitidula , активно заселяющие трупы в открытых биотопах, также являются основными утилизаторами и в лесах [9].
Встречаемость двукрылых на приманках различных животных различна. Мелкие трупы грызунов колонизируют мушки Aneurina unispinosa из семейства Горбатки (Phoridae), которые могут откладывать яйца на тушки, уже зарытые жуками-могильщиками. Представителей семейства Муравьевидок (Sepsidae) привлекают трупы, которые способны дольше сохранять влагу за счет волосяного покрова, замедляющего испарение, поэтому они чаще встречаются на крупных трупах млекопитающих и птиц.
Двукрылые активно колонизируют трупы во всех типах биоценоза, и главную роль в процессе утилизации принадлежит их личинкам. За период исследований из различных трупов выведены имаго 28 видов мух (табл. 2). В огромном количестве присутствуют личинки Calliphora vicina , P. terraenovae , Lucilia caesar, Hydrotaea dentipes , Muscina assimilis , Fannia manicata , Helicophagella melanura , Parasarcophaga albiceps и плодовых мушек Drosophila busckii. Их высокое обилие определяется и тем, что большинство видов являются полифагами и способны развиваться не только на трупах, но и в навозе, фекалиях и кухонных отбросах [5], [8].
Личинки разжижают ткани, выделяя секрет из пищеварительных желез, и питаются образовавшимся трупным бульоном. В период активного роста температура внутри трупа увеличивается за счет метаболического тепла до 30-35 ° C (при температуре воздуха 23 ° C, почвы - 19 ° C) и поддерживается круглосуточно в течение нескольких дней. Это создает благоприятные микроклиматические условия, которые ускоряют развитие насекомых [4].
Для некрофильных двукрылых также характерна межвидовая конкуренция. Крупные мухи Parasarcophaga spp. , Calliphora spp. на трупах агрессивны и изгоняют более мелких двукрылых. Личинки некоторых родов Fannia , Parasarcophaga , Muscina , Hydrotaea сочетают некро-фагию с хищничеством и уничтожают яйца и личинок других мух [8], [30].
В составе комплекса некрофильных членистоногих отмечены паразитоиды - Alysiina manducator (отряд Перепончатокрылые) и Aleo- chara curtula (отряд Жесткокрылые). Спектр паразитирования A. manducator довольно широк: они паразитируют на личинках двукрылых и некоторых коротконадкрылых жуков [27]. Самки способны откладывать яйца в личинок хозяев почти любого возраста, при этом у зараженных особей происходит изменение гормональной системы и метаморфоза, что необходимо для успешного завершения развития паразита [18]. Личинки жуков Aleochara curtula являются паразитами пупариев двукрылых. Пупарий поражает только одна личинка, которая начинает питаться содержимым, растет и для окукливания уходит в почву [31].
Почти все жуки приносят с собой на труп па-разитиформных клещей Poecilochirus necrophori. Имеется две точки зрения на форетические отношения клещей с мертвоедами. Согласно первой из них, клещи уменьшают конкуренцию между жуками и личинками двукрылых, уничтожая последних. В эксперименте Спрингет [34] показал, что при отсутствии клещей пара жуков не могла дать никакого потомства, но если жуки вместе приносили 30 клещей, то клещи уничтожали все яйца падальных мух и потомство жуков выживало. Согласно второй точке зрения, клещи - паразиты жуков, которые поедают отложенные яйца своих хозяев и тем самым снижают их численность [35].
Структура комплекса некробионтов
При анализе комплекса членистоногих-не-кробионтов использована классификация, предложенная Брааком [20], которая основана на экологических связях отмеченных видов с трупом. Автор выделяет три группы:
-
1. Облигатные некрофаги - виды, специализирующиеся на падали, питание и развитие которых связано с трупами животных;
-
2. Факультативные некрофаги - виды, для которых трупные ткани являются дополнительным источником питания и местом развития личинок, и факультативные некробионты - виды, которых привлекает обилие насекомых, грибов, водорослей, связанных с разлагающимися тканями;
-
3. Случайные посетители трупов.
Группа облигатных некрофагов немногочисленна. Она включает жуков-могильщиков, мертвоедов, кожеедов и кератофагов (жуки семейств Cleridae, Nitidulidae и моли Tineidae). Их личинки развиваются исключительно на мертвых тканях и останках животных.
Самой многочисленной группой являются виды, факультативно связанные с трупами . Факультативная некрофагия отмечена у целого ряда насекомых и сочетается с основным типом питания у лесного таракана (Ectobius lapponicus), имаго и личинок щелкунов (Prosternon tessel-latum), хищника серого (Creophilus maxillosus), скорпионницы обыкновенной (Panorpa communis ).
По мнению Б. М. Мамаева и др. [10], питаясь мертвыми тканями, животные восполняют недостаток белковых веществ. Ко второй группе также относятся личинки некрофильных двукрылых, паразитоиды, мицетофаги, сапрофаги и зоофаги. Эти насекомые обладают широкой экологической пластичностью и могут встречаться и питаться в других разлагающихся субстратах (в грибах, гниющих растительных остатках, экскрементах человека и животных) [6], [13].
Состав третьей группы небогат, находки ее представителей на приманках единичны. Обилие доступной пищи привлекает некоторых зоофагов: пауков (Clubiona sp .), клопов (Pyrrhocoris marginatus), жужелиц (Pterostichus niger) и ос (Vespula vulgaris). Осы активно нападают как на небольших (Fannia , Muscina ), так и на крупных мух (Protophormia , Calliphora ), однако добычей чаще становятся двукрылые небольшого размера. Осы преимущественно встречаются на крупных трупах, но также находились на мышах [19]. Жужелицы могут уничтожать личинок могильщиков и мертвоедов . В период активного разложения, когда сильно разжижены ткани, трупный сок может привлекать дневных чешуекрылых (ленточника тополевого Limenitis populi , перламутровку аглая Argynnis aglaja , чернушку лигея Erebia ligea ).
Среди трофических групп наибольшую долю видов в комплексе составляют облигатные и факультативные некрофаги - 47 % (рис. 1). Они утилизируют основную массу трупа. Питаясь тканями, некрофаги нарушают их целостность и создают благоприятные условия для проникновения и развития микроорганизмов, что приводит к ускорению процесса разложения.
4% 1%
24%
47%
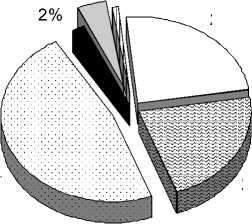
22%
некрофаги кожееды кератофаги паразитоиды зоофаги сапрофаги
Рис. 1. Трофическая структура комплекса членистоногих-некробионтов
Около трети видового состава представлено зоофагами (24 %), которые регулируют численность некробионтов (особенно личинок двукрылых). Например, среднее количество яиц, отложенных мясной мухой C. vicina на труп мыши массой 25-35 г, составляет от 100 до 300, но в результате развивается не более 50, то есть 17 % [32]. Многие виды жесткокрылых и личинки двукрылых совмещают некрофагию с зоофа-гией (табл. 2).
На последних стадиях, а также весной и осенью разложение происходит за счет сапрофагов. Сапрофильный комплекс включает в себя почвенных беспозвоночных, потребляющих гниющую органику, питающихся водорослями и микроскопическими грибами [15]. Утилизация волос, перьев, рогов, костной ткани протекает медленно. Небольшой видовой состав и численность кератофагов и кожеедов не позволяют им самостоятельно полностью завершить этот процесс, и утилизация происходит с участием микроорганизмов [3], а также под воздействием абиотических факторов.
На трупах всегда присутствуют муравьи: на лугах и в агроценозах Lasius niger , Myrmica rubra , в хвойных лесах Formicapolyctena , F aqui-lonia . Трупы мышей, расположенные в 50 м от муравейника, муравьи-фуражиры F. polyctena обнаруживают в течение нескольких минут. Появление муравьев всегда приводит к резкому обеднению состава некробионтов и затягиванию всего процесса разложения в 2-3 раза. Муравьи уничтожают некрофильных личинок, могут нападать на имаго двукрылых и жуков, особенно легкая добыча для них - только что вышедшие мухи из пупариев.
Участие муравьев в разложении трупов отмечено многими авторами и учитываются в судебной медицине [21], [22], [24]. По литературным данным, некрофагия встречается и у других видов муравьев. Например, Кларк и Блом [23] отмечают питание трупами позвоночных животных у красных огненных муравьев (Solenopsis invicta Buren) . В экспериментах по питанию F. polyctena также установлен факт некрофагии. Муравьи питаются как «свежими», так и сильно разложившимися трупными тканями. Трупы мышей, расположенные на муравьиной тропе, полностью перерабатываются муравьями в течение 5 дней (при температуре воздуха 18 ° С), на куполе муравейника - за сутки. Муравьи либо заносят в муравейник волоски, кусочки тканей, либо обкладывают трупы хвоинками.
Сукцессия некробионтов
В процессе разложения происходит изменение состояния трупных тканей, которые вызывают смену населения трупа. Последовательно сменяя друг друга, некробионты осуществляют полное разложение и утилизацию мертвых тканей. Сукцессия наблюдается на всех трупах позвоночных животных, но более длительный период разложения крупной падали позволяет лучше проследить изменения в составе населения некробионтов и выделить основные этапы разложения.
Первыми трупы обнаруживают двукрылые Calliphoridae, жуки-могильщики Silphidae и мелкие падальные жуки Leiodidae (рис. 2). Двукрылых из семейств Mucsidae, Fanniidae и Sarcophagidae привлекают слегка разложившие- ся трупы, но численность Calliphoridae при этом остается очень высокой. Обилие личинок двукрылых увеличивает присутствие зоофагов и паразитов (Histeridae, Staphylinidae, подсемейство Alysiina). Когда ткани сильно разжижены, на трупах среди двукрылых многочисленны Piop-hilidae и Sepsidae. Последующие этапы характеризуются усилением активности жуков сапрофагов и кератофагов и снижением привлекательности трупа для двукрылых.
Отряды Семейства
Coleopera Silphidae
Leiodidae Staphylinidae Hydrophilidae Histeridae Scarabaeidae Nitidulidae Dermestidae
Diptera Calliphoridae Sarcophagidae Muscidae Fanniidae Helomizidae Phoridae Sepsidae Sphaeroceridae Piophilidae Driomyzidae
Hymenoptera Formicidae Braconidae
1 5 10 15 20 25 30 35 40 45 50 55 60 65 70
дни разложения отмечены в большом количестве присутствие
Рис. 2. Смена состава некрофильных насекомых в процессе разложения (в летнее время, масса трупа - 5 кг)
ЗАКЛЮЧЕНИЕ
В Южной Карелии на трупах животных зарегистрированы 136 видов некрофильных членистоногих из 9 отрядов 2 классов, в основном представители отрядов Жесткокрылые (78 видов) и Двукрылые (43 вида). На трупах развивается огромное количество личинок жуков из семейств Мертвоеды, Блестянки, Коротконадрылые, но основная часть тканей утилизируется двукрылыми. Из различных трупных приманок выведе ны имаго 28 видов двукрылых. Личинки массовых видов (Protophormia terraenovae, Lucilia caesar, Hydrotaea dentipes, Nemopoda nitidula, Fannia manicata, Parasarcophaga albiceps) участвуют в разложении во всех типах биоценоза.
Комплекс некробионтов состоит из трех групп. Первая группа - небольшое число облигатных видов , специализирующихся на падали кожеедов, кератофагов и некрофагов. Их питание и развитие тесно связано с трупами. Вторая группа факультативных некрофагов и некро-бионтов включает большое число членистоногих (47 %). Для них трупные ткани являются дополнительным источником питания и развития; также некробионтов привлекает обилие организмов, обитающих на разлагающихся останках. Третья группа - случайные посетители, которые не участвуют в разложении и не относятся к трупной фауне.
В комплексе некробионты представлены разнообразными трофическими группами (некро-, зоо-, керато-, сапрофаги, кожееды, паразитои-ды), которые используют различные ткани трупа на разных стадиях разложения. Тем самым достигается наиболее полная утилизация. Некоторые некробионты сочетают основной тип питания с некрофагией. Например, рыжие лесные муравьи на трупах ведут себя как зоофаги, уничтожая личинок и имаго насекомых, как и некрофаги, способные утилизировать трупы мышей за короткий срок (24 ч).
БЛАГОДАРНОСТИ
Автор выражает искреннюю благодарность за помощь в определении и ценные советы А. Ю. Солодовникову (ЗИН РАН), А. В. Полевому (КарНЦ РАН), А. Л. Озерову (Зоомузей МГУ).
Список литературы Видовой состав и структура комплекса членистоногих-некробионтов Южной Карелии
- Абрамов Ю. Л. О некрофагии (Corpus lunaris L., Coleoptera: Scarabaeidae)//Зоологический журнал. 1968. Т. 47. № 8. С. 1251-1252.
- Басихин П. В., Петрова А. Д. Некрофильные двукрылые (Diptera) лесотундры Южного Ямала//Зоологический журнал. 1991. Т. 70. № 7. С. 68-72.
- Белова Э. В., Манучарова Н. А., Степанов А. Л., Полянская Л. М. Разложение хитина микробами в различных почвах//Почвоведение. 2006. № 9. С. 1082-1087.
- Виноградова Е. Б. Диапауза мух и ее регуляция//Труды Зоологического института АН СССР. 1991. Т. 214.
- Дербенева-Ухова В. П. Мухи и их эпидемиологическое значение. М.: Медгиз, 1952. 271 с.
- Кривошеина Н. П., Зайцев А. И., Яковлев Е. Б. Насекомые -разрушители грибов в лесах Европейской части СССР. М., 1986. 390 с.
- Лиховидов В. Е. О питании муравьев в период депрессии численности массовых видов вредителей в лесах Присамарья//Вопросы степного лесоведения. 1972. № 3. С. 84-87.
- Лобанов А. М. Потенциальная плодовитость, типы созревания и откладки яиц у мух семейства Fanniidae и Calliphoridae//Двукрылые насекомые. М.: МГУ, 1984. С. 58-69.
- Лябзина С. Н. Некрофильные двукрылые Южной Карелии и их участие в утилизации трупов животных//Вопросы популяционной экологии животных: Труды Петрозаводского государственного университета. Сер. «Биология». Вып. 2. Петрозаводск: Изд-во ПетрГУ, 2008. С. 101-109.
- Мамаев Б. М., Кривошеина Н. П., Потоцкая В. А. Определитель личинок хищных насекомых -энтомофагов стволовых вредителей. М.: Наука, 1977. 392 с.
- Марченко М. И. Влияние климатических факторов на продолжительность биологического разложения трупа насе-комыми-некробионтами в условиях Северо-Запада Европейской части России//Энтомологическое обозрение. 1992. Т. 63. № 4. С. 557-568. присутствие
- Озеров А. Л. К изучению некробионтных двукрылых Дальнего Востока СССР//Насекомые в экосистемах Сибири и Дальнего Востока. М.: МГУ, 1989. С. 114-142.
- Псарёв А. М. Трофические группировки копробионтных насекомых пастбищ горного Алтая//Зоологический журнал. 2001. Т. 80. № 12. С. 1523-1527.
- Пушкин С. В. Некробионтный энтомокомплекс высокогорий Северо-Западного Кавказа//Евроазиатский энтомологический журнал. 2004. Т. 3. № 3. С. 195-202.
- Стриганова Б. Р. Питание почвенных сапрофагов. М.: Наука, 1980. 243 с.
- Цеденова Л. У., Сальникова В. Э. Зависимость видового состава жуков-некрофагов от давности трупа//Животный мир Калмыкии, его охрана и рациональное использование. Элиста, 1982. С. 135-138.
- Чайка С. Ю. Судебная энтомология: Учеб. пособие. М.: Макс Пресс, 2003. 60 с.
- Черногуз Д. Г. Эффект блокирования метаморфоза мух при паразитировании Alysia manducator Panzer (Hymenoptera, Braconidae)//Труды Всесоюзного энтомологического общества. Общая энтомология. Л.: Наука, 1986. С. 114-119.
- Archer M. S., Elgar M. A. Effects of decomposition on carcass attendance in a guild of carrion-breeding fl ies//Medical and Veterinary Entomol. 2003. Vol. 17. P. 263-271.
- Braack L. E. O. Community dynamics of carrion-attendant arthropods in tropical African woodland//Oecologia. 1987. Vol. 72. № 3. P. 402-429.
- Campobasso C., Marchetti D., Introna F., Colonna M. Postmortem artifacts made by ants and the effect of ant activity on decompositional rates//Am. J. Forensic Med. Pathol. 2009. Vol. 30. № 1. Р. 84-87.
- Сhin Heo C., Marwi М., Hashim R., Abdullah N., Dhang C., Jeffery J., Kurahashi H., Omar B. Ants (Hymenoptera: Formicidae) associated with pig carcasses in Malaysia//Tropical Biomedicine. 2009. Vol. 26. № 1. P. 106-109.
- Clark W. H., Blom P. E. Observations of ants (Hymenoptera: Formicidae: Myrmicinae, Formicinae, Dolichoderinae) utilizing carrion//Southwest. Natur. 1991. Vol. 36. № 1. P. 140-142.
- Devinder S., Bharti M. Ants (Hymenoptera: Formicidae) associated with decaying rabbit carcasses//Uttar Pradesh J. Zool. 2001. Vol. 21. P. 93-94.
- Hanski I. Carrion fl y community dynamics: patchiness, seasonally and coexistence//Ecol. Entomol. 1987. Vol. 12. P. 257-266.
- Kimberly L. T., Richard D. F., Carlyle C. B. Insect fauna visiting carrion in Southwest Virginia//Forensic Science Inter. 2005. Vol. 150. Р. 73-80.
- Laing J. Host-Finding by Insect Parasites. 1. Observations on the Finding of Hosts by Alysia manducator, Mormoniella vitripennis and Trichogramma evanescens//J. Animal Ecol. 1937. Vol. 6. № 2. Р. 298-317.
- Macleod J., Donnelly J. Natural feature and blowfl y movement//J. Animal Ecol. 1960. Vol. 29. № 1. P. 85-93.
- Nuorteva P. Local distribution of blowfl ies in relation to human settlement in an area around the town of Forsa in South Finland//Ann. Entomol. Fenn. 1966. Vol. 32. P. 128-137.
- Pape T. The Sarcophagidae (Diptera) of Fennoscandia and Denmark//Fauna Entomol. Scandinav. Leiden. Copenhagen, 1987. Vol. 19.
- Peschke K. Chemical traits in sexual selection of the rove beetle, Aleochara curtula (Coleoptera: Staphylinidae)//Entomologia Generalis, 1990. Vol. 15. P. 127-132.
- Putman R. J. Dynamics of blowfl y Calliphora erythrocephala within carrion//J. Animal. Ecol. 1977. Vol. 46. P. 853-866.
- Reed H. B. A study of dog carcass communities in Tennessue with special reference to the insects//Am. Midland Naturalist. 1958. Vol. 59. Р. 213-245.
- Springett B. P. Aspect of the relationship between baring beetles Necrophorus spp. and the mite Poecilochirus necrophori Vitz.//J. Animal. Ecol. 1968. Vol. 37. P. 417-424.
- Wilson D. S., Knollenberg W. G. Adaptive inderects: the fi tness of burying beetles with and without their phoretic mites//Evol. Ecol. 1987. Vol. 1. P.139-159.
- Wilson D. S., Fudge J. Burying beetles: intraspecifi c interaction and reproductive success in the fi eld//Ecol. Entomol. 1984. Vol. 9. P. 195-203.


