Видовой состав возбудителей оппортунистических инфекций мочевыводящих путей и возможности преодоления их антибиотикорезистентности
Автор: Агаева Эмма, Ибадуллаева Саяра, Агаева Нигар, Нариманов Видади, Гурбанова Сара, Ширалиева Гюлнара
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 7 т.7, 2021 года.
Бесплатный доступ
В результате проведенных исследований изучена этиологическая структура оппортунистических инфекций мочевыводящих путей, представленная бактериями семейства Enterobacteriaceae (с преобладанием Escherichia coli, Klepsiella pneumoniae) а также неферментирующими грамотрицательными бактериями (Acinetobacter baumanii, Pseudomonas aeruginosa), стафилококками и энтерококком и др. Изучена антибиотикочувствительность возбудителей инфекций мочевыводящих путей к наиболее часто применяемым антибиотикам, выявлена антибиотикорезистентность E. coli и K. pneumoniae к ко-тримоксазолу, фторхинолонам, карбапенемам, цефалоспоринам I и II поколения, A. baumanii и P. aeruginosa - устойчивость к фторхинолонам, карбапенемам, а также VRE и MRSA. Произведено изучение и подбор новых лекарственных средств растительного происхождения. Наилучшим микробоцидным свойством обладали 10% раствор Geranium collinum Steph. и Rosmarinus officinalis L., которые можно применять в комплексной терапии ИМП. Установлена возможность замены некоторых антибиотиков на фитопрепараты.
Антибиотикорезистентные штаммы, растительные препараты, инфекции мочевыводящих путей
Короткий адрес: https://sciup.org/14120623
IDR: 14120623 | УДК: 579.61: | DOI: 10.33619/2414-2948/68/18
Текст научной статьи Видовой состав возбудителей оппортунистических инфекций мочевыводящих путей и возможности преодоления их антибиотикорезистентности
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 579.61: 616-036.22
В настоящее время инфекции мочевыводящих путей (ИМП) являются одной из актуальных проблем медицины. Наблюдается значительный рост числа больных циститами, уретритами с преобладанием в этиологической структуре условно-патогенных микроорганизмов-оппортунистов, что связано с распространением антибиотикорезистентных штаммов, а также наличием среди заболевших пациентов признаков иммунодефицита [1–2].
Полиэтиологичность заболеваний, вызванных условно патогенными микроорганизмами, распространение антибиотикорезистентных штаммов, гетерогенность их популяций, частая смена этиологического агента, а также сниженная способность к развитию иммунного ответа на условно-патогенные микроорганизмы создают сложность в диагностике, лечении и профилактике МП. Так, оппортунистические инфекции мочевыводящих путей составляют самый большой резервуар антибиотикорезистентных микроорганизмов [3–4].
С другой стороны, стремительный рост антибиотикорезистентных микроорганизмов и сокращение арсенала терапевтических средств требует дальнейшего изыскания и подбора новых лекарственных средств растительного происхождения, что может предотвратить дальнейшее распространение антибиотикоустойчивых штаммов. Возрастающий интерес к лекарственным средствам растительного происхождения связан с отсутствием побочного эффекта, низкой стоимостью, более мягким действием, малой токсичностью, высокой биодоступностью и что особенно важно, отсутствием развития резистентности у микроорганизмов.
Наиболее часто регистрируемыми возбудителями ИМП являются представители семейства Enterobacteriaceae — Escherichia coli, Klepsiella pneumoniae, Enterococcus faecalis, Staphylococcus aureus, S. epidermidis, S. saprophyticus , из неферментирующих бактерий — Pseudomonas aeruginosa , и реже — Candida albicans , а также антибиотикорезистентные штаммы, вызывающие моно- или ассоциированные инфекции. В настоящее время для лечения и профилактики ИМП часто применяют растительные препараты [5–6]. Эффективность их применения обусловлена низким уровнем развития осложнений, отсутствием нежелательных побочных эффектов и самое главное, препятствием к распространению антибиотикорезистентных штаммов.
В связи с этим изучение этиологической структуры ИМП, выявление антибиотикорезистентных штаммов, подбор и разработка альтернативных лечебных препаратов растительного происхождения являются значительными и своевременными мерами, способными помочь в решении актуальных проблем связанных с ИПМ. Целью наших исследований было изучение этиологической структуры инфекций мочевыводящих путей (ИМП), скрининг антибиотикорезистентных штаммов, определение динамики их распространения и подбор растительных препаратов, обладающих антимикробной активностью.
Материалы и методы
Исследования проводились в клинической микробиологической лаборатории и на кафедре медицинской микробиологии и иммунологии Азербайджанского медицинского университета.
Исследовали клинические изоляты E. coli, K. pneumoniae, P. aeruginosa, E. faecalis, S. aureus и коагулаза-негативные стафилококки (КОС — S. epidermidis , S. saprophyticus ), выделенные от больных с воспалительными заболеваниями МВП, и также эталонные культуры. Исследовали также MRSA, антибиотикорезистентные K. pneumoniae и др. штаммы, ранее выделенные нами при других патологиях.
Идентификацию выделенных микроорганизмов проводили с учетом морфо биологических свойств по общепринятому в микробиологии методу [2, 7].
Скрининг противомикробной активности выделенной культуры проводили дискодиффузионным методом и с применением автоматической системы идентификации VITEK. Для выявления чувствительных к ß-лактамным антибиотикам бактерий применяли ускоренный метод [8–9].
Чувствительность выделенных культур к растительным препаратам определяли следующим образом: суспензию микроорганизмов засевали газоном на поверхность плотной питательной среды в чашки Петри; использовали стерильные диски из фильтровальной бумаги, пропитанные исследуемыми растительными препаратами; чашки с посевами инкубировали 18–24 ч. при 37 °С. Учет результатов проводили измерением диаметра задержки роста микроорганизмов вокруг дисков.
В исследованиях также использовали антибиотикорезистентные штаммы E. coli, K. pneumoniae и MRSA, а также суточные бульонные культуры музейных штаммов, применяемых для оценки спектра действия лекарственных растительных препаратов. Микробная нагрузка составляла 1,0 млн клеток/мл.
Объектом исследования были 3 вида лекарственных растений — Geranium collinum Steph, Mentha longifolia (L.) Huds. а также Rosmarinus officinalis L. из листьев в форме эфирных масел и этаноловых растворов. Лекарственные растения были приготовлены в отделе Института ботаники Национальной академии наук Азербайджана. Водные и спиртово-водные экстракты извлечения получали и готовили по методике и в соответствии с требованиями Государственной Фармакопеи в асептических условиях.
Результаты исследований
От обследованных пациентов с клиническими признаками ИМП были выделены 280 культур микроорганизмов, из которых 110 отнесены к бактериям семейства Enterobacteriaceae с преобладанием E. coli — 32% и K. pneumoniae — 25%), остальные были идентифицированы и отнесены к неферментирующим грамотрицательным бактериям ( P. aeruginosa — 5,8%, Acinetobacter — 3,5%), а также к Стафилококкам (28%) и Энтерококкам (4,8%) и др. (Рисунок).
Из изолированных кокковидных бактерий чаще всего были обнаружены S. aureus, а также S. saprophyticus, S. epidermidis (KOC) и E. faecalis , которые чаще выделяли из мочи здоровых и носителей в ассоциации.
E. coli и K. pneumoniae чаще обнаруживались в посевах мочи больных, как в виде монокультуры, так и в составе микробных ассоциаций, при высоком и низком уровнях бактериурии.
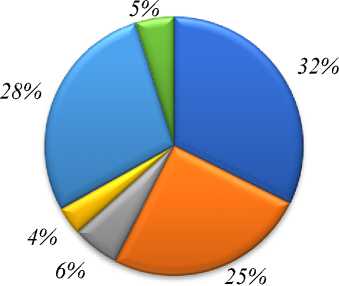
и E. coli LI K. pneumoniae й P.aeruginosa J Acinetobacter й Стафилококки й Энтерококки
Рисунок. Видовой состав уропатогенов, выделенный при ИМП
Микробное число выше 100 тысяч указывало на наличие инфекции в мочевой системе. При изучении антибиотикочувствительности выделенных культур выявлена антибиотикорезистентность E. coli и K. pneumonia к ко-тримоксазолу, фторхинолонам, карбапенемам, цефалоспоринам I поколения, в связи с наличием у них БЛРС — бета-лактамаз расширенного спектра действия. Выделенные нами неферментирующие грам-бактерии ( Pseudomonas aeruginosa и Acinetobacter baumanii ) показали устойчивость к фторхинолонам, карбапенемам. В 3% случаев выделяли MRSA и в 2,5% — устойчивые к ванкомицину энтерококки (VRE).
Таким образом, установлена антибиотикорезистентность некоторых этиологически значимых микроорганизмов ( E. coli, K. pneumonia, A. baumanii, P. aeruginosa ) к карбапенемам, стафилококков к ß-лактамным антибиотикам.
В связи с распространением антибиотикорезистентных штаммов при ИМП и сокращения арсенала антимикробных химиотерапевтических препаратов нам проведено изучение и подбор новых лекарственных средств растительного происхождения.
Проведенными ранее исследованиями установлена высокая бактерицидная активность эфирного масла и спиртоводного растворов герани ( Geranium collinum ) и Mentha longifolia (L.) Huds., а также спиртовой раствор Folia Rosmarini ( Rosmarinus officinalis ) из листьев розмарина.
Исследуемые лекарственные растения обладали бактерицидным действием к эталонным культурам S. aureus, E. coli, K. pneumonia, P. aeruginosa .
Ранее проведенными нами исследованиями установлено, что эфирные масла и спиртовые растворы (10%) обладают наиболее выраженной бактерицидной активностью в сравнении с водными растворами. В дальнейшей работе мы применяли 10% раствор эфирного масла Geranium collinum , Mentha longifolia а также Folia Rosmarinus officinalis (Таблица).
Как видно из Таблицы, наибольшим бактерицидным эффектом обладал 10% раствор Rosmarinus officinalis и спиртовой раствор Geranium collinum .
Так, зона задержки роста E. coli составила 15 мм и 11 мм соответственно; K. pneumonia — 14 и 13 мм; S. aureus — 13 и 12 мм; P. aeruginosa — 15 и 12 мм.
Таблица
БАКТЕРИЦИДНАЯ АКТИВНОСТЬ ЛЕКАРСТВЕННЫХ РАСТЕНИЙ К ОСНОВНЫМ ПАТОГЕНАМ УРОГЕНИТАЛЬНОГО ТРАКТА
|
Исследуемые культуры |
10% спиртовой раствор растительных экстрактов |
Контроль |
||
|
Geranium collinum Steph. |
Menta longifolia (L.) Huds. |
Rosmarinus officinalis L. |
||
|
E. coli |
11 |
8 |
15 |
5 |
|
K. pneumoniae |
13 |
9 |
14 |
5 |
|
S. aureus |
12 |
10 |
14 |
5 |
|
P. aeruginosa |
12 |
11 |
13 |
5 |
|
Антибиотикорезистентные штаммы |
||||
|
MRSA |
7 |
6 |
9 |
5 |
|
UPEC |
8 |
6 |
13 |
5 |
|
K. pneumoniae N-1 |
10 |
5 |
12 |
5 |
Зона задержки роста у антибиотикорезистентных штаммов MRSA к раствору Rosmarini составляла 9 мм, к Geranium — 7 мм; у E. coli 13 и 8 мм, у K. pneumonia — 12 и 10 мм соответственно, против 5 мм в контроле.
Таким образом, наибольшим бактерицидным эффектом в отношении клинических изолятов обладал 10% спиртовой раствор Rosmarini и Geranium как в отношении антибиотикорезистентных штаммов.
В комплексной терапии ИМП рекомендуем применять 10% спиртовые растворы Rosmarini и Geranium (Таблица).
Список литературы Видовой состав возбудителей оппортунистических инфекций мочевыводящих путей и возможности преодоления их антибиотикорезистентности
- Агаева Е. М., Нариманов В. А., Байрамов А. Г., Джавадов С. С., Бахышова Е. А. Динамика частоты распространения резистентности микроорганизмов к антибиотикам при урогенитальных инфекциях // Sağlamlıq jurnalı N. 2016. V. 6. P. 92-96.
- Малкоч А. В. Инфекция мочевой системы у детей // Лечащий врач. 2009. №1. С. 30-36.
- Синякова Л. А. Неосложненная инфекция верхних мочевых путей // Урология сегодня. 2010. Т. 4. №8. С. 11.
- Сидоренко С. В., Резван С. П., Стерхова Г. А., Грудинина С. А. Госпитальные инфекции, вызванные Pseudomonas aeruginosa. Распространение и клиническое значение антибиотикорезистентности // Антибиотики и химиотерапия. 1999. Т. 44. №3. С. 25-34.
- Гахраманова М., Ибадуллаева С. Ж. Иммуностимулирующий фитосбор с общеукрепляющим действием. Евразийское патентное бюро. 026106 Б1. М. 04.04.2017, п. 1-4.
- Ibadullayeva S., Alakberov R. Medicibal plants (Etnobotany and Phytotherapy). Baku, 2013. 360 p.
- Зайцев А. В., Тупикина Н. В. Рецидивирующая инфекция мочевых путей-междисциплинарная проблема // Медицинский совет. 2014. №19.
- Roos V., Ulett G. C., Schembri M. A., Klemm P. The asymptomatic bacteriuria Escherichia coli strain 83972 outcompetes uropathogenic E. coli strains in human urine // Infection and immunity. 2006. V. 74. №1. P. 615-624. DOI: 10.1128/IAI.74.1.615-624.2006
- Foxman B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs // The American journal of medicine. 2002. V. 113. №1. P. 5-13. DOI: 10.1016/S0002-9343(02)01054-9


