Вирус болезни Ньюкасла и иммунитет - эффективный альянс в борьбе против рака (обзор литературы)
Автор: Ситковская Анастасия Олеговна, Златник Елена Юрьевна, Новикова Инна Арнольдовна, Кит Олег Иванович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 6 т.17, 2018 года.
Бесплатный доступ
В настоящее время рак остается одной из ведущих причин смертности в развитых странах мира. Использование онколитических вирусов (ОВ) является перспективным возможным методом ингибирования опухолевого роста. Несмотря на то, что открытие онколитической функции ряда вирусов произошло еще в прошлом веке, использование ОВ до сих пор не нашло должного признания. Одни из наиболее многообещающих - вирусы семейства Paramyxoviridae, в частности вирус болезни Ньюкасла (ВБН), не являющийся патогенным для человека и обладающий некоторыми эффективными механизмами воздействия на опухолевые клетки и индукции иммунного ответа. Для ВБН характерны селективное инфицирование и распространение вируса в опухолевых клетках, прямой цитопатический эффект, а также косвенная индукция врожденного и адаптивного иммунного ответа хозяина. Однако внутриопухолевое введение ОВ не всегда является возможным и приводит лишь к локальному действию. Существует предположение, что клетки иммунной системы могут использоваться в качестве возможных носителей ОВ для обеспечения временной защиты от факторов иммунной системы организма опухоленосителя. В исследованиях действия ОВ самыми эффективными клеточными носителями среди многочисленных оцениваемых типов иммунных клеток являлись дендритные клетки (ДК). Таким образом, совместное действие ОВ и ДКВ является важным для взаимного потенцирования противоопухолевого эффекта обоих компонентов (вирусного и клеточного); получение таких продуктов представляется целесообразным с целью их дальнейшего клинического применения.
Вирус болезни ньюкасла, онколизис, дендритноклеточные вакцины, биотерапия, иммунный ответ, онколитические вирусы, вирусы семейства paramyxoviridae, виротерапия, противоопухолевая терапия, инфицирование опухолевых клеток, гибель клетки
Короткий адрес: https://sciup.org/140254220
IDR: 140254220 | УДК: 616-006-08:578.831:612.017.1 | DOI: 10.21294/1814-4861-2018-17-6-105-113
Текст обзорной статьи Вирус болезни Ньюкасла и иммунитет - эффективный альянс в борьбе против рака (обзор литературы)
Несмотря на успехи хирургического и хи-миолучевого лечения, достигнутые в последние десятилетия, рак по-прежнему является одной из ведущих причин смерти в развитых странах мира, в связи с чем необходимо расширение имеющихся противоопухолевых подходов и методов. Использование онколитических вирусов (ОВ) не является новейшим открытием, однако в настоящий момент не находит должного признания. Первым свидетельством виротерапии является работа De Pace (1912), в которой описана регрессия опухоли у онкологических больных после вакцинации против бешенства [1]. Известно, что ОВ предпочтительно инфицируют и уничтожают раковые клетки, что ведет к стимуляции долгосрочных противоопухолевых иммунных реакций. Вирусный онколизис вполне может служить в качестве нового подхода к лечению рака в сочетании со стандартной терапией [2]. Одни из наиболее перспективных – вирусы семейства Paramyxoviridae, в частности вирус болезни Ньюкасла (ВБН), не являющийся патогенным для человека [3] и обладающий некоторыми эффективными механизмами воздействия на опухолевые клетки и индукции иммунного ответа. ВБН довольно широко изучен в качестве самостоятельного онколитического агента, однако существует вероятность, что совместное действие антигенпрезентирующих клеток иммунной системы, таких как дендритные клетки, с ОВ усилит противоопухолевый эффект, что подробно будет рассмотрено в нашем обзоре.
Историческая справка
ВБН получил свое название в 1926 г. в результате вспышки вируса среди кур на ферме близ Ньюкасл-апон-Тайн в Англии [4]. За последние четыре десятилетия было несколько панзоотиков этой болезни у домашней птицы и у домашних голубей [5–7]. Первопроходцами в вирусной противоопухолевой терапии с применением вируса болезни Ньюкасла считаются Cassel и Sinkovics, которые в 1960-е и 1970-е годы ХХ века ввели ВБН в клинику в качестве онколитического агента и разработали вакцину в виде онколизата ВБН для иммунотерапии [8, 9]. В 1971 г. Csatary сообщил о спонтанной регрессии агрессивного метастатического рака толстой кишки у венгерского фермера после вспышки ВБН на его ферме, предполагая инфицирование ВБН и последующий онколитический эффект [10].
Описание вируса болезни Ньюкасла.Инфицирование клетки-мишени
В настоящее время вирус болезни Ньюкасла классифицируется как птичий парамиксовирус-1 (APMV-1) род Avulavirus семейства Paramyxoviridae в пределах порядка Mononegaviralis [11]. Это двуслойный оболочечный вирус сферической формы диаметром 100–300 нм с одноцепочечной несегментированной негативной РНК, состоящей обычно из 15 186 нуклеотидов. РНК содержит шесть генов, кодирующих несколько крупных полипептидов, среди которых: нуклеопротеид (NP, 55 кДа), фосфопротеин (P, 53 кДа), матричный белок (М, 40 кДа), крупный белок (L, 200 кДа). В свою очередь, белки NP, P и L в сочетании с вирусной РНК составляют комплекс рибонуклеопротеинов (РНП), являющийся единицей репликации ВБН. Наибольший интерес вызывают два поверхностных белка: гемагглютинин-нейраминидаза (HN, 74 кДа) и белок слияния (F, 67 кДа) (рис. 1). Белок HN обеспечивает связывание вируса с клетками, в то время как белок F способствует сли-
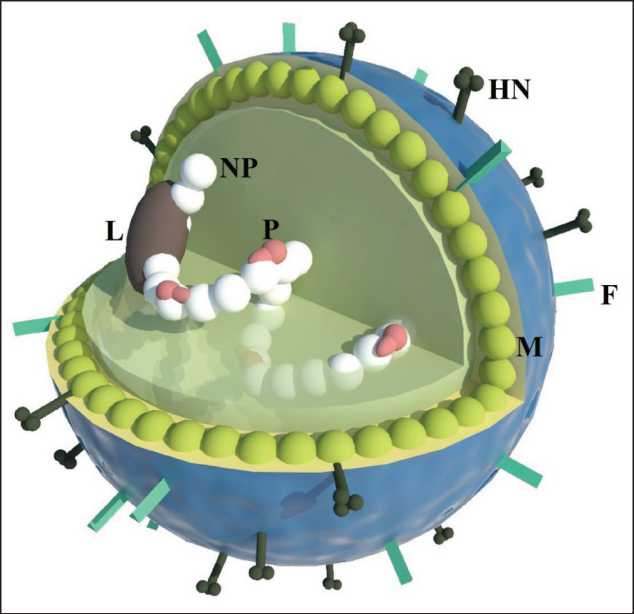
Рис. 1. Строение вируса болезни Ньюкасла. Примечания: NP – нуклеопротеид, P – фосфопротеин, М – матричный белок, L – крупный белок, HN – гемагглютинин-нейраминидаза, F – белок слияния
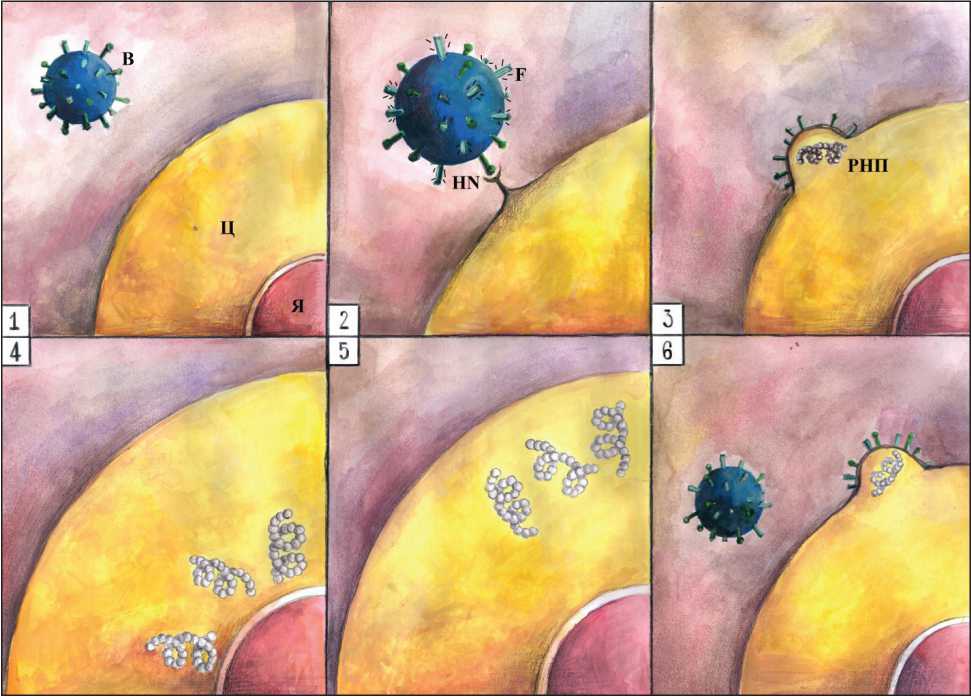
Рис. 2. Механизм встраивания в клетку вируса болезни Ньюкасла.
Примечания: В – вирус, Ц – цитоплазма клетки, Я – ядро клетки, РНП – комплекс рибонуклеопротеинов, HN – гемагглютинин-нейраминидаза, F – белок слияния
янию вирусной оболочки с клеточной мембраной клетки-мишени. Комплекс РНК-зависимой РНК полимеразы содержит белки L, P и NP [3, 7]. Посредством перекрывающейся считывающей структуры ген Р кодирует еще один продукт – белок V, который служит в качестве антагониста интерферона (ИФН) I типа у птиц [12]. Помимо этого, в процессе редактирования РНК, в ходе транскрипции гена Р образуется белок W (табл. 1). Вероятно, данный белок также играет роль в репликации и патогенезе ВБН [13]. Как правило, ВБН не является патогенным для человека, хотя и может вызвать незначительные проявления в виде конъюнктивита и гриппоподобных симптомов [14–16].
Инфицирование клеток ВБН можно разделить на два этапа (рис. 2) [3]. На первом этапе происходит связывание вируса через лектинподобный связывающий клетки домен молекулы HN с мембранными рецепторами клетки-мишени (α2-3 и α2-6-N-связанная сиаловая кислота) [17]. Далее наступает активация гибридного белка F, синтезирующегося в виде неактивного предшественника F0 (67 кДа). Во время слияния вирусной и клеточной мембраны, способствующего введению РНП в цитоплазму клетки-мишени, белок F претерпевает протеолитическое расщепление с образованием биологически активного белка, состоящего из дисульфидно-соединенных цепей F1 (55 кДа) и F2 (12,5 кДа) [12, 18]. Зрелые F1 и F2 чувствительны к клеточным сериновым протеазам. Из-за множественных последовательностей основных аминокислот вирус эффективно инфицирует клетки и распространяется в различных тканях, проявляя, таким образом, патогенность [3]. Совместные действия белков HN и F приводят к слиянию вирусной мембраны с мембраной клетки-хозяина. Этот процесс включает в себя два участка связывания с рецептором глобулярной головки HN и активацию ножки HN и белка F [19]. Слияние мембран позволяет вирусному геному проникать в цитоплазму клетки-хозяина, где негативный РНК-геном транскрибируется в мессенджеры РНК и транслируется на вирусные белки. Затем белки NP, P и L, образующиеся в инфицированных клетках, используются для сборки нуклеокапсида как антигенома.
Второй этап начинается с использования полученного антигенома в качестве матрицы для амплификации вирусного генома. Практически сразу после инфицирования, ВБН может вызывать аутофагию для повышения репликации вируса. После посттрансляционной модификации белок M и белки оболочки HN и F перемещаются к мембране, где происходит сборка вируса и отпочкование. В этом процессе единичные копии генома ВБН заворачиваются в наружную оболочку, образованную из плазматической мембраны клетки хозяина [20].
Механизмы онколизиса ВБН
На данный момент описано несколько механизмов онколитической активности ВБН, таких как селективное инфицирование и распространение вируса в опухолевых клетках, прямой цитопатический эффект [18], а также косвенная индукция врожденного и адаптивного иммунного ответа хозяина. Рассмотрим подробнее механизмы, способствующие вирусному онколизису и иммуномодуляции.
Избирательное инфицирование опухолевых клеток
В некоторых работах были изучены молекулярные механизмы, посредством которых ВБН избира- таблица 1
Участие вирусных компонентов в реакции гибели клеток
|
Вирусный компонент |
Биологическая функция |
Взаимодействие с клетками |
|
HN |
Формирование наружного слоя оболочки вириона |
Обеспечивает связывание вируса с клетками Способствует слиянию вирусной оболочки с клеточ- |
|
F |
Формирование наружного слоя оболочки вириона |
ной мембраной клетки-мишени и проникновению в нее |
|
M |
Формирование внутреннего слоя оболочки вириона |
Принимает участие в морфогенезе и почковании вируса |
|
L |
Выполняет функции РНК-полимеразы, формирование нуклеокапсида |
Формирование нуклеокапсида, выполняет посттранскрипционные модификации |
|
NP |
Формирование нуклеокапсида |
Заключение в нуклеокапсид геномной РНК, регулирует переход от транскрипции к репликации |
P
Кодирует белки V и W, регулирует переход от транскрипции к репликации
Участвует в синтезе РНК, формирование нуклеокап-сида
V
W
Ингибирование ответа интерферона и апоптоза в клетках курицы
Играет роль в репликации и патогенезе вируса тельно убивает опухолевые клетки [21]. По мнению многих авторов, в основе такого избирательного эффекта ВБН на опухолевые клетки лежит де-сиализация мембраны последних под действием вирусной нейраминидазы. Для метастатических опухолевых клеток характерна высокая экспрессия гликопротеинов, богатых сиаловой кислотой, которые, в свою очередь, способствуют увеличению инвазивного потенциала. Гиперэкспрессия сиаловой кислоты на клеточной поверхности создает отрицательный заряд на мембране, приводя к межклеточным «толчкам» и, тем самым, проталкивая опухолевые клетки в кровоток для последующего метастазирования. Действительно, способность опухолевых клеток к метастазированию коррелирует с изобилием сиаловых кислот на поверхности многих типов злокачественных клеток [22]. В 1994 г. было предложено в качестве маркера, характеризующего состояние дифференцировки клеток щитовидной железы и мелкоклеточного рака легких, использовать степень полисиализации клеточной поверхности [23]. В последнее время ингибиторы процесса сиализации рассматриваются в качестве кандидатов для препаратов против метастатического рака [24]. Существует предположение, что одним из возможных механизмов, связывающих повышенную сиализацию с клетками опухоли, является создание толстого «слоя» на поверхности клетки, скрывающей опухолевые антигены и обеспечивающей избегание злокачественных клеток от иммунного надзора [25]. Удаление сиалидазой некоторых остатков сиаловой кислоты с поверхности злокачественных клеток может «оголить» раковые антигены и сделать клетки видимыми для иммунной системы. Избавление опухолевых клеток от сиаловых кислот коррелирует с пониженным потенциалом роста, активацией НК-клеток и секрецией ИФН-гамма [26]. Белок гемагглютинин- нейраминидаза (HN), присутствующий в ВБН и некоторых других парамиксовирусах, например, в вирусе Сендай (SeV), помимо эритроцитарной агглютинации, действует в качестве нейраминидазы (сиалидазы). Нейраминидаза расщепляет и удаляет остатки сиаловой кислоты с поверхности злокачественных клеток, приводя к резкому увеличению их способности индуцировать Т-клеточный ответ [27].
Иммуногенная клеточная гибель (ICD)
В работе Elankumaran et al. показано, что ВБН оказывает онколитический эффект посредством как внутренних, так и внешних каспаза-зависимых путей клеточной гибели [28]. ВБН-индуцированный апоптоз зависит от повышенной регуляции ФНО-связанного апоптоз-индуцирующего лиганда (TRAIL) и активации каспазы [29]. В свою очередь, это вызывает раскрытие митохондриальных пор и снижение мембранного потенциала, приводя к активации процесса апоптоза [30]. В онколизисе, вызванном ВБН, важную роль играют MAPK-путь и стресс эндоплазматического ретикулума [28, 31]. Помимо этого, было выявлено, что ВБН также может оказывать онколитическое действие против гипоксических раковых клеток, что представляет собой клиническое значение и подтверждает его эффективность в качестве терапевтического агента [32].
В исследованиях на мультиформной глиобластоме было показано, что вирус болезни Ньюкасла при инфицировании опухолевых клеток взаимодействует с белком Rac-1. В пораженных клетках происходят реорганизация актина и индукция синцития, что подтверждает предположение о возможности использования ВБН в качестве нового биологического агента для специфической таргетной аберрантной сигнализации (пути пролиферации и инвазии) [33].
Современной парадигмой онколитической вирус-опосредованной иммунотерапии является концепция иммуногенной клеточной гибели (ICD) [34]. В классическом физиологическом плане апоптоз не является иммуногенным. Для данного процесса характерно сохранение целостности мембраны, сжатие клеток, образование мембранных везикул, высвобождение малых апоптозных тел, ядерная конденсация и фрагментация ДНК. Однако описаны и иммуногенные формы апоптотической гибели, к которым относится одна из его разновидностей (иммуногенный апоптоз), а также некроз и пироптоз. В отличие от классического апоптоза, при иммуногенном происходит транслокация на плазматическую мембрану кальретикулина и белков теплового шока, что вызвано некоторыми химиотерапевтическими агентами и онколитическими вирусами. Экспрессия дистресс-ассоциированного молекулярного паттерна (DAMP) происходит с запозданием. Для некроза характерно набухание органелл, ядра и мембраны, образование реактивных форм кислорода, разрыв мембраны и выделение внутриклеточного содержимого, включая DAMP (ATP, HMGB1, мочевая кислота и др.). При пироптозе происходит ядерная конденсация, фрагментация ДНК, набухание мембраны, выделение мембранных везикул, разрыв мембраны и высвобождение внутриклеточного содержимого, включая DAMP [35]. В основном смерть опухолевых клеток, вызванная иммуногенной клеточной гибелью, включает элементы ответов на повреждение ДНК и стресс эндоплазматического ретикулума, а также элементы апоптотического ответа [36]. Было показано, что онколитические вирусы способны вызывать аутофагию в раковых клетках. Аутофагия вызывает секвестрирование, деградацию и рециркуляцию органелл, белков, а также внутриклеточных патогенов. Данный процесс также усиливает иммуногенность опухоли, высвобождая DAMP.
Особенностями иммуногенной клеточной гибели, вызванной онколитическими вирусами, являются ответ на стресс эндоплазматического ретикулума (ЭПС-стресс), иммуногенный апоптоз, некроз и аутофагия. Совместное действие этих процессов приводит к остановке синтеза белка в клетке, воздействию кальретикулина и белков теплового шока на клеточную поверхность, индукции сигналов опасности, высвобождению провос-палительных цитокинов и улучшению антигенной презентации. Несмотря на это, производство вирусных белков в клетке и на ее поверхности во время инфицирования, напротив, увеличивается, что оказывает дополнительное влияние на клеточные процессы и пути [36].
«Иммуномодуляция»
Одной из главных проблем иммунотерапии является избегание опухолевых клеток иммунного надзора. Вместе с тем было показано, что ВБН об- ладает иммуностимулирующими свойствами. Его важной особенностью является способность индуцировать большие количества интерферона (ИНФ) I типа при контакте с клетками периферической крови человека. Данное свойство связано с характером структуры двухцепочечной РНК (дцРНК), которая образуется в цитоплазме во время репликации вируса, провоцируя таким образом усиление ответа ИНФ [3]. Помимо этого, дцРНК способна активировать цитоплазматическую протеинкиназу (PKR) и RIG-I, а также эндосому TLR3 [7].
Ранее нами был рассмотрен вирусный поверхностный белок HN в качестве эффективного фермента, расщепляющего сиаловую кислоту, маскирующую опухолевые антигены. Помимо этого, инфицирование опухолевых клеток ВБН изменяет их поверхность, экспрессия вирусных белков HN и F увеличивается примерно через 10 ч [37]. Белок HN способен активно связываться с рецепторами, повышая ко-стимуляцию Т-клеток [38]. Кроме того, инфицирование человеческих опухолевых клеток ВБН приводит к повышению регуляции молекул HLA и ICAM-1. Далее происходит индукция интерферонов, хемокинов (IP10, RANTES) и, в конечном счете, апоптоз [39].
Заражение ВБН провоцирует в организме множество сигналов опасности (дцРНК, ИНФ-альфа, HN), индуцируя активацию врожденных иммунных реакций. Помимо этого, вирусной инфекции отводится важная роль во время презентации опухоль-ассоциированных антигенов Т-клеткам. Все это является важным аспектом для индукции эффективного адаптивного иммунного ответа против опухоли, неотъемлемой частью которого являются CD4+ и CD8+ Т-клетки [40].
Не так давно было проведено иммунологическое исследование на мышах, в котором ИНФ I типа продемонстрировал важную роль в иммунном ответе против глиомы [41]. Ожидается, что ВБН, выступающий в качестве индуктора ИНФ I типа, усилит иммунный ответ. В исследовании in vitro с помощью клона Т-клеток было показано, что индукция воспалительных процессов при добавлении ВБН в состоянии разрушить толероген-ность опухолевых антигенов. Предполагается, что в организме опухоленосителя будет наблюдаться такой же эффект [42].
В мышиной ортотопической модели глиомы было продемонстрировано, что виротерапия ВБН индуцирует ICD с ее молекулярными детерминантами, такими как кальретикулин, HSP и группа высокой мобильности box-1 (HMGB1, амфотерин). За этим следует опухолеспецифическая иммунная Т-клеточная память [43].
ВБН связан с активацией как врожденного, так и адаптивного иммунного ответа против опухолевых антигенов в сочетании с вирусными. Интересно, что не только у птиц, но и у млекопитающих, которые не болеют ВБН, он проявляет иммуногенность. У данного вируса, как и у других, есть свои таблица 2
Некоторые доклинические и клинические примеры противоопухолевой терапии вБН
|
Локализация опухоли |
Штамм ВБН |
Результаты применения ВБН |
Литература |
|
Головной мозг |
Ulster |
Долгосрочная выживаемость у пациентов |
[46] |
|
Голова и шея |
73T |
Увеличение выживаемости у пациентов |
[47] |
|
Меланома |
73T |
Увеличение выживаемости у пациентов |
[48] |
|
ВБН |
Подавление опухолевого роста |
[49] |
|
|
Почки |
PV701 |
Объективные ответы на терапию на I этапе исследований |
[50] |
|
Печень |
Anhinga |
Противоопухолевое действие |
[51] |
|
Anhinga |
Противоопухолевый эффект |
[52] |
механизмы избегания иммунного ответа, таким является белок V, ингибирующий сигнальные белки-трансдукторы и активаторы транскрипции (STAT), опосредованные сигналом ИФН I типа. Однако этот механизм является видоспецифичным и активируется только у птиц [3]. После инфицирования ВБН у птиц и млекопитающих наблюдается сильная стимуляция адаптивного иммунитета, с участием антител и цитотоксических Т-лимфоцитов (ЦТЛ) [40]. В связи с тем, что ВБН селективно инфицирует клетки опухоли, на них экспрессируются вирусные антигены, приводя к повышению регуляции молекул главного комплекса гистосовместимости I класса, что, в свою очередь, способствует усилению процесса распознавания опухолевых клеток, являющегося важнейшим этапом иммунного ответа. Данное действие сводит к минимуму все «старания» опухолевых клеток по избеганию иммунной системы. Инфицированные опухолевые клетки впоследствии распознаются и уничтожаются CD8+ цитотоксическими Т-лимфоцитами [44]. Внутриопухолевые инъекции ВБН-HUJ приводили к снижению массы опухоли у мышей [14]. Кроме того, выживаемость повторно зараженных мышей указывает на активность клеток иммунной памяти против тех же раковых клеток. В другом исследовании Yaacov et al. показали, что лечение мышей линии C57/BL, зараженных клетками карциномы легкого Льюиса (3LL), путем внутривенной или подкожной инъекции ВБН-HUJ приводило к ингибированию роста первичной опухоли и отдаленных метастазов, а также к длительной выживаемости животных [18]. В работе с имплантированной в организм мышей меланомой В16 инъекция ВБН вызывала системный противовоспалительный эффект, приводя к инфильтрации опухоли специфическими CD4+ и CD8+ Т-клетками, также наблюдалось противоопухолевое действие на отдаленные метастазы [45]. В табл. 2 представлены некоторые примеры противоопухолевого действия ВБН в доклинических и клинических испытаниях.
Впервые Schirrmacher et al. продемонстрировали один из подходов к лечению рака путем использования противоопухолевой вакцины, созданной с применением аутологичных облученных опухолевых клеток, ex vivo инфицированных ВБН (ATV-NDV). Этот терапевтический протокол ин- дуцировал как врожденную, так и адаптивную системы иммунитета против опухолевых антигенов, способствуя эффективному онколизису. Несколько клинических испытаний, основанных на данном подходе у пациентов с метастазами меланомы и рака толстой кишки, показали регрессию опухоли, увеличение выживаемости и развитие иммунной памяти против опухоли [53].
Таким образом, ВБН является эффективным иммуноадъювантом, вызывающим и/или усиливающим как врожденные, так и адаптивные иммунные реакции для генерации противоопухолевого иммунного ответа.
Иммунные клеткикак транспорт для вирусов
Внутриопухолевое введение ОВ не всегда является возможным и приводит лишь к локальному действию. Системное введение вирусов считается более эффективным, поскольку обеспечивает высокую объективную возможность их поступления в метастатические или многоузловые опухоли. Несмотря на отсутствие патогенности ВБН по отношению к человеку, существует вероятность затруднения реализации противоопухолевого эффекта вируса из-за действия клеточных и гуморальных факторов иммунной системы [54, 55].
В настоящее время существует предположение, что клетки иммунной системы могут использоваться в качестве возможных носителей ОВ для временной защиты от факторов иммунной системы организма опухоленосителя [56]. Для ОВ с применением реовируса [57] и вируса кори [58] самыми эффективными клеточными носителями для обоих вирусов среди многочисленных оцениваемых авторами типов иммунных клеток (например, Т-клетки, макрофаги) являлись дендритные клетки (ДК); вирус проникал в ДК, которые защищали его от нейтрализующих антител и обеспечивали адресную доставку в ткань опухоли. Инъекции ДК-вакцин, нагруженных инфицированными реовирусом опухолевыми антигенами, продемонстрировали повышенную выживаемость мышей с меланомой, сопровождающуюся устойчивой противоопухолевой и противовирусной иммунной реакцией [59], т.е. реовирус, находящийся в составе ДК, не элиминируется и сохраняет онколитические и иммуномодулирующие свойства.
Несмотря на свидетельства отечественных исследователей о клинической эффективности лечения с использованием ДК вакцин у некоторых категорий больных [60–63], в сегодняшний момент происходит поиск методов и способов улучшения эффективности противоопухолевой иммунологической вакцинации, одним из которых может являться синтез онколитической способности вирусов и клеток иммунной системы.
В настоящее время в качестве комбинированной противоопухолевой ВБН-ДК вакцины разрабатывается DeltaVir (Лейпциг, Германия). Препарат сочетает в себе вирус болезни Ньюкасла и ДК. Введение DeltaVir разделено на два последовательных этапа: сначала ВБН вводится системно, а далее проводят подкожные инъекции ДК вакцины, нагруженной инфицированным аутологичным опухолевым лизатом [3]. Исследования с применением данного противоопухолевого подхода продемонстрировали долгосрочную ремиссию у пациента с раком предстательной железы с обширными метастазами в кости. Лечение вызывало долговременную реакцию Т-клеток с противоопухолевой памятью [64]. Напротив, работы с аутологичными опухолевыми вакцинами (АОВ), инфицированными ВБН, показали необходимость не только большого количества опухолевых клеток, но и важность сохранения жизнеспособности клеток во введенной вакцине для достижения клинического эффекта [65]. Клеточная жизнеспособность в ВБН-
Список литературы Вирус болезни Ньюкасла и иммунитет - эффективный альянс в борьбе против рака (обзор литературы)
- De Pace N. Sulla scomparsa di un enorme cancro vegetante del collo dell’utero senza cura chirurgica. Ginecologia. 1912; 9: 82-89.
- Ottolino-Perry K., Diallo J.S., Lichty B.D., Bell J.C., McCart J.A. Intelligent design: combination therapy with oncolytic viruses. Mol Ther. 2010; 18 (2): 251-263. DOI: 10.1038/mt.2009.283
- Fournier P., Schirrmacher V. Oncolytic Newcastle Disease Virus as Cutting Edge between Tumor and Host. Biology (Basel). 2013 Jul 2; 2 (3): 936-75. DOI: 10.3390/biology2030936
- Alexander D.J. Historical aspects. Newcastle disease. Boston: Kluwer Academic Publishers. 1988: 1-10.
- Dimitrov K.M., Ramey A.M., Qiu X., Bahl J., Afonso C.L. Temporal, geographic, and host distribution of avian paramyxovirus 1 (Newcastle disease virus). Infect Genet Evol. 2016 Apr; 39: 22-34. DOI: 10.1016/j.meegid.2016.01.008


