Визуализация контакта PD-l1-положительных и PD-1-положительных иммунных клеток в микроокружении рака молочной железы
Автор: Калинчук А.Ю., Перельмутер В.М., Таширева Л.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.23, 2024 года.
Бесплатный доступ
Введение. Хронический лимфолейкоз (ХЛЛ) - заболевание, которое характеризуется высокой межиндивидуальной гетерогенностью как клинического течения, так и молекулярных паттернов экспрессии генов и регуляторных РНК, способных оказывать влияние на патологический процесс. Вовлеченность регуляторных miR-155 и miR-223 в патогенез ХЛЛ в целом известна, но информации о возможных колебаниях экспрессии miR-155 и miR-223 в зависимости от динамики развития патологического процесса и характеристик врачебного вмешательства недостаточно. Цель исследования - изучение уровня экспрессии miR-155 и miR-223 у больных ХЛЛ с разными биологическими, клиническими особенностями и характеристиками проводимой терапии в субстратах периферической крови: плазме, лимфоцитах, внеклеточных везикулах, а также в костном мозге. Материал и методы. При выполнении работы использовались образцы периферической крови и костного мозга 38 пациентов с диагнозом ХЛЛ из Городского гематологического центра ГБУЗ Новосибирской области «Городская клиническая больница № 2» с 2016 по 2017 г. Оценка уровня экспрессии miR-155 и miR-223 проводилась методом ОТ-ПЦР в реальном времени по принципу TaqMan. Оценку значимости различий групп проводили с помощью непараметрического критерия Манна-Уитни либо непараметрического критерия Краскела-Уоллиса с последующим попарным сравнением с помощью критерия Манна-Уитни.
Рак молочной железы, микроокружение, pd-1, pd-l1, макрофаги
Короткий адрес: https://sciup.org/140303750
IDR: 140303750 | УДК: 618.19-006+616-091.8 | DOI: 10.21294/1814-4861-2024-23-1-87-97
Текст научной статьи Визуализация контакта PD-l1-положительных и PD-1-положительных иммунных клеток в микроокружении рака молочной железы
Избыточная активация механизмов иммунного ответа может привести к серьезным патологиям, поэтому в организме человека существуют регулирующие механизмы для поддержания гомеостаза, одним из которых является иммунная контрольная точка PD-1/PD-L1. Белок запрограммированной смерти 1 (PD-1) является распространенным иммунодепрессантом на поверхности иммунных клеток и играет важную роль в подавлении иммунного ответа и развитии аутотолерантности. Взаимодействие между PD-1 и его лигандом PD-L1 ослабляет передачу сигналов Т-клеточного рецептора и подавляет активацию Т-клеток [1]. Экспрессия PD-L1 характерна для Т-клеток, В-клеток, дендритных клеток и макрофагов, а также для опухолевых клеток, которые используют данный физиологический механизм, чтобы избежать иммунной атаки. Центральным звеном противоопухолевого иммунного ответа считаются CD8+ Т-клетки. Взаимодействие PD-1-положительных CD8+ Т-клеток и PD-L1-положительных опухолевых клеток, как считается, приводит к неспособности CD8+ Т-клеток осуществлять противоопухолевые функции. В экспериментальных работах это приводило к уклонению опухоли от иммунного ответа и прогрессированию заболевания [2]. Вопрос о роли PD-L1 на иммунных клетках, инфильтрирующих опухоль, остается спорным. Макрофаги являются одними из наиболее часто встречающихся клеток в микроокружении опухоли, поэтому функция PD-L1 в макрофагах представляет не меньший интерес. С одной стороны, считается, что связывание PD-L1-положительного макрофага и PD-1-положительной Т-клетки приводит к подавлению активности как
Т-клетки, так и макрофага [3]. С другой стороны, показано, что PD-L1, экспрессируемый на макрофагах, не ингибирует ответ Т-клеток, а защищает макрофаги от разрушения Т-клетками, в отличие от PD-L1, экспрессируемого на опухолевых клетках [4], связывание с которым приводит к такому эффекту. Кроме того, есть данные, свидетельствующие о том, что экспрессия PD-L1 макрофагами связана с их поляризацией в сторону проопухолевого фенотипа М2 [5].
Иммунотерапия, основанная на блокаде иммунных контрольных точек (ИКТ) PD-1/PD-L1, продемонстрировала многообещающие результаты в клинических испытаниях при различных видах рака [6–8], а экспрессия PD-L1 в опухоли или в микроокружении опухоли (при трижды негативном РМЖ) является одним из основных критериев назначения терапии ингибиторами ИКТ. Однако зачастую даже у пациентов с положительным PD-L1 статусом не наблюдается ожидаемой частоты объективного ответа на анти-PD-1/PD-L1 терапию [9]. В настоящее время проводится большое количество исследований, посвященных поиску причин не соответствующей ожиданиям эффективности иммунотерапии и, соответственно, более надежных предикторных маркеров ответа.
Визуализация контакта клеток считается наиболее достоверным методом для изучения их взаимодействия [10]. Неизвестно, как часто у больных РМЖ наблюдается связывание PD-L1 с PD-1, какие PD-L1-позитивные клетки преимущественно участвуют во взаимодействии и какую прогностическую значимость оно несет. Если учесть, что ко-локализованные макрофаги могут демонстрировать проопухолевый фенотип, то применение анти-PD-1/PD-L1 терапии в таком случае может быть не только не эффективным, но и в некоторых случаях приводить к прогрессированию опухоли [11]. Изучение ко-локализации иммуноцитов в микроокружении тем более актуально при РМЖ, поскольку рекомендуемым прогностическим критерием эффективности терапии ингибиторами PD-L1 является доля иммуноцитов, но не опухолевых клеток, экспрессирующих PD-L1.
Цель исследования – оценить частоту встречаемости ко-локализации PD-1-положительных и PD-L1-положительных клеток в микроокружении РМЖ вне проведения иммунотерапии, а также определить популяционную принадлежность данных клеток.
Материал и методы
В исследование включены 25 пациенток (табл. 1) с гистологически верифицированным диагнозом инвазивной карциномы молочной железы неспецифического типа (T1–4N0–3M0, возраст от 43 до 78 лет), проходивших лечение на базе НИИ онкологии Томского НИМЦ. Пациентки получали терапию в соответствии с клиническими рекомендациями.
Материалом исследования послужили срезы ткани первичной опухоли, предварительно фиксированной формалином и залитой парафином. Метод мультиплексной TSA-модифицированной иммуногистохимии (ИГХ) срезов ткани позволил идентифицировать и подсчитать иммунные клетки в строме опухоли молочной железы. С помощью иммуностейнера BOND RXm (Leica, Germany) была проведена автоматическая депарафинизация, демаскировка и окраска ткани. Для окрашивания ткани были использованы первичные антитела anti-PD-1 (Cell Marque, USA, clone NAT105, 1:100), anti-CD68 (Agilent Dako, USA, clone KP1, 1:5), anti-PD-L1 (Ventana, USA, clone SP142, 1:50), anti-CD3 (Agilent Dako, USA, polyclonal, 1:5), anti-CD163 (Diagnostic Biosystems, USA, clone 10D6, 1:100), anti-pan-CK (Agilent Dako, USA, clone AE1/AE3, 1:20) и набор Opal 7-color Automation IHC Kit (Akoya Bioscience, USA). Для окрашивания ядер применяли ProLong Diamond Antifade Mountant with DAPI (Invitrogen, USA). Оценить в каждой клетке среза ткани экспрессию PD-1, CD68, CD3, CD163 и CKAE1/3 позволило создание комплексов маркер-Opal: PD-1 – Opal520 (1:150), CD68 – Opal540 (1:150), PD-L1 – Opal570 (1:150), CD3 – Opal620 (1:150), CD163 – Opal650 (1:150), CKAE1/3 – Opal690 (1:150). Окрашенные срезы ткани сканировали при 20-кратном увеличении с использованием автоматизированной системы для мультиплексного иммунофлуоресцентного анализа Vectra 3.0.3 (PerkinElmer, USA) и анализировали с помощью программного обеспечения для анализа изображений InForm (PerkinElmer, v2.4.2).
Таблица 1/Table 1
Клинико-патологические характеристики пациентов
Clinicopathological characteristics of patients
|
Параметры/Parameters |
Частота/Frequency |
|
|
Возраст/Age |
<50 лет/years >50 лет/years |
7 (28 %) 18 (72 %) |
|
Менструальная функция/ |
Сохранена/Saved |
8 (32 %) |
|
Menstrual function |
Менопауза/Menopause |
17 (68 %) |
|
Неоадъювантная химиотерапия/ Neoadjuvant chemotherapy |
Нет/No Есть/Yes Нет данных/No data |
20 (80 %) 3 (12 %) 2 (8 %) |
|
Люминальный А/Luminal A |
4 (16 %) |
|
|
Молекулярный подтип/ |
Люминальный В (HER2-)/Luminal B (HER2-) |
16 (64 %) |
|
Molecular subtype |
Трижды негативный/Triple negative |
4 (16 %) |
|
Нет данных/No data |
1 (4 %) |
|
|
Лимфогенные метастазы/ Lymph node metastasis |
Нет/No Есть/Yes Нет данных/No data |
15 (60 %) 8 (32 %) 2 (8 %) |
|
Гематогенные метастазы/ Hematogenous metastasis |
Нет/No Есть/Yes Нет данных/No data |
19 (76 %) 5 (20 %) 1 (4 %) |
|
TILs |
<10 % >10 % |
6 (24 %) 19 (76 %) |
|
PD-L1 |
<1 % >1 % |
18 (72 %) 7 (28 %) |
Примечание: таблица составлена авторами.
Note: created by the authors.
Подсчет клеток на изображении был автоматизирован и проводился в десяти полях зрения. При этом М1 макрофагами считались клетки микроокружения опухоли, обладавшие фенотипом CD68+CD163-CD3-CKAE1/3-, М2 макрофагами – CD68+/-CD163+CD3-CKAE1/3-, лимфоцитами – CD68-CD163-CD3+CKAE1/3-. Опухолевые клетки имели фенотип CD68-CD163-CD3-CKAE1/3+. Под «другими» клетками понимали клетки микроокружения, которые не экспрессировали ни CD68, ни CD163, ни CD3. На всех клетках микроокружения была оценена экспрессия PD-1 и PD-L1. Количество PD-L1-положительных (PD-L1+) иммунных клеток, а также количество PD-1-положительных (PD-1+) иммунных клеток микроокружения было подсчитано у всех включенных в выборку пациентов и представлено в процентах от всех клеток микроокружения. Также было подсчитано соотношение количества PD-1+ клеток и PD-L1+ клеток микроокружения, показывающее, сколько PD-1+ клеток приходится на одну PD-L1+ клетку.
Помимо автоматизированного подсчета клеток проводилась визуальная оценка их расположения относительно друг друга. Ко-локализованными считались непосредственно контактирующие иммунные клетки, одна из которых несет рецептор PD-1, а вторая – лиганд PD-L1. Оценивались ко-локализации М1 макрофагов и CD3+ лимфоцитов, М2 макрофагов и CD3+ лимфоцитов, М1 и М2 макрофагов, М1 макрофагов и «других» клеток, М2 макрофагов и «других» клеток, CD3+ лимфоцитов и «других» клеток. Количество PD-L1+ клеток, ко-локализованных с PD-1+ клетками, было представлено в процентах от всех PD-L1+ клеток микроокружения опухоли.
Показатель TILs определялся как процент площади стромы, занятой мононуклеарными иммунными клетками, по сравнению с общей стромальной площадью, в соответствии с рекомендациями International TILs Working Group 2014. Уровень TILs считался высоким, если значения превышали установленный, согласно рекомендациям, порог в 10 % [12].
PD-L1 статус был определен в соответствии с рекомендациями по интерпретации теста VENTANA PD-L1 (SP142). При наличии заметного окрашивания PD-L1 любой интенсивности в инфильтрирующих опухоль иммунных клетках, покрывающих ≥1 % области опухоли, занимаемой опухолевыми клетками и интратуморальной и прилегающей перитуморальной стромой, PD-L1-статус считался положительным. При отсутствии какого-либо заметного окрашивания PD-L1 или при наличии заметного окрашивания PD-L1 любой интенсивности в инфильтрирующих опухоль иммунных клетках, покрывающих <1 % области опухоли, занимаемой опухолевыми клетками и ин-тратуморальной и прилегающей перитуморальной стромой, PD-L1-статус определялся как отрица- тельный (Ventana Medical Systems Inc. VENTANA PD-L1 (SP142) Assay Interpretation Guide (Oro Valley, AZ, USA)).
Статистическая обработка данных была проведена с помощью программ Statistica 12 (StatSoft, USA) и Prism 8.0.1. (GraphPad, USA). Качественные данные были представлены в виде n/N (%). Сравнение двух групп по качественному признаку осуществлялось с помощью точного критерия Фишера. Количественные данные не подчинялись нормальному распределению и были представлены в виде Me (Q1; Q3). Для сравнения двух независимых групп по количественному признаку был использован критерий Манна–Уитни. При проведении корреляционного анализа был рассчитан коэффициент корреляции Спирмена. Для оценки выживаемости были использованы кривые Каплана–Майера и log rank-критерий.
Результаты
Частота встречаемости и количество ко-локализованных клеток микроокружения, несущих PD-1 и PD-L1
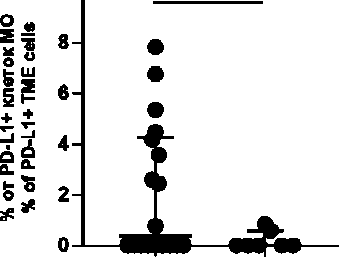
Лишь небольшая часть иммунных клеток микроокружения экспрессирует PD-1 или PD-L1, еще меньше из них контактирует друг с другом. Визуализация контакта рецептора PD-1 и лиганда PD-L1 является прямым свидетельством функционирования в опухоли иммунной контрольной точки PD-1/PD-L1. Ко-локализация иммунных клеток, одна из которых несет лиганд PD-L1, а другая – рецептор PD-1, в микроокружении рака молочной железы обнаруживалась у 13 (52,0 %) пациенток. Только 3,6 (0,8; 4,9) % PD-L1+ клеток микроокружения РМЖ были ко-локализованы с PD-1+ клетками. Соотношение PD-1/PD-L1 было
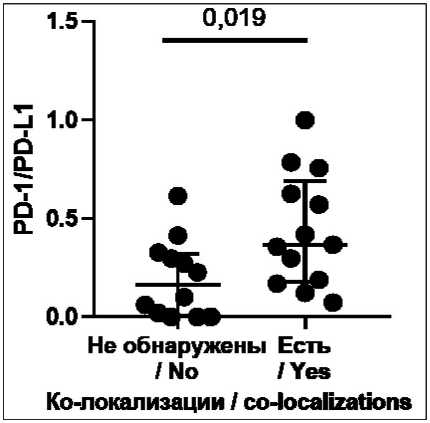
Рис. 1. Соотношение количества PD-1+ и PD-L1+ клеток в микроокружении у пациентов с ко-локализациями PD-1+ и PD-L1+ клеток и без них.
Примечание: рисунок выполнен авторами
Fig. 1. The ratio of the number of PD-1+ and PD-L1+ cells in the microenvironment in patients with and without co-localizations of PD-1+ and PD-L1+ cells. Note: created by the authors
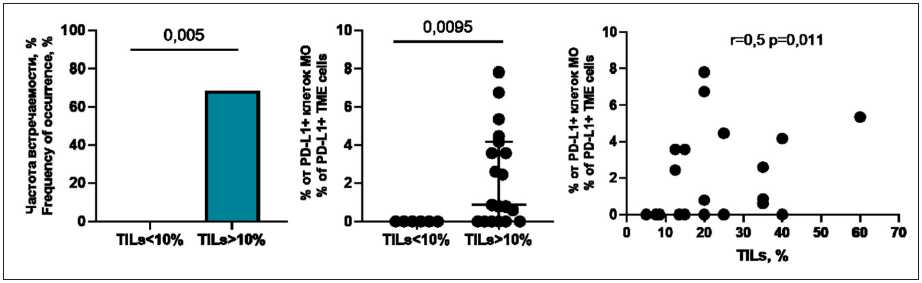
Рис. 2. Частоты встречаемости ко-локализаций клеток, несущих PD-1 и PD-L1, и количество PD-L1+ клеток, ко-локализованных с PD-1+ клетками, в зависимости от уровня TILs; корреляция количества ко-локализованных клеток и уровня TILs (коэффициент корреляции Спирмена). Примечание: рисунок выполнен авторами
Fig. 2. Frequency of co-localization of cells carrying PD-1 and PD-L1, and the number of PD-L1+ cells co-localized with PD-1+ cells with relation to the level of TILs; correlation between the number of co-localized cells and the level of TILs (Spearman’s correlation coefficient). Note: created by the authors
выше у больных с ко-локализациями, чем у пациенток без них (0,36 (0,07; 0,69 и 0,16 (0,005; 0,32); р=0,019) (рис. 1).
Связь между количеством ко-локализованных клеток микроокружения, несущих PD-1 и PD-L1, и уровнем TILs
Проведена оценка частоты встречаемости ко-локализации иммунных клеток с PD-1 и PD-L1 в зависимости от уровня TILs (рис. 2). Уровень TILs ниже 10 % (7,5 (7,5; 8,5) %) был у 6 (24 %) пациенток, выше 10 % (20,0 (15,0; 35,0) %) – у 19 (76 %) больных РМЖ. Анализ показал, что ко-локализации обнаруживались только у пациенток с уровнем TILs выше 10 % (в количестве 0,85 (0; 4,17) % от всех PD-L1+ клеток микроокружения; p=0,0095). При этом между количеством ко-локализаций и уровнем TILs наблюдалась умеренная положительная корреляция (r=0,5; p=0,011).
Ко-локализации клеток микроокружения, несущих PD-1 и PD-L1, в случаях с положительным и отрицательным
PD-L1 статусом опухоли
Важной представлялась оценка наличия ко-локализаций иммунных клеток, несущих PD-1 и
PD-L1, у пациенток с положительным и отрицательным PD-L1-статусом. Поскольку при оценке PD-L1 статуса рассчитывается количество PD-L1+ клеток на площадь всей ткани, в некоторых случаях с отрицательным PD-L1 статусом доля PD-L1+ клеток в расчете на площадь стромы может быть выше порогового значения в 1 %. Данные о количестве PD-L1+ клеток, а также PD-1+ клеток в группах пациентов с положительным и отрицательным PD-L1 статусом представлены в табл. 2. Количество PD-1+ клеток микроокружения, приходящееся на каждую PD-L1+ клетку, а также уровень TILs не различались в зависимости от PD-L1 статуса (табл. 2).
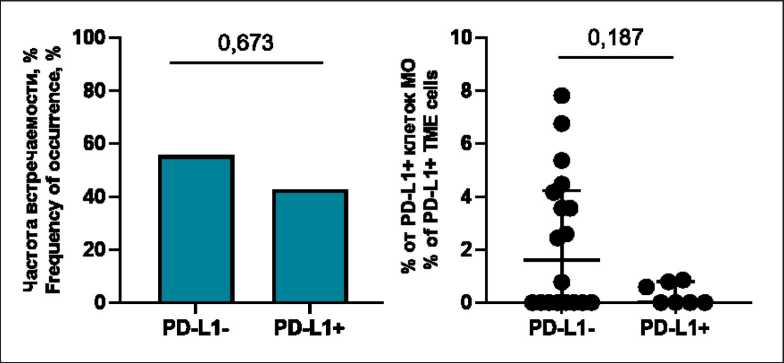
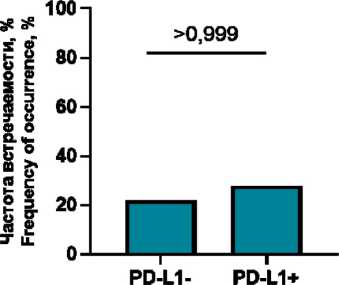
У пациенток с отрицательным PD-L1 статусом обнаруживались PD-L1+ иммунные клетки ко-локализованные с PD-1+ клетками (55,5 % (10/18)), причем с той же частотой, что и у больных с позитивным PD-L1 статусом (42,86 % (3/7), р=0,673). Доля ко-локализованных клеток также не различалась у пациенток с отрицательным и положительным PD-L1 статусом (1,6 (0; 4,2) и 0 (0; 0,8) % соответственно; p=0,187) (рис. 3).
Частота встречаемости и количество пар иммунных клеток микроокружения, взаимодействующих через PD-1/PD-L1, не различались в зависимости от PD-L1 статуса (рис. 4).
Таблица 2/Table 2
Характеристики микроокружения опухоли в зависимости от PD-L1 статуса Characteristics of the tumor microenvironment depending on PD-L1 status
|
Параметры/Parameters |
Отрицательный PD-L1статус/ Negative PD-L1 status (n=18) |
Положительный PD-L1+ статус/ Positive PD-L1 status (n=7) |
р |
|
|
Количество PD-L1+ клеток/ the number of PD-L1+ cells |
% от всех клеток МО/ |
4,1 (2,9; 8,8) |
18,0 (14,6; 18,5) |
<0,001 |
|
Количество PD-1+ клеток/ the number of PD-1+ cells |
% of all TME cells |
0,9 (0,3; 3,1) |
4,8 (1,8; 9,1) |
0,005 |
|
Соотношение PD-1/PD-L1/PD-1/PD-L1 ratio |
0,26 (0,05; 0,58) |
0,29 (0,12; 0,41) |
0,615 |
|
|
TILs, % |
15,0 (8,25; 21,25) |
25,0 (13,5; 35,0) |
0,170 |
|
Примечание: таблица составлена авторами.
Note: created by the authors.
М1 макрофаги М1 macrophages
М1 макрофаги М1 macrophages
PD-L1- PD-L1+
Рис. 3. Частота встречаемости ко-локализаций клеток, несущих PD-1 и PD-L1, и количество PD-L1+ клеток, ко-локализованных с PD-1+ клетками, в зависимости от PD-L1 статуса. Примечание: рисунок выполнен авторами Fig. 3. The frequency of co-localization of cells carrying PD-1 and PD-L1, and the number of PD-L1+ cells co-localized with PD-1+ cells with relation to the PD-L1 status. Note: created by the authors
М2 макрофаги М2 macrophages
М2 макрофаги М2 macrophages
PD-L1- PD-L1+
CD3+ лимфоциты
CD3+ lymphocytes
CD3+ лимфоциты
CD3+ lymphocytes
0,160
PD-L1- PD-L1+
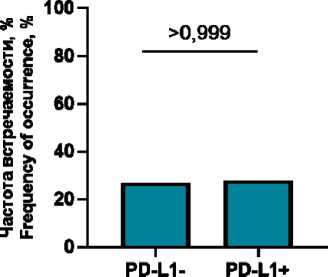
Рис. 4. Частоты встречаемости и количество ко-локализаций, включающих М1 макрофаги, М2 макрофаги или лимфоциты, в зависимости от PD-L1 статуса. Примечание: рисунок выполнен авторами
Fig. 4. The frequency and the number of colocalizations including M1 macrophages, M2 macrophages or lymphocytes with respect to PD-L1 status. Note: created by the authors
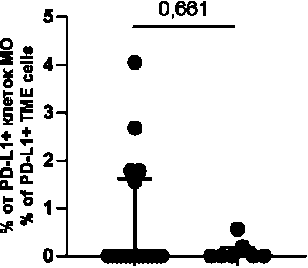
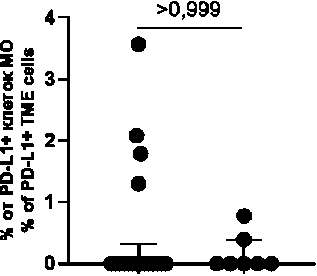
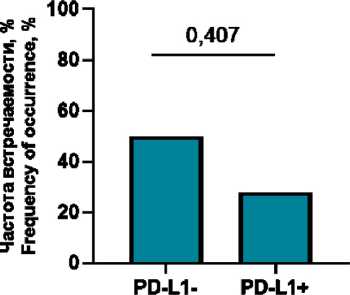
Ко-локализации PD-L1+ М1 макрофагов с PD-1+ клетками в случаях с отрицательным PD-L1 статусом обнаруживались у 27,7 % пациенток (5/18) и составляли 0 (0; 1,6) % от всех PD-L1+ клеток микроокружения, в случаях с положительным PD-L1 – у 28,6 % пациенток (2/7) и составляли 0 (0; 0,2) % от всех PD-L1+ клеток микроокружения (p>0,999; p=0,661). Ко-локализации PD-L1+ М2 макрофагов с PD-1+ клетками в случаях с отрицательным PD-L1 статусом обнаруживались у 22,2 % (4/18) и составляли 0 (0; 0,3) % от всех PD-L1+ клеток микроокружения, в случаях с положительным PD-L1 – 28,6 % (2/7), 0 (0; 0,4) % от всех PD-L1+ клеток микроокружения (p>0,999; p>0,999). Ко-локализации PD-L1+ клеток с PD-1+ CD3+ лимфоцитами (или PD-L1+ CD3+ лимфоцитов с PD-1+ клетками) в случаях с отрицательным PD-L1 статусом обнаруживались у 50 % пациенток (9/18) и составляли 0,4 (0; 4,2) % от всех PD-L1+ клеток микроокружения, в случаях с положитель-
Таблица 3/Table 3
Частоты встречаемости ко-локализаций в опухолевом микроокружении иммуноцитов с рецептором PD-1 и лигандом PD-L1
Frequency of co-localizations in the tumor microenvironment of immunocytes with PD-1 receptor and PD-
L1 ligand
|
Ко-локализации/Сo-localizations |
Частота/Frequency |
|
PD1-PDL1+ M1 макрофаги и PD1+PDL1- лимфоциты / PD1-PDL1+ M1 macrophages and PD1+PDL1- lymphocytes |
7 (28,0 %) |
|
PD1-PDL1+ M2 макрофаги и PD1+PDL1- лимфоциты / PD1-PDL1+ M2 macrophages and PD1+PDL1- lymphocytes |
4 (16,0 %) |
|
PD1-PDL1+ M2 макрофаги и PD1+PDL1- другие клетки / PD1-PDL1+ M2 macrophages and PD1+PDL1- other cells |
2 (8,0 %) |
|
PD1+PDL1+ M2 макрофаги и PD1+PDL1+ другие клетки/ PD1+PDL1+ M2 macrophages and PD1+PDL1+ other cells |
1 (4,0 %) |
|
PD1+PDL1- лимфоциты и PD1-PDL1+ другие клетки / PD1+PDL1- lymphocytes и PD1-PDL1+ other cells |
7 (28,0 %) |
|
PD1-PDL1+ лимфоциты и PD1+PDL1- другие клетки / PD1-PDL1+ lymphocytes и PD1+PDL1- other cells |
3 (12,0 %) |
Примечание: таблица составлена авторами.
Note: created by the authors.
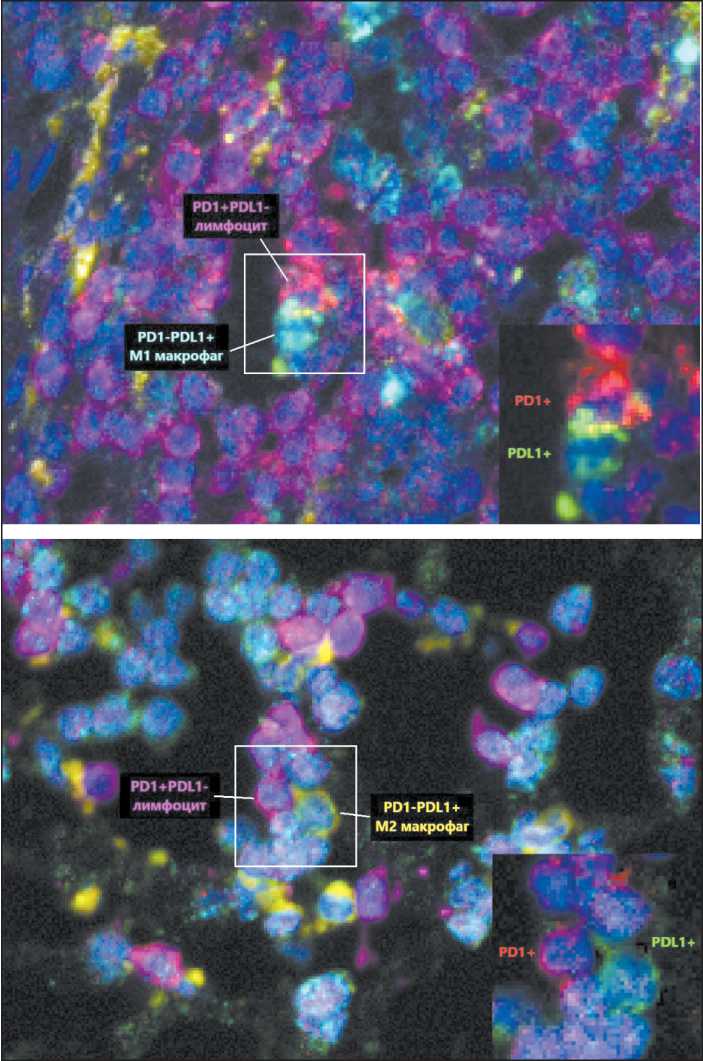
Рис. 5. TSA-модифицированная ИГХ, маркеры с присвоенными им псевдоцветами (CD68 – голубой, CD163 – желтый, CD3 – фиолетовый, PD-1 – красный, PD-L1 – зеленый), ×400.
Примечание: рисунок выполнен авторами
Fig. 5. TSA-modified IHC, markers with pseudo-colors assigned to them (CD68 – cyan, CD163 – yellow, CD3 – magenta, PD-1 – red, PD-L1 – green), ×400. Note: created by the authors
ным PD-L1 – у 28,6 % пациенток (2/7) и составляли 0 (0; 0,6) % от всех PD-L1+ клеток микроокружения (p=0,407; p=0,160).
В табл. 3 и на рис. 5 представлены фенотипы ко-локализованных клеток и частоты их встречаемости. Макрофаги участвовали в рассмотренных клеточных контактах в роли клеток, несущих PD-L1. Для макрофагов, несущих PD-1, не были характерны контакты с клетками, несущими PD-L1. Наоборот, для лимфоцитов с экспрессией PD-1 ко-локализации были более характерны, чем для лимфоцитов с экспрессией PD-L1.
Межперсональные различия встречаемости ко-локализованных клеток микроокружения, несущих PD-1 и PD-L1
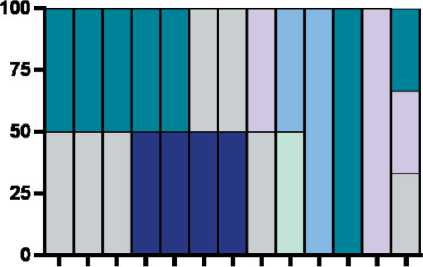
Кроме того, было оценено количество различных ко-локализаций клеток с рецептором и лигандом у каждого пациента (рис. 6). Не более трех различных пар ко-локализованных клеток присутствовало в микроокружении опухоли. У 3 из 13 пациентов были ко-локализованы только PD1-PDL1+ M1 макрофаги и PD1+PDL1- лимфоциты, а также PD1+PDL1- лимфоциты и PD1-PDL1+ «другие» клетки, у 2 из 13 пациентов – только PD1-PDL1+ M2 макрофаги и PD1+PDL1-лимфоциты, а также PD1+PDL1- лимфоциты и PD1-PDL1+ «другие» клетки. У 2 из 13 в микроокружении обнаруживались ко-локализации как М1 макрофагов (PD1-PDL1+ M1 макрофаги и PD1+PDL1- лимфоциты), так и М2 макрофагов (PD1-PDL1+ M2 макрофаги и PD1+PDL1- лимфоциты). У остальных пациентов комбинации ко-локализованных клеток варьировали. Кроме того, у 5 из 13 пациентов были ко-локализованы М1, но не М2 макрофаги, и у 4 из 13 – М2 макрофаги, но не М1.
u
8S
1 2 3 4 5 6 7 8 9 10 11 12 13
Номер пациента Patient number
PD1-PDL1+ М2 макрофаги и PD1+PDL1-лимфоциты
PD1-PDL1+ М1 макрофаги и PD1+PDL1- лгмфоциты
PD1+PDL1+ М2 макрофаги и PD1+PDL1+другие клетки
PD1-PDL1 + лимфоциты и PD1+PDL1 - другие клетки
PD1-PDL1+ М2 макрофаги и PD1+PDL1-другие клетей
PD1+PDL1- лимфоциты и PD1-PDL1+другие клетки
Рис. 6. Комбинации ко-локализаций у пациенток с ко-локализациями клеток, несущих PD-1 и PD-L1. Примечание: рисунок выполнен авторами Fig. 6. Combinations of colocalizations in patients with co-localizations of cells carrying PD-1 and PD-L1. Note: created by the authors
Оценка безметастатической выживаемости больных РМЖ в зависимости от наличия ко-локализаций клеток, несущих PD-1 и PD-L1, в опухолевом микроокружении
У включенных в исследование больных РМЖ безметастатическая выживаемость за весь срок наблюдения (медиана – 48 мес) при отсутствии ко-локализаций клеток с экспрессией PD-1 и PD-L1 в опухолевом микроокружении равнялась 83,3 % (10/12), а при наличии ко-локализаций PD-1 и PD-L1 – 76,9 % (10/13) (р=0,372) (рис 7). Таким образом, безметастатическая выживаемость не была сопряжена с наличием или отсутствием в опухолевом микроокружении ко-локализованных клеток, несущих PD-1 и PD-L1.
Обсуждение
Механизм действия иммунной контрольной точки PD-1/PD-L1 известен давно, исследована прогностическая роль определения в опухоли и опухолевой строме экспрессии белка PD-L1 для течения заболевания и эффективности терапии, но к настоящему моменту накоплено много данных, демонстрирующих недостаточную прогностическую точность этого параметра. Положительный PD-L1 статус для больных РМЖ означает, что в микроокружении опухоли присутствует много PD-L1+ иммунных клеток, но не означает, что они взаимодействуют с PD-1+ клетками. В отличие от экспрессии PD-L1, визуализация контактов клеток в опухоли, одна из которых несет рецептор PD-1, а другая – лиганд PD-L1, напрямую указывает на функционирование контрольной точки PD-1/ PD-L1. К настоящему моменту проведен ряд исследований, предлагающих методы визуализации в опухоли прямых контактов клеток, несущих PD-1 и PD-L1 [13].
Согласно полученным в нашем исследовании результатам, ко-локализация PD-L1+ клеток микроокружения с PD-1+ клетками обнаруживается лишь у половины больных РМЖ, причем их количество равнялось 3–4 на 100 PD-L1+ клеток. Ко-локализации PD-1+ и PD-L1+ клеток являются достаточно редкими событиями, однако мы обнаружили закономерности, которые лежат в основе этих событий. Во-первых, непосредственный контакт PD-1+ и PD-L1+ клеток был обнаружен
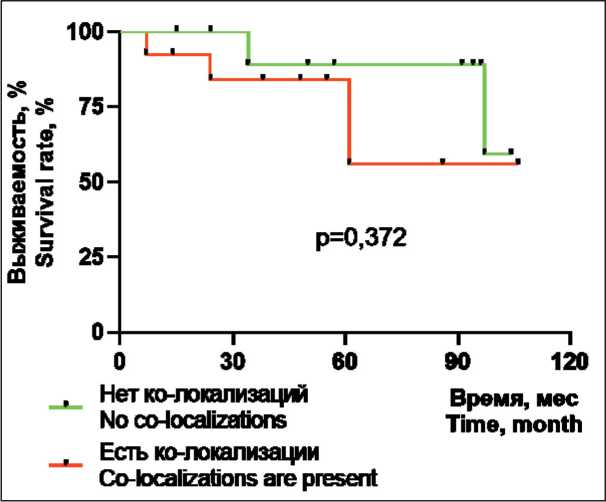
Рис. 7. Безметастатическая выживаемость больных РМЖ в зависимости от наличия ко-локализаций клеток, несущих PD-1 и PD-L1. Примечание: рисунок выполнен авторами Fig. 7. Metastasis-free survival of patients with breast cancer depending on the presence of co-localizations of cells carrying PD-1 and PD-L1. Note: created by the authors только у больных РМЖ с уровнем TILs выше 10 %. Это можно объяснить тем, что при высоком уровне TILs иммунные клетки расположены в строме на меньшем расстоянии друг от друга, что повышает вероятность их непосредственного контакта. Во-вторых, в группе больных с обнаруженными ко-локализациями соотношение PD-1/PD-L1 было выше. Это указывает на то, что контакт PD-L1+ клеток с PD-1+ тем более вероятен, чем более PD-1+ клеток приходится на каждую PD-L1+ клетку.
Однако ко-локализации иммунных клеток, несущих PD-1 и PD-L1, в микроокружении обнаруживались в равном количестве в группах больных РМЖ с положительным и отрицательным PD-L1 статусом, несмотря на то, что при положительном PD-L1 статусе в микроокружении опухоли значительно больше PD-L1+ и PD-1+ клеток. Схожие результаты получены в исследовании J. Sánchez-Magraner et al. [14], в котором с помощью метода iFRET оценено взаимодействие в опухоли рецептора PD-1 и лиганда PD-L1. Взаимодействие PD-1/PD-L1 в опухоли при меланоме наблюдалось в равной степени при высокой и при низкой экспрессии PD-L1.
Стоит отметить, что само по себе значение PD-L1 статуса как прогностического маркера течения РМЖ является противоречивым, судя по литературным данным. Согласно метаанализу, положительный PD-L1 статус при РМЖ достоверно связан с более короткой общей выживаемостью, но при этом не имеет существенной связи с без-метастатической выживаемостью [15]. Однако в другом исследовании PD-L1+ TILs были связаны с лучшей выживаемостью [16]. Но нет исследований, где бы изучалась прогностическая роль частоты контактов в опухоли клеток, несущих PD-1 и PD-L1, у больных РМЖ. Согласно полученным нами данным, безметастатическая выживаемость у больных РМЖ не сопряжена с наличием или отсутствием ко-локализованных клеток, несущих PD-1 и PD-L1.
Кроме того, нами обнаружено, что вне зависимости от PD-L1 статуса как М1, так и М2 макрофаги участвуют в рассмотренных взаимодействиях в качестве клеток, несущих лиганд PD-L1. М1 макрофаги играют важную роль в презентации антигена, секреции провоспалительных цитокинов и противоопухолевой резистентности, тогда как М2 макрофаги способствуют разрешению воспаления и развитию опухоли [17]. Согласно литературным данным, взаимодействие рецептора PD-1 и лиганда PD-L1 приводит к изменению функционального состояния контактирующих клеток. Считается, что связывание PD-L1, экспрессируемого на макрофагах с PD-1 на Т-клетках, приводит к подавлению активации Т-клеток и ускользанию опухолевых клеток от иммунитета. E. Peranzoni et al. показано, что при плоскоклеточном раке легкого в строме опухоли макрофаги контактируют с лимфоцитами, формируя длительные взаимодействия с CD8+ Т-клетками [18]. Истощение макрофагов ингибитором рецептора колониестимулирующего фактора-1 (CSF-1R), которое приводит к исключению контакта макрофагов и CD8+ Т-клеток в строме, в сочетании с анти-PD-1 у мышей усиливает миграцию и инфильтрацию CD8+ Т-клеток в опухоли [18].
Менее ясен результат взаимодействия PD-L1+ макрофагов и PD-1+ лимфоцитов для макрофагов. С одной стороны, это взаимодействие, вероятно, приводит к ингибированию их функции, поскольку результат взаимодействия PD-L1/PD-1 может считаться одинаковым для макрофагов и Т-клеток, учитывая, что это общий эффект лиганд-рецептор [3]. В таком случае существенное значение для эффекта терапии ИИКТ имел бы фенотип (противоопухолевый или проопухолевый) «разблокированных» клеток. С другой стороны, S. Singhal et al. показали, что PD-L1, экспрессируемый на макрофагах, не ингибирует ответ Т-клеток, а просто защищает макрофаги от разрушения Т-клетками, в отличие от PD-L1, экспрессируемого на опухолевых клетках [4]. G.P. Hartley et al. получены результаты, указывающие на то, что PD-L1, экспрессирующийся на макрофагах, через путь mTOR стимулирует приобретение макрофагом иммуносупрессивного фенотипа [19]. Обработка PD-L1+ мышиных и человеческих макрофагов растворимым PD-1, растворимым CD80 и антителами к PD-L1 приводила к схожим результатам – наблюдалось повышение спонтанной пролиферации, а также экспрессии костимулирующих молекул и продукции провоспалительных цитокинов [19].
В настоящий момент нет единого мнения по поводу механизма влияния белка PD-L1 на функциональное состояние макрофагов, не полностью изучен результат взаимодействия PD-L1, экспрессирующегося на М1 и М2 макрофагах, с PD-1 других клеток и эффект ИИКТ, опосредованный действием на макрофаги.
Одна из сторон механизма действия анти-PD-1 или анти-PD-L1 иммунотерапии заключается в создании препятствия для функционирования иммунной контрольной точки PD-1/PD-L1 и предотвращении таким путем ингибирования механизмов противоопухолевого иммунитета. Однако для эффективности этого механизма необходимо, чтобы иммунная контрольная точка изначально функционировала в опухоли. О возможности такого функционирования может свидетельствовать обнаружение в опухоли изначальной ко-локализации PD-1/PD-L1. По данным J. Sánchez-Magraner et al., у пациентов с метастатическим немелкоклеточным раком легкого, получавших анти-PD-1- или анти-PD-L1-терапию, общая выживаемость и выживаемость без прогрессирования были выше в тех случаях, когда взаимодействие PD-1/PD-L1 в опухоли встречалось чаще, но при этом не различалась в зависимости от уровня экспрессии PD-L1 [20]. Это подтверждает, что наличие в опухоли ко-локализованных клеток, несущих PD-1 и PD-L1, свидетельствует в пользу работы иммунной контрольной точки PD-1/PD-L1 точнее, чем положительный PD-L1 статус. Предполагается, что в опухолях с частым взаимодействием PD-1 и PD-L1 превалирует именно этот путь уклонения от разрушения иммунными клетками, и поэтому они с большей вероятностью реагируют на анти-PD-1-или анти-PD-L1- иммунотерапию.
Заключение
В микроокружении РМЖ обнаружены взаимодействия PD-1 и PD-L1 иммунных клеток, причем вероятность данного взаимодействия тем выше, чем выше уровень TILs и соотношение количества PD-1+ и PD-L1+ клеток в микроокружении опухоли. У пациенток с положительным и отрицательным PD-L1 статусом не различалось количество ко-локализаций PD-1+ и PD-L1+ клеток, приходящихся на PD-L1+ клетки микроокружения, вне зависимости от того, какие клетки (М1 макрофаги, М2 макрофаги или лимфоциты)
участвовали в таком взаимодействии. Не выявлено связи между наличием или отсутствием в опухолевом микроокружении ко-локализованных клеток, несущих PD-1 и PD-L1, и безметастатиче-ской выживаемостью. Значение ко-локализации
Список литературы Визуализация контакта PD-l1-положительных и PD-1-положительных иммунных клеток в микроокружении рака молочной железы
- Okazaki T., Honjo T. The PD-1-PD-L pathway in immunological tolerance. Trends Immunol. 2006; 27(4): 195-201. https://doi.org/10.1016/j.it.2006.02.001.
- Han Y., Liu D., Li L. PD-1/PD-L1 pathway: current researches in cancer. Am J Cancer Res. 2020; 10(3): 727-42.
- Lu D., Ni Z., Liu X., Feng S., Dong X., Shi X., Zhai J., Mai S., Jiang J., Wang Z., Wu H., Cai K. Beyond T Cells: Understanding the Role of PD-1/PD-L1 in Tumor-Associated Macrophages. J Immunol Res. 2019. https://doi.org/10.1155/2019/1919082.
- Singhal S., Stadanlick J., Annunziata M.J., Rao A.S., Bhojnagarwala P.S., O’Brien S., Moon E.K., Cantu E., Danet-Desnoyers G., Ra H.J., Litzky L., Akimova T., Beier U.H., Hancock W.W., Albelda S.M., Eruslanov E.B. Human tumor-associated monocytes/macrophages and their regulation of T cell responses in early-stage lung cancer. Sci Transl Med. 2019; 11(479). https://doi.org/10.1126/scitranslmed.aat1500.
- Zhu Z., Zhang H., Chen B., Liu X., Zhang S., Zong Z., Gao M. PD-L1-Mediated Immunosuppression in Glioblastoma Is Associated With the Infiltration and M2-Polarization of Tumor-Associated Macrophages. Front Immunol. 2020; 11. https://doi.org/10.3389/fimmu.2020.588552.
- Horn L., Spigel D.R., Vokes E.E., Holgado E., Ready N., Steins M., PoddubskayaE.,BorghaeiH.,FelipE.,Paz-AresL.,PluzanskiA.,ReckampK.L., Burgio M.A., Kohlhäeufl M., Waterhouse D., Barlesi F., Antonia S., Arrieta O., Fayette J., Crinò L., Rizvi N., Reck M., Hellmann M.D., Geese W.J., Li A., Blackwood-Chirchir A., Healey D., Brahmer J., Eberhardt W.E.E. Nivolumab Versus Docetaxel in Previously Treated Patients With Advanced Non-Small-Cell Lung Cancer: Two-Year Outcomes From Two Randomized, Open-Label, Phase III Trials (CheckMate 017 and CheckMate 057). J Clin Oncol. 2017; 35(35): 3924-33. https://doi.org/10.1200/JCO.2017.74.3062.
- Schmid P., Adams S., Rugo H.S., Schneeweiss A., Barrios C.H., Iwata H., Diéras V., Hegg R., Im S.A., Shaw Wright G., Henschel V., Molinero L., Chui S.Y., Funke R., Husain A., Winer E.P., Loi S., Emens L.A.; IMpassion130 Trial Investigators. Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. N Engl J Med. 2018; 379(22): 2108-21. https://doi.org/10.1056/NEJMoa1809615.
- Kang Y.K., Boku N., Satoh T., Ryu M.H., Chao Y., Kato K., Chung H.C., Chen J.S., Muro K., Kang W.K., Yeh K.H., Yoshikawa T., Oh S.C., Bai L.Y., Tamura T., Lee K.W., Hamamoto Y., Kim J.G., Chin K., Oh D.Y., Minashi K., Cho J.Y., Tsuda M., Chen L.T. Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017; 390(10111): 2461-71. https://doi.org/10.1016/S0140-6736(17)31827-5.
- Keenan T.E., Tolaney S.M. Role of Immunotherapy in Triple-Negative Breast Cancer. J Natl Compr Canc Netw. 2020; 18(4): 479-89. https://doi.org/10.6004/jnccn.2020.7554.
- Kamakura D., Asano R., Kawai H., Yasunaga M. Mechanism of action of a T cell-dependent bispecific antibody as a breakthrough immunotherapy against refractory colorectal cancer with an oncogenic mutation. Cancer Immunol Immunother. 2021; 70(1): 177-88. https://doi.org/10.1007/s00262-020-02667-9.
- Yamaguchi K., Tsuchihashi K., Tsuji K., Kito Y., Tanoue K., Ohmura H., Ito M., Isobe T., Ariyama H., Kusaba H., Akashi K., Baba E. Prominent PD-L1-positive M2 macrophage infiltration in gastric cancer with hyper-progression after anti-PD-1 therapy: A case report. Medicine (Baltimore). 2021; 100(19). https://doi.org/10.1097/MD.0000000000025773.
- Salgado R., Denkert C., Demaria S., Sirtaine N., Klauschen F., Pruneri G., Wienert S., Van den Eynden G., Baehner F.L., Penault-Llorca F., Perez E.A., Thompson E.A., Symmans W.F., Richardson A.L., Brock J., Criscitiello C., Bailey H., Ignatiadis M., Floris G., Sparano J., Kos Z., Nielsen T., Rimm D.L., Allison K.H., Reis-Filho J.S., Loibl S., Sotiriou C., Viale G., Badve S., Adams S., Willard-Gallo K., Loi S.; International TILs Working Group 2014. The evaluation of tumor-infiltrating lymphocytes (TILs) in breast cancer: recommendations by an International TILs Working Group 2014. Ann Oncol. 2015; 26(2): 259-71. https://doi.org/10.1093/annonc/mdu450.
- Larijani B., Miles J., Ward S.G., Parker P.J. Quantification of biomarker functionality predicts patient outcomes. Br J Cancer. 2021; 124(10): 1618-20. https://doi.org/10.1038/s41416-021-01291-3.
- Sánchez-Magraner L., Miles J., Baker C.L., Applebee C.J., Lee D.J., Elsheikh S., Lashin S., Withers K., Watts A.G., Parry R., Edmead C., Lopez J.I., Mehta R., Italiano A., Ward S.G., Parker P.J., Larijani B. High PD-1/PD-L1 Checkpoint Interaction Infers Tumor Selection and Therapeutic Sensitivity to Anti-PD-1/PD-L1 Treatment. Cancer Res. 2020; 80(19): 4244-57. https://doi.org/10.1158/0008-5472.CAN-20-1117.
- Cirqueira M.B., Mendonça C.R., Noll M., Soares L.R., de Paula Carneiro Cysneiros M.A., Paulinelli R.R., Moreira M.A.R., Freitas-Junior R. Prognostic Role of PD-L1 Expression in Invasive Breast Cancer: A Systematic Review and Meta-Analysis. Cancers (Basel). 2021; 13(23): 6090. https://doi.org/10.3390/cancers13236090.
- Huang W., Ran R., Shao B., Li H. Prognostic and clinicopathological value of PD-L1 expression in primary breast cancer: a meta-analysis. Breast Cancer Res Treat. 2019; 178(1): 17-33. https://doi.org/10.1007/s10549-019-05371-0.
- Yunna C., Mengru H., Lei W., Weidong C. Macrophage M1/M2 polarization. Eur J Pharmacol. 2020; 877. https://doi.org/10.1016/j.ejphar.2020.173090.
- Peranzoni E., Lemoine J., Vimeux L., Feuillet V., Barrin S., Kantari-Mimoun C., Bercovici N., Guérin M., Biton J., Ouakrim H., Régnier F., Lupo A., Alifano M., Damotte D., Donnadieu E. Macrophages impede CD8 T cells from reaching tumor cells and limit the efficacy of anti-PD-1 treatment. Proc Natl Acad Sci U S A. 2018; 115(17): 4041-50. https://doi.org/10.1073/pnas.1720948115.
- Hartley G.P., Chow L., Ammons D.T., Wheat W.H., Dow S.W. Programmed Cell Death Ligand 1 (PD-L1) Signaling Regulates Macrophage Proliferation and Activation. Cancer Immunol Res. 2018; 6(10): 1260-73. https://doi.org/10.1158/2326-6066.CIR-17-0537.
- Sánchez-Magraner L., Gumuzio J., Miles J., Quimi N., Martínez Del Prado P., Abad-Villar M.T., Pikabea F., Ortega L., Etxezarraga C., Martín-Algarra S., Lozano M.D., Saiz-Camin M., Egurrola-Izquierdo M., Barredo-Santamaría I., Saiz-López A., Gomez-Mediavilla J., Segues-Merino N., Juaristi-Abaunz M.A., Urruticoechea A., Geraedts E.J., van Elst K., Claessens N.J.M., Italiano A., Applebee C.J., Del Castillo S., Evans C., Aguirre F., Parker P.J., Calleja V. Functional Engagement of the PD-1/ PD-L1 Complex But Not PD-L1 Expression Is Highly Predictive of Patient Response to Immunotherapy in Non-Small-Cell Lung Cancer. J Clin Oncol. 2023. https://doi.org/10.1200/JCO.22.01748.


