Влияние аэрации на образование продуктов биотрансформации D-ксилозы дрожжами Pachysolen tannophilus
Автор: Болотникова Ольга Ивановна, Михайлова Наталья Павловна, Гинак Анатолий Ио, Немова Нина Николаевна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 6 (111), 2010 года.
Бесплатный доступ
Аэрация, дрожжи p. tannophilus, d-ксилоза, ксилит, этанол
Короткий адрес: https://sciup.org/14749761
IDR: 14749761
Текст статьи Влияние аэрации на образование продуктов биотрансформации D-ксилозы дрожжами Pachysolen tannophilus
Гидролиз растительной гемицеллюлозы приводит к появлению D-ксилозы, которая может быть подвергнута биоконверсии с помощью ксилозоассимилирующих микроорганизмов. Дрожжи, относящиеся к виду P. tannophilus , обладают уникальной способностью восстанавливать этот сахар в ксилит и при неполном его окислении образовывать этанол [6]. Многочисленные исследования показывают, что эффективность накопления ксилита и этанола при ферментации D-ксилозы в значительной мере определяется внешними факторами, главным из которых считают кислород. Интенсивность аэрации непосредственно регулирует синтез D-ксилулозы из ксилита в присутствии ксилозоредуктазы [7].
Накопление ксилита часто является следствием кислородного голодания клеток. Напротив, увеличение концентрации растворенного кислорода в среде обеспечивает прирост дрожжевой биомассы, так как гликолитическому окислению D-ксилулозы предшествует ее метаболизм в гли-церальдегид-3-фосфат и фруктозо-6-фосфат – интермедиаты пентозофосфатного цикла [11]. И наконец, являясь акцептором электронов и протонов дыхательной цепи митохондрий, кислород оказывает влияние на спиртообразующую активность дрожжей [8], [11]. Тем не менее до сих пор не определены параметры аэрации, которые обеспечивают переключение внутриклеточного метаболизма P. tannophilus и накопление того или иного промежуточного продукта ферментации D-ксилозы. Поэтому анализ влия-
ния условий аэрации на образование дрожжами P. tannophilus ксилита и этилового спирта из D-ксилозы являлся целью настоящей работы.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали дрожжи P. tannophilus Y-1532 (ВКПМ, ВНИИГенетика, Москва). Среда для ферментаций имела состав (г/л): D-ксилоза-20, пептон-20, дрожжевой экстракт-5 [6]. Посевной материал выращивали на среде с 2 % D-глюкозой в соответствии с [4]. Скорости поступления кислорода в среду (OTR, мМоль/л ·ч) оценивали сульфитным методом [2]. Необходимые режимы аэрирования создавали путем варьирования степени заполнения колб и ферментера питательной средой, а также числа оборотов круговой качалки (мешалки ферментера). Параметры культивирования дрожжей приведены в табл. 1. При скоростях поступления кислорода от 0,0 мМоль/л · ч до 8,0 мМоль/л · ч ферментации проводили в колбах Эрленмейера объемами 100 мл и 250 мл согласно [7]. Значения OTR в пределах 5,8–140,0 мМоль/л · ч поддерживали в лабораторной ферментационной установке Biostat M (Braun, Германия) емкостью 2 л (коэффициент заполнения – 0,75), снабженной турбинной мешалкой и барботером, компрессором с регулируемой подачей стерильного воздуха, редуктором для варьирования скорости вращения мешалки, датчиками для измерения pH и pO 2 . Поддержание значения pH достигалось автоматической подачей раствора едкого натра, пеногашение – разовыми подачами олеиновой кислоты. Концентрацию растворенного кислорода в среде определяли с использованием кислородного электрода (Ingold, Германия) согласно [13]. Калибровку кислородного электрода проводили непосредственно перед каждым экспериментом: за 100 % шкалы рО2 принимали содержание кислорода в среде при интенсивной аэрации (1,8 объема воздуха / 1 объем среды и скорости перемешивания 800 об/мин в течение часа), за нулевой уровень – содержание кислорода в среде, насыщенной раствором сульфита натрия. Величина рН среды и температура культивирования соответствовали указанным в [4], [6]. Раннее истощение питательной среды и быстрое наступление субстратного лимитирования предотвращали внесением низких концентраций посевного материала [5].
В качестве контроля использовали условия без принудительной аэрации (анаэробные) и не лимитирующие рост (аэробные) [7]. Пробы для исследования отбирали через каждые 2 часа ферментации. По окончании ферментации дрожжевую биомассу отделяли на лабораторной центрифуге ПК-6 (СССР) в течение 5–10 мин при 5000 об/мин. Анализ концентраций этилового спирта, ксилита и остаточной D-ксилозы в культуральной жидкости проводили методами газо-жидкостной хроматографии на приборе Vis- ta 600 («Varian», США) в соответствии с условиями, описанными в [6]. Биомассу определяли по поглощению суспензии клеток при 620 нм на спектрофотометре СФ-46 (СССР). Статистическую обработку результатов осуществляли согласно [1].
Таблица 1
Параметры ферментации D-ксилозы дрожжами P. tannophilus при различных скоростях растворения кислорода в среде
|
Условия |
с |
Объем |
Кол- |
Кол-во |
Интенсивность |
Скорость |
|
|
п |
колбы |
во |
посев- |
аэрации |
раство- |
||
|
о с о б |
или ферментера, мл |
среды, мл |
ного мате риала, г а.с.в./л |
ско рость вращения, об/мин-1 |
об.возд./ об. сре-ды/мин |
рения кислорода, (OTR), мМоль/л· ч |
|
|
анаэробные* |
к о |
100 |
100 |
10,0 |
нет |
0 |
|
|
микро- |
л |
200 |
– |
2,0 |
|||
|
аэробные |
б |
250 |
100 |
1,0 |
100 |
5,0 |
|
|
ы |
50 |
8,0 |
|||||
|
ф е |
1500 |
6,0 |
100 200 |
0,1 0,3 |
5,8 8,0 |
||
|
р |
1400 |
3,0 |
300 |
0,5 |
13,0 |
||
|
м |
1300 |
1,0 |
1,0 |
36,0 |
|||
|
аэробные |
е |
2000 |
|||||
|
н |
|||||||
|
т |
900 |
0,9 |
600 |
1,4 |
140,0 |
||
|
е |
|||||||
|
р |
|||||||
Примечание. * – условия без принудительной аэрации, при которых ферментационная среда была полностью насыщена раствором сульфита натрия.
РЕЗУЛЬТАТЫ
Среди известных методов оценки степени аэрирования культуральной среды наиболее удобным является сульфитный, характеризующий скорость растворения кислорода (OTR, мМоль/л · ч) и одновременно с этим позволяющий определить его количество, необходимое для достижения максимального экономического коэффициента образования того или иного продукта. Поскольку режим ограниченного снабжения дрожжей кислородом благоприятствует накоплению в ферментационной среде не только ксилита, но и этанола [6], [7], [10], особое внимание было уделено микроаэробной ферментации D-ксилозы.
ФЕРМЕНТАЦИЯ D-КСИЛОЗЫ ПРИ РАЗЛИЧЫХ УСЛОВИЯХ АЭРАЦИИ
Образование ксилита, этанола и биомассы дрожжами P. tannophilus при различных скоростях поступления кислорода в ферментационную среду иллюстрируют табл. 2 и рисунок. Показано, что увеличение интенсивности аэрации приводило к сокращению времени ассимиляции
D-ксилозы. При OTR = 0 мМоль/л · ч (условия, названные нами анаэробными) потребление сахара было менее 5 % и накопления продуктов биоконверсии не наблюдалось. Однако при режиме аэрации 2,0 мМоль/л · ч к концу ферментации утилизировалось до 87 % D-ксилозы со скоростью 0,20 г/л · ч. В этом случае основным продуктом микроаэробной ферментации был ксилит (с максимальной концентрацией 4,60 г/л и величиной экономического коэффициента образования 0,23 г/г). Тем не менее наибольшую объемную (0,08 г/л · ч) и удельную (0,04 ч-1) продуктивности пятиатомного спирта зарегистрировали при OTR 5,0 мМоль/л · ч, когда потребление D-ксилозы уже достигло 99 %. Более того, данный режим аэрации обеспечивал максимальные значения концентрации и экономического выхода этанола (5,00 г/л и 0,25 г/г соответственно). В то же время наибольшие показатели объемной и удельной продуктивности спирта (0,14 г/л · ч и 0,10 ч-1) были выявлены при OTR 8,0 мМоль/л · ч (табл. 2). Таким образом, незначительный сдвиг интенсивности аэрации ферментационной среды в сторону увеличения, необходимый для достижения максимальных продуктивностей, является общей тенденцией, ха- рактерной как для ксилита, так и для этилового спирта.
Использование лабораторной ферментационной установки позволило рассчитать с помощью кислородного электрода значения pO 2 . Быстрое снижение этого параметра до нуля при скоростях растворения кислорода от 5,8 до 36,0 мМоль/л · ч указывало на лимитирование биосинтетической активности дрожжей за счет создания микро-аэробных условий культивирования (см. рисунок А, В). Резкое (уже к 5-му часу ферментации) падение pO 2 при OTR 5,8–13,0 мМоль/л · ч свидетельствовало о значительном дефиците кислорода в среде. Динамика образования ксилита, этанола и дрожжевой биомассы в этом случае характеризовалась рядом общих черт (см. рисунок А). Так, ксилит появлялся в среде уже с первых часов ферментации, и при 40 % исчерпании D-ксилозы его концентрация достигала максимального значения. Только после этого активизировался синтез этанола, который продолжался вплоть до окончания процесса биоконверсии сахара. Удельная скорость роста дрожжей и накопление биомассы в данном режиме аэрации были незначительными: 0,05–0,14 ч-1 и 0,08–0,25 г/г соответственно (табл. 2).
Таблица 2
Ферментация D-ксилозы дрожжами Y-1532 P. tannophilus в различных режимах принудительной аэрации
|
Способ ферментации |
колбы |
ферментер |
||||||
|
Объемная скорость растворения кислорода (OTR), мМоль/л·ч |
0 |
2,0 |
5,0 |
8,0 |
13,0 |
36,0 |
140,0 |
|
|
D-ксилоза |
Скорость утилизации, г/л·ч |
≤0,01 |
0,20 |
0,46 |
0,50 |
0,64 |
0,76 |
0,91 |
|
Степень потребления, % |
≤5 |
87 |
≥99 |
|||||
|
Конечная концентра- |
ксилит |
≤0,01 |
4,60 |
3,20 |
2,40 |
1,00 |
≤0,01 |
≤0,01 |
|
ция, г/л |
этанол |
≤0,01 |
3,40 |
5,00 |
4,60 |
3,20 |
1,80 |
≤0,01 |
|
биомасса |
1,01 |
1,60 |
2,40 |
2,80 |
6,00 |
7,80 |
10,40 |
|
|
Экономический ко- |
ксилит |
≤0,01 |
0,23 |
0,16 |
0,12 |
0,05 |
≤0,01 |
≤0,01 |
|
эффициент, г/г |
этанол |
≤0,01 |
0,17 |
0,25 |
0,23 |
0,16 |
0,09 |
≤0,01 |
|
биомасса |
≤0,01 |
0,03 |
0,08 |
0,09 |
0,25 |
0,34 |
0,41 |
|
|
Объемная продук- |
ксилит |
≤0,01 |
0,04 |
0,08 |
0,06 |
0,03 |
≤0,01 |
≤0,01 |
|
тивность, г/л·ч |
этанол |
≤0,01 |
0,03 |
0,13 |
0,14 |
0,07 |
0,04 |
≤0,01 |
|
биомасса |
≤0,01 |
0,01 |
0,05 |
0,07 |
0,11 |
0,42 |
0,53 |
|
|
Удельная продуктив- -1 |
ксилит |
≤0,01 |
0,02 |
0,04 |
0,03 |
0,01 |
≤0,01 |
≤0,01 |
|
ность, ч |
этанол |
≤0,01 |
≤0,01 |
0,08 |
0,10 |
0,03 |
0,01 |
≤0,01 |
|
Удельная скорость роста, ч-1 |
≤0,01 |
0,02 |
0,05 |
0,07 |
0,14 |
0,18 |
0,23 |
|
|
Время ферментации, ч |
96 |
44 |
40 |
36 |
26 |
22 |
||
Примечание. Начальные концентрации: биомасса – 1,00 ± 0,05 г а.с.в/л, D-ксилоза – 20,0 ± 3,00 г/л. Максимальная ошибка в каждой экспериментальной точке не превышала 5,0 %.
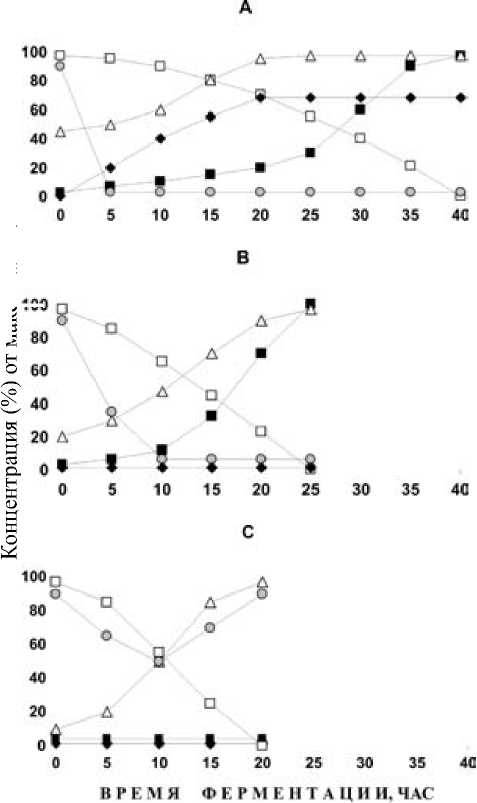
IS о и л ч св 2 дню св 2
А (5,8–13,0 мМоль/л·ч) и В (36,0 мМоль/л·ч) – микроаэроб-ные ферментации D-ксилозы; С (140,0 мМоль/л·ч) – аэробная ферментация D-ксилозы. В скобках приведены соответствующие значения OTR
Условные обозначения:
♦ – ксилит
– рО 2
----■ – этанол
– биомасса
– D-ксилоза
Более высокая скорость растворения кислорода в среде (36,0 мМоль/л · ч) несколько замедляла падение величины pO2, которая достигала нуля к 10-му часу ферментации (рисунок В). Тем не менее в этом случае дрожжи образовывали этанол с экономическим коэффициентом 0,09 г/г и продуктивностями 0,04 г/л · ч и 0,01 ч-1 на фоне полного отсутствия ксилита (табл. 2). Основным продуктом такой ферментации D-ксилозы становилась дрожжевая биомасса (динамику прироста которой характеризовала более продолжительная экспоненциальная фаза). Согласно выполненным расчетам, при аэробной ферментации (OTR 140,0 мМоль/л · ч) величина pO2 достигала 90 %, что обеспечивало практически полное насыщение среды кислородом, а также способствовало активному росту дрожжевой культуры и накоплению биомассы (см. рисунок С). В этих условиях скорость утилизации D-ксилозы была максимальной (0,91 г/л · ч), тогда как время ферментации сокращалось до 22 часов (табл. 2).
Таким образом, режим снабжения ферментационной среды кислородом в значительной степени определял динамику биоконверсии D-ксилозы у P. tannophilus и количественное соотношение промежуточных продуктов ее распада. Накопление ксилита и этилового спирта происходило лишь при условиях ограниченной аэрации, лимитирующих рост дрожжевой культуры. Причем узкий диапазон концентраций растворенного кислорода около 2,0–5,0 мМоль/л · ч способствовал активному образованию ксилита, в то время как незначительное увеличение интенсивности принудительной аэрации до величины OTR 8,0 мМоль/л · ч повышало эффективность спиртообразования.
ОБСУЖДЕНИЕ
Активное функционирование дыхательной системы ксилозоассимилирующих дрожжей параллельно с реакциями брожения сегодня подтверждено экспериментальными исследованиями [10], [11], [12]. Поэтому режим аэрации будет в значительной мере определять эффективность бродильного и окислительного звеньев катаболизма D-ксилозы, что в конечном итоге влияет на образование промежуточных продуктов ферментации дрожжевой клетки [6]. Технически поддержание низких скоростей поступления кислорода в ферментационную среду осложнено прежде всего невысокой чувствительностью кислородных электродов. Проведение микроаэробной ферментации D-ксилозы в колбах Эрленмейера и лабораторном аппарате при перекрывающихся режимах снабжения дрожжей P. tannophilus кислородом способствовало выявлению узких интервалов значений OTR, в которых наблюдались максимальные экономические коэффициенты образования ксилита (2,0–5,0 мМоль/л·ч) и этилового спирта (5,0–8,0 мМоль/л·ч). Накопление обоих спиртов возможно лишь в условиях, значительно ограничивающих рост дрожжевой культуры, что хорошо согласуется с литературными данными [9], [14].
Сравнительный анализ полученных в эксперименте максимальных выходов ксилита и этанола с теоретически рассчитанными величинами (0,91 г/г [12] и 0,51 г/г [3] соответственно) позволяет рассматривать указанный пятиатомный спирт в качестве побочного продукта микро-аэробной ферментации D-ксилозы у P. tannophi-lus . Распространено мнение, что накопление ксилита в значительной мере является следствием дисбаланса, возникающего при регенерации коферментов, участвующих в превращении D-ксилозы в D-ксилулозу [8], [11], [12], [14].
Степень этого дисбаланса определяется специфичностью ксилозоредуктазы и ксилитдегидрогеназы дрожжей [7]. Однако кислород также участвует в данном процессе, выполняя роль акцептора электронов при окислении НАДH [8]. Тогда образование не только ксилита, но и этанола можно объяснить двойной НАД+/НАДФ+ коферментной зависимостью ксилозоредуктазы P. tannophilus [7]. Напротив, преимущественная НАДН – специфичность этого фермента, характерная для Candida shehatae и Pichia stipitis [7], [10], будет обеспечивать при условиях аэрации, ограничивающих рост дрожжевой культуры, внутриклеточное образование этилового спирта. И наконец, НАДФН – зависимость ксилозоре- дуктазы Debaromyces hansenii и Kluyveromyces marxianus [7], [12] вследствие увеличения внутриклеточного пула НАДH по отношению к НАД+ приведет к замедлению или полному блокированию катаболизма D-ксилозы на этапе появления ксилита. Таким образом, фактические выходы ксилита и этанола даже при микро-аэробной биоконверсии D-ксилозы будут определяться биохимическими особенностями штаммов-продуцентов.
Работа выполнена при поддержке грантов Программы Президента РФ «Ведущие научные школы» (НШ-4310.2006.4, НШ-306.2008.4 и НШ-3731.2010.4).
Список литературы Влияние аэрации на образование продуктов биотрансформации D-ксилозы дрожжами Pachysolen tannophilus
- Глотов Н. В., Животовский Н. В., Хованов В. Г., Хромов-Борисов Н. Н. Биометрия Л.: Изд-во ЛГУ, 1982. 244 с.
- Егоров Н. С. Практикум по микробиологии. М.: Из-во МГУ, 1976. 276 с.
- Квасников Е. И., Щелокова И. Ф. Дрожжи: биология, пути использования. Киев: Наукова думка, 1991. 326 с.
- Огородникова Т. Е., Михайлова Н. П., Борохова О. Э., Яблочкова Е. Н., Андреевский В. В., Шаповалов О. И. Количественные показатели роста ксилозоусваивающих дрожжей Pachysolen tannophilus и Candida chehatae//Микробиология. 1995. Т. 64. № 1. C. 13-17.
- Перт С. Д. Основы культивирования микроорганизмов и клеток: Пер. с англ. М.: Мир, 1978. 331 с.
- Яблочкова Е. Н., Болотникова О. И., Михайлова Н. П., Немова Н. Н., Гинак А. И. Особенности ферментации D-ксилозы и D-глюкозы ксилозоассимилирующими дрожжами//Прикладная биохимия и микробиология. 2003. Т. 39. № 3. С. 303-306.
- Яблочкова Е. Н., Болотникова О. И., Михайлова Н. П., Немова Н. Н., Гинак А. И. Активность ключевых ферментов ксилозоассимилирующих дрожжей при различной скорости поступления кислорода в ферментационную среду//Микробиология. 2004. Т. 73. № 2. С. 163-168.
- Bruinenberg P. M. The NAD(P)H redox couple in yeast metabolism//Antonie van Leeuvenhoek J. Microbiol. Serol. 1986. Vol. 52. P. 411-417.
- Converti A., Prego P., Dominguez J. M., Silva S. S. Effect of temperature on the microaerophilic metabolism of Pachysolen tannophilus//Enzyme Microbiol. Technol. 2001. № 28. P. 339-345.
- Jeffries T. W., Jin Y. -S. Metabolic engineering for improved fermentation of pentoses by yeast//Appl. Microbiol. Biotechnol. 2004. Vol. 63. Р. 495-509.
- Jeppson M., Johansson B., Barbel Hahn -Hagerdal B. Reduced oxidative pentose phosphate pathway flux in recombinant xylose-utilizing Saccharomyces cerevisiae strains improves the ethanol yield from xylose//Appl. Environ. Microbiol. 2002. Vol. 68. № 4. P. 1604-1609.
- Ojamo H. Yeast xylose metabolism and xylitol production//VTT Biotech. Food Research, Finland. 1994. № 176. 91 p.
- Slininger P. J., Petroski R. J., Bothasts P. J. et all. Measurement of oxygen solubility in fermentation media: a colorimetric method//Biotech. Bioeng. 1989. Vol. 33. № 5. P. 578-583.
- Walther T., Hеnsirisak P., Agblevor F. A. The influence of aeration and hemicellulosic sugars on xylitol productivity by Candida tropicalis//Bioresour. Technol. 2000. Vol. 76. № 3. P. 213-220.


