Влияние анионов на коррозионно-электрохимическое поведение стали СТ3 в сульфатных средах. Сообщение 1. Термодинамика
Автор: Тюрин Александр Георгиевич, Бирюков Александр Игоревич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 3 т.5, 2013 года.
Бесплатный доступ
Построены сечения диаграммы потенциал pH системы «сталь Ст3 -H 2SO 4 Н 2О». Анализируются термодинамические особенности влияния сульфат-ионов на коррозионно-электрохимическое поведение стали.
Сталь ст3, сульфатные среды, диаграмма электрохимического равновесия, коррозионно-электрохимическое поведение
Короткий адрес: https://sciup.org/147160268
IDR: 147160268 | УДК: 541.13
Текст научной статьи Влияние анионов на коррозионно-электрохимическое поведение стали СТ3 в сульфатных средах. Сообщение 1. Термодинамика
Универсальной моделью для определения поверхностных фаз при коррозии сталей и сплавов являются диаграммы потенциал – pH [1]. Метод построения таких диаграмм электрохимического равновесия многокомпонентных металлических и смешанных систем предложен в работе [2].
Диаграмма электрохимического равновесия стали Ст3 в сильнокислых сульфатных растворах построена авторами в работе [3]. Общая диаграмма потенциал – pH стали включает в себя как составляющие равновесные диаграммы для всех возможных фазовых составляющих стали Ст3: феррита (α-фаза (Fe)), цементита (Fe, Mn) 3 C, включений сульфида марганца MnS и кремнезема SiO 2 .
Активности компонентов ферритной фазы стали Ст3 при 25 °С составляют [3]: а Fe(α) ≈ 0,985; а Mn(α) ≈ 0,0247; а Si(α) ≈ 4,0 · 10–26 (стандартное состояние – чистый компонент с о.ц.к. решеткой). Марганец в решетке цементита Fe 3 C может замещать практически все атомы железа. Активности компонентов смешанного карбида (Fe, Mn)3C приняты равными их мольным долям (идеальное приближение). Это допущение достаточно корректно, поскольку экспериментальные данные об активностях компонентов отсутствуют, а их изменение в пределах порядка величин практически не сказывается на значениях электродных потенциалов [2].
В настоящей работе диаграмма электрохимического равновесия стали Ст3 обобщена на всю возможную область pH существования сульфатных сред. Диаграмма потенциал – pH системы SO42– – H2O при 25 °С, 1 бар (воздух) и a 2- = 0,1 моль/л представлена на рис. 1.
SO 4
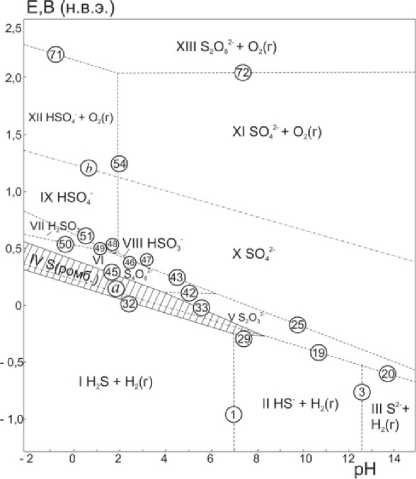
Рис. 1. Диаграмма Е–pH системы SO 4 2– – Н 2 О при 25 °С, давлении 1 бар (воздух) и a 2– = 0,1 моль/л SO 4
На ней можно выделить 13 основных областей преобладания фаз и фазовых составляющих системы. В зависимости от pH раствора и потенциала на поверхности стали Ст3 могут протекать катодные реакции восстановления сульфат- или гидросульфат-ионов до сернистой кислоты H 2 SO 3 , гидросульфит-ионов HSO 3 – , тетратионат-ионов S 4 O 6 2–, тиосульфат-ионов S 2 O 3 2–, свободной серы S (ромб) , сероводородной кислоты H 2 S, гидросульфид-ионов HS – , и сульфид-ионов S2–, и анодные реакции окисления сульфат- SO 4 2– и гидросульфат-ионов HSO 4 – до персульфат-ионов S 2 O 8 2–.
Потенциалы коррозии (саморастворения) стали Ст3 в сернокислых растворах при температурах 25 – 80°С изменяются в пределах от –0,3 до –0,23 В (н.в.э.) [3], что приходится на область термодинамической устойчивости сероводородной кислоты (области I на рис.1). Поэтому, наряду с водородным электродом (линия а), при коррозии стали в сильнокислых сульфатных растворах необходимо учитывать конкурирующую катодную реакцию
HSO 4 –+ 9H++ 8e– = H 2 S адс. + 4H 2 O; Е° 298 = 0,289 В [3].
Однако это явление, возможность «серной» пассивации стали (заштрихованная область IV на рис. 1), образование сульфидов железа и марганца на стали Ст3 и их конкурирующее влияние с оксидами целиком игнорируется в предлагаемых кинетических моделях [4–11] растворения железа и стали в сульфатных растворах.
Результаты расчетов и их обсуждение
Основные химические и электрохимические равновесия в системе «сталь Ст3 – SO42– – Н2О» при 25 °С, давлении 1 бар (воздух) и a = 0,1 моль/л, a = 10–3 моль/л (ионов железа, марганца SO 4
и кремния), рассчитанные по термодинамическим данным [2, 3, 12], представлены в таблице Диаграмма электрохимического равновесия феррита стали Ст3 в сульфатных средах приведена на рис. 2.
Е, В (н.в.э.)
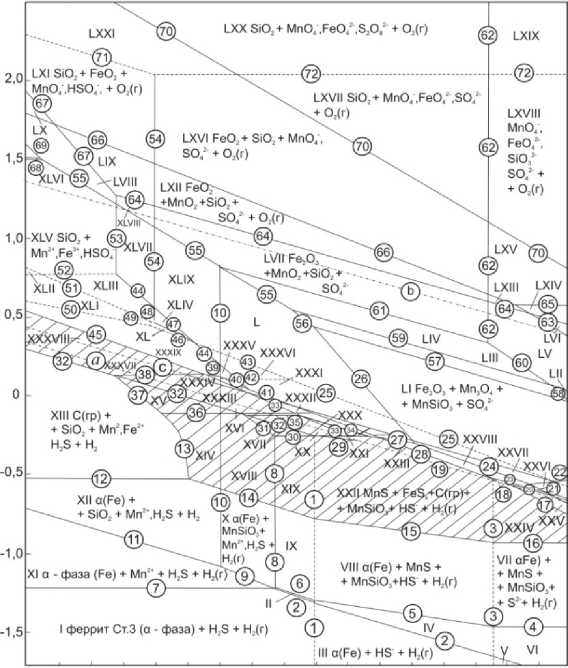
2 0 2 4 6 8 10 12 14
Рис. 2. Диаграмма Е–pH системы феррит Ст3 (α-фазы) – SO 4 2– – Н 2 О при 25 °С, давлении 1 бар (воздух) и a 2– = 0,1 моль/л и a i = 10–3 моль/л (негидратированная форма оксидов) SO 4
На ней можно выделить 71 область преобладания различных фаз и фазовых составляющих системы: I – феррит Ст3 (α-фаза (Fe)) + H 2 S + H 2 (г); II – феррит Ст3 (α-фаза (Fe)) + MnSiO 3 + H 2 S + H 2 (г); III – (α-фаза (Fe)) + HS – + H 2 (г); IV – (α-фаза (Fe)) + MnSiO 3 + HS – + H 2 (г); V – (α-фаза (Fe)) + S2– + H 2 (г); VI – (α-фаза (Fe)) + MnSiO 3 + S2– + H 2 (г); VII – (α-фаза (Fe)) + MnSiO 3 + MnS + S2– + H 2 (г); VIII – (α-фаза (Fe)) + MnSiO 3 + MnS + HS– + H 2 (г); IX – (α-фаза (Fe)) + MnSiO 3 + MnS + H 2 S + H 2 (г); X – (α-фаза (Fe)) + MnSiO 3 + Mn2+,H 2 S + H 2 (г); XI – (α-фаза (Fe)) + Mn2+,H 2 S + H 2 (г); XII – (α-фаза (Fe)) + SiO 2 + Mn2+,H 2 S + H 2 (г); XIII – C (гр.) + SiO 2 + Mn2+, Fe2+, H 2 S + H 2 (г); XIV – C (гр.) + SiO 2 + FeS x (1 ≤ x ≤ 1,105) + Mn2+, H 2 S + H 2 (г); XV – C (гр.) + SiO 2 + FeS x (1 ≤ x ≤ 1,105) + Mn2+, Fe2+, H 2 S + H 2 (г); XVI – C (гр.) + S(ромб.) + MnSiO 3 + FeS 2 + Mn2+,Fe2+; XVII – C (гр.) + MnSiO 3 + FeS x + MnS 2 + Mn2+, H 2 S + H 2 (г); XVIII – C (гр.) + MnSiO 3 + FeS x + Mn2+, H 2 S + H 2 (г); XIX – C (гр.) + MnSiO 3 + FeS x + MnS+ H 2 S + H 2 (г); XX – C (гр.) + MnSiO 3 + S(ромб) + FeS x + MnS 2 + Mn2+; XXI – C (гр.) + MnSiO 3 + S(ромб) + FeS x + MnS+ H 2 (г); XXII – C (гр.) + MnSiO 3 + FeS x + MnS+ HS– + H 2 (г); XXIII – C (гр.) + MnSiO 3 + FeS x + MnS+ S 2 O 3 2– + H 2 (г); XXIV – C (гр.) + MnSiO 3 + FeS x + MnS+ S2– + H 2 (г); XXV – C (гр.) + MnSiO 3 + Fe 3 O 4 + MnS + S2– + H 2 (г); XXVI – C (гр.) + MnSiO 3 + Fe 2 O 3 + HMnO 2 –, S 2 O 3 2–; XXVII – C (гр.) + MnSiO 3 + Fe 2 O 3 + Mn 3 O 4 + S 2 O 3 2–; XXVIII – C (гр.) + MnSiO 3 + Fe 2 O 3 + MnS + S 2 O 3 2–; XXIX – C (гр.) + MnSiO 3 + FeS x + MnS + S 2 O 3 2–; XXX – C (гр.) + FeS x + Mn2+,S 2 O 3 2–; XXXI – MnSiO 3 + Fe 2 O 3 + Mn2+, S 2 O 3 2–; XXXII – C (гр.) + MnSiO 3 + FeS 2 + Mn2+, S 2 O 3 2–; XXXIII – MnSiO 3 + Mn2+, Fe2+, S 2 O 3 2–; XXXIV – SiO 2 + FeS 2 + Mn2+, S 4 O 6 2–; XXXV – MnSiO 3 + Mn2+, Fe2+, S 4 O 6 2–; XXXVI – MnSiO 3 + Fe 2 O 3 + Mn2+,S 4 O 6 2–; XXXVII – C(гр.) + S(ромб) + SiO 2 + Mn2+, Fe2+; XXXVIII – S(ромб) + SiO 2 + Mn2+, Fe2+; XXXIX – SiO 2 + Fe2+, Mn2+, S 4 O 6 2–; XL – SiO 2 + Fe2+, Mn2+, HSO 3 –; XLI – SiO 2 + Fe2+, Mn2+, H 2 SO 3 ; XLII – SiO 2 + Fe3+, Mn2+, H 2 SO 3 ; XLIII – SiO 2 + Fe2+, Mn2+, HSO 4 –; XLIV – SiO 2 + Fe2+, Mn2+, SO 4 2–; XLV – SiO 2 + Mn2+, Fe3+, HSO 4 –; XLVI – SiO 2 + Mn3+, Fe3+, HSO 4 –; XLVII – SiO 2 + Fe 2 O 3 + Mn2+, HSO 4 –; XLVIII – SiO 2 + Fe 2 O 3 + MnO 2 + HSO 4 –; XLIX – SiO 2 + Fe 2 O 3 + Mn2+, SO 4 2–; L – MnSiO 3 + Fe 2 O 3 + Mn2+, SO 4 2–; LI – MnSiO 3 + Fe 2 O 3 + Mn 3 O 4 + SO 4 2–; LII – Fe 2 O 3 + Mn 2 O 3 + SiO 3 2–, SO 4 2–; LIII – MnSiO 3 + Fe 2 O 3 + Mn 2 O 3 + SO 4 2–; LIV – MnSiO 3 + Fe 2 O 3 + MnO 2 + SO 4 2–; LV – Fe 2 O 3 + MnO 2 + SiO 3 2–, SO 4 2–; LVI – Fe 2 O 3 + MnO 4 2–, SiO 3 2–, SO 4 2–; LVII – SiO 2 + Fe 2 O 3 + MnO 2 + SO 4 2–; LVIII – SiO 2 + MnO 2 + Fe3+, HSO 4 – + O 2 (г); LIX – SiO 2 + MnO 2 + FeO 2 + HSO 4 – + O 2 (г); LX – SiO 2 + Fe3+, MnO 4 –, HSO 4 – + O 2 (г); LXI – SiO 2 + FeO 2 + MnO 4 –, HSO 4 –; LXII – SiO 2 + FeO 2 + MnO 2 + SO 4 2– + O 2 (г); LXIII – FeO 2 + MnO 2 + SiO 3 2–, SO 4 2– + O 2 (г); LXIV – FeO 2 + MnO 4 2–, SiO 3 2–, SO 4 2– + O 2 (г); LXV – FeO 2 + MnO 4 –, SiO 3 2–, SO 4 2– + O 2 (г); LXVI – SiO 2 + FeO 2 + MnO 4 –, SO 4 2– ; LXVII – SiO 2 + MnO 4 –, FeO 4 2–, SO 4 2– + O 2 (г); LXVIII – MnO 4 –, FeO 4 2–, SiO 3 2–, SO 4 2– + O 2 (г); LXIX – MnO 4 –, FeO 4 2–, SiO 3 2–, S 2 O 8 2– + O 2 (г); LXX – SiO 2 + MnO 4 –, FeO 4 2–, S 2 O 8 2– + O 2 (г); LXXI– SiO 2 + FeO 2 + MnO 4 –, S 2 O 8 2– + O 2 (г).
Основные химические и электрохимические равновесия в системе «сталь Ст3 – H 2 SO 4 – Н 2 О» при 25 °С, давлении 1 бар (воздух) и a 2– = 0,1 моль/л, a i = 10–3 моль/л
SO 4
|
Обозначение линии |
Электродная реакция |
Равновесный потенциал, В, или pH раствора |
|
a |
2H+ + 2 e –= H 2 (г); P H ≈ 5·10–7бар |
0,186 – 0,0591 pH |
|
b |
O 2 (г) + 4H++ 4 e –= 2H 2 O; P O ≈ 0,21бар |
1,219 – 0,0591 pH |
|
c |
C(гр.) + 4Н++ 4 е –= СН 4 (г)ж; P СH ≈ 5·10–7 бар |
0,318 – 0,0591 pH |
|
Феррит (α-фаза(Fe)) |
||
|
1 |
H 2 S = HS– + H+ |
pH 6,99 |
|
3 |
HS– = S2– + H+ |
pH 12,60 |
|
8 |
MnS + 2H+ = Mn2+ + 2H 2 S |
pH 5,73 |
|
13 |
FeS x + 2xH+ = Fe2+ + x H 2 S: 1≤ x ≤1,105 |
pH 8,945/x – 5,9 |
|
17 |
400Fe 3 O 4 + 663 S2–+ 3200H++ 1874 e – = 1200FeS 1,105 + 1600H 2 O |
0,772 – 0,1009pH |
|
18 |
400Fe 3 O 4 + 663 S 2 О 3 2–+ 7178H++ 5852 e – = 1200FeS 1,105 + 3589H 2 O |
0,396 – 0,0725pH |
|
19 |
S 2 О 3 2–+ 8H+ + 8 e –= 2HS– + 3H 2 O |
0,223 – 0,0591pH |
|
20 |
S 2 О 3 2–+ 6H+ + 8 e –= 2S2– + 3H 2 O |
0,022 – 0,0443pH |
Продолжение таблицы
|
Обозначение линии |
Электродная реакция |
Равновесный потенциал, В, или pH раствора |
|
21 |
2 HMnO 2 – + S 2 О 3 2– + 12H+ + 8 e –= 2MnS + 7H 2 O |
0,6445 – 0,08865pH |
|
22 |
Mn 3 O 4 + 2H 2 O + 2 e –= 3HMnO 2 – + H+ |
-0,975 – 0,0295pH |
|
23 |
3Fe 2 O 3 + 2H++ 2 e – = 2Fe 3 O 4 + H 2 O |
0,231 – 0,0591pH |
|
24 |
2Mn 3 O 4 + 3S 2 О 3 2– + 34H+ + 28 e –= 6MnS + 17H 2 O |
0,414 – 0,0718pH |
|
25 |
2SО 4 2– + 10H++ 8 e – = S 2 О 3 2– + 5H 2 O |
0,544 – 0,0739pH |
|
26 |
Mn 3 O 4 + 8H+ + 2 e –= 3Mn2+ + 4H 2 O |
2,079 – 0,2364pH |
|
27 |
2Mn2+ + S 2 О 3 2– + 6H++ 8 e –= MnS + 3H 2 O |
0,135 – 0,0443pH |
|
28 |
200Fe 2 O 3 + 221S 2 О 3 2–+ 2526H+ + 2084 e – = 400FeS 1,105 + 1263H 2 O |
0,384 – 0,0716pH |
|
29 |
S(ромб) + H++ 2 e –= HS – |
–0,0355 – 0,0295pH |
|
30 |
MnS 2 + Mn2++ 2 e –= 2 MnS |
-0,249 |
|
31 |
MnS 2 + 4H++ 2e– = Mn2+ + 2H 2 S |
0,428 – 0,1182pH |
|
32 |
S(ромб) + 2H++ 2e–= H 2 S |
0,172 – 0,0591pH |
|
33 |
S 2 О 3 2–+ 6H++ 4 e – = 2S(ромб) + 3H 2 O |
0,453 – 0,08865pH |
|
34 |
Mn2+ + S 2 О 3 2–+ 6H++ 6 e –= MnS 2 + 3H 2 O |
0,772 – 0,1009pH |
|
35 |
Mn2+ + 2S(ромб) + 2 e – = MnS 2 |
– 0,119 |
|
36 |
221FeS 2 + 179Fe2+ + 358 e –= 400FeS 1,105 |
– 0,1135 |
|
37 |
FeS 2 + 4H++ 2 e –= Fe2+ + 2H 2 S |
0,207 – 0,1182pH |
|
38 |
Fe2+ + 2S(ромб) + 2 e –= FeS 2 |
0,136 |
|
39 |
2Fe2+ + S 4 О 6 2–+ 12H++ 14 e –= 2FeS 2 + 6H 2 O |
0,385 – 0,0665pH |
|
40 |
Fe2+ + S 2 О 3 2–+ 6H+ + 4 e –= FeS 2 + 3H 2 O |
0,477 – 0,08865pH |
|
41 |
Fe 2 O 3 + 2S 2 О 3 2– + 18H++ 14 e –= 2FeS 2 + 9H 2 O |
0,415 – 0,076pH |
|
42 |
S 4 О 6 2–+ 2 e –= 2S 2 О 3 2– |
0,1095 |
|
43 |
4SО 4 2– + 20H++ 14 e – = S 4 О 6 2– + 10H 2 O |
0,606 – 0,0844pH |
|
44 |
Fe 2 O 3 +6H++ 2 e –= 2Fe2+ + 3H 2 O |
0,909 – 0,1773pH |
|
45 |
S 4 О 6 2–+ 12H++ 10e– = 4S(ромб) + 6H 2 O |
0,385 – 0,0709pH |
|
46 |
4HSО 3 –+ 8H+ + 6 e –= S 4 О 6 2– + 6H 2 O |
0,596 – 0,0788pH |
|
47 |
SО 4 2– + 3H++ 2 e –= HSО 3 – + H 2 O |
0,632 – 0,08865pH |
|
48 |
HSО 4 –+ 2H+ + 2 e –= HSО 3 – + H 2 O |
0,575 – 0,0591pH |
|
49 |
H 2 SО 3 = HSО 3 – + H+ |
pH 1,85 |
|
50 |
4H 2 SО 3 + 4H+ + 6e–= S 4 О 6 2– + 6H 2 O |
0,5235 – 0,0394pH |
|
51 |
HSО 4 –+ 3H+ + 2 e –= H 2 SО 3 + H 2 O |
0,630 – 0,08865pH |
|
52 |
Fe2++ e – = Fe3+ |
0,771 |
|
53 |
Fe 2 O 3 +6H+= 2Fe3+ + 3H 2 O |
pH 0,779 |
|
54 |
HSО 4 – = SО 4 2–+ H+ |
pH 1,94 |
|
55 |
MnO 2 + 4H+ + 2 e –= Mn2+ + 2H 2 O |
1,3145 – 0,1182pH |
|
56 |
Mn 2 O 3 + 6H+ + 2 e –= 2Mn2+ + 3H 2 O |
1,667 – 0,1773pH |
|
57 |
3Mn 2 O 3 + 2H+ + 2 e –= 3Mn 3 O 4 + H 2 O |
0,846 – 0,0591pH |
|
59 |
2MnO 2 + 2H+ + 2 e –= Mn 2 O 3 + H 2 O |
0,926 – 0,0591pH |
|
62 |
SiO 3 2– + 2H+ = SiO 2 + H 2 O |
pH 12,44 |
|
63 |
MnO 4 2– + 4H+ + 2 e –= MnO 2 + 2H 2 O |
2,1605 – 0,1182pH |
|
64 |
2FeO 2 + 2H++ 2e– = Fe 2 O 3 + H 2 O |
1,315 – 0,0591pH |
|
65 |
MnO 4 – + e – = MnO 4 2– |
0,588 |
|
66 |
MnO 4 – + 4H+ + 3 e –= MnO 2 + 2H 2 O |
1,636 – 0,0788pH |
|
67 |
FeO 2 + 4H++ e – = Fe3+ + 2H 2 O |
1,453 – 0,2364pH |
|
68 |
Mn3++ e –= Mn2+ |
1,510 |
|
69 |
MnO 2 + 4H+ + e –= Mn3+ + 2H 2 O |
1,117 – 0,2364pH |
Окончание таблицы
|
Обозначение линии |
Электродная реакция |
Равновесный потенциал, В, или pH раствора |
|
70 |
FeO 4 2– + 4H++ 2 e –= FeO 2 + 2H 2 O |
2,584 – 0,1182pH |
|
71 |
S 2 О 8 2–+ 2H+ + 2 e –= 2HSО 4 – |
2,1525 – 0,0591pH |
|
72 |
S 2 О 8 2–+ 2 e –= 2SО 4 2 – |
2,0395 |
|
Феррит стали Ст3 |
||
|
2 |
MnSiO 3 + 6H+ + 6 e – = Si(α) + Mn(α) + 3H 2 O; а Mn(α) ≈ 0,025; а Si(α) ≈ 4,0 · 10–26 |
– 0,888 – 0,0591pH |
|
4 |
MnS+ 2 e – = Mn(α) + S2–; а Mn(α) ≈ 0,025 |
– 1,461 |
|
5 |
MnS+ H+ + 2 e –= Mn(α) + HS– ; а Mn(α) ≈ 0,025 |
– 1,0897 – 0,0285pH |
|
6 |
MnS+ 2H+ + 2 e –= Mn(α) + H 2 S; а Mn(α) ≈ 0,025 |
– 0,883 – 0,0591pH |
|
7 |
Mn2+ + 2 e –= Mn(α); а Mn(α) ≈ 0,025 |
– 1,222 |
|
10 |
MnSiO 3 + 2H+ = Mn2+ + SiO 2 + H 2 O |
pH 4,05 |
|
11 |
SiO 2 + 4H+ + 4 e –= Si(α) + 2H 2 O; а Si(α) ≈ 4,0 · 10–25 |
– 0,841 – 0,0591pH |
|
12 |
Fe2++ 2 e – = Fe(α); а Fe(α) ≈ 0,985 |
– 0,529 |
|
14 |
FeS + 2H+ + 2 e – = H 2 S + Fe(α); а Fe(α) ≈ 0,985 |
– 0,351 – 0,0591pH |
|
15 |
FeS + H+ + 2 e – = HS– + Fe(α); а Fe(α) ≈ 0,985 |
– 0,557 – 0,0295pH |
|
16 |
FeS + 2 e – = S2– + Fe(α); а Fe(α) ≈ 0,985 |
– 0,930 |
|
58 |
Mn 2 O 3 + 2SiO 3 2– + 6H+ + 2 e – = 2MnSiO 3 + 3H 2 O |
2,658 – 0,1773pH |
|
60 |
MnO 2 + SiO 3 2– + 4H+ + 2 e –= MnSiO 3 + 2H 2 O |
1,8105 – 0,1182pH |
|
61 |
SiO 2 +MnO 2 + 2H+ + 2 e –= MnSiO 3 + H 2 O |
1,075 – 0,0591pH |
|
Цементит стали Ст3 |
||
|
12’ |
Fe2+ + 2 e – = Fe(α); а Fe(α) ≈ 1 |
– 0,529 |
|
14’ |
FeS + 2H+ + 2 e – = H 2 S + Fe(α); а Fe(α) ≈ 1 |
– 0,351 – 0,0591pH |
|
15’ |
FeS + H+ + 2 e – = HS– + Fe(α); а Fe(α) ≈ 1 |
– 0,557 – 0,0295pH |
|
16’ |
FeS + 2 e – = S2– + Fe(α); а Fe(α) ≈ 1 |
– 0,930 |
|
73 |
3MnS + С(гр)+ 6 e –= Mn 3 C + 3S2– |
– 1,518 |
|
74 |
MnS+ 2 e – = Mn(α) + S2–; а Mn(α) ≈ 1 |
– 1,508 |
|
75 |
3MnS + C(гр) + 3H+ + 6e– = Mn 3 C + 3HS– |
– 1,146 – 0,0295pH |
|
76 |
MnS + H++ 2 e –= Mn(α) + HS–; а Mn(α) ≈ 1 |
– 1,136 – 0,0295pH |
|
77 |
3MnS + C(гр.) + 6H+ + 6 e – = Mn 3 C + 3H 2 S |
– 0,939 – 0,0591pH |
|
78 |
MnS + 2H++ 2 e – = Mn(α) + H 2 S ; а Mn(α) ≈ 1 |
– 0,929 – 0,0591pH |
|
79 |
3Mn2+ + C(гр) + 6 e – = Mn 3 C |
– 1,278 |
|
80 |
Mn2+ + 2 e – = Mn() |
– 1,268 |
|
81 |
3FeS + С(гр) + 6 e – = Fe 3 C + 3S2– |
– 0,9625 |
|
82 |
3FeS + С(гр) + 3H++ 6 e – = Fe 3 C + 3HS– |
– 0,5895 – 0,0295pH |
|
83 |
3FeS + С(гр) + 6H++ 6 e – = Fe 3 C + 3H 2 S |
– 0,3835 – 0,0591pH |
|
84 |
3Fe2+ + С(гр) + 6 e – = Fe 3 C |
– 0,5615 |
|
Включения сульфида марганца (MnS) |
||
|
74 |
MnS + 2 e – = S2– +Mn(α(Mn)), а Mn(α) = 1 |
– 1,508 |
|
76 |
MnS + H++ 2 e – = HS– +Mn(α(Mn)); а Mn(α) = 1 |
– 1,136 – 0,0295pH |
|
78 |
MnS + 2H+ + 2 e – = H 2 S +Mn(α(Mn)); а Mn(α) = 1 |
– 0,929 – 0,0591pH |
|
80 |
Mn2+ + 2 e – = Mn(α(Mn)); а Mn(α) = 1 |
– 1,268 |
|
Включения кремнезема |
||
|
85 |
SiO 2 + 4H++ 4 e – = Si(A) + 2H 2 O; а Si(α) = 1 |
– 0,857 – 0,0591 pH |
|
86 |
SiO 3 2– + 6H++ 4 e –= Si(A) + 3H 2 O; а Si(α) = 1 |
– 0,499 – 0,0591 pH |
Содержание кремния (0,2 мас. %) и марганца (0,5 мас. %) в стали Ст3 недостаточно, чтобы совместно (MnSiO 3 ) или раздельно (SiO 2 , Mn 3 O 4 , Mn 2 O 3 , MnO 2 ) образовывать сплошную оксидную пассивационную пленку. То же самое касается сульфидов марганца (MnS и MnS2) и возможности образования ими сплошной сульфидной пассивационной пленки.
В присутствии MnS оксид марганца (II) на диаграмме неустойчив. Аналогично практически исчезает магнетит (Fe3O4), его область устойчивости XXV ограничена линиями 17, 18 и 23. Таким образом, в сульфидсодержащих средах металлическая матрица стали Ст3 может подвергаться «серной» (S (ромб) , области XXXVII и XXXVIII), серно-сульфидной (S (ромб) , FeS 2 и FeS x , 1 ≤ x ≤ 1,105) или сульфидной (FeS 2 , FeS x ) пассивации, а также оксидной пассивации с образованием (Fe2O3 и/или Fe3O4). Первая область пассивности достигается системой самопроизвольно при потенциалах коррозии, а вторая (оксидная) – только при анодной поляризации. На рис. 2 штрихом отмечены области «серной», серно-сульфидной и сульфидной пассивности, обеспечиваемые наличием избыточных сульфат-ионов в водном растворе.
Диаграмма электрохимического равновесия цементита (Fe, Mn) 3 C с сульфатсодержащей средой при 25 °С и a = 0,1 моль/л приведена на рис. 3. На ней аналогично рис. 2 можно выде- SO 4
лить 65 областей преобладания. Также штрихом отмечены области «серной», серно-сульфидной и сульфидной пассивности для смешанного карбида.
Е,В (н.в.э.)
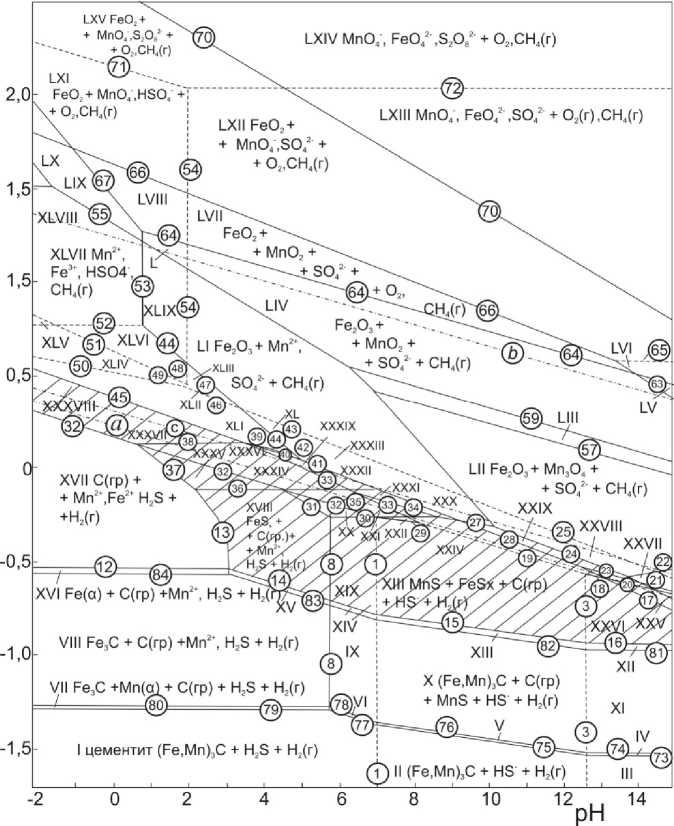
Рис. 3. Диаграмма Е–pH системы цементит (Fe, Mn) 3 C – SO 4 2– – Н 2 О при 25 °С, давлении 1 бар (воздух) и a 2– = 0,1 моль/л и a i = 10–3 моль/л (негидратированная форма оксидов)
SO 4
Как видно из рис. 4, включения сульфидов марганца устойчивы в стали лишь в нейтральных и щелочных средах, в кислых они подвергаются активному растворению.
Самой стабильной фазовой составляющей стали Ст3 являются включения кремнезема. На диаграмме Е – pH они термодинамически устойчивы выше линии 85 и левее линии 62 (см. таблицу). Правее линии 62 и выше линии 86 кремнезем термодинамически неустойчив и растворяется с образованием метасиликат-иона (SiO 3 2–).
,В (н.в.э.)
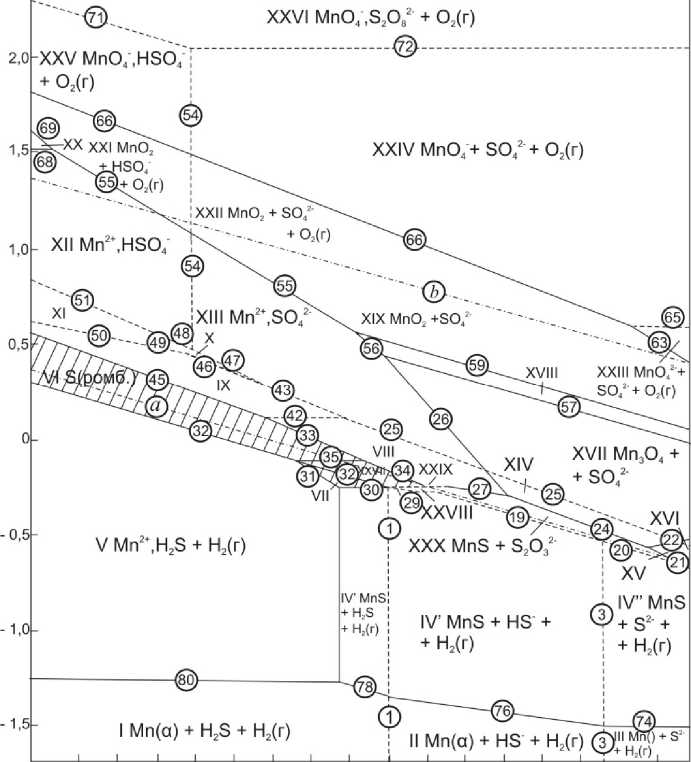
Рис. 4. Диаграмма Е–pH системы включения MnS – SO 4 2– – Н 2 О при 25°С, давлении 1 бар (воздух) и a SO 2– = 0,1 моль/л и a Mn 2+ = 10–3 моль/л (негидратированная форма оксидов)
Заключение
-
1. Построена диаграмма Е-pH системы «сталь Ст3 – SO 4 2– – H 2 O» при 25 °С.
-
2. Доказано, что самопроизвольно в сульфатсодержащих средах сталь Ст3 может подвергаться «серной», серно-сульфидной или сульфидной пассивности, а в условиях анодной поляризации – оксидной.
Список литературы Влияние анионов на коррозионно-электрохимическое поведение стали СТ3 в сульфатных средах. Сообщение 1. Термодинамика
- Куров, О.В. К определению поверхностных химических соединений при коррозии сплавов/О.В. Куров//Защита металлов. 1998. Т. 34, № 3. С. 237-244.
- Тюрин, А.Г. Термодинамика химической и электрохимической устойчивости твердых сплавов железа, хрома и никеля: монография/А.Г. Тюрин. Челябинск: Изд-во Челяб. гос. ун-та, 2011. 241 с.
- Тюрин, А.Г. Диаграмма электрохимического равновесия стали Ст3 в сильнокислых сульфатных растворах/А.Г. Тюрин, А.И. Бирюков//Вестник Казанского национального исследовательского технологического университета. 2012. Вып. № 18. С. 40-45.
- Колотыркин, Я.М. Об участии анионов в элементарных стадиях электрохимической реакции растворения железа в кислых растворах/Я.М. Колотыркин, Г.М. Флорианович, Л.А. Соколова//Электрохимия. 1967. Т. 3, № 11. С. 1359-1363.
- Савиткин, И.И. Восстановление водорода на вращающемся дисковом электроде на железе армко в слабокислых сульфатных растворах/И.И. Савиткин, Н.И. Подобаев//Электрохимия. 1975. Т. 10, № 4. С. 582-583.
- Томашов, Н.Д. Теория коррозии и коррозионно-стойкие конструкционные сплавы/Н.Д. Томашов, Г.П. Чернова. М.: Металлургия, 1986. 200 с.
- Сухотин, А.М. Физическая химия пассивирующих пленок на железе/А.М. Сухотин. -Л. Химия. 1989. 320 с.
- Киш, Л. Кинетика электрохимического растворения металлов/Л. Киш. М.: Мир, 1990. 272 с.
- Киш, Л. Моделирование влияния среды на анодное растворение металлов/Л. Киш//Электрохимия. 2000. Т. 36, № 10. С. 1191-1196.
- Подобаев, Н.И. Уточненная схема механизма анодного растворения железа в кислых сульфатных растворах/Н.И. Подобаев, О.В. Кривохвостова//Защита металлов. 2003. Т. 39. -№ 2.С. 213-216.
- Плетнев, М.А. Кооперативные эффекты в задаче о кислотной коррозии металлов/М.А. Плетнев, С.М. Решетников//Защита металлов. Т. 40, № 5. С. 513-521.
- Николайчук, П.А. Термодинамика химической и электрохимической устойчивости медно-никелевых сплавов/П.А. Николайчук, А.Г. Тюрин//Физикохимия поверхности и защита материалов. 2012. Т. 48, № 4. С. 398-412.


