Влияние аномальных климатических явлений 2010 г. на фауну тетрапод Волжско-Камского заповедника
Автор: Павлов Алексей Владиленович, Аюпов Анвар Сабирзянович, Гаранин Валериан Иванович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общие проблемы экологии
Статья в выпуске: 5-1 т.16, 2014 года.
Бесплатный доступ
В статье обсуждается влияние засухи 2010 г. на состояние фауны мелких видов млекопитающих, зимнего населения птиц, амфибий и рептилий и представлены данные по их динамике Волжско-Камского заповедника за период 2008-2013 гг.
Фауна тетрапод, засуха 2010 г, волжско-камский заповедник
Короткий адрес: https://sciup.org/148205696
IDR: 148205696 | УДК: 574.4
Текст научной статьи Влияние аномальных климатических явлений 2010 г. на фауну тетрапод Волжско-Камского заповедника
П рошедшее пятилетие на территории центральной части Европейской России и Поволжья было ознаменовало проявлением климатических событий аномального характера. Основным явлением этого ряда следует считать засуху 2010 года. Периоды с подобным отклонением от средне многолетних метеопараметров в указанном регионе происходили и ранее. Наиболее засушливые сезоны в Поволжье наблюдались в 1921 и 1972 гг. Основная масса данных об их влиянии на естественную биоту относится к растительной составляющей и, в первую очередь, затрагивает лесохозяйственную сферу интересов [5]. Информация о последствиях для различных компонентов животного мира единична и отрывочна. С 2010 г. опубликовано лишь несколько работ, затрагивающих обозначенную тему [1, 3, 7]. Общая тенденции потепления климата, устойчиво проявляющая себя и в Поволжском регионе начиная с 1955 г. по настоящее время [8], несомненно, будет определять состояние многих видов фауны и опосредованно через них окажет воздействие на качественный и количественный состав зооценозов. Без учета вклада антропогенного фактора наиболее точно оценка такого влияния связана с изучением охраняемых эталонных сообществ. Авторы настоящей статьи на примере Волжско-Камского государственного природного биосферного заповедника (далее – ВКГПБЗ) предприняли попытку обобщить данные по влиянию экстремальной засухи 2010 г. на отдельные группы позвоночных.
МАТЕРИАЛ И МЕТОДЫ
Исследования проведены в ВКГПБЗ в рамках ежегодного цикла наблюдений за природными процессами и явлениями «Летопись природы».
Для оценки влияния метеоусловий сезона на фауну использованы результаты учетов мелких млекопитающих, зимующих видов птиц с территории Раифского участка, рептилий и амфибий со всей территории заповедника. В анализ включены данные учетов мелких млекопитающих, сведения по плотности отдельных видов зимнего населения птиц и данные по встречам видов герпетофауны (табл. 1) за период 2008-2013 гг. Особенности учета указанных групп поясняются в соответствующих разделах. Оценка климатических условий проведена по данным метеостанции заповедника (Раифский участок) в весенний и летний сезоны года.
|
Таблица 1. Методы и периоды учета животных |
||
|
Группа |
Период |
Метод учета |
|
Мелкие млекопитающие |
октябрь |
давилки Геро, траншеи (8 цилиндров) |
|
Птицы |
ноябрь – февраль |
маршрутный учет [11] |
|
Амфибии и рептилии |
май – август |
учет вдоль береговой линии, маршрутный учет (ширина 2-4 м) |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Динамика усредненных климатических показателей, отражающих засушливость сезонов, свидетельствует об аномально высоких и низких значениях соответственно температурного режима и количества осадков на протяжении весны и лета 2010 г. (рис. 1, 2). 2012 г. также характеризуется повышенным температурным фоном как весны, так и лета с отклонениями от среднесуточных значений + 1,0˚С, но при этом сумма осадков выше среднемноголетней нормы: весна и лето соответственно, +11, 4 и 19,9 [4]. В остальные годы рассматриваемые показатели отклоняются от среднемноголетних значений незначительно.
Мелкие млекопитающие. Исследования проведены в лесных биотопах: сосняках (мшистый с елью, сложный, ландышевый с березой) и липняке снытевым с дубом. Учет с помощью ловушек Геро показывает изменение видового состава и удельной доли в уловах животных (рис. 3). С 2008
по 2011 гг. отмечены только 3 вида: лесная (Apodemus sylvaticus) и желтогорлая (A. flavicolis) мыши и рыжая полевка (Clethrionomis glareolus). Максимальные показатели характерны для рыжей полевки, численность которой в два раза снижается в 2011 г., оставаясь до 2013 г. в пределах 1215 особей на 100 ловушко/суток (далее – ос. на 100 л/с). По данным учета траншеями попадае-мость вида в цилиндры напротив возрастает, достигая максимума (50 особей на 100 цилинд-ро/суток (далее – ос. на 100 ц/с)) в 2011 г., и, в 2012 г. резко (более чем в 3 раза) падает, слегка возрастая в последующий год. Численность лесной мыши оставаясь относительно стабильной в 2008-2010 гг., в год следующий после засухи резко возрастает (до 45 ос. на 100 л/с), снижаясь в 9 раз в 2012 г. Сходные тенденции выявлены при учете вторым методом, но при этом в год засухи щий сезон появляется с высокими показателями, – 34 ос. на 100 ц/с, - впоследствии снижая численность до уровня 2008-2009 гг. Уловистость желтогорлой мыши ловушками Геро относительно постоянна за все время наблюдений (3-8 ос. на 100 л/с), в траншеях не отмечена в 2008 и 2010 гг. При этом наибольшие показатели уловистости (17 ос. на 100 ц/с) отмечаются в 2011 г. Обыкновенная полевка (Microtus arvalis), отсутствующая в уловах 2008-2011 гг., с минимальной долей (рис. 3, 1-2 ос. на 100 л/с), появляется осенью 20122013 гг., а в траншеях ее доля равноценна составу остальных видов (18,8 ос. на 100 ц/с). Значительные колебания численности и изменения состава сообщества не отразились на лидирующем положении видов-доминантов (C. glareolus, A. sylvati-cus).
лесная мышь отсутствует в уловах, а на следую-
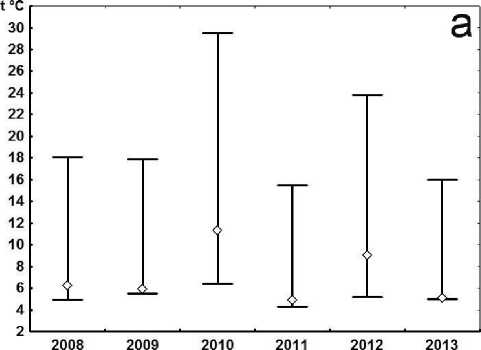
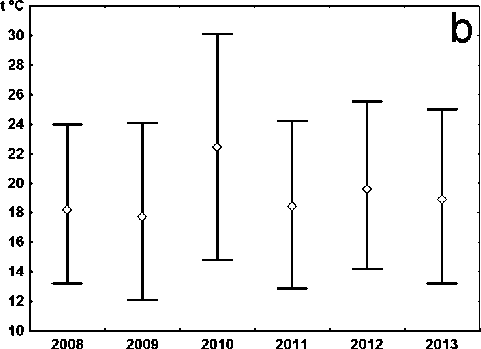
Рис. 1 . Динамика температур за исследуемый период. Представлены максимальные, минимальные и средние значения. a. Весна. b. Лето
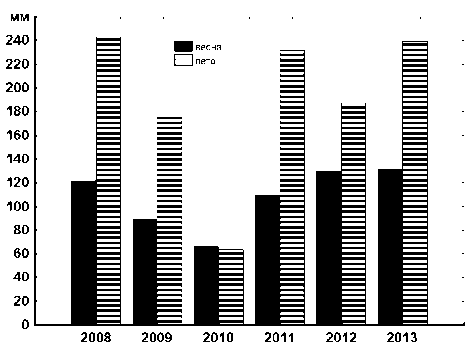
Рис. 2. Изменение суммы осадков за исследуемый период
По результатам лова траншеями в год засухи и предшествующий в составе фауны мышевидных грызунов присутствует мышовка лесная (Sicista betulina), а из насекомоядных достаточную долю составляла обыкновенная бурозубка (Sorex ara- neus). Последний вид в осенних учетах достигает максимума в 2010 г. (66,4 ос. на 100 ц/с), в дальнейшем исчезая и появляется в 2013 г. (рис. 4). Различия результатов 2-х методов, по-видимому, определяются их особенностями: если ловушки Геро главным образом отражают пищедобыва-тельное поведение зверьков, то отлов траншеями, связанный со случайностью, демонстрирует, помимо показателей плотности/численности, миграционную активность грызунов. В целом показатели колеблются в пределах, свойственных изученным видам на территории Волжско-Камского края [10], вписываясь в пределы микродинамиче-ских циклов [6].
Полученная картина динамики уловистости объясняется высокой степенью временной ксеро-фитизации природных комплексов заповедника, позволившая мезо-ксерофильным видам ( A. sylva-ticus, M. arvalis ) увеличить свое присутствие в биотопах, в норме имеющих хорошее увлажнение. Сходные выводы были получены при длительном (25 лет) изучении сообществ грызунов заповедника «Столбы» [2].
В настоящем исследовании не рассмотрена роль других климатических факторов, влияние которых на изменение численности мелких млекопитающих несомненна [2, 12]. В условиях ВКГПБЗ группа последних обусловлена зимними условиями: высотой и обилием снежного покрова, суммой отрицательных температур. Так пред- шествующая засухе зима 2009/2010 гг. характеризуется аномально необычным бесснежным пе риодом с низкими температурами, во время которого промерзаемость почвы местами достигала 2 м, что не могло сказаться на видах фауны, связанных с почвой и ее покровом.
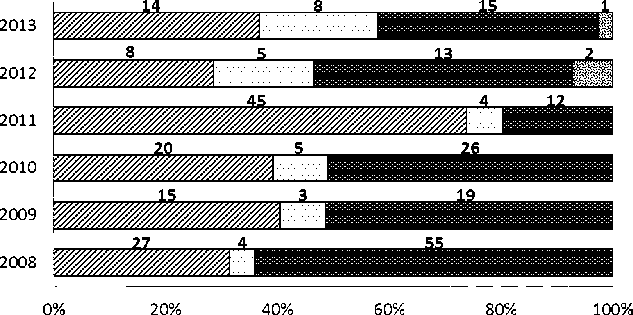
BA.sylvaticus DA.flavicolis HC.glareolus SM.arvalis
Рис. 3. Видовой состав и удельная доля мышевидных грызунов осенью (октябрь), выявленных с использованием ловушек Геро. Цифрами обозначено количество особей на 100 ловушко/суток
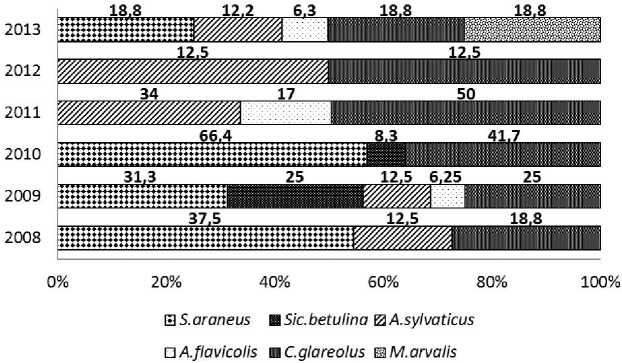
Рис. 4 . Видовой состав и удельная доля мелких млекопитающих осенью (октябрь), выявленных с использованием ловчих траншей. Цифрами обозначено количество особей на 100 цилиндро/суток
Птицы. Относительная плотность птиц по усредненным значениям в последующие после засухи два года падает в 2-3 раза, увеличиваясь к зиме 2013/2014 гг. (табл. 2). Данная тенденция отчетливо прослеживается в семействе синиц и близких к ним видам (Aegithalos caudatus, Certhia familiari, Sitta europea, Regulus regulus), и также хорошо проявляется на примере длиннохвостой неясыти (Strix uralensis). Следует отметить, что при проведении зимних маршрутных учетов до 2010 г. на снегу фиксировались от 6 до 10 следов нападения этого вида на мышевидных грызунов. В 2011 и 2012 гг. следы деятельности сов не отмечали и только в декабре 2013 г. зафиксировано 4 следа. Кроме того, в течение 2013 г. зафиксировано 3 встречи длиннохвостой неясыти, по одной встречи болотной совы (Asio flammeus) и сыча домового (Athene noctua) [4]. Плотность врановых за 5 сезонов учетов варьирует в незначительных пределах. В отряде дятлообразных у черного (Dryocopus martius) и пестрого (Dendrocopus major) дятлов заметно снижение плотности начиная с зимы 2010/2011 гг. с последующим восстановлением в 2013 г. Данные по плотности зимующих зерноядных видов варьируют от нулевых значений (Acanthis flammea, Bombycilla garrulus) до достаточно высоких (27,8 ос./км2), что связано с урожайностью семян и ягод древесных и кустарниковых растений. Другие представители орнитофауны фиксировались на маршруте по единичным встречам (Accipiter gentilis, Carduelis cardu-elis и др.).
Амфибии и рептилии. В табл. 3 представлены данные по изменению относительной плотно- сти 7 видов амфибий и 6 видов рептилий на территории обоих участков заповедника. Из анализа в связи с недостатком данных исключены гребенчатый тритон (Triturus cristatus), зеленая жаба (Bufo viridis) и травяная лягушка (Rana temporaria). При учетах зеленых лягушек для выделения озерной (Pelophilax ridibunda) учитывались морфологические, поведенческие признаки и ее биотопические предпочтения; остальные зеленые лягушки определялись как Pelophilax sp.
На протяжении 6 лет из амфибий в наименьшей степени меняются показатели у жерлянки краснобрюхой (Bombina bombina) и зеленых лягушек, годовой цикл которых целиком связан с водной средой. Тенденция отчетливо проявляется в Саралинском участке, где популяции видов в подавляющей основе связаны с водоемами Куйбышевского водохранилища, условия которого в течение 2010 г. сильно не изменились. В Раиф-ской части иссушение всех временных водоемов и водотоков отразилось на Pelophilax sp. – их плотность в последующие после засухи годы сни- зилась более чем в 2 раза. С 2010 г. практически исчезает обыкновенный тритон (Lissotriton vulgaris), характеризующийся сравнительно низкими показателями встречаемости в годы и с нормальными климатическими условиями. Наиболее острую депрессию претерпели популяции остромордой лягушки (Rana arvalis), встречи которой на протяжении 2010-2011 гг. практически отсутствуют. В 2013 г. наблюдается рост показателей численности вида и отмечены единичные явления массового выхода сеголетков, завершивших метаморфоз. Серая жаба (B. bufo) исчезает из свойственных ей биотопов по всей территории заповедника, сохраняясь близ водоемов-рефугиумов (оз. Линево, Раифский участок) и поселений человека в охранной зоне. Чесночница (Pelobates fuscus) демонстрирует сходные тенденции, однако ее возможности из наземных видов несколько выше: в 2012 г. показатели учетов в Саралинском участке самые высокие за весь период наблюдений, и в первой декаде августа отмечаются явления выхода сеголетков.
Таблица 2 . Зимнее население птиц Раифского участка ВКГПБЗ, ос./км2
|
Вид / Годы |
2007/2008 |
2009/2010 |
2010/2011 |
2011/2012 |
2012/2013 |
|
Accipiter gentilis |
0 |
0 |
0 |
0 |
0,2 |
|
Strix uralensis |
0,6 |
0,2 |
0 |
0 |
0 |
|
Tetrastes bonasia |
1 |
0 |
0 |
0,4 |
0 |
|
Dryocopus martius |
1,5 |
2,8 |
0,2 |
0,9 |
2,8 |
|
Dendrocopus major |
33,9 |
27,7 |
22,7 |
10,2 |
24,3 |
|
D. leucotos |
0 |
0 |
0,3 |
0,2 |
0 |
|
D. minor |
0 |
0 |
0 |
0 |
4,7 |
|
Picus canus |
0,3 |
0 |
0 |
0 |
0,7 |
|
Picoides tridactylus |
4,2 |
0 |
0 |
0 |
0 |
|
Corvus corax |
3,8 |
2,5 |
2,8 |
2,5 |
1,2 |
|
C. cornix |
0,6 |
0,4 |
0,5 |
0,3 |
0,7 |
|
Pica pica |
1,6 |
0 |
0,1 |
0 |
0,4 |
|
Garrulus glandarius |
1,8 |
2,2 |
3 |
0,7 |
3,6 |
|
Pyrrhula pyrrhula |
0,5 |
27,8 |
7,3 |
3,5 |
3,2 |
|
Acanthis flammea |
0,2 |
0 |
16,1 |
6,2 |
3,9 |
|
Carduelis carduelis |
0 |
0 |
0 |
0 |
0,04 |
|
Spinus spinus |
4,2 |
13,8 |
3,0 |
0,4 |
1,7 |
|
Pinicola leucoptera |
1,2 |
0 |
2,7 |
0 |
6,5 |
|
Bombycilla garrulus |
0 |
0,1 |
8,1 |
0 |
0 |
|
Sitta europea |
6,8 |
11,6 |
1,7 |
0,8 |
4,1 |
|
Certhia familiaris |
7,8 |
3,2 |
1,3 |
0 |
4,3 |
|
Aegithalos caudatus |
23,5 |
22,6 |
0 |
2,3 |
0 |
|
Parus palustris |
3,2 |
0,4 |
0,4 |
0 |
0 |
|
P. caeruleus |
0,6 |
6,6 |
0 |
0 |
1,8 |
|
P. major |
7,8 |
7,2 |
0,4 |
0,8 |
10,2 |
|
P. montanus |
28 |
41,6 |
12,5 |
14,1 |
35,9 |
|
P. ater |
24,2 |
9,3 |
2,7 |
0,5 |
6,1 |
|
P. cristatus |
6,4 |
3,6 |
2,2 |
0,7 |
9,8 |
|
Regulus regulus |
15,6 |
4,4 |
0,4 |
0,2 |
12,9 |
|
Всего |
179,3 |
188,0 |
88,5 |
46,7 |
139,0 |
На состояние фауны рептилий в сравнении с земноводными климатическая ситуация 2010 г. оказала минимальное прямое воздействие. Наименьшие флуктуации плотности проявились в популяции веретеницы ломкой (Anguis fragilis) Раифского участка. В период 2010-2011 гг. произошло существенное пространственное перераспределение веретеницы: ее встречи приурочены к затененным биотопам с хорошо развитой подстилкой и обильной травянистой растительностью. На таких участках количество встреч достигает 3-4 особей/км маршрута. В 2011 г. в открытых биотопах веретеница не найдена. Резкое снижение встречаемости вида в весенне-летний сезон 2010 г. в Саралинском участке, с учетом их 9-кратного увеличения в следующем году, свидетельствуют о сохранении общей численности не менее чем в среднегодовых пределах. Близкая тенденция характерна для популяций прыткой ящерицы (Lacerta agilis) обоих участков, выявленная плотность которой минимальна в 2010 г., но в 2011-2013 гг. плавно повышается, достигая на территории Саралинского участка более высокого уровня, чем до года засухи. Крайне нестабильны показатели плотности у видов, биотопически тесно связанных с водными и мезофильными элементами биотопов - живородящей ящерицы (Zootoca vivipara) и ужа обыкновенного (Natrix natrix). В случае с живородящей ящерицей ее численность варьирует в широких пределах, резко падая в год засухи и последующие сезоны на- блюдения, в зависимости от изменения доли увлажненных территорий и общего иссушения экосистем заповедника. Центрами восстановления вида являются сохранившиеся микропопуляции в озерно-болотных комплексах, доля которых выше в Раифском участке, и здесь плотность ящерицы в самые засушливые периоды локально сохраняется на уровне 2,0-5,5 ос./км маршрута. Распределение ужа в большей степени определяется трофическими факторами [9]. Обыкновенная медянка (Coronella austriaca) в Раифской части известна по единичным встречам, в Саралинской - является обычной. На территории последней среднегодовая частота встреч составляет 0,2-0,5 ос./км маршрута. В 2010 г. показатель возрастает в 2 раза, что не может быть объяснено ростом численности, и, по предварительным материалам, связано с увеличением продолжительности суточной активности. Редкость и особенности распределения обыкновенной гадюки (Vipera berus) в Раифе не позволяют судить о влиянии засухи на популяцию вида. Данные по Саралинскому участку свидетельствуют о незначительном снижении встречаемости вида. Изменилось распределение гадюки за период 2010-2011 гг. по сравнению с предыдущими годами: подавляющая доля встреченных змей приходится на закрытые биотопы. В 2012 г. частота находок гадюки в откры -тых и приопушечных биотопах восстанавливается, достигая 78%.
Таблица 3 . Плотность амфибий и рептилий Раифского/Саралинского участков ВКГПБЗ, ос./км маршрута
|
Виды / Годы |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
|
L. vulgaris |
*/0,2 |
0/1 |
0/0 |
0/0,1 |
0/0 |
*/0 |
|
B. bufo |
0,4/0,2 (+++) |
*/0,3 (++) |
0/0 (-) |
0,04/0,08 (-) |
0,07/0 (-) |
0,1/0 (-) |
|
B. bombina |
*/4,0 |
*/2,2 |
*/1,3 |
0,3 / 5,5 |
0,8/2,9 |
0,4/2,2 |
|
P. fuscus |
*/0,9(++) |
*/1,5 (++) |
0/0,1 (-) |
0/2,0 (-) |
0,3/4,5 (+) |
0/1,7 (-) |
|
P. ridibunda |
*/5,5 |
*/4,2 |
*/4,5 |
0,1/4,0 |
0/5,7 |
0,7/7,2 |
|
P. sp. |
>2,0/1,5 |
>2,0/2,2 |
>2,0/1,2 |
0,9/2,5 |
0,8/2,5 |
*/5,7 |
|
R. arvalis |
8,4/6,0 (+++) |
4,2/2,5 (+) |
0/0 (-) |
0/0,2 (-) |
0,3/0,7 (-) |
0,8/1,9 (+) |
|
A. fragilis |
0,8/1,8 |
0,3/1,5 |
0,5/0,4 |
0,3/3,5 |
0,4/1,4 |
0,2/1,7 |
|
L. agilis |
1,1/0,5 |
0,9/0,7 |
0,04/0,2 |
0,4/1,7 |
0,6/1,1 |
0,7/1,3 |
|
Z. vivipara |
5,3/1,7 |
12,0/3,5 |
6,7/0,4 |
2,5/0,5 |
1,3/0 |
3,5/0,5 |
|
C. austriaca |
0/0,2 |
*/0,6 |
0/1,2 |
0,03/0,3 |
0/,4 |
0/0,7 |
|
N. natrix |
>2,0/7,5 |
>2,0/11,2 |
0,5/0,6 |
0,7/0,8 |
1,6/1,4 |
2,6/14,5 |
|
V. berus |
0,5/0,4 |
1,2/1,1 |
0,5/0,1 |
0,01/0,4 |
0/0,4 |
0/1,2 |
Примечание: звездочкой (*) обозначено присутствие вида без возможности оценки его плотности; плюсы (+) и их количество показывают массовый выход сеголетков на сушу и обилие явления; минусами (-) - отсутствие зафиксированного массового выхода.
ЗАКЛЮЧЕНИЕ
Аномальные климатические явления 2009/2010 гг. в различной степени повлияли на фауну тетрапод ВКГПБЗ. Значительный спад численности мелких грызунов находится в преде- лах микродинамических циклов и не является критичным.
Ключевым свойством для большинства видов птиц является спектр их трофических предпочтений. Явления депрессии популяций наиболее выражены у видов, в питании которых преобладают животные корма.
Экосистемы Волжско-Камского заповедника являются устойчивыми природными резерватами с функциями рефугиумов для подавляющего большинства видов герпетофауны. Из амфибий крайне острый отклик на влияние засухи выражен в популяциях редких и топически связанных с наземными биотопами видов. Реакция рептилий в большей степени проявляется опосредованно, как и у птиц, через трофические взаимосвязи.
Список литературы Влияние аномальных климатических явлений 2010 г. на фауну тетрапод Волжско-Камского заповедника
- Аюпов А.С. Особенности выживания диких животных в природных условиях (На примере Раифского участка Вожско-Камского заповедника 2010-2011 годах)//Бутурлинский сборник: матер. IV Междунар. Бутурлиских чтен. Ульяновск: Изд. «Корпорация технологий продвижения», 2012. С. 7-13.
- Виноградов В.В., Кельбешеков Б.К. Структурно-временная организация сообщества грызунов среднегорной темнохвойной тайги Восточного Саяна (на примере заповедника «Столбы»)//Вестник Томского государственного университета. Сер. Биология. 2009. Т. 8, № 4. С. 5-14.
- Кудинов К.А. Засуха в Жигулях. Краткий обзор результатов экологического мониторинга за 2010 г.//Вестник Волжского университета им. В.Н. Татищева. 2011. № 12. С. 51-57.
- Летопись природы. Волжско-Камский государственный природный биосферный заповедник. Книга 50. 2012. . пос. Садовый. 2013. 263 с.
- Маслов А.Д. Короед-типограф и усыхание еловых лесов. М.: ВНИИЛМ, 2010. 138 с.
- Окулова Н.М. Опыт изучения многолетней динамики численности млекопитающих//Поволжский экологический журнал. 2009. № 2. С. 125 -136.
- Павлов А.В., Свинин А.О., Литвинчук С.Н., Забиякин В.А. Аннотированный список амфибий и рептилий заповедника, отмеченных в период 2009-2012 гг.//Научные труды Государственного природного заповедника «Большая Кокшага». Вып. 6. Йошкар-Ола: Мар. гос. ун-т, 2013. С. 216-234.
- Переведенцев Ю.П., Важнова Н.А., Наумов Э.П., Шанталинский К.М., Шарипова Р.Б. Современные тенденции изменения климата в Приволжском федеральном округе//Георесурсы. 2012. 6 (48). С. 19-23.
- Петрова И.В., Чижикова Н.А., Павлов А.В. Микроклиматические условия в термобиологии ужа обыкновенного//Ученые записки Казанского гос. университета. Сер. Естественные науки, 2010. Т. 152, Н. 2. С. 237-251.
- Попов В.А. Млекопитающие Волжско-Камского края. Насекомые, рукокрылые, грызуны. Казань: 1960. 468 с.
- Равкин Ю.С. К методике учета птиц в лесных ландшафтах//Природа очагов клещевого энцефалита на Алтае. Новосибирск, 1967. С. 66-75.
- Селюниина З.В. Многолетний мониторинг динамики численности мышевидных грызунов Черноморского заповедника//Вестник зоологии. 2003. 27 (2). С. 23-30.


