Влияние антибактериальных факторов на смешанную культуру Escherichia coli и Staphylococcus epidermidis в условиях повышенного осмотического давления
Автор: Елтышева Ирина Валерьевна, Затворницкий Лев Евгеньевич, Масленникова Ирина Леонидовна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2020 года.
Бесплатный доступ
Комменсальные штаммы кишечника человека Escherichia coli K12 и кожи Staphylococcus epidermidis нередко встречаются в одних и тех же атипичных биотопах, где они могут выступать инфекционными агентами. Цель работы - изучение эффективности действия хлорамфеникола, це-фтриаксона, пиобактериофага поливалентного и хлоргексидина на моновидовые и смешанные культуры условно-патогенных микроорганизмов E. coli К12 и S. epidermidis на фоне 2%-ного NaCl. Показано, что эффект цефтриаксона и хлорамфеникола, с антибактериальными свойствами только в отношении E. coli, нивелировался в условиях повышенного осмотического давления в концентрациях 12-200 мг/л в смешанной культуре. Для E. coli К12 отмечено снижение эффективности действия бактериофага при высоком осмотическом давлении, что является противоположным по отношению к S. epidermidis. Что касается хлоргексидина, то в условиях 2%-ного NaCl его действие на E. coli K12 и S. epidermidis усиливалось в моновидовых и смешанных культурах. В целом, повышение осмотического давления среды выступало синергистом ингибирования роста бактерий антибиотиками и бактериостатиком.
Смешанные культуры, антибиотики, бактериофаг, хлоргексидин
Короткий адрес: https://sciup.org/147229631
IDR: 147229631 | УДК: 579.264: | DOI: 10.17072/1994-9952-2020-1-19-25
Текст научной статьи Влияние антибактериальных факторов на смешанную культуру Escherichia coli и Staphylococcus epidermidis в условиях повышенного осмотического давления
Staphylococcus epidermidis – комменсал кожи человека, нередко могут встречаться в одних и тех же атипичных биотопах, где они могут выступать инфекционными агентами: в мочеполовых путях ( E. coli группы A – 12; S. epidermidis – 11.6%), в трофических язвах ( E. coli – 6.4 – 14.3; S. epidermi-dis – 28.2%), в ожоговых ( E. coli – 6.3; S. epider-midis – 4.4%), хирургических ранах ( E. coli группы А – 20 изолятов; S. epidermidis – 2.2% ), на постоянных медицинских устройствах, таких как катетеры, импланты [Moet et al., 2007; Otto, 2009; DiMuzio et al., 2014; Chakraborty et al., 2015; Hinojosa et al., 2016; Козлова и др., 2017; Assadian, Humphreys, Ousey, 2018; Méric et al., 2018; Oliveira et al., 2018; Szweda, Gorczyca, Tylingo, 2018].
С этих позиций использование антибиотиков с широким спектром действия при полимикробных инфекциях вполне оправдано. Однако примерно 50% всех госпитальных инфекций в настоящее время вызываются резистентными к антибиотикам микроорганизмами [Фадеева и др., 2006], причем среди комменсальной группы E. coli и S. epidermidis все чаще выявляются случаи множественной устойчивости [Chakraborty et al., 2015; Козлова и др., 2017]. Поэтому использование наряду с антибиотиками поливалентных бактериофагов или универсальных бактериостатиков, таких как хлоргексидин, для санации поверхностных, глубоких гнойных ран, труднозаживающих трофических язв до сих пор не потеряло своей значимости [Schmidt et al., 2018].
В некоторых ситуациях, таких как ряд патологических состояний (сахарный диабет, ожирение, гипертензия, заболевания щитовидной железы и др. [Akbaş, Kilinç, 2018], физические нагрузки, жаркие климатические условия, инфекционные процессы могут протекать на фоне интенсивного потоотделения, в ходе которого концентрация Na+ и Cl- варьирует в пределах 10 – 90 мМ [Baker, 2019] и в близлежащих биотопах может достигать 12 – 21 мМ [Hendricks et al., 2018]. Учитывая бактерицидный характер действия высоких концентраций NaCl, а также разную устойчивость видов E. coli и S. epidermidis к высокому осмотическому давлению можно предположить разницу в составе по-лимикробного сообщества в этих условиях и, возможно, в устойчивости к антимикробным препаратам с разным механизмом действия.
В связи с этим, целью данной работы было изучение эффективности действия хлорамфеникола, цефтриаксона, пиобактериофага поливалентного и хлоргексидина на моновидовые и смешанные культуры условно-патогенных микроорганизмов E. coli К12 и S. еpidermidis на фоне 2%-ного NaCl .
Материалы и методы исследования
В качестве объекта исследования использовали референтный штамм S. еpidermidis (ATCC 29887) и генно-инженерный штамм E. coli К12 TG1 (pXen7) c полным lux-опероном светящейся бактерии Photorhabdus luminescens [Данилов и др., 2002].
Культивирование бактерий проводили на жидкой богатой питательной среде Luria-Bertani (LB) (Sigma, США). В ряде вариантов конечная концентрация NaCl в среде была 2%.
Ночные культуры S. еpidermidis и E. coli К12, выращенные на LB, разводили свежей питательной средой до концентрации бактерий 106 кл/мл. Планктонные моновидовые и смешанные культуры S. еpidermidis и E. coli К12 (соотношение 1:1) вносили по 200 мкл в лунки плоскодонных полистироловых планшетов (Медполимер, Россия) и выращивали в термостате при 37ºС в течение суток.
Для оценки влияния антибактериальных препаратов на моновидовые и смешанные культуры S. еpidermidis и E. coli К12 использовали хлорамфеникол (1 – 200 мг/л) (Northeast pharmaceutical group Co., Китай), цефтриаксон (1 – 200 мг/л) (Синтез, Россия), пиобактериофаг поливалентный очищенный (разведение в 10 – 800 раз) (Микроген, Россия), 0.05%-ный водный раствор хлоргексидина биглюконата (разведение в 10 – 1500 раз) (Сама-рамедпром, Россия).
Интенсивность роста моновидовых культур оценивали через 24 ч. по оптической плотности при длине волны 600 нм (ОП 600) на микроплан-шетном ридере Synergy H1 (BioTek, США). Влияние антибактериальных препаратов на E. coli в смешанной культуре оценивали согласно уровню ингибирования биолюминесценции через 4 ч. культивирования по сравнению с соответствующим контролем. Соотношение видов в культурах оценивали через 24 ч. путем высевов на селективные среды: для E. coli K12 – LB агар c 100 мг/л ампициллина (учитывались светящиеся колонии, КОЕ/мл); для S. еpidermidis – LB c 3% NaCl (конечная концентрация).
Повторность экспериментов трехкратная. Статистическая обработка проводилась с использованием программы Excel: рассчитывали среднее арифметическое, стандартное отклонение, t -критерий Стьюдента.
Результаты и их обсуждение
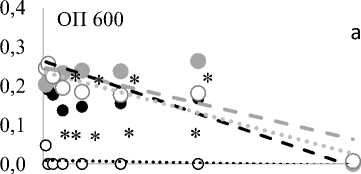
В результате проведенных исследований было показано, что в условиях повышенного осмотического давления рост E. coli K12 ингибировался (p < 0.05), а S. epidermidis – нет (p = 0.26). Однако при действии 10–100 мг/л цефтриаксона на моно-видовые культуры развитие обоих видов бактерий на фоне 2%-ного NaCl замедлялось (рис. 1, а). Подобное ингибирующее действие отмечено у хлорамфеникола (1–100 мг/л) только для E. coli K12, поскольку S. epidermidis обладал устойчивостью к данному антибиотику (рис. 1, б). Таким образом, действие осмотического фактора усиливало антибактериальное действие антибиотика на моновидо-вые культуры.
0 50 100 150 200
Концентрация, мг/л
0,4
0,3
0,2
0,1
0,0
-0,1
0,3
0,2
0,1
0,0
ОП 600
б
** * * *• Ч.О
* **
0,0 20,0 40,0 60,0 80,0100,0
Концентрация, мг/л
ОП 600
*



в

Разведение, раз
.^. —.^.^.ж.тт..-:
0 100 200 300 400 500 600 700
0 2 ОП 600
.28 8 о________- аз L ^л^"
’ Разведение. раз
оо q——-
0 200 400 600
• E.cdi, 0.9*4 NaCl о Е. cdi, 2% NaCl
S. epic etmicis. 0.9* о NaCl О S. epidamidis: 2*4 NaCl ---Линейная (E coli, 09*4 NaCl) .........Линейная (E coli, 296 NaCl)
~ Линейная (S. epidemucis. 0.9*4 NaQ)
Линейная (S. epidetmidis. 2*4 NaCl)
Рис. 1 . Влияние цефтриаксона (а), хлорамфеникола (б), бактериофага (в), хлоргексидина (г) на рост E. coli K12 и S. epidermidis в моновидовой культуре на фоне 2%-ного NaCl
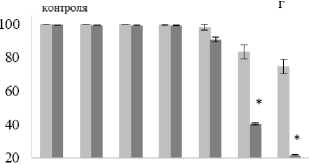
При действии поливалентного бактериофага отмечена его высокая активность в отношении E. coli К12, но на фоне 2%-ного NaCl эффективность действия данного препарата на оба вида снижалась при разведении в 10 раз (рис. 1, в). Что касается хлоргексидина, то в условиях повышенного осмотического давления его действие на E. coli K12 и S. epidermidis усиливалось (рис. 1, г). Это связано с тем, что действие бактериостатика обусловлено его связыванием c фосфолипидами плазматической мембраны, что приводит к нарушению осмотического равновесия [Hidalgo, Dominguez, 2001], поэтому присутствие 2%-ного NaCl вносило дополнительный вклад в нарушение целостности клеток, вызывая гибель бактерий обоих видов.
В составе смешанных культур действие вышеуказанных антибактериальных веществ на клетки E. coli K12 оценивалось по биолюминесценции, поскольку энергетическое обеспечение свечения бактерий тесно взаимосвязано с основными метаболическими путями [Пшеничнов, Масленникова, Никитина, 2003]. Присутствие S. epidermidis ингибировало обмен веществ E. coli , причем сильнее в среде с 2%-ным NaCl (63.2±16.0 против 33.8±12.9; р = 0.001) Однако степень ингибирования свечения E. coli К12 в составе смешанной культуре было меньше (79.3±6.6), чем в моновидовой (86.6±5.5) (р = 0.035) при действии 2% NaCl, что может свидетельствовать о том, что в полимикробной ассоциации с S. epidermidis вероятность выживания E. coli К12 увеличивается при повышении осмотического давления окружающей среды. Вероятно, наличие в составе мембран стафилококков 8 видов протонных помп и 6 видов транспортных систем осмопротекторов [Rogers, Fey, Rupp, 2009] позволяет обеспечивать защиту от NaCl не только собственных клеток, но и бактерий-ассоциантов.
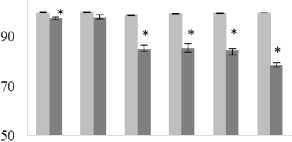
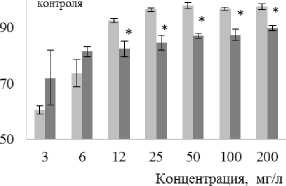
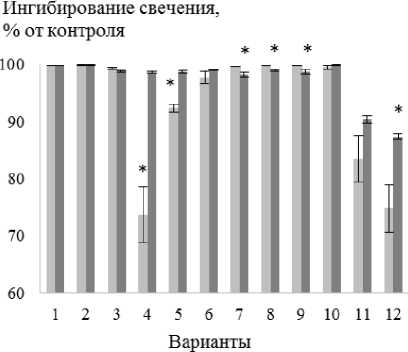
На рисунке 2 представлены данные действия антибактериальных препаратов на E. coli К12 в составе смешанной культуры. Показано, что эффект обоих антибиотиков (цефтриаксона с широким спектром действия, хлорамфеникола с антибактериальными свойствами только в отношении E. coli ) нивелировался в условиях повышенного осмотического давления в концентрациях 12 – 200 мг/л. Подобного рода снижение восприимчивости к антибиотикам ранее отмечалось у моновидовых культур S. aureus , E. coli на фоне высокого содержания NaCl в среде, связанное с индукцией защитных белков стресса и снижением активности сайтов связывания клеточной стенки [McMahon et al., 2007]. Вероятно, что данный механизм, также обеспечивает увеличение резистенстности E. coli K12 к актибиотикам и в условиях смешанного сообщества.
Инбирование свечения, % от контроля
6 12 25 50 100 200
Концентрация, мг/л
Ингибирование б свечения, % от
Ингибиро ванне свечения, % от В
6 12 24 48 96 192 384
Разведение, раз
Ингибирование свечения, % от
12 24 48 96 192 384 768
0,9%NaCl ■ 2%NaCl Разведение, раз
Рис. 2 . Влияние цефтриаксона (а), хлорамфеникола (б), бактериофага (в), хлоргексидина (г) на E. coli в составе смешанной культуры с S. epidermidis
Бактерицидное действие хлоргексидина на клетки E. coli К12 не зависело от осмотического фона, за исключением вариантов с сильным разведением препарата (больше 350 раз) (рис. 2, г). Если оценивать суммарное воздействие антибактериального препарата и 2%-ного NaCl, то дополнительный бактерицидный эффект последнего явно проявлялся только при низких концентрациях хло-рамфекола и хлоргексидина (частично данные эксперимента представлены на рис. 3).
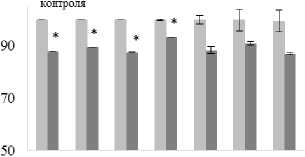
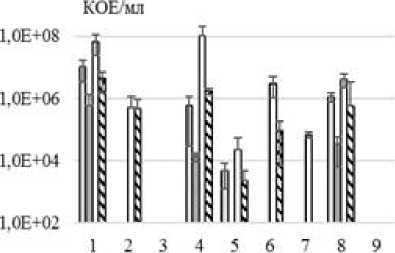
Что касается состава смешанной культуры, то при действии осмотического фактора выживаемость обоих видов снижалась (рис. 4). При действии 200 мг/л цефтриаксона роста бактерий не было, при низкой (6 мг/л) – действие соли не оказывало влияния на КОЕ/мл S. epidermidis. В отношении действия хлорамфеникола показано, что в условиях смешанной культуры клетки E. coli выживали при 200 мг/л, в то время, как в моновидовой культуре антибиотик в концентрации 100 мг/л полностью ингибировал рост данного вида. Подобный эффект появления устойчивости к антибиотикам в смешанных культурах описан ранее для видов S. aureus и E. coli [Shahidi et al., 1969]. По всей видимости, комменсал кожи S. epidermidis в составе смешанной культуры также может способствовать появлению устойчивости к антибиотикам у видов-ассоциантов. Механизмы подобной устойчивости могут быть связаны с инактивацией бактериями-ассоциантами антибиотиков, с изменениями в экспрессии генов, вызванные метаболитами и сигналами кворума, ингибированием цепи переноса электронов и c изменениями свойств клеточных мембран [Orazi, O’Toole, 2019]. Однако, присутствие осмотического фактора нивелировало появившуюся устойчивость E. coli к хлорамфениколу и оказывало бактерицидное действие, свидетельствуя об изменении механизмов устойчивости бактериальных ассоциаций в данных условиях.
■ АБ препарат "АБ препарат + 2%NaCl
Рис. 3. Суммарное влияние 2%-ного NaCl и антибактериального (АБ) препарата на E. coli
K12 в составе смешанной культуры с
S. epidermidis :
1, 2, 3 – цефтриаксон (6, 12, 50 мг/л); 4, 5, 6 – хлорамфеникол (6, 12, 50 мг/л); 7, 8, 9 – бактериофаг (разведение в 6, 50, 200 раз); 10, 11, 12 – хлоргексидин (разведение в 100, 400, 700 раз)
В отношении бактериофага выявлено, что его литическое действие вне зависимости от исходного количества проявлялость только на E. coli К12 в смешанной культуре со S. epidermidis. Данный эффект выборочного лизиса бактериофагом видов бактерий в смешанной культуре связан с ранее описанным феноменом «Kill the winner», согласно которому более успешно пролиферирующие виды в сообществе, в условиях нашего эксперимента E. coli K12, в большей степени подвергаются давлению фаговой инфекции [Weinbauer, 2004].
Варианты
-
□Е. coli, 0,9%NaCl
ОЕ coli,2%NaCl
OS. epidennidis, O.9°oNaCl
3S. epidennidis, 2% NaCl
Рис. 4 . Жизнеспособность E. coli К12 и
-
S. epidermidis в смешанной культуре при действии антибактериальных факторов:
-
1 – контроль; 2, 3 – цефтриаксон (6, 200 мг/л); 4,
-
5 – хлорамфеникол (6, 200 мг/л); 6, 7 – бактериофаг (разведение в 200 и 10 раз); 8, 9 – хлоргексидин (разведение в 400 и 10 раз)
Кроме этого, если ранее для E. coli К12 отмечено снижение эффективности действия бактериофага при высоком осмотическом давлении, согласно данным высевов, у S. epidermidis данный эффект не обнаружен. Вероятно, тип взаимодействия бактериофагов с грамположительными бактериями (не исключающий формирование пор в клеточной стенке) [Moller, Lindsay, Read, 2019], частично объясняет усиление гибели S. epidermidis при повышенном осмотическом давлении среды.
Что касается хлоргексидина, то его действие в составе смешанной культуры было аналогично моновидовым культурам (рис. 4). При сильном разведении бактериостатика 2%-ный NaCl сильнее ингибировал выживаемость обоих видов бактерий.
Заключение
Существование бактериальных видов в составе сообщества неизменно сопровождается изменениями в экспрессии генов и соотвественно в регуляции метаболизма, необходимые для антагонистических или мутуалистических форм взаимодействия членов ассоциации. В связи с этим механизмы действия антибактериальных факторов различной природы могут модифицироваться и не проявляться в такой же степени, как в моновидовой культуре. Дополнительно к выше указанному, различные стрессорные факторы внешней среды, та- кие как анормальные температуры, осмоляльность или кислотность среды, могут вносить коррективы реагирования бактериальных видов, а именно появление устойчивости к антибактериальным агентам, обусловленные разными механизмами. В целом, в большинстве случаев повышение осмотического давления среды выступало синергистом ингибирования роста бактерий антибиотиками и бак-териостатиком.
Исследование выполнено в рамках государ-ственнного задания номер госрегистрации темы: 01201353249.
Список литературы Влияние антибактериальных факторов на смешанную культуру Escherichia coli и Staphylococcus epidermidis в условиях повышенного осмотического давления
- Данилов В.С. и др. Сенсорные биолюминесцентные системы на основе lux-оперонов разных видов люминесцентных бактерий // Вестник МГУ. Cер. 16: Биология. 2002. № 3. С. 20-23.
- Козлова Ю. и др. Генетическая и биохимическая характеризация стафилококков, встречающихся в Новосибирске // Вавиловский журнал генетики и селекции. 2017. Т. 21, № 8. С. 952-958.
- Пшеничное Р.А., Масленникова И.Л., Никитина Н.М. Влияние антибактериальных факторов и биостимуляторов клеточного метаболизма на бактериальную люминесценцию // Прикладная биохимия и микробиология. 2003. Т. 39, № 3. С. 307-312.
- Фадеева Т.В. и др. Актуальные проблемы госпитальной инфекции: реинфицирование, суперинфицирование и резистентность возбудителей к антимикробным препаратам // Бюллетень Восточно-Сибирского научного центра СО РАМН. 2006. № 5. С. 298-301.
- Akba§ A., Kiling F. Investigation on aetiological factors in patients with hyperhidrosis // Cutaneous and Ocular Toxicology. 2018. Vol. 37, № 4. P. 344-349.
- Assadian O., Humphreys P.N., Ousey K.J. Disinfection of artificially contaminated gloved hands reduces transmission of Staphylococcus epidermidis to catheter valves // Journal of Hospital Infection. 2018. Vol. 100, № 3. P. e57-e59.
- Baker L.B. Physiology of sweat gland function: The roles of sweating and sweat composition in human health // Temperature (Austin). 2019. Vol. 6, № 3. P. 211-259.
- Chakraborty A. et al. Characterization of Escherichia coli phylogenetic groups associated with extraintestinal infections in South Indian population // Annals of Medical and Health Sciences Research. 2015. Vol. 5, № 4. P. 241-246.
- DiMuzio E.E. et al.Trends in bacterial wound isolates and antimicrobial susceptibility in a pediatric burn hospital // Journal of burn care and research. 2014. Vol. 35, № 5. P. e304-11.
- Hendricks A.J. et al. Sweat mechanisms and dysfunctions in atopic dermatitis // Journal of Dermato-logical Science. 2018. Vol. 89, № 2. P. 105-111.
- Hidalgo E., Dominguez C. Mechanisms underlying chlorhexidine-induced cytotoxicity // Toxicology in vitro. 2001. Vol. 15, № 4-5. P. 271-276.
- Hinojosa C.A. et al. Impact of the bacteriology of diabetic foot ulcers in limb loss // Wound Repair and Regeneration. 2016. Vol. 24, № 5. P. 923-927.
- Jonczyk E. et al. The influence of external factors on bacteriophages - review // Folia Microbiologica (Praha). 2011 Vol. 56, № 3. P. 191-200.
- McMahon M.A. et al. Environmental stress and antibiotic resistance in food-related pathogens // Applied and Environmental Microbiology. 2007. Vol. 73, № 1. P. 211-217.
- Meric G. et al. Disease-associated genotypes of the commensal skin bacterium Staphylococcus epi-dermidis // Nature communications. 2018. Vol. 9, № 1. P. 5034.
- Moet G.J. et al. Contemporary causes of skin and soft tissue infections in North America, Latin America, and Europe: report from the SENTRY Antimicrobial Surveillance Program (1998-2004) // Diagnostic microbiology and infectious disease. 2007. Vol. 57, № 1. P. 7-13.
- Moller A.G., Lindsay J.A., Read T.D. Determinants of phage host range in Staphylococcus species // Applied and environmental microbiology. 2019. Vol. 85, № 11. P: e00209-19.
- Oliveira W.F. et al. Staphylococcus aureus and Staphylococcus epidermidis infections on implants // The Journal of hospital infection. 2018. Vol. 98, № 2. P. 111-117.
- Orazi G., O'Toole G.A. «It takes a village»: mechanisms underlying antimicrobial recalcitrance of polymicrobial biofilms // The Journal of bacteriology. 2019. Vol. 202, № 1. P. e00530-19.
- Otto M. Staphylococcus epidermidis - the «accidental» pathogen // Nature reviews. Microbiology. 2009. Vol. 7, № 8. P. 555-567.
- Rogers K.L., Fey P.D., Rupp M.E. Coagulase-negative staphylococcal infections // Infectious disease clinics of North America. 2009. Vol. 23, № 1. P. 73-98.
- Schmidt K. et al. Chlorhexidine antiseptic irrigation eradicates Staphylococcus epidermidis from biofilm: an in vitro study // Clinical orthopedics and related research. 2018. Vol. 476, № 3. P. 648653.
- Shahidi A., Ellner P.D. Effect of mixed cultures on antibiotic susceptibility testing // Applied microbiology. 1969. Vol. 18, № 5. P. 766-770.
- Szweda P., Gorczyca G., Tylingo R. Comparison of antimicrobial activity of selected, commercially available wound dressing materials // Journal of wound care. 2018. Vol. 27, № 5. P. 320-326.
- Weinbauer M.G. Ecology of prokaryotic viruses // FEMS microbiology reviews. 2004. Vol. 28, № 2. P. 127-181.


