Влияние антигипоксантов на ферментативный дисбаланс при комбинированной травме
Автор: Козлов С.А., Лазарева Т.И.
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Медицина
Статья в выпуске: 1-2, 2003 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14720289
IDR: 14720289
Текст статьи Влияние антигипоксантов на ферментативный дисбаланс при комбинированной травме
Тяжелые механические повреждения стали не просто медицинской проблемой: они приобрели острую социальную значимость. В общем числе травм доля комбинированных и сочетанных повреждений составляет 5 — 14 % [7]. Их особенностью является синдром взаимного отя гощения, обусловленный синергическим взаимодействием патологических механизмов, связанных с нарушением работы органов и систем, и приводящий к поли-органной недостаточности [8]. Достижение последних лет — внедрение функционального и метаболического мониторинга
при устранении критических состояний
Как изолированная, так и комбинированная травма сопровождаются структурно-функциональными изменениями в паренхиматозных органах. В условиях гипоксии происходят сдвиги в функционировании клеточных и тканевых структур организма. Развивающиеся при этом биохимические изменения могут служить критерием для оценки тяжести повреждений и функционального состояния различных органов и жизненно важных систем [2]. При тяжелых повреждениях в результате нарушения проницаемости клеточных мембран [9] аминотрансферазы — ферменты-индикаторы претерпевают значительные изменения [6; 10]. Тяжесть шока и степень повышения активности в сыворотке крови ряда лизосомальных ферментов находятся в прямой зависимости [3].
Терапия патологических состояний различной этиологии, сопровождающихся гипоксией, требует рационального использования средств, уменьшающих метаболические отклонения в организме либо предупреждающих их нарастание в постгипоксическом периоде, т. е. антиги-поксантов [5]. Учитывая многогранность патологии при недостаточности снабжения организма кислородом, наиболее целесообразным следует считать комбинированное применение лекарственных средств, позволяющих одновременно влиять на все лимитирующие звенья патогенеза гипоксических состояний [4].
Для изучения терапевтического эффекта инфузионной терапии с включением антигипоксантов проведены эксперименты на 38 собаках обоего пола массой от 10 до 24 кг под тиопентал-натриевым наркозом (0,04 г/кг) на модели комбинированной травмы (глубокий ожог 10 % поверхности тела на фоне острой кровопотери — 22,83 + 0,24 мл/кг). В 1-й серии (И собак) через 1 ч после травмы внутривенно (в/в) вливали реополиглю-кин, изотопический раствор натрия хлорида (1:1), аплегин (15 мг/кг) и мекси-дол (50 мг/кг); во 2-й серии (9 собак) эти лекарственные препараты вводили в дистальный метаэпифиз левого бедра; в
3-й серии (9 собак) вместо мексидола использовали димефосфон (100 мг/кг) внутривенно; в 4-й серии (9 собак) осуществляли внутрикостно инфузию ап-легина и димефосфона. Объем инфузионной терапии в два раза превышал величину кровопотери. В сыворотке венозной крови определяли активность аспарагиновой и аланиновой трансаминаз — по методу Райтмана—Френкеля, содержание лактатдегидрогеназы — унифицированным микрометодом на биохимическом анализаторе ФП-901М «Лабсистема». Рассчитывали коэффициент Де Ритиса как отношение аспарагиновой и аланиновой трансаминаз (АсАТ/А л АТ).
Комбинированная травма приводила к усилению активности АсАТ на 102,04 %, Ал АТ — на 55,30, лактатдегидрогеназы (ЛДГ) — на 284,33 %. Коэффициент Де Ритиса равнялся 1,16 (130,79 % от пер-воначального значения). Через 1 ч после лечения активность АсАТ продолжала увеличиваться в 1-й серии — до 218,65 %, во 2-й - до 316,25 %, в 4-й - до 235,70 % от нормального уровня. В 3-й серии при применении аплегина и димефосфона отмечалось уменьшение содержания фермента на 8,86 % относительно предыдущего этапа травмы (рис. 1). При этом
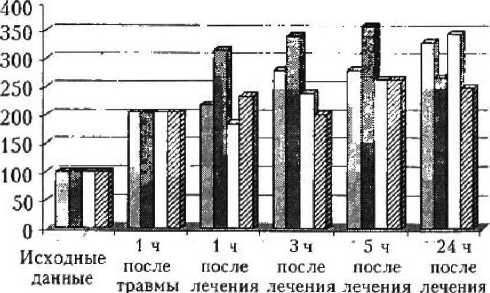
Qв/в аплегин + мексидол яв/к аплегин + мексидол
□ в/в аплегин + димефосфон 0 в/к аплегин + димефосфон
Рис. 1. Динамика АсАТ при различных схемах лечения активность Ал АТ в 1-й серии снижалась на 12,15 %, в 3-й оставалась на уровне предыдущего этапа, тогда как в сериях с внутрикостным введением аплегина, мексидола и димефосфона продолжался рост активности фермента — на 116,67 и 104,38 % от исходного значения (рис. 2).
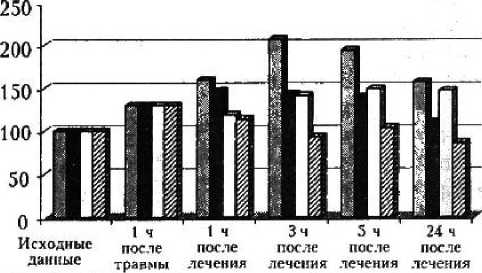
активности фермента после лечения — соответственно па 13,39; 9,96; 14,95; 16,35 % по сравнению с ее состоянием в период 1 ч после травмы (рис. 4).
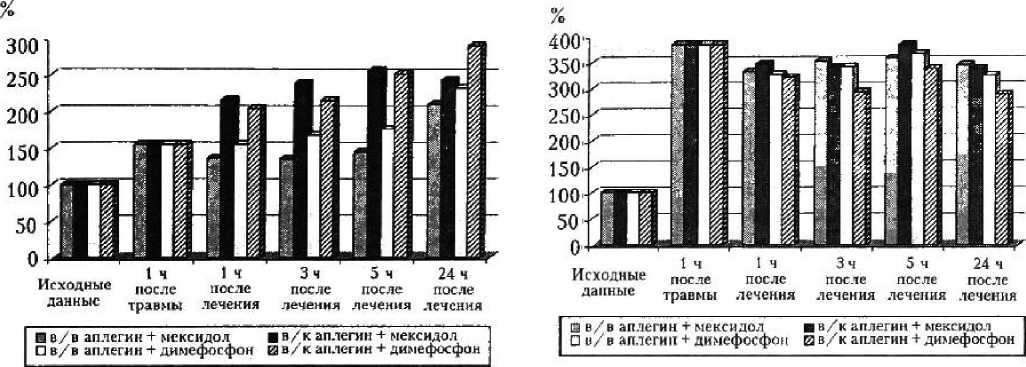
Рис. 4. Динамика Л ДР при различных схемах лечения
Рис. 2. Динамика АлАТ при различных схемах лечения
Коэффициент Де Ритиса достигал в t-й серии 1,43 ± 0,02 (160,22 % от начального уровня), во 2-й — 1,31 ± 0,03 (146,63%). При в/в инфузии аплегина в комбинации с димефосфоиом соотношение АсАТ/ АлАТ составило 1,06 ± 0,02 (118,88 % от нормы), что на 9, И % ниже, чем на этапе до лечения. При в/к терапии коэффициент Де Ритиса равнялся 1,02 ±0,02 (114,27 %), т. е. сократился на 12,63 % (рис. 3). Концентрация ЛДГ че-
□ в/в аплсгин + мексидол ■ в/к аплегкн + мексидол
□ в/в аплегин + дямсфосфпп И в/к аплегин + лимефосфон
Рис. 3. Динамика коэффициента Де Ритиса при различных схемах лечения рез 1 ч после инфузионной терапии составила в 1-й серии 332,88 %, во 2-й — 346,10, в 3-й - 326,92, в 4-й - 321,55 %, но во всех сериях отмечалось ослабление
Через 3 ч в постинфузионной стадии уровень АсАТ в 1-й серии поднимался до 279,96 %, во 2-й — до 341,19, в 3-й — до 239,82 % от исходной величины. Лишь после в/к введения гемокорректоров, аплегина и димефосфона концентрация фермента снизилась до 202,29 % от нормы. Активность АлАТ через 3 ч после лечения возрастала во 2-й серии до П^О Г*П О/ _ *> М. ___Я Г* О ГьА _ /
ZDO?OZ /о, В D-И — ДО 1ОО,УУ, В ^"И — ДО 215,85 % от первоначального значения. Только в/в введение аплегина и мекси-дола на фоне инфузионной терапии сдерживало увеличение активности фермента. Коэффициент Де Ритиса после в/в лечения повышался до 207,98 % в 1-й и до 141,57 % от нормы — в 3-й серии. Во 2-й серии он составил 143,37, в 4-й — 93,26 % от начального значения.
С 3 ч постипфузионпого периода до первых суток наблюдения содержание ЛДГ становилось больше в группе животных, которым лекарственные препараты вводились внутривенно, тогда как при внутрикостном лечении происходило недостоверное уменьшение активности ЛДГ (см. рис. 4). К 5 ч постинфузионного периода содержание всех исследованных ферментов продолжало увеличиваться. Через 24 ч после травмы активность АсАТ в сериях с внутривенным ведением была максимальной (1,67 ± 0,05 ммоль/л), тогда как при внутрикостном введении наблюдалось некоторое уменьшение содержания фермента относительно предыдущего этапа (см. рис. 1). К первым суткам рост активности АлАТ продолжался в 1, 3, 4-й сериях до максимальных значений, а во 2-й концентрация снизилась до 243,66 % от нормы, или на 5,01 % от уровня предыдущего этапа. Коэффициент Де Ритиса уменьшился в сериях с внутрикостным лечением соответственно до 109,78 и 86,18 % от нормы после инфузии аплетина в сочетании с мексидо-лом или димефосфоном за счет некоторого ослабления активности АсАТ в этих сериях с одновременным ростом АлАТ (см. рис. 3). А после внутривенной инфузии коэффициент в 1-й и 3-й сериях составил 157,3 и 147,19 % от исходного уровня. Активность ЛДГ к первым суткам посттрансфузионного периода незначительно снижалась во всех сериях, но оставалась высокой относительно исходной величины (см. рис. 4), превосходя ее соответственно на 243,09; 236,66; 223,41; 187,58 %.
Анализ полученных данных показал, что комбинированная травма сопровождается грубыми нарушениями метаболизма. Гиперферментемия при ожоге на фоне ТГ Г^ПП/ЛГГПТ йТИГ Z> ТЗ ГТ 1'I Т Т-^ ГТ ГТДГЛПХГУГч AirSTltlTTL П IXpiVlX^lLW 1 ^pri 1^Е17ЮС4,11Ы 13 ll^^r>YlV/ VTLр^Д-О V выходом ферментов из тканей внутренних органов в кровеносное русло в результате изменения проницаемости клеточных мембран и «утечки» внутриклеточных ферментов из-за нарушения процессов окислительного фосфорилирования при гипоксии.
Естественный метаболит аплегин играет одну из центральных ролей в липидном и энергетическом обменах клетки, усиливает устойчивость тканей, в том числе и печени, к воздействию токсических продуктов распада. Вследствие диффузного распределения мексидола по клетке он непосредственно влияет на структуру мембран, ведя себя как струк турный стабилизатор клеточных мембран. Мексидол выступает в качестве потенцированного защитного агента при наличии различных повреждающих факторов. Он нормализует содержание гликогена в печени при стрессе, способен защищать ее от избыточной пероксидации, стабилизирует ферментативное окисление, повышает порог чувствительности ткани печени к негативному действию активных форм кислорода. Димефосфон быстро проникает в липидный бислой наружной мембраны клеток благодаря своей липофильности и дает мембраностабилизирующий эффект. Он угнетает активность протеолитических феРментов, делает устойчивыми мембраны лизосом, ослабляет нарушение функций и структуры мембран при энергодефиците, стимулируя синтез структурных компонентов.
Применение инфузионной терапии и антигипоксантов (аплегина, мексидола и димефосфона) не приводит к нормализации активности исследованных ферментов. Внутривенное введение аплегина и димефосфона в составе инфузионной терапии в течение часа после лечения сдерживает рост активности АсАТ, а после применения аплегина и мексидола содержание фермента неуклонно возрастает. ВнуТрИВСННаЯ инфузия ГсМОКОррбКТирОБ, аплегина и мексидола уменьшает активность АлАТ до 5 ч постинфузионного периода. Внутрикостное введение аплегина с димефосфоном способствует снижению концентрации ЛДГ в большей степени, чем в других вариантах лечения. Антигипоксаитный и мембраностабилизирующий эффекты аплегина и димефосфона способствуют увеличению продолжительности жизни экспериментальных животных до 62,94 ± 18,98 ч при внутривенной и до 50,07 ± 11,14ч при внутрикостной инфузии. После в/в и в/к вливаний аплегина с мексидолом их выживаемость составила соответственно 43,57 ± 13,09 и 32,97 ±6,97 ч.
Список литературы Влияние антигипоксантов на ферментативный дисбаланс при комбинированной травме
- Жданов Г. Г. «Метаболическая реанимация» -основа интенсивной терапии полиорганной недостаточности//VIII Всероссийский съезд анестезиологов и реаниматологов: Тез. докл. Омск, 2002. С. 173 -174.
- Карякин А. М. Динамика показателей некоторых ферментативных систем в сыворотке крови больных с острой ишемией конечностей/А. М. Карякин, А. Ф. Квитко//Вестн. хирургии. 1997. В 1. С. 53 -56.
- Косоногое Л. Ф. Печень в динамике травматической болезни при различных методах реанимации/Л. Ф. Косоногов, А. Д. Магомедов. Воронеж: Изд-во Воронеж, ун-та, 1986. 144 с.
- Лукьянчук В. Д. Антигипоксанты: состояния и перспективы/В. Д. Лукьянчук, Л. Д. Савченко//Эксперим. и клин, фармакология. 1998. № 4. С. 72 -79.
- Мороз В. В. Проблемы реаниматологии и постреанимационная болезнь//VIII Всероссийский съезд анестезиологов и реаниматологов: Тез. докл. Омск, 2002. С. 9-10.
- Подымова С. Д. Болезни печени. М.: Медицина, 1984. 280 с.
- Полушин Ю. С. Некоторые вопросы организации анестезиологической и реаниматологической помощи в экстремальных ситуациях/Ю. С. Полушин, Б. Н. Богомолов//Анестезиология и реаниматология. 1999. № 2. С. 4 -9.
- Сафар П. Сердечно-легочная и церебральная реанимация: Пер. с англ./П. Сафар, Н. Дж. Би-гер. М: Медицина, 1997. 552 с.
- Эндогенное фосфорилирование белков лизосом сердца и печени крыс в раннем постреанимационном периоде/Т. И. Шанова, Э. Д. Полякова, С. Е. Никулина, Л. В. Молчанова//Бюл. эксперим. биологии и медицины. 1995. № 7. С. 51 -56г
- Biochemical markers of cerebral trauma/S. Haldre, L. Koiv, M. Roose et al.//9-th European Congress of Neurosurgery: Book of Abstracts. Moscow, 1991. P. 505.


