Влияние арсената (V) натрия на содержание свободных и связанных аминокислот растворенного органического вещества почвы
Автор: Окунев Р.В., Сунгатуллина Л.М., Григорьян Б.Р.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Биологические науки: Почвоведение
Статья в выпуске: 6, 2015 года.
Бесплатный доступ
В лабораторном опыте установлено влияние арсената (V) натрия на количественный состав и качественное содержание свободных и связанных аминокислот растворенного органического вещества темно-серой лесной почвы. В зависимости от дозы внесения As(V) содержание свободных аминокислот изменялось от 53,0±7,5 до 240,2±53,7 мкг/кг, а связанных от 106,9±13,9 до 527,5±93,4 мкг/кг. Качественный состав аминокислот при мышьяковом загрязнении не изменялся.
Почва, свободные аминокислоты, растворенное органическое вещество, мышьяк, аминокислоты почвы
Короткий адрес: https://sciup.org/14084355
IDR: 14084355 | УДК: 631.4
Текст научной статьи Влияние арсената (V) натрия на содержание свободных и связанных аминокислот растворенного органического вещества почвы
Введение. Влияние одного из самых токсичных элементов – мышьяка на свойства почв активно изучается во многих странах [1–3]. Известно, что элемент влияет на ферментативную активность почв, состав и количество почвенных микроорганизмов и т.д. [2–4]. Свободные и связанные аминокислоты растворенного органического вещества (РОВ) являются биохимически активными соединениями. Их количество, с одной стороны, зависит от ферментативного (протеолитического) разложения органического вещества почвы, а с другой – от переработки аминокислот в NH 4 микроорганизмами [5]. Согласно рабочей гипотезе, мышьяковое загрязнение может привести к изменению состава или содержания аминокислот РОВ. Изменение состава свободных аминокислот, в свою очередь, может оказать воздействие на азотное питание растений и микроорганизмов [6].
Цель работы. Установить влияние различных доз мышьяка на количественное содержание и качественный состав свободных и связанных аминокислот РОВ темно-серой лесной почвы. Мышьяк в почву вносился в виде водного раствора арсената (V) натрия, так как арсенаты являются одной из самых распространенных форм нахождения элемента в почвах [7].
Материалы и методы исследований. В качестве объекта исследования использовали верхний горизонт темно-серой лесной почвы на делювиальных суглинках. Образцы имели следующие характеристики: содержание органического углерода – 4,8 %; содержание валового азота – 0,42 %; рН – 6,0; сумма фракций размерностью <0,01 мм – 34 %; содержание мышьяка – 3,4 мг/кг.
Воздушно-сухие образцы почвы (20 г) насыщались водными растворами Na 3 AsO 4* 12H2O различных концентраций так, чтобы содержание мышьяка в пробах составило 0, 5, 50, 200, 1200, 4000 мг/кг. Затем пробы доводились бидистиллированной стерильной водой до 60–70 % от полной влагоемкости и инкубировались 10 дней при постоянной влажности при 28°С [4]. После инкубационного периода для извлечения растворенного органического вещества брали навески почвы 2 г, приливали 20 мл бидистиллированной воды и экстрагировали на ротаторе в течение 30 минут. Затем суспензии фильтровали через бумажный складчатый фильтр и мембранный фильтр с диаметром пор 0,2 мкм.
Для определения аминокислотного состава почвы навески 0,2 г гидролизовали 6н HCl в герметичных сосудах в течение 4 часов при 145°С по методу, описанному в работе [8].
В состав РОВ входят как связанные в полипептиды, так и свободные аминокислоты. Содержание свободных аминокислот РОВ определяли в водных вытяжках без стадии гидролиза. Суммарное содержание аминокислот РОВ (свободные+связанные) определяли в гидролизатах сухого остатка водной вытяжки. Для этого фильтрат водной вытяжки объемом 1 мл выпаривали под вакуумом при 60°С. К сухому остатку добавляли 500 мкл 6н HCl и гидролизовали вышеописанным способом. Содержание связанных аминокислот РОВ определяли по формуле: связанные аминокислоты = аминокислоты РОВ – свободные аминокислоты.
Содержание аминокислот в вытяжках и гидролизатах определяли методом высокоэффективной жидкостной хроматографии с модификацией аминокислот фенилизотиоцианатом, как указано в работе [9].
Статистическая обработка результатов выполнена с помощью программы Statistica. Данные в тексте и на диаграммах представлены как среднее ± стандартное отклонение (n=2; p<0,05). Корреляционный анализ проводился по Спирмену. Значимость различий между вариантами определяли с помощью теста ANOVA при p<0,05.
Результаты и их обсуждение. Аминокислоты органического вещества почвы являются источником и резервом свободных аминокислот и связанных аминокислот РОВ [10]. В результате анализа гидролизата в изучаемой темно-серой лесной почве обнаружено 16 аминокислот, суммарное содержание которых составило 2,3±0,1 г/кг. Значительная часть аминокислотного фонда представлена глицином (33,6±1,2%), аланином и пролином (Ala+Pro 11,1±0,9%), аспарагиновой кислотой (9,7±0,2%), серином (8,2±0,4%) и глутаминовой кислотой (6,3±0,1%). Следует учитывать, что при гидролизе данным способом (обработка 6н HCl в течение 4 часов при 145°С) часть аминокислот разрушается. Теряется около 40–47 % серина, 14–15 % изолейцина и лейцина, 25 % аспарагина и треонина, 20 % тирозина. Триптофан при таком способе гидролиза разрушается полностью [8].
Доля азота аминокислот в азотном фонде почвы составила 54±0,7 %. Для сравнения, доля азота гидролизуемых аминокислот в большинстве почв варьирует от 20 до 54 % [10–13]. Наши результаты совпадают с работой [13]. Обработка почвы 6н HCl не разрушает белковые структуры полностью, и в почвенном гумусе всегда остается негидролизуемый остаток. Кроме того, часть белковых образований (около 10%) и аминокислот находится в кремниевых структурах и высвобождается лишь после обработки HF [13].
В данном опыте инкубация почвы проводилась в наиболее благоприятных для развития микроорганизмов условиях. Микробиологическая активность в таких почвах обычно намного выше, чем в полевых условиях. Так, в почвах, загрязненных мышьяком, с одной стороны, идет стимуляция жизнедеятельности сообщества микробов, а с другой стороны – влияние одного из самых токсичных элементов. Так как содержание свободных и связанных аминокислот во многом зависит от деятельности микроорганизмов, в данных условиях под влиянием мышьяка их содержание заметно изменяется в зависимости от дозы (рис., табл.).
Содержание аминокислот и разность с контрольным значением (n=2, p<0,05) при различных дозах As(V)
|
Доза As(V), мг/кг |
Суммарное содержание аминокислот |
Стандартное отклонение |
Разность с контролем |
|
Свободные аминокислоты РОВ |
|||
|
0 (контроль) |
68,6 |
5,1 |
- |
|
5 |
129,4 |
13,3 |
-62,2* |
|
50 |
160,6 |
10,9 |
-93,0* |
|
200 |
240,2 |
53,7 |
-172,6* |
|
1200 |
164,9 |
12,5 |
-97,3* |
|
4000 |
53,0 |
7,5 |
14,5 |
|
НСР |
- |
- |
58,0 |
|
Связанные аминокислоты РОВ |
|||
|
0 (контроль) |
106,9 |
13,9 |
- |
|
5 |
186,7 |
28,1 |
-79,7 |
|
50 |
401,4 |
46,2 |
-294,4* |
|
200 |
527,5 |
93,4 |
-420,5* |
|
1200 |
142,5 |
26,9 |
-35,5 |
|
4000 |
369,9 |
34,4 |
-263,0* |
|
НСР |
- |
- |
117,1 |
Примечание. НСР – наименьшая существенная разница; * – статистически значимые разли- чия.
600 [-я
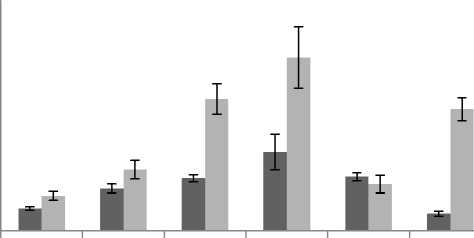
конт 5 50 200 1200 4000
As, мг/кг свободные связанные
Суммарное содержание свободных и связанных аминокислот (ССА) РОВ при различных дозах арсената As(V)
Сумма свободных аминокислот (ССА) в контрольной пробе составила 68,6±5,1 мкг/кг. При 5 мг/кг As(V) значение ССА возрастает до 129,4±13,3 мкг/кг. Максимальная концентрация аминокислот составляет 240,2±53,7 мкг/кг при 200 мг/кг As(V). При 1200 и 4000 мг/кг As(V) содержание аминокислот значительно снижается по сравнению с максимумом и составляет 164,9±12,5 и 53,0±7,5 мкг/кг соответственно, причем при 4000 мг/кг ССА не отличается от контрольного образца.
Содержание связанных аминокислот РОВ изменяется в диапазоне от 106,9±13,9 до 527,5± 93,4 мкг/кг. Их содержание, так же как и свободных, увеличивается при дозах As(V) 50, 200 мг/кг. Максимальное значение 527,5±107,5 мкг/кг достигается при дозе мышьяка 200 мг/кг. При дозе арсената 1200 мг/кг содержание связанных аминокислот РОВ совпадает с контрольным значением, а при 4000 мг/кг As(V) снова увеличивается и составляет 369,9±43,1 мкг/кг.
Качественный состав аминокислот во всех испытуемых вариантах оставался неизменным. Всего было обнаружено 16 свободных аминокислот.
Качественный состав аминокислот не зависел от воздействия различных концентраций мышьяка на жизнедеятельность почвенных микроорганизмов, а определялся только генезисом органического вещества данной почвы.
Вне зависимости от дозы As(V), в образцах профиль свободных и связанных аминокислот РОВ, как и в контрольном образце, главным образом представлен глицином и серином. Для свободных аминокислот их содержание находилось в диапазоне от 26,0 до 31,6 % и от 20,8 до 24,3 % соответственно от ССА, для связанных аминокислот варьировало от 34,9 до 42,1 % и от 7,8 до 29,8 % соответственно. Содержание свободных и связанных аминокислот не имеет достоверной линейной корреляционной связи с дозами арсената (r=0,06 и 0,41 соответственно при n=12).
Выводы. Таким образом, инкубирование почвы с различными дозами As(V) в наиболее благоприятных для микроорганизмов условиях не привело к изменению качественного состава свободных и связанных аминокислот РОВ почвы. В целом загрязнение почвы арсенатом привело к накоплению свободных и связанных аминокислот РОВ. Их содержание нелинейно изменялось в зависимости от дозы As(V).
Список литературы Влияние арсената (V) натрия на содержание свободных и связанных аминокислот растворенного органического вещества почвы
- Ghosh A.K., Bhattacharyya P., Pal R. Effect of arsenic contamination on microbial biomass and its activities in arsenic contaminated soils of Gangetic West Bengal, India//Environ. Int. -2004. -V. 30, № 4. -P. 491-499.
- Lorenz N., Hintemann T., Kramarewa T. Response of microbial activity and microbial community composition in soils to long-term arsenic and cadmium exposure//Soil Biol. Biochem. -2006. -V. 38. -P. 1430-1437.
- Das S., Jean J.-S., Kar S. Effect of arsenic contamination on bacterial and fungal biomass and enzyme activities in tropical arsenic-contaminated soils//Biol. Fertil. Soils. -2013. -V. 49. -P. 757-765.
- Prasad P., George J., Masto R.E. Evaluation of microbial biomass and activity in different soils exposed to increasing level of arsenic pollution: a laboratory study//Soil Sediment. Contam. -2013. -V. 22. -P. 483-497.
- Полуэктов Р.А. Описание процесса аммонификации в рамках модели трансформации углерода и азота в почве//Проблемы агрохимии и экологии -2011. -№ 4. -С. 25-28.
- Jamtgard S. The occurrence of amino acids in agricultural soil and their uptake by plants: doctoral thesis -Umea, 2010. -52 p.
- Moreno-Jimenez E., Esteban E., Penalosa J.M. The fate of arsenic in soil-plant systems//Rev. Environ. Contam. Toxicol. -2012. -V. 215. -P. 1-37.
- Adebiyi A.P., Jin D.-H., Ogawa T. Acid hydrolysis of protein in microcapillary tube for recovery of tryptophan//Biosci. Biotechnol. Biochem. -2005. -V. 69. -P. 255-257.
- Okunev R.V., Grigoryan B.R., Sharipova A.I. Determination of free proteinogenic amino acids in soil solutions by HPLC with phenyl isothiocyanate derivatization//J. of Siberian Federal University. Chemistry. -2014. -V.7, № 4. -P. 480-486.
- Friedel J.K., Dcheller E. Composition of hydrolysable amino acids in soil organic matter and soil microbial biomass//Soil Biol. Biochem. -2002. -V.34. -P. 315-325.
- Senwo Z.N., Tabatabai M.A. Amino acid composition of soil organic matter//Biol. Fertil. Soils. -1998. -V. 26. -P. 235-242.
- Мошкина Е.В. Азотные соединения в почвах Северо-Запада России и динамика их под влиянием антропогенного воздействия: на примере Карелии: дис.. канд. с.-х. наук: 03.00.27. -Петрозаводск, 2009. -173 с.
- Schnitzer M., Hindle D.A. Effects of different methods of acid hydrolysis on the nitrogen distribution in two soils//Plant and Soil. -1981. -V. 60. -P. 237-243.


