Влияние АТФ на белковый состав нервного волокна в процессе регенерации
Автор: Новожилова О.С., Степушкина О.Г.
Журнал: Огарёв-online @ogarev-online
Статья в выпуске: 8 т.6, 2018 года.
Бесплатный доступ
Проведено исследование влияния АТФ на белковый состав миелиновой фракции и фракции осевых цилиндров (аксонов) периферического нерва при повреждении. Установлена зависимость белкового состава при введении АТФ. Наличие выявленных белков указывает на процесс регенерации нерва, а увеличение их концентрации - на действие АТФ на процессы синтеза белков.
Аксон, атф, белки, глия, миелин, нервное волокно, повреждение, регенерация
Короткий адрес: https://sciup.org/147249624
IDR: 147249624 | УДК: 577.122:611.018.28
Текст научной статьи Влияние АТФ на белковый состав нервного волокна в процессе регенерации
В последнее время одной из первостепенных задач неврологии является исследование заболеваний периферической нервной системы. Регенерация периферических нервов, восстановление функций поврежденных тканей и органов имеет немалый клинический интерес [2].
В регенерации нерва, в частности аксона, непосредственное участие принимают шванновские клетки [3]. После повреждения травмированные нейроны должны перейти от режима передачи к режиму роста и начать продуцировать белки, имеющие потенциал для стимуляции регенерации [10]. При повреждении нерва АТФ быстро высвобождается, что способствует активации ряда сигнальных путей, которые приводят к активации клеток глии и к восстановлению функций нерва [9]. Так же АТФ участвует в активации лизосомального экзоцитоза, способствующего последующей активной регенерации нерва [10; 11]. Высокая концентрация внеклеточного АТФ ингибирует деградацию аксонов [11].
Целью исследования явлсяется изучение влияния АТФ на белковый состав периферического нерва в процессе регенерации.
Материал и методы исследования. Объектом исследования служили белые крысы линии Wistar обоего пола, массой 200–250 г в возрасте 3–4 месяцев. Животные содержались на стандартном рационе питания, в условиях вивария со свободным доступом к воде и пище. Материалом исследования служили седалищные нервы. Все манипуляции с животными осуществлялись в соответствии с «Правилами проведения работы с использованием экспериментальных животных» (приказ Минвуза от 13.11.1984 г. № 724). Животные были разделены на группы: контрольная группа; группа животных с перерезанным седалищным нервом, которые выводились из эксперимента через 1, 7 и 30 суток. Также животные с перерезанным седалищным нервом делились на группы, которым вводились инъекции АТФ (в концентрации 0,5 мг/кг) и животные без инъекций.
У крыс под действием хлороформного наркоза препарировали седалищный нерв на уровне средней трети бедра и перерезали его ножницами. Рану обрабатывали спиртом и зашивали. При извлечении материала животных усыпляли парами хлороформа. Выделенные нервы помещали в раствор Рингера, проводили гомогенизацию нервного волокна, в гомогенате определяли общее содержание белка методом Лоури [8]. Гомогенат разделяли на две фракции: миелиновая и осевые цилиндры [4] и проводили электрофоретическое разделение белков в ПААГе после делипидизации [6].
Результаты и их обсуждение. Установлено, что концентрация белков миелина под действием АТФ незначительно снижалась в течение 7 суток, на 30-е сутки после перерезки нерва концентрация белка увеличивалась на 21% по сравнению с контролем, что соответствует данным, полученным Морозовой А. А. [1]. Похожая картина наблюдалась во фракции осевых цилиндров: на 7-е сутки значительных изменений не наблюдалось, на 30-е сутки концентрация увеличилась на 8% по сравнению с контролем.
Полученные данные указывают на регенеративные процессы в нервном волокне. Максимальной активности они достигают к 4-й неделе после повреждения. Образуются бюнгеровы ленты, состоящие из колоний шванновских клеток, участвующих в регенеративном процессе [2]. Под действием АТФ шванновские клетки активно делятся, образуя бюнгеровы ленты и культю [9].
Электрофоретическое разделение белков миелиновой фракции седалищного нерва животных, которым вводился АТФ в течение 1, 7 и 30 суток, показало наличие в ней следующих миелин-специфических белков: MAG – миелин-ассоциированный белок; CNP – циклическая нуклеотидфосфодиэстераза; PLP – протеолипидный белок; P0 – нулевой белок; PMP22 – периферический миелиновый белок 22; МВР – основной белок миелина; липофилин (рисунок 1).
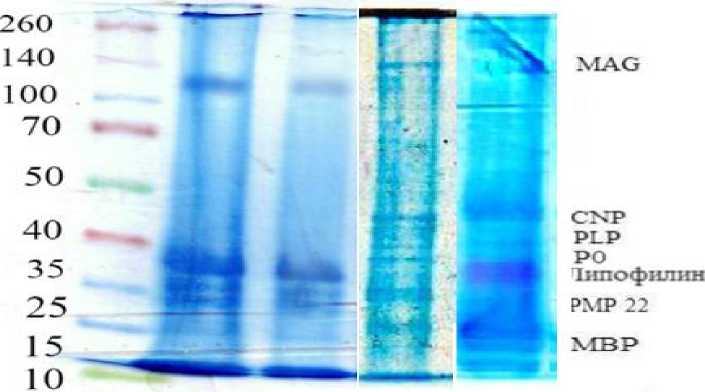
Контроль 1 сутки 7 сую к 30 суток
Рис. 1. Электрофореграмма миелин-специфических белков при перерезке нерва и после введения АТФ в течение 1, 7 и 30 суток.
При разделении белков миелиновой фракции опытных образцов после введения препарата через сутки на электрофореграмме были обнаружены те же белки, что и в контроле. Интенсивность полос ниже в сравнении с контрольной группой, что говорит о понижении концентрации белков.
При разделении белков миелиновой фракции опытных образцов после введения АТФ в течение 7 суток были обнаружены те же белки, что и в контроле. Стали видны 2 белка, связанные с регенерацией нервного волокна – P0 и PMP22. При введении АТФ их интенсивность увеличивалась в сравнении с образцами без введения вещества, что указывает на увеличение концентрации белков.
Через 30 суток после введения АТФ новые белки не обнаружены. Интенсивность белковых полос значительно увеличивалась по сравнению с контролем и данными, полученными через 7 суток и через сутки после перерезки, что говорит об увеличении в нерве содержания миелин-специфических белков, участвующих в процессах регенерации нервного волокна. Полученные данные согласуются с данными Ceballos D. et. al., согласно которым увеличение уровня миелин-специфических белков способствует процессам регенерации [5].
При электрофорезе белков фракции осевых цилиндров после введения АТФ в течение суток были обнаружены следующие белки: GAP-43, GP 350, тубулин, периферин, PGP 9.5, нейрофиламенты и SCG10 (рисунок 2).

Рис. 2. Электрофореграмма белков фракции осевых цилиндров при перерезке нерва и после введения АТФ в течение 1, 7 и 30 суток.
Интенсивность полос опытных образцов в сравнении с контролем стала ниже, что говорит о снижении концентрации белков осевых цилиндров.
Интенсивность белковых полос осевых цилиндров снижалась в сравнении с контролем в течение первых суток. На 7-е сутки интенсивность полос также снижалась по сравнению с контролем, новые белки не идентифицированы.
На электрофореграмме опытных образцов после повреждения через 30 суток видны те же белки фракции осевых цилиндров, что и в контроле, но полосы более интенсивные, что говорит об увеличении концентрации данных белков, необходимых в процессе регенерации. Белки Р0, РМР играют непосредственную роль в регенерации нервного волокна [1]. Изменений в качественном составе белков под действием АТФ отмечено не было.
В ходе проведения электрофореза было замечено, что в образцах проксимальной части нерва интенсивность полос уменьшалась в течение первой недели, к 30 суткам интенсивность полос увеличивалась в сравнении с контролем или же становилась такой же интенсивности. У опытной группы животных, которой вводили препарат АТФ, также было замечено, что в течение первой недели интенсивность белковых полос снижалась в сравнении с контролем, но по сравнению с опытными образцами полосы более интенсивные. К 30 суткам полосы по интенсивности превосходили и контроль, и опытные образцы без АТФ.
В процессе регенерации нервного волокна задействованы различные белки. Некоторые из них были зарегистрированы как в миелиновой фракции, так и во фракции осевых цилиндров. Белки миелиновой фракции: GAP-43 – белок, участвующий в регенерации аксона [1]; PGP 9.5 является маркером регенерации; Р 0 , формирующий миелин;
PMP22. Белки фракции осевых цилиндров: CNPаза, инициирующая сборку микротрубочек [7]; ПМБ 2, стабилизирующий мембраны миелина [1]; периферин; SCG10, запускающий процесс регенерации. Наличие данных белков указывает на процесс регенерации, а увеличение их концентрации – на действие АТФ в процессах их синтеза.


