Влияние бактерии Salinicola socius SMB35T на рост озимого рапса при низкой положи-тельной температуре
Автор: Ананьина Л.Н., Шестакова Е.А., Старцева А.В., Горбунов А.А.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2025 года.
Бесплатный доступ
В настоящем исследовании выявлена способность штамма Salinicola socius SMB35T синтезировать фитогормон – индол-3-уксусную кислоту. Продукция фитогормона зависела от фазы роста бактерии. Изучено влияние инокуляции семян ауксинсинтезирующей бактерией S. socius SMB35T на рост и холодоустойчивость озимого рапса в условиях in vitro. Установлено, что эффект являлся дозозависимым: применение 40 мг биомассы бактерии для обработки 1 г семян значительно снижало высоту побегов, отмечена тенденция к снижению длины корней, в то время как использование бактериальных клеток в концентрации в 2 раза ниже нивелировало негативный эффект и формировало тенденцию к увеличению средних показателей длины корней и высоты побегов. Исследовано действие бактериальной обработки семян на рост рапса (всхожесть и биомассу) при стрессе, вызванном низкой положительной температурой. Показано, что в условиях холода инокуляция семян ростостимулирующей концентрацией бактерии приводила к увеличению всхожести семян на 13.3% и биомассы проростков на 15.1%. Однако применение штамма S. socius SMB35T не вызвало увеличения количества осмолитов, таких как сахароза и пролин, в проростках рапса. Напротив, обнаружено значимое снижение содержания сахарозы на 35.5%. Полученные результаты свидетельствуют о других механизмах взаимодействия бактерии и растения, приведших к увеличению устойчивости к холоду растений на раннем этапе развития. Экспериментально подтверждено, что определение концентрационной специфичности и последующее изучение альтернативных молекулярных механизмов взаимодействия бактерий с растениями являются ключевыми факторами для разработки эффективных микробных препаратов.
Brassica napus L., Salinicola socius, индол-3-уксусная кислота, холод, низкая температура
Короткий адрес: https://sciup.org/147252647
IDR: 147252647 | УДК: 579.64 | DOI: 10.17072/1994-9952-2025-4-396-405
Текст научной статьи Влияние бактерии Salinicola socius SMB35T на рост озимого рапса при низкой положи-тельной температуре
Успешная перезимовка озимого рапса напрямую связана с достижением растениями оптимального физиологического состояния до наступления зимы [Горлов, Бушнев, Асхадуллин, 2009; Бородько, 2020; Пилюк, 2020; Ториков и др., 2022; Фетюхин, Ахмадов, Алиев, 2023]. Ключевую роль в помощи растениям для преодоления абиотических стрессов, в том числе холода, играют ризосферные бактерии, стимулирующие рост растений (PGPB – Plant Growth-Promoting Bacteria). Большинство этих бактерий обладают способностью улучшать характеристики роста и урожайность в естественных условиях, осуществляя азотфиксацию, синтезируя фитогормоны, а также увеличивая доступность питательных веществ у многих растений, проводя дезаминирование молекулы-предшественника фитогормона этилена, накопление которого в корневой ткани, как известно, вредно для роста и развития корней [Glick, Penrose, Jiping, 1998; Максимов и др., 2015], индуцируя системную устойчивость растений к патогенным микроорганизмам [Lavania et al., 2006] и антагонизм по отношению к вредным микроорганизмам [Singh et al., 2010; ALKahtani et al., 2020]. В связи с этим обработка семенного материала перед посевом биологическими препаратами является перспективным приемом повышения устойчивости растений озимых культур к неблагоприятным условиям зимнего периода [Горьков, 2019; Березнов, Астарханова, Шаповал, 2022; Старцева, Акманаев, Майсак, 2024].
Одними из представителей группы PGPB являются бактерии рода Salinicola. В наземных биотопах бактерии рода Salinicola являются типичными компонентами микробиомов галофитов и населяют в том числе ткани надземных и подземных органов растений. Представители этого рода влияют на рост и развитие растений, разрушая токсичные органические соединения, увеличивая доступность минеральных компонентов, модулируя выработку или деградацию фитогормонов, а также подавляя патогены или поставляя растениям органические соединения, способствующие солеустойчивости [Plotnikova et al., 2020].
Цель исследования – оценить влияние бактерии Salinicola socius SMB35T на ростовые показатели озимого рапса в опытах in vitro .
Материалы и методы исследования
Объект исследования . В работе использовали штамм S. socius SMB35T. В качестве тестового объекта выбрали озимый рапс ( Brassica napus L.) сорта ‘Северянин’ категории «первая репродукция» (РС1). Семена рапса предоставлены Пермским НИИСХ.
Среды и условия культивирования бактерии. Штамм бактерии хранили на плотной богатой питательной среде Раймонда [Plotnikova et al., 2011], содержащей хлорид натрия в концентрации 3%. Дальнейшие эксперименты проводили с использованием жидкой минеральной среды Раймонда (МСР) [Plotnikova et al., 2011]. В МСР добавляли хлорид натрия до концентрации 5%. Источником углерода и энергии в МСР служила глюкоза в конечной концентрации 1 г/л. Культивирование проводили в течение 24 ч при 25ºС на роторной качалке со скоростью вращения 100 об/мин. Далее биомассу собирали, центрифу- гируя суспензию клеток при 10 000 х g в течение 10 мин в условиях комнатной температуры. Культуральную жидкость сливали.
Изучение роста бактерии в условиях низкой температуры . Культивирование бактерии осуществляли на агаризованной МСР [Plotnikova et al., 2011], содержащей 2% хлорида натрия и глюкозу в конечной концентрации 1 г/л. Инокулятом служила культура, выращенная до стационарной фазы в жидкой МСР с тем же количеством хлорида натрия и ростового субстрата. Биомассу на плотную питательную среду наносили штрихом микробиологической петлей. Рост при температуре 5oC оценивали каждые седьмые сутки.
Детекция индол-3-уксусной кислоты . Штамм S. socius SMB35T выращивали в 1% триптоновом бульоне как с добавлением триптофана (150 мг/л), так и без него. Предварительно среду разливали в колбы по 20 мл, автоклавировали при 0.5 АТМ в течение 30 мин. Затем вносили бактерию и инкубировали в течение 2 сут. Из полученной суспензии отбирали 1.5 мл и центрифугировали при 10 000 х g в течение 2 мин. Определение индол-3-уксусной кислоты (ИУК) проводили в 1.5 мл супернатанта согласно методике, описанной Glickmann, Dessaux [1995]. Пробирки инкубировали в темноте при комнатной температуре в течение 30 мин. Развитие розовой окраски свидетельствовало о присутствии ИУК. В качестве отрицательного контроля использовали среду без добавления бактерии.
Обработка семян рапса бактерией . Семена стерилизовали, сначала помещая на 15 мин в 3% раствор перекиси водорода, затем выдерживая в течение 15 мин в 1% растворе перманганата калия. На следующем этапе семена отмывали дистиллированной водой до получения прозрачного раствора. Как правило, инокуляцию семян проводят, выдерживая их в суспензии клеток бактерии. Однако концентрация хлорида натрия в среде культивирования бактерии является слишком высокой для растений. В связи с этим обработку осуществляли сырой биомассой бактерии. К 40 или 20 мг сырой биомассы бактерии добавляли 1 г стерилизованных семян озимого рапса. Выдерживали в течение 30 мин, периодически встряхивая для распределения бактерий по семенам.
Условия культивирования растений . Эксперименты проводили в чашках Петри. 25 семян рапса помещали на фильтровальную бумагу, предварительно увлажненную 5 мл дистиллированной воды. Инкубирование проводили в темноте при 25ºС или 5oС. В ходе эксперимента дистиллированную воду добавляли порциями по 1 мл с разной периодичностью в зависимости от температуры: при 25°C – каждые третьи сутки, а при 5°C – каждые седьмые сутки. Всхожесть, высоту побегов и длину корней определяли на седьмые сутки культивирования. Сырую массу (СМ) проростков определяли через 14 дней. Для этого проростки промокали фильтровальной бумагой, затем взвешивали.
Подготовка экстрактов из проростков растений . Проростки, отобранные из одной чашки, промывали 3 раза дистиллированной водой, затем растирали с кварцевым песком. К полученной суспензии добавляли 80% раствор этанола. Экстракцию проводили в течение 2 ч на встряхивателе АВ 30-С (Россия) при комнатной температуре. Остатки клеток и кварцевый песок осаждали, центрифугируя при 10 000 х g в течение 3 мин. Раствор отбирали. Экстракт упаривали при температуре 45oС.
Спектроскопия протонного магнитного резонанса . Определение осмолитов проводили с помощью спектроскопии протонного магнитного резонанса на приборе Bruker Avance Neo 400 (400 МГц). При записи спектров ЯМР 1Н использовали 30-градусные импульсы, релаксационная задержка составляла 1 с, ширина спектрального окна была равна 5.9 кГц. Данные обрабатывали с помощью программного обеспечения Topspin, версия 4.0.8 (Bruker Corporation, США). Высушенный осадок этанольного экстракта растворяли в 0.50 мл D 2 O (ООО «Кемикал Лайн», Россия). Спектр предварительно записывали с 8 накоплениями, затем в пробу вносили внутренний стандарт, серную кислоту и записывали спектр с 64 накоплениями, который использовали для количественных расчетов. 0.7‒1.0 мг серной кислоты вносили с целью смещения химических сдвигов пролина в слабое поле, в область, свободную от сигналов других веществ. Химические сдвиги (δ) указывали в миллионных долях (м.д.) и измеряли относительно сигнала HDO (4.71 м.д.). В качестве внутреннего стандарта использовали малеиновую кислоту, после подкисления имеющую сигнал при 6.32‒6.35 м.д. Идентификацию сигналов в спектре проводили добавлением в исследуемые растворы коммерческих препаратов соответствующих соединений. Химические сдвиги пиков, использованных для интегрирования, составили 4.14 м.д. для пролина (α-CH, дублет дублетов) и 5.40 м.д. – для сахарозы (аномерный протон, дублет). Количества соединений рассчитывали путем сравнения площади пика соединения с площадью пика внутреннего стандарта [Nagata et al., 1996].
Поиск генов в геноме S. socius SMB35T . Поиск генов, кодирующих ферменты синтеза ИУК, осуществляли в геноме S. socius SMB35T, депонированном в Genbank под номером PRJNA357614.
Статистическая обработка результатов . Оценку статистической достоверности различий средних значений проводили с использованием t-критерия Стьюдента в Microsoft Office Excel 2003.
Результаты и их обсуждение
Штамм S. socius SMB35T проверили на способность синтезировать ИУК. Для этого бактерию выращивали в 1% триптоновом бульоне с добавлением триптофана. Детекцию ИУК проводили, отбирая образцы клеточной суспензии через 5, 24 и 48 ч культивирования. Добавление реактива Сальковского спустя 5 ч культивирования не привело к изменению цвета культуральной жидкости. После внесения реактива Сальковского в суточную культуру было отмечено изменение цвета культуральной жидкости на розовый, это свидетельствовало о наличии в среде гетероауксина. Спустя 48 ч культивирования также фиксировали положительный результат после добавления реактива. Кроме того, изучена способность исследованного штамма синтезировать ауксин в 1%-ном триптоновом бульоне без дополнительного внесения триптофана. Спустя 48 ч инкубирования в культуральную жидкость добавили реактив Сальковско-го, что привело к развитию розового окрашивания раствора. Зависимость синтеза ИУК от фазы роста описана для представителей разных таксонов прокариот. У большинства из них, за исключением штаммов рода Pseudomonas , максимальное количество этого соединения было обнаружено в стационарной фазе роста [Мирзоева, Широких, 2010]. В геноме штамма S. socius SMB35T осуществлен поиск генов, ассоциированных с синтезом ауксинов. В настоящей работе гены, продукты которых идентифицированы как ферменты синтеза гетероауксина, в геноме бактерии S. socius SMB35T не выявлены. Представители многих видов рода Salinicola , например, S. halimionae, S. aestuarinus, S. endophyticus, S. halophyticus, S. lusitanus и S. salarius , в том числе штаммы вида S. socius , продуцируют гормон ИУК [Fidalgo et al., 2019; Lavanya, Deepika, Sridevi, 2023]. Однако, несмотря на это, конкретные метаболические пути, обеспечивающие выработку ИУК, как и гены, кодирующие ферменты его синтеза, у представителей этого рода до сих пор не описаны. Между тем, в геноме исследованного штамма присутствовал ген, продукт которого осуществляет экскрецию гетероауксина из клетки (GenBank №OLO06226), что также косвенно подтверждает способность бактерии синтезировать ИУК.
Влияние инокуляции семян бактерией S. socius SMB35T на рост озимого рапса . В данной работе изучили влияние разного количества бактерии S. socius SMB35T на морфометрические показатели проростков озимого рапса при оптимальной температуре, соответствующей 25oС (табл. 1).
Таблица 1
Влияние инокуляции семян бактерией S. socius SMB35T на рост озимого рапса при оптимальной температуре
[The effect of seed inoculation with S. socius SMB35T on the growth of winter rapeseed at optimal temperature]
|
Вариант эксперимента |
Параметр |
|||
|
Высота стеблей, мм |
Длина корней, мм |
Мин-Макс высота стеблей, мм |
Мин-Макс длина корней, мм |
|
40 мг бактериальной биомассы/г семян
|
Контроль |
29.4±10.0 |
44.2±35.9 |
3‒50 |
5‒120 |
|
Семена, обработанные бактерией |
23.5±11.0* |
37.9±31.8 |
3‒50 |
3‒110 |
20 мг бактериальной биомассы/г семян
|
Контроль |
37.4±14.3 |
44.3±36.9 |
5‒75 |
2‒125 |
|
Семена, обработанные бактерией |
40.2±13.9 |
48.9±38.8 |
15‒80 |
4‒135 |
Примечание: * –различия достоверны при р < 0.01. Три биологических повторности.
Для этого использовали 20 или 40 мг сырой бактериальной биомассы для обработки 1 г семян. Показано, что действие бактерии зависело от количества биомассы. Так, использование 40 мг биомассы значительно снижало высоту побегов, отмечен тренд к уменьшению длины корней (табл. 1). Помимо этого, значения минимальной и максимальной величин корней у проростков, выросших из инокулированных бактерией семян, были ниже, чем в контрольной группе (табл. 1), в то время как снижение количества биомассы бактерии до 20 мг в обработке семян нивелировало негативный эффект. Более того, хотя достоверно значимого различия высоты побегов и длины корней между проростками, выросшими из обработанных бактерией семян, и контролем не получено, очевидна тенденция на увеличение этих показателей в опытной группе (табл. 1). Кроме того, у инокулированных бактерией проростков наблюдалось возрастание минимальных и максимальных значений высоты побегов и длины корней по сравнению с контролем (табл. 1), что указывает на стимуляцию роста. Опираясь на полученные данные, в последующих экспериментах использовали 20 мг биомассы штамма S. socius SMB35T.
Таким образом, характер действия бактерий на рост растений напрямую зависит от их концентрации. Оптимальные концентрации способствуют развитию растений, стимулируя, в частности, рост корней и побегов, вероятно, посредством синтеза фитогормонов. В то же время превышение концентрации может привести к гормональным нарушениям, вызывая угнетение корнеобразования, морфологические аномалии и гибель растений [Li et al., 2022; dos Santos et al., 2022; Васильев и др., 2025].
Влияние инокуляции семян бактерией S. socius SMB35T на всхожесть и биомассу проростков озимого рапса при низкой положительной температуре . Инкубирование штамма S. socius SMB35Т в течение длительного периода (мес.) позволило выявить его способность к росту при температуре 5°С. В конце третьей недели культивирования на плотной МСР штамм формировал в основании штриха множество мелких колоний диаметром менее 1 мм. В связи с тем, что исследованный штамм сохраняет физиологическую активность при низкой температуре, исследовали его влияние на рост озимого рапса в условиях холода. Семена озимого рапса обработали бактерией и культивировали в течение 2 недель в темноте при температуре 5oС. В контрольной и опытной группах параметры всхожести семян отличались. Отмечено увеличение всхожести инокулированных бактерией семян на 13.3% (табл. 2). В конце эксперимента оценка сырой биомассы проростков показала ее возрастание на 15.1% в опытной группе.
Таблица 2
Всхожесть семян и биомасса проростков озимого рапса при низкой положительной температуре [Germination and biomass of winter rapeseed at low positive temperature]
|
Вариант эксперимента |
Всхожесть, % |
Изменение биомассы относительно контроля, % |
|
Контроль |
43.3±13.0 |
100 ± 13.3 |
|
Опыт |
56.6±13.3* |
115.1±20.3* |
Примечание: * ‒ различия достоверны при р < 0.05. Три независимых эксперимента в 3-х биологических повторностях.
Холодовой стресс сопровождается обезвоживанием, повышением осмотического давления, а также окислительным стрессом. Это приводит к повреждению мембран и ДНК, денатурации белков. Осмолиты в значительной степени снижают негативное действие стрессовых факторов на макромолекулы и компоненты клеток. Известно, что в адаптации растений к низким температурам немаловажную роль играют низкомолекулярные органические соединения, такие как сахара и аминокислоты, в частности сахароза и пролин [Moieni-Korbekandi, Karimzadeh, Sharifi, 2014; Jankovska-Bortсevič et al., 2019; Lei et al., 2019]. Поэтому было исследовано влияние бактерии на синтез клетками растений этих соединений. Сравнение внутриклеточных количеств сахарозы и пролина в проростках из семян, обработанных клетками S. socius SMB35T, и проростках из контрольной группы выявило достоверно значимое снижение количества сахарозы на 35.5% в проростках опытной группы (см. рисунок). В меньшей степени изменилось содержание пролина. Отмечена тенденция к снижению его количества на 13.4% в проростках из семян, обработанных бактерией. Как правило, у инокулированных бактерией растений значительно повышался уровень пролина, но на более поздних стадиях роста [Barka et al., 2006; Mishra et al., 2009].
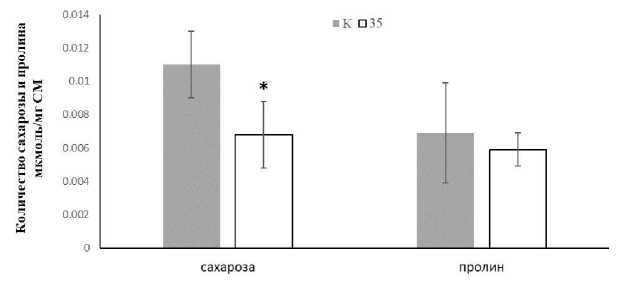
Влияние инокуляции семян бактерией S. socius SMB35T на аккумуляцию осмолитов проростками рапса при низкой положительной температуре:
К – проростки из семян, необработанных бактерией, 35 – проростки из семян, обработанных бактерией,
* ‒ различия достоверны при р < 0.01. Три независимых эксперимента в 3-х биологических повторностях
[The effect of seed inoculation with S. socius SMB35T on the accumulation of osmolytes by rapeseed seedlings at low positive temperatures:
K – seedlings from seeds untreated with the bacterium, 35 – seedlings from seeds treated with the bacterium, * ‒ the differences are significant at p < 0.01. Three independent experiments in 3 biological replications]
Между тем, к снижению количества пролина в клетках растений в условиях холодового стресса может приводить предварительная обработка ауксинами [Jankauskienė et al., 2022]. В некоторых случаях ауксины могут ингибировать процессы, приводящие к накоплению сахарозы [Tao et al., 2022]. По-видимому, это связано с развитием метаболических изменений, способствующих повышению холодоустойчивости за счет других механизмов. Так, было показано, что ауксины содействуют холодовой акклиматизации, увеличивая выработку дегидринов (термостабильных гидрофильных белков), а также модулируя состав и количество полиаминов, снижая содержание малонового диальдегида и перекиси водорода [Jankauskienė et al., 2022; Jankovska-Bortkevič et al., 2023]. Малоновый диальдегид служит основным маркером перекисного окисления липидов и конечным продуктом повреждения жирных кислот, в то время как перекись водорода сама по себе является свободным радикалом, который генерирует другие более опасные свободные радикалы и участвует в оксидативном повреждении клеток.
Поскольку пролин и сахароза играют важную роль в борьбе растений с окислительным стрессом, действуя как эффективные антиоксиданты, удаляя активные формы кислорода и стабилизируя клеточные компоненты, такие как мембраны и белки [Hayat et al., 2012], спад их количества может быть следствием снижения негативного действия окислительного стресса, вызванного низкой температурой.
Растительный гормон гетероауксин является одним из ключевых регуляторов роста и развития растений, занимая ключевое место, обеспечивая интеграцию сигналов абиотического стресса и контроле последующих реакций [Musazade, Mrisho., Fen, 2025]. В условиях холода уровень синтеза ИУК снижается и нарушается его транспорт между клетками. Это обусловлено, в том числе, нарушением работы PIN-белков, которые играют ключевую роль в базипетальном транспорте гетероауксина [Zhu et al., 2015]. Бактерии, продуцирующие ИУК, могут способствовать восстановлению его уровня в клетках растения, тем самым повышая устойчивость к стрессам и стимулируя рост. Это взаимодействие делает ауксинпро-дуцирующие бактерии перспективным инструментом для создания биопрепаратов, помогающих растениям справляться с неблагоприятными абиотическими факторами внешней среды.
Заключение
Проведенное исследование позволило установить существенное влияние инокуляции семян ауксин-синтезирующей бактерией S. socius SMB35T на рост озимого рапса, который носит дозозависимый характер. Полученные результаты указывают на то, что оптимальная концентрация бактериального штамма SMB35 стимулирует ключевые показатели роста, такие как длина побегов и корней. В то же время превышение оптимальной концентрации приводит к эффекту ингибирования. Применение бактериальных клеток в концентрации, стимулирующей рост, позволило добиться статистически значимого увеличения всхожести семян и биомассы проростков рапса при низкой положительной температуре. Несмотря на это, инокулирование семян бактерией S. socius SMB35T не привело к увеличению количества осмолитов (сахарозы и пролина) в проростках рапса. Таким образом, определение концентрационной специфичности взаимодействия «бактерия – растение» является важным условием для разработки эффективных и экологически безопасных микробных препаратов для сельского хозяйства. Перспективы работы видятся в продолжении исследований молекулярных аспектов взаимодействия растений с бактериями.


