Влияние биотического стресса на активность различных форм аденилатциклазы в органеллах клеток растений картофеля
Автор: Ломоватская Л.А., Романенко А.С., Криволапова Н.В., Копытчук В.н
Журнал: Журнал стресс-физиологии и биохимии @jspb
Рубрика: Original article
Статья в выпуске: 2 т.2, 2006 года.
Бесплатный доступ
Поступила в редакцию 17 апреля 2006 г. Несмотря на значительный интерес, проявляемый к изучению аденилатциклазной сигнальной системы растений, нет полного представления о функционировании и механизмах регуляции данной сигнальной системы у растений при биотическом стрессе. В связи с этим в задачу настоящего исследования входило выявление различных форм аденилатциклазы (трансмембранной и «растворимой») в ядре и хлоропластах клеток картофеля и модулирование их активности под воздействием экзополисахаридов возбудителя кольцевой гнили картофеля. Проведенные исследования позволили установить, что в ядрах и хлоропластах клеток растений картофеля функционируют две формы аденилатциклазы: трансмембранная и "растворимая". Активность данных форм фермента, выделенных из клеток растений двух сортов картофеля, контрастных по устойчивости к возбудителю кольцевой гнили Clavibacter michiganensis subsp. sepedonicus, менялась противоположным образом при опосредованном воздействии экзополисахаридов, секретируемых вирулентным и мукоидным штаммом бактериального возбудителя: у растений устойчивого сорта возрастала, восприимчивого - угнеталась. Сделан вывод о том, что активность обеих форм аденилатциклазы прямо зависит от степени устойчивости сорта картофеля к данному патогену
Картофель, аденилатциклаза
Короткий адрес: https://sciup.org/14323957
IDR: 14323957
Текст обзорной статьи Влияние биотического стресса на активность различных форм аденилатциклазы в органеллах клеток растений картофеля
Растительные организмы в природных условиях часто подвергаются воздействию неблагоприятных факторов внешней среды как абиотической так и биотической природы. В результате у растений развиваются первичные защитные механизмы, интенсивность которых в значительной степени зависит от активности путей сигнальной индукции. Одним из таких путей является аденилатциклазная сигнальная система. Несмотря на накопленные сведения, касающиеся функционирования такого сигналинга в разных условиях (Carricarte et al, 1988; Cooke et al., 1994; Bundschedler et al., 2001), нет полного представления о внутриклеточной компартментации и механизмах регуляции активности аденилатциклазной сигнальной системы у растений. До недавнего времени считалось, что аденилатциклаза (АЦ)
локализуется только на плазматической мембране, поскольку ее активность регулируется соответствующими G-белками, связанными с рецептором, воспринимающим сигнал из окружающий среды (Sunahara, Taussig, 2002). Но исследования последних лет, проведенные на животных объектах, позволили обнаружить и другую форму этого фермента - так называемую растворимую аденилатциклазу (рАЦ) (Zippin et al., 2004).
Она была выявлена в ядрах и митохондриях клеток животных и ее активность не зависела от типичных активаторов трансмембранной аденилатциклазы (тмАЦ) – ГТФ, форсколина и фторида натрия (Zippin et al., 2004). Авторы объясняют присутствие такой формы АЦ необходимостью оперативной трансдукции сигнала в генетический аппарат клетки, поскольку цАМФ - продукт реакции тмАЦ, быстро утилизируется вблизи от места его синтеза ( Rich et al., 2001; Zippin et al., 2004). По имеющимся сведениям, у растений активность аденилатциклазы выявлялась в мембранах ядер и хлоропластов (Witters et al., 2005), но не обсуждается, к какому типу АЦ относилась обнаруженная активность.
Для картофеля одним из биогенных стрессовых факторов является бактериальный возбудитель кольцевой гнили Clavibacter michiganensis subsp. sepedonicus (Spieck. et Kott.) Skaptason et Burkh, (Cms). Ранее было установлено, что инициация данного бактериоза происходит также по принципу лиганд-рецепторного взаимодействия. Со стороны Cms в этом процессе, в числе других факторов патогенности, участвуют экзополисахариды (ЭПС), а со стороны растений картофеля -рецепторы к ЭПС, локализованные в клеточных стенках и на плазмалемме (Романенко и др., 1999; Шафикова др., 2003). Было показано, что устойчивость сорта обратно пропорциональна количеству данных рецепторов: у восприимчивого сорта их примерно на порядок больше, чем у резистентного (Романенко и др., 1999). Тем не менее, пути трансдукции сигнала, в частности, с участием аденилатциклазной системы при биотических стрессах у растений, включая картофель, изучены явно недостаточно.
В этой связи в данном исследовании было поставлено две задачи. Во-первых, выяснить, какие формы АЦ присутствуют в растительной клетке, в том числе в органеллах - носителях генетической информации – в ядре и хлоропластах. Во-вторых, установить, какова реакция различных форм этого фермента, выделенных из растений двух сортов картофеля, контрастных по устойчивости к возбудителю кольцевой гнили, на биотический стресс, которым в данном случае являлись ЭПС возбудителя. Проведение такого эксперимента представлялось целесообразным, поскольку ранее было показано, что в зависимости от устойчивости сорта картофеля к Cms, его ЭПС могут оказывать как элиситорный, так и супрессорный эффект, в частности, на активность in vitro пероксидаз, участвующих в защитных реакциях (Граскова и др., 2004).
МАТЕРИАЛЫ И МЕТОДЫ
Пробирочные растения картофеля двух сортов, контрастных по устойчивости к Cms (сорт Луговской - устойчивый и сорт Лукьяновский – восприимчивый к данному возбудителю), культивировали в течение 3-4 недель на жидкой среде Мурасиге-Скуга (Murashige, Skoog, 1962) с добавками витаминов и гормонов (Бутенко и др., 1984). Экзополисахариды вирулентного и мукоидного штамма 5369 возбудителя кольцевой гнили картофеля из культурального фильтрата выделяли и очищали методом колоночной ионообменной хроматографии (Strobel, 1967).
Инкубацию растений с ЭПС Cms, добавленными к среде роста растений в конечной концентрации 0,1%, проводили в течение 1 мин. Контролем служили растения без внесения ЭПС в среду роста.
По окончании инкубации растения гомогенизировали на холоду в 50 мМ трис-НСl буфере, рН 7,2 с добавлением 0,1мМ теофиллина и 1мМ дитиотреитола («Sigma», США). Гомогенат фильтровали через два слоя капрона, фильтрат наносили на градиент плотности сорбита («Реахим», Россия) состоящий из следующих слоев: 4 М, 2,5 М, 1,5 М, 0,75 М и центрифугировали при 600 g на холоду 30 мин. Определение чистоты фракций осуществляли путем подсчета соответствующих органелл в люминесцентном микроскопе МЛ-2АУ4.2 («Ломо», Россия): хлоропласты обладали собственной ярко-красной флюоресценцией, а ядра, предварительно окрашенные 0,01% 4,6-диамидин-2-фенилиндолом (“Sigma”, США), имели голубоватое свечение. Чистота фракций, оцененная таким образом, составляла 80-85%. Далее, в каждую пробу добавляли 0,3% октилглюкопиранозида («Sigma, США) -детергента для высвобождения «растворимой» формы аденилатциклазы, и центрифугировали 3 часа при 80000 g. Реакцию инициировали внесением растительного белка (100-150 мкг/г сырой массы) в 500 мкл инкубационной среды: 50 мМ трис-НСl, рН 7,2, 0,1 мМ теофиллин, 1мМ дитиотреитол, 0,5 мМ АТФ (“Sigma”, США), 3 мМ MgSO 4 («Реахим», Россия). В некоторые пробы из осадка и из супернатанта добавляли специфические эффекторы трансмембранной и «растворимой» форм АЦ: 10мМ NaF («Реахим», Россия) для стимуляции тмАЦ (Sunahara, Taussig, 2002) а 3 мМ MnCl 2 («Реахим», Россия) или 20 мМ NaHCO 3 («Реахим», Россия) – для активации рАЦ (Zippin et al., 2004).
Пробы инкубировали при 32°С в течение 30 мин. Реакцию останавливали кипячением (3 мин) на водяной бане. Затем, для повышения специфичности иммунной реакции, образцы дополнительно очищали от присутствия других циклических нуклеотидов с помощью нейтральной окиси алюминия («Merk”, Германия) (White, Zenser,1971).
Количество цАМФ определяли иммуноферментным анализом (Lomovatskaya et al., 2005). Белок в растительной пробе определяли по методу Брэдфорд (Яворская, Калинин,1984). Эксперименты проводили в трех биологических и пяти аналитических повторностях. Результаты обрабатывали статистически с вычислением стандартной ошибки среднего (Брехман,1970).
Следует заметить, что в осадке выявлялась активность только тмАЦ, а в супернатанте – только рАЦ.
РЕЗУЛЬТАТЫ
Трансмембранная и «растворимая» формы АЦ ядер клеток растений устойчивого сорта. Было установлено, что в контрольном варианте (без добавления ЭПС Cms в среду роста растений) активность тмАЦ, выявляемая в присутствии NaF, была в 3 раза ниже, чем «растворимой», определяемой с помощью MnCl2 и NaHCO 3 (Рис.1 А). Уровни активности рАЦ под воздействием этих агентов были почти одинаковыми. После кратковременной инкубации (1 мин) корней растений картофеля с ЭПС (опыт), наблюдалось увеличение активности обеих форм АЦ со специфическими эффекторами в 4,5-7 раз, соответственно, причем наибольшая величина активации была получена в варианте с NaHCO 3 (Рис.1 А) .
Трансмембранная и «растворимая» АЦ хлоропластов клеток растений устойчивого сорта. В контроле (без ЭПС) уровень активности рАЦ превышал таковую тмАЦ примерно в 1,3-2 раза в присутствии MnCl2 и NaHCO3, соответственно (рис.1 А). ЭПС Cms в различной степени стимулировали как тмАЦ, так и рАЦ хлоропластов. В максимальной степени – в 17 раз - активировалась трансмембранная АЦ (эффектор NaF); уровень рАЦ в варианте с MnCl2 был выше относительно контроля в 9 раз, а при добавлении NaHCO3 - в 3,5 раза (Рис.1 А).
Трансмембранная и «растворимая» АЦ ядер клеток растений восприимчивого сорта. Как видно из Рис. 1 Б, активности обеих форм АЦ между собой существенно не различались, но были значительно ниже, чем у устойчивого сорта – в 10 и 23 раза, соответственно. ЭПС ингибировали активности обеих форм данного фермента, причем тмАЦ в 2 раза, рАЦ - в 1,2 раза в присутствии MnCl 2 и в 1,6 раза при добавлении NaHCO 3 .
Трансмембранная и «растворимая» АЦ хлоропластов клеток растений восприимчивого сорта. Активность тмАЦ в контроле (без ЭПС) была значительно – в 5 раз ниже, чем у растений устойчивого сорта, в то время как уровень активности растворимой формы АЦ соответствовал аналогичному показателю у устойчивого сорта (рис.1 А, Б). ЭПС, как и во фракции ядер, значительно ингибировали активность обеих форм фермента – тмАЦ в 3,5 раза, рАЦ в присутствии двух типов эффекторов - в 13-14 раз, соответственно (Рис.1 Б).
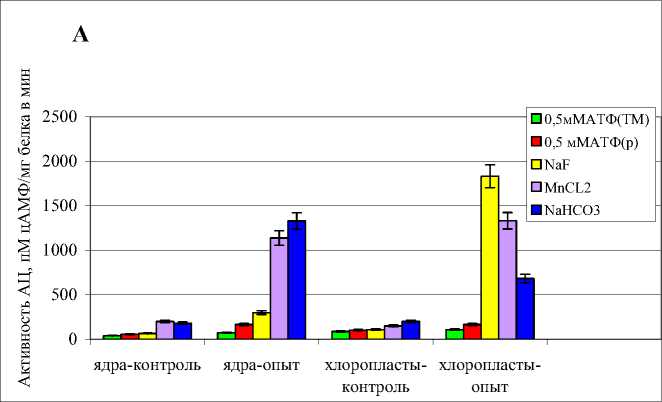
Рис.1. Влияние 0,1% ЭПС Cms на активность различных форм АЦ в клетках пробирочных растений картофеля, пМ цАМФ/мг белка в мин. А - сорт Луговской (устойчивый); Б – сорт Лукьяновский (восприимчивый).
Б
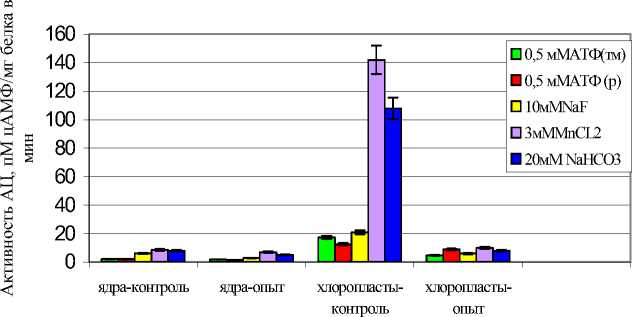
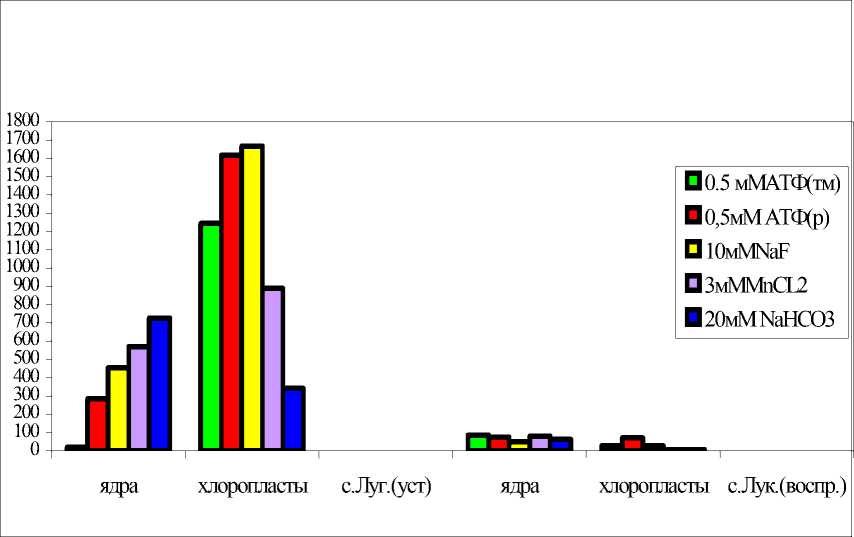
Рис.2. Влияние ЭПС Cms на активность различных форм АЦ, % к контролю.
ОБСУЖДЕНИЕ
Согласно представленным данным, в ядрах и хлоропластах клеток растений картофеля присутствовали «растворимая» и трансмембранная формы АЦ. Причем исходный уровень активности этих форм ферментов различался как у сортов, так и в разных органеллах (рис.1 А, Б). Эти сведения позволяют выдвинуть гипотезу о дополнительных механизмах внутриклеточной сигнализации. Ранее полагали, что синтезирующийся на плазмалемме цАМФ запускает последующие каскадные реакции с участием различных протеинкиназ и факторов транскрипции, которые «переносят» сигналы в ядро (Тарчевский, 2002).
Но так как реакция данной системы на различные внешние воздействия проявлялась уже через 1-5 мин не только в пределах клетки (Cooke et al., 1994), но и в участках, отдаленных от места приложения фактора, стимулирующего возникновение сигнала (Lomovatskaya et al., 2005), трудно представить, что весь набор предполагаемых реакций может протекать за столь короткое время.
Более вероятно, что трансдукция сигнала с помощью аденилатциклазной системы может осуществляться как минимум двумя путями: первый - через цАМФ, синтезируемый АЦ, локализованной на плазмалемме и далее по стандартной схеме (Тарчевский, 2002), и второй -через цАМФ, появляющийся при функционировании трансмембранной и «растворимой» АЦ непосредственно в клеточных органеллах и цитозоле. Степень активности тмАЦ, локализованной в плазмалемме, зависит от нескольких составляющих: от действующего внешнего раздражителя, то есть лиганда, количества и качества рецепторов и соответствующих G-белков (Sunahara, Taussig, 2002). Благодаря активности этого фермента происходит выброс значительной части цАМФ за пределы клетки, который через ряд специальных механизмов способствует передаче системного сигнала на большие расстояния (Тарчевский, 2002; Lomovatskaya et al., 2005). Что касается различных форм АЦ, локализованных в клеточных органеллах, механизм регуляции их активации пока неизвестен, но опираясь на литературные данные, можно предположить, что в этом процессе могут участвовать G-белки и цАМФ-зависимые кальциевые ионные каналы, локализованные в плазмалемме и, соответственно, внутриклеточный Са2+ (Talke et al., 2003). Недавно было установлено, что в клетках животных G-белки различных типов связаны с элементами цитоскелета, а также встроены в ядерную мембрану (Willard, Crouch, 2000). Если такой же феномен существует у растений, то активность тмАЦ в клеточных органеллах растений может модулироваться с помощью соответствующих G-белков. Это также предполагает наличие в данном сигнальном ансамбле какого-либо рецептора и соответствующего лиганда. В отношении кальциевых каналов существуют более конкретные сведения. В этом процессе первоначальная важная роль принадлежит тмАЦ, локализованной в плазмалемме. Известно, что повышение уровня эндогенного цАМФ, синтезированного тмАЦ, инициирует вход ионов кальция в клетку через фосфорили-рование/дефосфорилирование кальциевых каналов плазмалеммы (Lemtiri-Chlieh, Berkowitz, 2004). Кроме того, на примере расоспецифичного грибного элиситора было ранее показано, что он способен повышать активность G-белок-зависимых кальциевых каналов в плазмалемме (Gelli et al., 1997). Вероятно, такая возможность существует и для бактериального элиситора, в качестве которого выступают ЭПС Cms. Далее пул кальция может повышаться также за счет освобождения из внутриклеточных депо, например, вакуолей и цистерн эндоплазматического ретикулума (Тарчевский, 2002). О неодинаковом влиянии ионов кальция на различные изоформы тмАЦ хорошо известно (Ishikawa, Homcy, 1997), а для растворимой АЦ, локализованной в ядрах и митохондриях клеток животных недавно получены данные о том, что в сочетании с NaHCO3 кальций способен оказывать мощный синергический эффект (Jaiswall, Conti, 2003). В этой связи представляется неожиданной и интересной роль бикарбоната в регуляции активности «растворимой» формы АЦ в клетках растений картофеля. Учитывая, что в хлоропластах бикарбонат присутствует всегда, так как является важным промежуточным продуктом фотосинтеза, активация «растворимой» АЦ этим агентом представляется уместной. Остается неясным, почему происходит аналогичное стимулирование такого же фермента (устойчивый сорт) в ядре; одно из возможных объяснений этому может быть основано на сходстве структуры «растворимой» АЦ из ядра и хлоропластов.
Влияние ЭПС Cms на все формы АЦ ядер и хлоропластов, изолированных из клеток растений картофеля, вероятно, осуществляется по вышеприведенной схеме: у устойчивого сорта -через рецепторы клеточных стенок и плазмалеммы, возможно к элиситорным компонентам ЭПС, далее через G s -белки (активирующие субъединицы), тмАЦ, локализованную в плазмалемме, которая опосредованно активирует тмАЦ и рАЦ, локализованные в различных компартментах клетки (рис. 2). У восприимчивого к Cms сорта, напротив, происходит частичное ингибирование данных форм фермента, скорее всего, супрессорными компонентами ЭПС через соответствующие рецепторы и Gi-белки (рис.2).
Таким образом, можно сделать вывод, что у растений картофеля в клеточных органеллах -ядрах и хлоропластах, присутствует как трансмембранная, так и «растворимая» формы АЦ. Под влиянием ЭПС Cms активность этих форм фермента, выделенных из растений контрастных по устойчивости к Cms сортов, меняется неодинаково: у растений устойчивого сорта возрастает, восприимчивого - угнетается. В первом случае генерируется оперативный сигнал, запускающий защитные ответы, а во втором инициация такого сигнала значительно запаздывает, что приводит к отсутствию или слабому развитию таких ответов..
Список литературы Влияние биотического стресса на активность различных форм аденилатциклазы в органеллах клеток растений картофеля
- Брехман И.И. (1970) Вариационная статистика в спортивной медицине и педагогике. М. ЦНИИТЭИ. 109 с.
- Бутенко Р.Г., Хромова Л.М., Седнина Г. Г. (1984) Методические указания по получению вариантных клеточных линий и растений у разных сортов картофеля. М. ВАСХНИЛ.28 с.
- Граскова И.А., Владимирова С.В., Колесниченко А.В., Рихванов Е.Г., Войников В.К. (2002) Изменение активности пероксидазы клеток картофеля при патогенезе кольцевой гнили. Вестник Харьковского нац. аграр. университета. 9. С. 37-44.
- Тарчевский И.А. (2002) Сигнльные системы растений. М. Наука. 294 с.
- Яворская В.К., Калинин Ф. Л. (1984) О функционировании цАМФ-регулирующей системы в растениях. Физиология и биохимия культ. растений. 16. С. 217-229.
- Cooke C.J., Smith C.J., Walton T.J., Newton R.P. (1994) Evidence that cyclic AMP is involved in the hypersensitive response of Medicago sativa to fungal elicitor. Phytochemistry. 35. P. 889-895.
- Gelli A., Higgins V.J., Blumwald E. (1997) Activation of plant plasma membrane Ca2+ -permeable channels by rase-specific fungal elicitors. Plant Physiol. 113. P.269-279.
- Ishikawa I., Homcy C.J. (1997) The adenylyl cyclases as integrators of transmembrane signal transduction. Circulation Research., 80. P.297-304.
- Jaiswall B.S., Conti M. (2003) Calcium regulation of the soluble adenylyl cyclase expressed in mammalian spermatozoa. Proc. Nat.USA. 100. P.10676-10681.
- Lomovatskaya L.A., Romanenko A.S., Krivolapova N.V., Kopytchuk V.N. (2005) Partisipation of potato cells cAMP in the transfer of systemic signal in ring rot pathogenesis. Acad. Open Inter., 15. P.1-7.
- Murashige T., Skoog F. (1962) A revised medium for rapid growth and bioassay with tobacco tissue cultures. Physiol Plant. 15. P.473-499
- Rich T., Fagan K.A., Tse T.E., Sehaack I., Cooper D.M.F., Karpen I.W. (2001) A uniform extracellular stimulus triggers distinct cAMP signals in different compartments of a simple cell. Proc. Nat.USA. 98. P. 13049-13054.
- Strobel G. (1967) Purification and properties of phytotoxic polyssacharide produced by Corinebacterium sepedonicum. Plant Physiol. 47. P.1433-1441.
- Sunahara R.K, Taussig R. (2002) Isoforms of mammalian adenylyl cyclase: multiplicities of signaling. Mol. Interventions 2. P. 168-184.
- Talke I., Blaudes D., Maathuis F.J.M., Sanders D. (2003) CNGCs: prime targets of plant cyclic nucleotide signalling? Trends in plant sciences. 8. P.286-293
- White A., Zenser White A., Zenser T. (1971) Separation of cyclic 3:5-nucleoside monophosphates from other nucleotides on aluminium oxide columns. Application to the assay of adenyl cyclase and guanyl cyclase. Analyt. Biochem. 41. P. 372-396.
- Witters E., Valcke R., van Onckelen H. (2005) Cytoenzymological analysis of adenylyl cyclase activity and 3':5'-с AMP immunolocalization in chloroplasts of Nicotiana tabacum. New Phytologist. 168. P. 709-712.
- Zippin J.H., Farrel J., Kamenetsky M., Hess K.C., Fiscman D.A., Levin L.R., Buck J. (2004) Bicarbonate-responsive «soluble» adenylyl cyclase defines a nuclear cAMP microdomain. J. Cell. Biol. 164. P.527-534.


