Влияние блокатора потенциал-зависимых Са 2+-каналов (верапамил) на биосинтез резвератрола и экспрессию генов CDPK в культуре клеток винограда амурского Vitis amurensis Rupr
Автор: Шумакова О.А., Дубровина А.С., Киселев К.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Растениеводство
Статья в выпуске: 6, 2013 года.
Бесплатный доступ
В данной работе был показан эффект блокатора потенциал-зависимых Са 2+-каналов верапамила (VER) на продукцию резвератрола и экспрессию генов кальций-зависимых протеинкиназ (CDPK) в культуре клеток Vitis amurensis Rupr. При добавлении в питательные среды 0.75 мМ VER наблюдается достоверное снижение продукции резвератрола и увеличение экспрессии дополнительных форм CDPK в клетках винограда с повышенным содержанием резвератрола. Полученные результаты свидетельствуют о том, что CDPK участвуют в регуляции биосинтеза резвератрола в клетках винограда.
Кальций-зависимые протеинкиназы, резвератрол, верапамил, культура клеток, виноград амурский (vitis amurensis rupr.)
Короткий адрес: https://sciup.org/14083064
IDR: 14083064 | УДК: 581.1
Текст научной статьи Влияние блокатора потенциал-зависимых Са 2+-каналов (верапамил) на биосинтез резвератрола и экспрессию генов CDPK в культуре клеток винограда амурского Vitis amurensis Rupr
Рынок получения и сбыта резвератрола находится в стадии формирования. Резвератрол получают из выращиваемых растений горца птичьего Polygonum cuspidatum, что является длительным и затратным процессом, поскольку необходимо вырастить взрослое растение, содержание резвератрола в котором не превышает десятых долей процента от сухой массы клеток. Это объясняет довольно высокую цену резвератро-ла. Клеточные культуры имеют определенные преимущества перед традиционным растительным сырьем, так как продукт можно получать независимо от ареала распространения растения, сезона, погоды и почвенных условий. Если к тому же учесть быстрое истощение естественных сырьевых ресурсов, то преимущества использования клеточных технологий становятся очевидными. Однако содержание БАВ в клеточных культурах растений обычно ниже необходимого для использования этих культур в промышленном производстве фармакологически активных веществ, поэтому необходимо увеличить биосинтез БАВ с помощью методов биотехнологии. Для создания организмов, активно продуцирующих резвератрол, необходимо изучить молекулярные механизмы регуляции биосинтеза этого стильбена в клетках растений.
В настоящее время регуляторы биосинтеза стильбенов полностью не изучены, но показано, что несколько вторичных мессенджеров, особенно Са2+, активно вовлечены в регуляцию биосинтеза стильбенов [6–7]. К группе регуляторных белков растений, связывающих Са2+, относятся Са2+-зависимые протеинкиназы (CDPK) [8]. Показано, что увеличение накопления фитоалексинов коррелирует с повышением активности CDPK [9].
Цель исследований . Проанализировать взаимосвязь изменения [Ca2+] цит , биосинтеза резвератрола и экспрессии генов CDPK . Для этого мы исследовали влияние верапамила (VER) - ингибитора Ca2+-каналов плазматической мембраны L-типа на рост, биосинтез резвератрола и экспрессию генов CDPK в культурах клеток винограда с низким, средним и высоким содержанием этого стильбена.
Материалы и методы исследований
Растительный материал и клеточные культуры. В работе мы использовали культуры клеток V . amurensis с разным содержанием резвератрола: от низкого (0,003% от сухой массы клеток) в контрольной культуре клеток V2 до относительно высокого (до 0,3 % от сухой массы клеток) в rolB -трансгенных культурах. Контрольная культура клеток V2 была получена из стебля V . amurensis , rolB -трансгенные культуры клеток VB1 и VB2, полученные в результате обработки культуры V2 Agrobacterium tumefaciens , в состав Т-ДНК которых входили маркерный ген nptII и ген rolB . [10].
Компоненты питательных сред. Для проведения экспериментов использовали агаризованную питательную среду W B/A [11] с добавлением 0,5 мг/л 6-бензиламинопурина и 2 мг/л α-нафтилуксусной кислоты, которую разливали в пробирки 200*20 мм по 15 мл. Интервал субкультивирования составлял 30–35 дней в темноте при 24 ±1oС.
Обработка блокатором потенциал-зависимых мембранных Ca2+-каналов. Верапамил (ICN Pharmaceuticals) растворяли в дистиллированной воде и добавляли в культуральные среды до измерения pH среды (исходный раствор 100 мг/мл). Рабочая концентрация 0,75 мМ. Эта концентрация была использована, потому что была наиболее подходящей для ингибирования биосинтеза резвератрола в клетках винограда из ранее полученных результатов [12].
Выделение нуклеиновых кислот и получение комплементарной ДНК (кДНК). Тотальная РНК экстрагировалась из клеточных культур на 35-е сутки культивирования по методике с LiCl [13], которая оптимизирована для работы с тканями растений, богатыми вторичными метаболитами. кДНК получали, используя 1–3 мкг тотальной РНК (предварительно обработав ДНКазой, Fermentas, Вильнюс, Литва), с помощью набора для обратной транскрипции (Силекс M, Москва, Россия). Для проведения обратной транскрипции (ОТ) использовали 50 мкл реакционной смеси, содержащей 1х ОТ буфер, по 0,24 мМ каждого из dNTP, 0,2 мкM олиго-(dT) 15 праймера, 200 единиц активности M-MLV-ревертазы. Реакцию проводили при 37°C в течение 1,5 часов.
Количественная и качественная оценка экспрессии генов CDPK . Большое количество генов CDPK и отсутствие информации о последовательности генов CDPK для V. amurensis не дало возможности применить в первую очередь такие стандартные молекулярно-биологические методы, как ПЦР с использованием специфических праймеров и ПЦР в реальном времени, поэтому мы анализировали экспрессию генов CDPK с помощью вырожденных праймеров и секвенирования полученных клонов [14]. Преимущество данного подхода заключается в том, что изучается экспрессия всего мультигенного семейства, поэтому можно определить долю экспрессии каждого гена в суммарной экспрессии генов семейства. Кроме того, есть возможность описать экспрессию новых генов, неизвестных ранее.
ПЦР генов CDPK проводили с вырожденными праймерами, разработанными на основе сравнения аминокислотных последовательностей генов CDPK разных подсемейств из разных видов растений (AF363784, AF072908, AB236787, D87707, AF418563, AF090835, AY312268, X96723, NM_106132, NM_101746, AY138479, AC097277, AY394009, U20626, AJ344154, AB042550, D84408, AY704444, AB051809, AB051808, AY247754, AY072802, U90262, U08140). Прямой праймер 5’- GGWGGWGARYTYTTYGA и обратный праймер
5’- TCDGCCCARAADGGDGG фланкируют продукт 362 п.н., Ta = 54oС, время элонгации 22 с. Полученные ампликоны CDPK были выделены из геля при помощи набора Glass Milk (Силекс, Москва) и клонированы в вектор pTZ57R/T согласно протоколу фирмы-производителя (Fermentas, Вильнюс, Литва).
Секвенирование ДНК. Клонированные ПЦР продукты CDPK были получены с использованием универсальных М13 праймеров и секвенированы с использованием Big Dye Terminator Cycle Sequencing Kit (Perking-Elmer Biosystems, Остин, США), следуя протоколу и рекомендациям изготовителя. После очистки этанолом последовательности были идентифицированы на ABI 3130 Genetic Analyser (Perking-Elmer Biosystems).
Полученные нуклеотидные последовательности генов CDPK V. amurensis сравнивали c известными последовательностями этих генов из других организмов в программе NCBI BLAST. Номера секвенированных фрагментов CDPK , депонированных в ГенБанк: VaCDPK1a (EU305622), VaCDPK1as (EU643699), VaCDPK1b (EU643694), VaCDPK1c (EU643695), VaCDPK1d (EU305623), VaCDPK1e (EU643696), VaCDPK2a (EU309795), VaCDPK3a (EU309796), VaCDPK3as (EU643697), VaCDPK3b (EU643693), VaCDPK3c (KC488322), VaCDPK3d (KC488323), VaCDPK1-L1-a (EU327878).
Экспрессию отдельных генов CDPK оценивали количественно, основываясь на данных секвенирования о количестве клонов каждого транскрипта в исследуемых пробах и данных о суммарной экспрессии генов, полученных с помощью вырожденных праймеров. Относительные единицы рассчитывали по формуле: нормализованная к экспрессии гена актина V. amurensis суммарная экспрессия генов CDPK × % клонов каждого гена /100 [14].
Определение содержания стильбенов в образцах ткани V. amurensis . Определение качественного и количественного содержания стильбенов производилось методом высокоэффективной жидкостной хроматографии (ВЭЖХ), как описано ранее [15]. Количество резвератрола определяли путем сравнения со стандартом резвератрола (Sigma-Aldrich, Сент-Луис, США).
Статистический анализ. Статистическую обработку результатов проводили при помощи программы Statistica, версия 10.0. Все данные представлены как среднее значение ± стандартная ошибка. Полученные данные проверены по спаренному критерию Стьюдента. Уровень значимости в 0,05 был выбран как минимальное значение статистической разницы во всех экспериментах.
Результаты и их обсуждение. Мы предположили, что Ca2+-сигнальная система вовлечена в регуляцию биосинтеза резвератрола. Поскольку ранее было показано, что увеличение накопления фитоалексинов коррелирует с повышением активности CDPK [9], мы решили проанализировать влияние изменение [Ca2+] цит в клетке на биосинтез резвератрола и экспрессию генов CDPK в культуре клеток винограда амурского. Для этого мы культивировали каллусные культуры клеток V. amurensis с разным содержанием резвератрола на питательных средах с добавлением 0,75 мМ блокатора потенциал-зависимых мембранных Ca2+-каналов (VER).
Нами было показано, что при добавлении в питательные среды 0,75 мМ VER наблюдается тенденция на снижение прироста сырой биомассы в культуре клеток V2 в 1,3 раза (табл.). Прирост rolB -трансгенных культур клеток винограда достоверно не изменялся при добавлении ингибитора Ca2+-каналов плазматической мембраны (табл.). Таким образом, рост rolB -трансгенных культур клеток винограда менее чувствителен к ингибитору Сa2+-каналов по сравнению с контрольной культурой клеток.
Далее с помощью ВЭЖХ было определено содержание резвератрола во всех культурах клеток, обработанных VER (табл.). Достоверное уменьшение содержания резвератрола в 5,3 и 10,6 раза было в rolB -трансгенных каллусных культурах VB1 и VB2, растущих на питательных средах с добавлением 0,75 мМ VER. Мы предполагаем, что незначительное изменение содержания резвератрола в контрольной культуре клеток винограда амурского V2 при добавлении VER связано с тем, что в норме в культуре клеток V2 низкое содержание резвератрола. Поэтому продукция резвератрола в контрольной культуре клеток V2 при добавлении ингибитора Ca2+-каналов достоверно не изменялась, а продукция резвератрола в rolB -трансгенных каллу-сных культурах клеток VB1 и VB2 достоверно ингибировалась в 5,3 и 9,8 раза соответственно. Уменьшение продукции резвератрола при добавлении VER может свидетельствовать о том, что Сa2+-сигнальная система участвует в регуляции биосинтеза этого ценного стильбена. Чтобы подтвердить это предположение, мы решили проанализировать экспрессию генов CDPK , которые кодируют основные белки, связывающие ионы Сa2+ в растительной клетке.
Прирост сырой и сухой биомассы, содержание и продукция резвератрола клеточными культурами V. amurensis, обработанными 0,75 мМ VER
|
Культура |
Сырая биомасса, г/л |
Сухая биомасса, г/л |
Резвератрол, % от сух. веса |
Продукция резвератрола культурами, мг/л |
|
V2 |
170.1 ±10.7 |
6.9 ±0.9 |
0.004 ±0.002 |
0.28 ±0.14 |
|
V2+VER |
134.7 ±3.4 |
5.1 ±1.1 |
0.006 ±0.001 |
0.32 ±0.05 |
|
VB1 |
163.4 ±30.1 |
7.9 ±0.8 |
0.037 ±0.022* |
2.95 ±1.74* |
|
VB1+VER |
158.8 ±29.4 |
8.0 ±1.2 |
0.007 ±0.001 |
0.56 ±0.08 |
|
VB2 |
40.7 ±10.7 |
4.5 ±0.5 |
0.243 ±0.038** |
10.95 ±1.71* |
|
VB2+VER |
51.4 ±31.4 |
4.8 ±0.6 |
0.023 ±0.009 |
1.12 ±0.43 |
Для того чтобы проанализировать экспрессию генов CDPK в клеточных культурах V. amurensis , мы выполнили дизайн вырожденных праймеров к участку киназного домена CDPK (V, VI, VII, VIII и IХ каталитические субдомены) на основе 24 известных последовательностей CDPK из разных растений. Известно, что сравнения аминокислотных последовательностей киназного домена генов CDPK достаточно для того, чтобы идентифицировать подсемейства генов CDPK A. thaliana [16]. Используя вырожденные праймеры методом ПЦР на кДНК из культур V2, VB1, VB2 и из каллусных клеток винограда, культивируемых на питательных средах с VER, мы получили ампликоны CDPK ожидаемого размера. В rolB -трансгенных культурах винограда VB1 и VB2 общая экспрессия генов CDPK была выше, чем в контрольной, однако в пределах доверительного интервала (рис.1). При обработке VER наблюдалась тенденция на снижение тотальной экспрессии CDPK во всех использованных в исследовании культурах клеток винограда амурского (рис.1). Ампликоны CDPK клонировали и секвенировали. Проанализировано 184, 111 и 234 клонов для V2, VB1 и VB2 культур клеток соответственно.
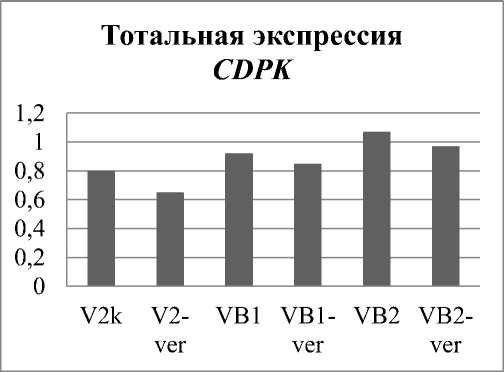
Рис. 1. Оценка суммарной экспрессии генов CDPK в культурах V. amurensis: V2 – векторная культура;
VB1 и VB2 – rolB-экспрессирующие культуры
При анализе выведенных аминокислотных последовательностей генов CDPK V. amurensis в программе BioEdit CDPK разделились на три подсемейства, которые получили названия: VaCDPK1, VaCDPK2 и VaCDPK3. Каждое подсемейство представлено несколькими транскриптами (выделено 13 отдельных транскриптов). Нами показано, что в контрольной культуре клеток V2 в норме экспрессируется пять форм генов CDPK: CDPK1а, CDPK1d, CDPK1e, CDPK2a и CDPK3a. При добавлении блокатора потенциал-зависимых мембранных Ca2+-каналов экспрессия генов CDPK оставалась в пределах доверительного интервала, наблюдалась лишь тенденция на уменьшение экспрессии CDPK1e, CDPK2a, CDPK3a. Стоит отметить, что при обработке культуры клеток V2 VER появлялась экспрессия гена CDPK3b (рис. 2, А).
частота встречаемости клонов CDPK в
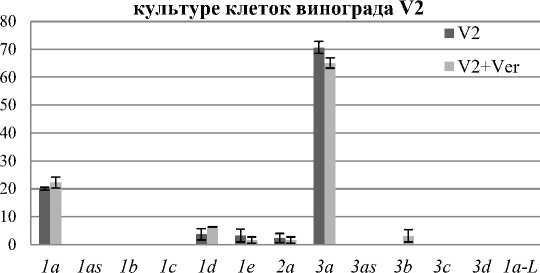
А частота встречаемости клонов CDPK в rolB-
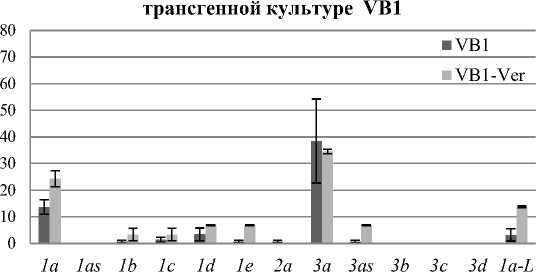
Б частота встречаемости клонов CDPK в rolB-
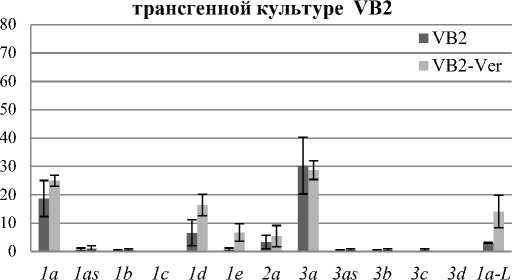
В
Рис. 2. Число клонов (процентное содержание) различных транскриптов CDPK, полученных из кДНК культур клеток V. amurensis в норме и растущих на питательных средах с добавлением 0,75 мМ VER:
А – контрольной культуры клеток V2; Б – rolB-трансгенной культуры клеток VB1;
В – rolB-трансгенной культуры клеток VB2
Анализ частоты встречаемости клонов каждого транскрипта CDPK в VB1 культуре клеток винограда амурского со средним содержанием резвератрола показал, что в норме в rolB-трансгенной культуре экспрес- сируются те же формы, что и в контрольной культуре V2 (рис. 2, Б). Частота встречаемости клонов CDPKIa, CDPKIe, CDPK2a и CDPK3a в VB1 культуре была в среднем в 2 раза ниже по сравнению с частотой встречаемости транскриптов этих генов в культуре клеток винограда V2, но стоит отметить, что процентное содержание клонов гена CDPK1d достоверно не изменялось. Помимо экспрессирующихся транскриптов в культуре клеток со средним меньшим содержанием резвератрола в VB1 культуре клеток появлялись клоны следующих форм CDPK: CDPKIb, CDPKIc, CDPK3as и CDPK1a-L. При добавлении VER в питательные среды культуры клеток VB1 экспрессия генов CDPKIb, CDPKIc и CDPK3a значительно не изменялась. Экспрессия генов CDPKIa, CDPKId, CDPKIe, CDPK3as и CDPK1a-L достоверно увеличивалась при культивировании клеток винограда на питательной среде с добавлением VER (рис.2, Б).
В rolB -трансгенной культуре с наивысшим содержанием резвератрола VB2 в норме и в культуре VB2, которая культивировалась на питательной среде с добавлением 0,75 мМ VER, экспрессировалось 10 транскриптов CDPK из 13 известных (кроме CDPKIc, CDPK3c и CDPK3d) . Экспрессия одиннадцатой формы - CDPK3c, появлялась в культуре клеток VB2, растущей на среде с добавлением ингибитора Са2+-каналов плазматической мембраны (рис.2, В). Если сравнить частоту встречаемости экспрессирующихся клонов CDPK в контрольной культуре V2 с экспрессией CDPK VB2 культуры клеток винограда, то можно отметить, что процентное содержание всех присутствующих в V2 культуре клеток форм CDPK , за исключением CDPK1а и CDPK3а , значительно не изменялось в VB2 культуре клеток. Процентное содержание транскриптов CDPKIa и CDPK3a от общей экспрессии CDPK достоверно снижалось в 2 раза. Добавление VER в питательные среды культуры клеток винограда VB2 с высоким уровнем содержания резвератрола практически не изменяло процентное содержание транскриптов CDPK . Экспрессия генов CDPK1d, CDPK1e и CDPK1a-L достоверно увеличивалась при культивировании клеток винограда на питательных средах, содержащих VER. Частота встречаемости остальных транскриптов была в пределах ошибки эксперимента.
Таким образом, можно отметить, что в культурах клеток винограда со средним и высоким содержанием резвератрола экспрессируются дополнительные формы генов CDPK . Так, в норме в контрольной культуре клеток V2 встречается только пять форм клонов CDPK , в то время как в VB1 и VB2 культурах экспрессируется 9 и 10 форм соответственно. Постоянная экспрессия CDPKIa, CDPKId, CDPKIe, CDPK2a и CDPK3a во всех трех культурах с разным содержанием резвератрола при уменьшении [Ca2+] цит посредством добавления в питательные среды VER может свидетельствовать о том, что данные белки вовлечены в такие биохимические процессы, без которых существование клетки невозможно, так как клетка в первую очередь отдает недостающий Ca2+ именно этим формам CDPK. В случае снижения частоты встречаемости транскриптов CDPK1а и CDPK3а в VB2 трансгенной культуре можно предположить, что они вовлечены в процессы клеточного роста, так как прирост сырой биомассы VB2 в 4,2 раза ниже, чем в контрольной культуре клеток. Появление клонов в культурах клеток винограда с повышенным содержанием резвератрола или увеличение частоты встречаемости клонов при культивировании культур клеток винограда VB1 и VB2 на средах, содержащих VER транскриптов CDPKIb , CDPKIc , CDPKId , CDPKIe , CDPK3as и CDPK1a-L , может свидетельствовать о том, что они вовлечены в регуляцию биосинтеза резвератрола. Вероятно, в растительной клетке при недостаточной [Ca2+] цит включается программа по восполнению функции данных протеинкиназ, которая осуществляется посредством увеличения экспрессии CDPKIb , CDPKIc , CDPKId , CDPKIe , CDPK3as и CDPK1a-L . А так как CDPK не могут осуществлять фосфорилирование субстрата без ионов Ca2+, даже при увеличении числа этих форм белков, прерывается каскад биохимических реакций, связанный с биосинтезом резвера-трола, что ведет к снижению аккумуляции резвератрола в растительной клетке.
Заключение. Полученные в ходе нашей работы результаты свидетельствуют о том, что в культурах клеток винограда VB1 и VB2 с повышенным содержанием резвератрола появляется экспрессия дополнительных форм CDPK: CDPKIb, CDPKIc, CDPKId, CDPKIe, CDPK3as и CDPK1a-L , что может свидетельствовать о том, что именно эти формы вовлечены в регуляцию биосинтеза резвератрола в клетках винограда амурского. Уменьшение содержания и продукции резвератрола на средах с блокатором потенциалзависимых Ca2+-каналов подтверждает вышеизложенное предположение. Таким образом, в нашей работе показана связь биосинтеза резвератрола с кальциевой сигнальной системой растений через экспрессию генов кальций-зависимых протеинкиназ.


