Влияние бронхолитической терапии на функцию внешнего дыхания и состояние легочной паренхимы при хирургическом лечении больных немелкоклеточным раком легкого в сочетании с хронической обструктивной болезнью легких
Автор: Добнер С.Ю., Федосенко С.В., Добродеев А.Ю., Яровой Н.Д., Самцов Е.Н., Дубаков А.В., Старовойтова Е.А., Денисова О.А., Кириллова Н.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 т.22, 2023 года.
Бесплатный доступ
Цель исследования - сравнить эффективность в периоперационном периоде регулярной пролонгированной ингаляционной терапии тиотропия бромидом в системе доставки Респимат и терапии коротко-действующим бронхолитиком (КДБ) ипратропия бромидом/фенотеролом у больных немелкоклеточным раком легкого (НМРЛ) с хронической обструктивной болезнью легких (ХОБЛ). материал и методы. В исследование включены 66 пациентов с НМРЛ с ХОБЛ, которые в течение 6 нед до операции и 6 нед после нее получали тиотропия бромид 5 мкг ежедневно (группа ТБ) или фиксированную комбинацию ипратропия бромида/фенотерола - 20/50 мкг/доза, 2 дозы 4 раза в сут (группа КДБ). Группу контроля составили пациенты, не получавшие до операции бронхолитики, но которым в послеоперационном периоде назначалась комбинация ипратропия бромида/фенотерола. Проводились оценка вентиляционной функции (спирометрия, бодиплетизмография), измерение плотности паренхимы легких и площади эмфизематозно измененных участков легких (компьютерная томография высокого разрешения).
Немелкоклеточный рак легких, периоперационный период, хроническая обструктивная болезнь легких, бронхолитическая терапия, тиотропия бромид
Короткий адрес: https://sciup.org/140303542
IDR: 140303542 | УДК: 616.24-006.6-089+616.24-008.4-08:615.23 | DOI: 10.21294/1814-4861-2023-22-5-49-59
Текст научной статьи Влияние бронхолитической терапии на функцию внешнего дыхания и состояние легочной паренхимы при хирургическом лечении больных немелкоклеточным раком легкого в сочетании с хронической обструктивной болезнью легких
У 50–70 % больных раком легких (РЛ) хроническая обструктивная болезнь легких (ХОБЛ) сосуществует в качестве коморбидной патологии [1, 2]. Современные данные указывают на наличие связи между РЛ и ХОБЛ, которая выходит за рамки курения и включает общие воспалительные и генетические пути [3, 4].
Основным методом лечения пациентов с ре-зектабельным немелкоклеточным раком легких (НМРЛ) является радикальное оперативное вмешательство, которое наиболее эффективно на ранних стадиях (I–IIA), а при местнораспростра- ненном НМРЛ (IIB–IIIA стадии) – в комбинациях с химио- и/или лучевой терапией [5, 6]. Однако операции по поводу НМРЛ сопряжены с высоким риском интра- и послеоперационных осложнений. Существенное влияние на их развитие оказывают объем вмешательства, состояние функции внешнего дыхания (ФВД), возраст и связанные с ним сопутствующие заболевания [7].
Как известно, ХОБЛ является значимым предиктором периоперационной смертности и основной причиной развития послеоперационных респираторных осложнений, а также дыхательной недостаточности из-за выраженных нарушений
ФВД [8]. В исследовании E. Roy et al. на основе анализа 1126 случаев хирургического лечения НМРЛ, включая 672 пациента с ХОБЛ, установлено, что после резекции легких у больных с ХОБЛ чаще возникали послеоперационные осложнения любого характера (p<0,0001), чем у пациентов без ХОБЛ, в частности, пневмонии (7 vs 3,7 %; p=0,0251) и более длительное поступление воздуха по дренажам из плевральной полости (17 vs 8,2 %; р<0,0001). При этом госпитальная смертность была выше у больных НМРЛ в сочетании с ХОБЛ тяжелой степени выраженности обструктивных нарушений вентиляции [9]. В связи с этим при подготовке больных НМРЛ с ХОБЛ к операции, а также в рамках последующей долгосрочной стратегии их ведения одной из ключевых задач является обеспечение максимально возможной и устойчивой бронходилатации для улучшения вентиляционной функции легких и уменьшения выраженности легочной гиперинфляции, что может быть достигнуто благодаря применению на регулярной основе современных ингаляционных бронхолитических препаратов пролонгированного действия, составляющих основу базисной терапии ХОБЛ [10].
Целью исследования явилась сравнительная оценка эффективности ингаляционной терапии у больных НМРЛ с ХОБЛ с использованием М3-холиноблокатора пролонгированного действия тиотропия бромида в системе доставки Респимат и короткодействующей фиксированной комбинации ипратропиума бромида/фенотерола в форме ДАИ, назначаемых на регулярной основе в периопераци-онном периоде, посредством динамической оценки параметров вентиляционной функции легких и состояния легочной паренхимы.
Материал и методы
Проведено открытое рандомизированное проспективное сравнительное исследование, включающее 66 пациентов с морфологически верифицированным НМРЛ IВ–IIIА стадии в сочетании с ХОБЛ I–III стадии вентиляционных нарушений по классификации GOLD (Global Initiative for Chronic Obstructive Lung Disease), проходивших лечение в НИИ онкологии Томского НИМЦ в период с октября 2016 г. по март 2021 г. [10].
Все пациенты были разделены на 3 группы. Основную группу составили больные (n=22), которым в периоперационном периоде (за 6 нед до операции и в течение 6 нед после неё) назначался ингаляционный длительно действующий М3-холиноблокатор тиотропия бромид в форме дозированного аэрозоля Респимат в стандартной дозе 5 мкг однократно в сутки (группа ТБ). Пациентам группы сравнения (n=21) в аналогичные сроки назначался короткодействующий комбинированный бронхолитик ипратропия бромид/ фенотерол в форме ДАИ – 20/50 мкг/доза, в режиме дозирования 2 дозы 4 раза в сут (группа КДБ). Для рандомизации пациентов в группы ТБ и КДБ использован метод случайного выбора запечатанных пронумерованных конвертов, содержащих указание на вид ингаляционного препарата. В рамках комбинированного лечения НМРЛ пациенты группы ТБ и КДБ получали неоадъювантную химиотерапию (НАХТ) по схеме винорелбин/карбоплатин или паклитаксел/карбо-платин (2 курса с интервалом в 3 нед), после чего выполнялась радикальная операция (лобэктомия, билобэктомия, пневмонэктомия).
В группе контроля (n=23), сформированной методом сплошной выборки, пациенты по не зависящим от исследования причинам не получали НАХТ. В послеоперационном периоде на протяжении 6 нед все пациенты этой группы регулярно применяли короткодействующий комбинированный бронхолитик ипратропия бромид/фенотерол в форме ДАИ – 20/50 мкг/доза, в режиме дозирования 2 дозы 4 раза в сут (рис. 1).
Эффективность НАХТ оценивали с использованием шкалы RECIST 1.1. После хирургического лечения больные всех групп по показаниям получали адъювантную химиотерапию. Данное исследование не предполагало влияния на выбор тактики лечения НМРЛ.
Больные в сравниваемых группах (табл. 1, 2) были сопоставимы по основным прогностическим критериям (p>0,05). Из 66 пациентов, включенных в исследование, 61 мужчина и 5 женщин. Пациенты в группах ТБ, КДБ и контроля относились к пожилой возрастной категории – 64, 65 и 63 года – и характеризовались высокой интенсивностью курения – 37, 35 и 35 пачка/лет соответственно. Важно отметить высокую распространенность респираторных инфекций у пациентов в анамнезе. В период до 3 мес, предшествующих включению в исследование, 43 (65,2 %) пациента перенесли как минимум одно обострение ХОБЛ, у 27 (40,9 %) – зарегистрированы эпизоды внебольничной пневмонии, нередко сочетающейся с обострением ХОБЛ. При этом параканкрозная пневмония наблюдалась у 18 пациентов (более половины от всех случаев пневмонии). Антибиотикотерапия в этот период проводилась у 40 (60,6 %) больных, в том числе и по причине развития обострений ХОБЛ.
В сравниваемых группах периферический НМРЛ диагностирован у 29 (43,9 %), центральный НМРЛ – у 37 (56,1 %) пациентов. Распространенность опухолевого процесса оценивалась по классификации TNM (8-е издание, 2017 г.). Суммарно во всех 3 группах у 11 (16,7 %) больных диагностирована IB стадия НМРЛ, у 9 (13,6 %) – IIA стадия, у 14 (21,2 %) – IIB стадия, у 32 (48,5 %) пациентов – IIIA стадия заболевания. Наиболее частым гистологическим вариантом был плоскоклеточный рак – 47 (71,2 %) случаев, реже встречалась аденокарцинома – 18 (27,3 %).
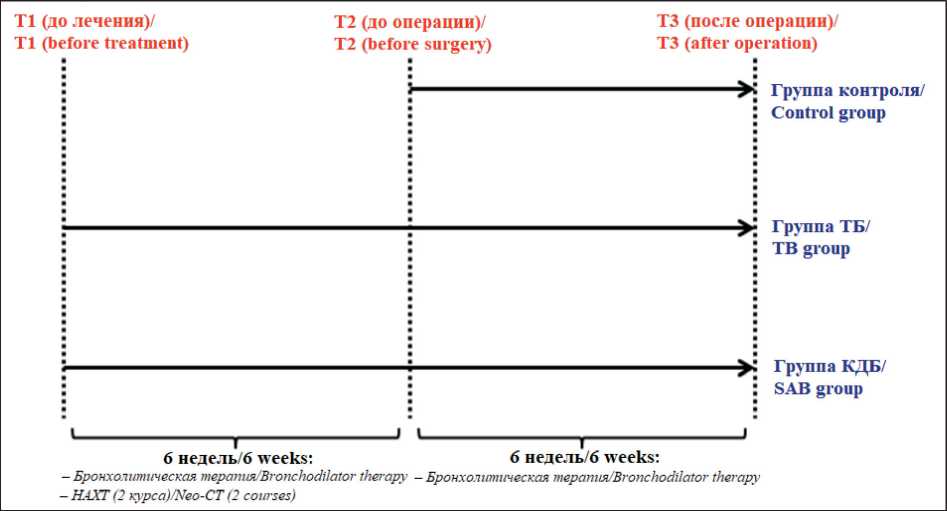
Рис. 1. Дизайн исследования. Т – контрольные точки исследования. Примечание: рисунок выполнен авторами
Fig. 1. Study design. T – control points of the study.
Note: created by the authors
Таблица 1/Table 1
Исходная характеристика пациентовCharacteristics of patients
|
Параметры/Parameters |
Группа ТБ/ TB group (n=22) |
Группа КДБ/ SAB group (n=21) |
Группа контроля/ Control group (n=23) |
|
Пол/Gender |
|||
|
Мужчины/Males |
21 (95,5 %) |
19 (90,5 %) |
21 (91,3 %) |
|
Женщины/Females |
1 (4,5 %) |
2 (9,5 %) |
2 (8,7 %) |
|
Возраст, лет/Age, years |
64 (59; 69) |
65 (58; 67) |
63 (59; 68) |
|
Статус курения/Smoking status |
|||
|
Курящие/Smokers |
14 (63,6 %) |
13 (61,9 %) |
13 (56,5 %) |
|
Бывшие курильщики/Former smokers |
7 (31,8 %) |
5 (23,8 %) |
8 (34,8 %) |
|
Не курящие/Non-smokers |
1 (4,6 %) |
3 (14,3 %) |
2 (8,7 %) |
|
Стаж курения, лет/ Smoking experience, years |
37,5 (30; 45) |
35 (30; 40) |
35 (30; 40) |
|
ИКЧ, пачка/лет/ Smoking index (SI), pack/years |
37 (30; 45) |
35 (30; 40) |
35 (30; 47,5) |
|
Степень обструктивных нарушений по GOLD/Severity of obstructive lung disease (GOLD) |
|||
|
Легкая/Mild |
12 (54,6 %) |
10 (47,6 %) |
13 (56,5 %) |
|
Средняя/Moderate |
8 (36,4 %) |
9 (42,9 %) |
8 (34,8 %) |
|
Тяжелая/Severe |
2 (9,1 %) |
2 (9,5 %) |
2 (8,7 %) |
|
Фенотип ХОБЛ/COPD phenotype |
|||
|
Эмфизема/Emphysema |
15 (68,2 %) |
15 (71,4 %) |
13 (56,5 %) |
|
Хронический бронхит/Chronic bronchitis |
1 (4,6 %) |
3 (14,3 %) |
4 (17,4 %) |
|
Смешанный/Mixed |
6 (27,3 %) |
3 (14,3 %) |
6 (26,1 %) |
|
Пациенты с обострением ХОБЛ за 3 мес до исследования/ Patients with COPD 3 months before examination |
8 (36,4 %) |
7 (33,3 %) |
9 (39,1 %) |
|
Пациенты с пневмонией за 3 мес до исследования/ Patients with pneumonia 3 months before examination |
10 (45,5 %) |
8 (38,1 %) |
9 (39,1 %) |
Примечания: межгрупповые различия показателей незначимы (р>0,05); ИКЧ – индекс курящего человека; таблица составлена авторами.
Notes: all the inter-group differences in values are not statistically significant (p>0.05); SI – smoker index; created by the authors.
Таблица 2/Table 2
Клинико-морфологическая характеристика НМРЛ
Clinical and morphological characteristics of NSCLC
|
Параметры/Parameters |
Группа ТБ/ TB group (n=22) |
Группа КДБ/ SAB group (n=21) |
Группа контроля/ Control group (n=23) |
|
Форма рака легкого/Locations of lung cancer |
|||
|
Центральная/Central |
12 (54,5 %) |
11 (52,4 %) |
14 (60,9 %) |
|
Периферическая/Peripheral |
10 (45,5 %) |
10 (47,6 %) |
9 (39,1 %) |
|
Стадии/Stages |
|||
|
I B |
3 (13,6 %) |
3 (14,3 %) |
5 (21,7 %) |
|
II A |
3 (13,6 %) |
2 (9,5 %) |
4 (17,4 %) |
|
II B |
5 (22,7 %) |
5 (23,8 %) |
4 (17,4 %) |
|
III A |
11 (50 %) |
11 (52,4 %) |
10 (43,5 %) |
|
Гистологический вариант опухоли/Histological type of the tumor |
|||
|
Плоскоклеточный рак/ Squamous cell carcinoma |
17 (77,3 %) |
15 (71,4 %) |
15 (65,2 %) |
|
Аденокарцинома/Adenocarcinoma |
5 (22,7 %) |
6 (28,6 %) |
7 (30,4 %) |
|
Крупноклеточный рак/ Large cell carcinoma |
– |
– |
1 (4,4 %) |
|
Степень дифференцировки опухоли/Differentiation grade |
|||
|
Высокая/Well differentiated |
1 (4,5 %) |
1 (4,8 %) |
3 (13 %) |
|
Умеренная/Moderately differentiated |
14 (63,6 %) |
12 (57,2 %) |
11 (47,8 %) |
|
Низкая/Poorly differentiated |
7 (31,8 %) |
8 (38,1 %) |
9 (39,1 %) |
Примечания: межгрупповые различия показателей незначимы (р>0,05); таблица составлена авторами.
Notes: all the inter-group differences in values are not statistically significant (p>0.05); created by the authors.
Таблица 3/Table 3
Методы комбинированного лечения
Methods of combined modality treatment
|
Метод лечения/ Treatment method |
Группа ТБ/ TB group (n=22) |
Группа КДБ/ SAB group (n=21) |
Группа контроля/ Control group (n=23) |
|
Неоадъювантная химиотерапия/Neoadjuvant chemotherapy |
|||
|
Частичная регрессия/Partial regression |
2 (9,1 %) |
3 (14,3 %) |
– |
|
Стабилизация/Stable disease |
20 (90,9 %) |
18 (85,7 %) |
– |
|
Объем операции/Extent of surgery |
|||
|
Лобэктомия/Lobectomy |
9 (40,9 %) |
11 (52,3 %) |
11 (47,8 %) |
|
Билобэктомия/Bilobectomy |
5 (22,7 %) |
4 (19,1 %) |
6 (26,1 %) |
|
Пневмонэктомия/Pneumonectomy |
8 (36,4 %) |
6 (28,6 %) |
6 (26,1 %) |
Примечания: межгрупповые различия показателей незначимы (р>0,05); таблица составлена авторами.
Notes: all the inter-group differences in values are not statistically significant (p>0.05); created by the authors.
Таблица 4/Table 4
Межгрупповые различия показателей спирометрии, бодиплетизмографии и состояния легочной паренхимы в динамике
Intergroup differences in spirometry, body plethysmography and the state of the lung parenchyma over time
|
Параметры/ Parameters |
Группа ТБ/ TB group (n=22) 1 |
Группа КДБ/ SAB group (n=21) 2 |
Группа контроля/ Control group (n=23) 3 |
Сравнение (p)/ Comparison (p) |
||
|
1 и 2 |
1 и 3 |
2 и 3 |
||||
|
Показатели спирометрии/Spirometry parameters |
||||||
|
Пост-ОФВ1 в Т1, % к должному/ Post-FEV1in Т1, % |
75 (65,8; 82,3) |
76 (67,5; 85) |
79 (75; 85) |
>0,05 |
||
|
Пост-ОФВ1 в Т2, % к должному/ Post-FEV1in Т2, % |
82,5 (75,8; 89) |
80 (73,5; 87,5) |
79 (75; 85) |
>0,05 |
||
|
Пост-ОФВ1 в Т3, % к должному/ Post-FEV1in Т3, % |
57,5 (49; 62,5) |
61 (54,5; 65,5) |
58 (50; 65) |
>0,05 |
||
|
Пост-ЖЕЛ в Т1, % к должному/ Post-VC in T1, % |
95,5 (90,8; 108,3) |
109 (96; 120) |
103 (98; 112) |
>0,05 |
||
|
Пост-ЖЕЛ в Т2, % к должному/ Post-VC in T2, % |
104 (94,8; 113,8) |
112 (100; 122) |
103 (98; 112) |
>0,05 |
||
|
Пост-ЖЕЛ в Т3, % к должному/ Post-VC in T3, % |
69 (60,8; 77) |
77 (70,5; 80,5) |
72 (58; 81) |
0,019 |
>0,05 |
>0,05 |
|
Пост-ФЖЕЛ в Т1, % к должному/ Post-FVC in Т1, % |
101 (84,3; 107,3) |
103 (91; 116) |
106 (95; 113) |
>0,05 |
||
|
Пост-ФЖЕЛ в Т2, % к должному/ Post-FVC in Т2, % |
107,5 (89,5; 110) |
106 (95; 117,5) |
106 (95; 113) |
>0,05 |
||
|
Пост-ФЖЕЛ в Т3, % к должному/ Post-FVC in Т3, % |
65 (55; 73,3) |
76 (67,5; 80) |
72 (63; 82) |
0,004 |
0,042 |
>0,05 |
|
Пост-ОФВ1/ФЖЕЛ в Т1/ Post-FEV1/Post-FVC in Т1, % |
65 (55; 68) |
63 (55; 67) |
61 (55; 65) |
>0,05 |
||
|
Показатели бодиплетизмографии/Body plethysmography parameters |
||||||
|
ООЛ в Т1, % к должному/RV in Т1, % |
121 (98,5; 134) |
112 (98; 125,3) |
121 (106; 128) |
>0,05 |
||
|
ООЛ в Т2, % к должному/RV in Т2, % |
114 (94,5; 126,5) |
108 (95; 123) |
121 (106; 128) |
>0,05 |
||
|
ООЛ в Т3, % к должному/RV in Т3, % |
74 (68; 86) |
86 (76; 97) |
88 (80,5; 105,8) |
0,041 |
0,023 |
>0,05 |
|
ОЕЛ в Т1, % к должному/TLC in Т1, % |
103 (95,5; 113) |
103 (99; 110) |
108 (100; 112) |
>0,05 |
||
|
ОЕЛ в Т2, % к должному/TLC in Т2, % |
103 (92,5; 108) |
103 (98; 105) |
108 (100; 112) |
>0,05 |
||
|
ОЕЛ в Т3, % к должному/TLC in Т3, % |
70 (65; 80) |
80 (75; 90) |
86 (73,8; 91,3) |
0,008 |
0,009 |
>0,05 |
|
ФОЕ в Т1, % к должному/ITGV in Т1, % |
106 (92; 119,5) |
104 (94,3; 111,5) |
110 (103; 118) |
>0,05 |
||
|
ФОЕ в Т2, % к должному/ ITGV in Т2, % |
104 (89; 110,5) |
100 (85,8; 105,3) |
110 (103; 118) |
>0,05 |
>0,05 |
0,049 |
|
ФОЕ в Т3, % к должному/ ITGV in Т3, % |
74 (65; 82) |
81 (76,3; 88) |
87 (78; 96) |
>0,05 |
0,005 |
>0,05 |
|
ООЛ/ОЕЛ в Т1, % / RV/TLC in Т1, % |
107 (100; 117,5) |
103 (90,8; 106,8) |
104 (97; 109) |
>0,05 |
||
|
ООЛ/ОЕЛ в Т2, % / RV/TLC in Т2, % |
106 (94,5; 112,5) |
97 (86; 110) |
104 (97; 109) |
>0,05 |
||
|
ООЛ/ОЕЛ в Т3, % / RV/TLC in Т3, % |
97 (87; 103) |
100 (90; 104) |
101,5 (90,8; 110,3) |
>0,05 |
||
|
Rtot в Т1, % к должному/Rtot in Т1, % |
106 (95,5; 138) |
102 (94,3; 104,3) |
107 (105; 124) |
>0,05 |
||
|
Rtot в Т2, % к должному/Rtot in Т2, % |
98 (90; 106) |
97 (87; 103) |
107 (105; 124) |
>0,05 |
0,014 |
0,049 |
|
Rtot в Т3, % к должному/Rtot in Т3, % |
86 (83; 91,2) |
93 (71,3; 99,8) |
101,5 (93; 111,8) |
0,03 |
0,02 |
0,041 |
|
Данные КТВР легких/Data of high resolution computed tomography of lungs |
||||||
|
Плотность паренхимы на вдохе, HU, Т1/ Inspiratory parenchymal density, HU, Т1 |
-852 (-822; -875,8) |
-864 (-839,5; -880) |
-865 (-854; -875) |
>0,05 |
||
|
Плотность паренхимы на вдохе, HU, Т2/ Inspiratory parenchymal density, HU, Т2 |
-865 (-833; -878,5) |
-860 (-842; -884) |
-865 (-854; -875) |
>0,05 |
||
|
Плотность паренхимы на вдохе, HU, Т3/ Inspiratory parenchymal density, HU, Т3 |
-844 (-826,5; -870,5) |
-870,5 (-842,5; -892,3) |
-870,5 (-852,5; -876) |
0,022 |
0,019 |
>0,05 |
|
Плотность паренхимы на выдохе, HU, Т1/ Exhaled parenchyma density, HU, Т1 |
-839 (-756,8; -857,8) |
-844 (-795; -870) |
-855 (-844; -879) |
>0,05 |
||
|
Плотность паренхимы на выдохе, HU, Т2/ Exhaled parenchyma density, HU, Т2 |
-785 (-756,5; -820,5) |
-816 (-799; -868,5) |
-855 (-844; -879) |
0,028 |
0,049 |
<0,001 |
|
Плотность паренхимы на выдохе, HU, Т3/ Exhaled parenchyma density, HU, Т3 |
-780 (-765; -818,5) |
-822 (-803,5; -875) |
-850,5 (-823,3; -883,8) |
0,005 |
<0,001 |
>0,05 |
Примечания: Т – контрольная точка исследования, в группе контроля Т1=Т2; ОФВ1 – объем форсированного выдоха за 1-ю сек; ЖЕЛ – жизненная емкость легких; ФЖЕЛ – форсированная ЖЕЛ; ООЛ – остаточный объем легких; ОЕЛ – общая емкость легких; ФОЕ – функциональная остаточная емкость; КТВР – компьютерная томография высокого разрешения; HU – единицы Хаунсфилда; Rtot – бронхиальное сопротивление; таблица составлена авторами.
Notes: T – control point of the study, in the control group T1=T2; FEV1 – forced expiratory volume in 1 second; VC – vital capacity of the lungs; FVC – forced VC; RV – residual volume; TLC – total lung capacity; ITGV – intrathoracic gas volume; HRCT – high resolution computed tomography; HU are Hounsfield units; Rtot – bronchial resistance; created by the authors.
После постановки диагноза НМРЛ у всех пациентов до начала лечения проводилась оценка вентиляционной функции (спирометрия, бодиплетизмография), градиента плотности паренхимы легких и площади эмфизематозно измененных участков легких (компьютерная томография высокого разрешения – КТВР). Затем подобное исследование в группах ТБ и КДБ выполнялось после предоперационной бронхолитической терапии и НАХТ (до операции) и далее во всех 3 группах, спустя 6 нед после хирургического лечения (рис. 1). Выраженность респираторных симптомов оценивалась по шкале mMRC (Modified Medical Research Council) и опроснику CAT (COPD Assessment Test) [10].
Эффективность НАХТ в группах ТБ и КДБ была сопоставима (p>0,05) и в большинстве случаев соответствовала стабилизации опухолевого процесса – у 90,5 и 85,7 % больных соответственно (табл. 3). Хирургическое лечение проведено у всех больных и включало лобэктомии (47 %), билобэктомии (22,7 %) и пневмонэктомии (30,3 %). Значимых межгрупповых отличий по объему хирургического лечения не было (p>0,05).
Статистический анализ выполнен при помощи пакета программ SPSS 23.0 (IBM SPSS Statistics, США). Описание количественных показателей проведено с указанием медианы (25; 75 процентили). Качественные показатели описаны с указанием абсолютных и относительных частот n (%). Сравнение количественных и качественных по-
казателей независимых выборок проводилось с использованием U-критерия Манна–Уитни и χ2 Пирсона или точного критерия Фишера. Сравнение количественных показателей зависимых выборок осуществлялось при помощи критерия Вилкоксона. При множественных сравнениях использовалась поправка Бонферрони. Результаты считали значимыми при p<0,05.
Результаты и обсуждение
До начала лечения у пациентов с НМРЛ отмечалась вариабельность нарушений вентиляции легких, обусловленных ХОБЛ. При этом доминировали легкие и среднетяжелые формы бронхиальной обструкции (табл. 1). Примечательно, что у 42 (63,6 %) пациентов ХОБЛ впервые диагностирована в рамках госпитализации по поводу НМРЛ. Во всех группах значимо преобладал эмфизематозный фенотип ХОБЛ, который был выявлен у 43 (65,2 %) пациентов. Смешанный фенотип ХОБЛ идентифицирован у 15 (22,7 %), изолированный фенотип хронического бронхита – у 8 (12,1 %) больных, что соответствует литературным данным [11]. Исходно выраженность респираторных симптомов по опроснику CAT составила 12 баллов в группе ТБ, 10 баллов – в группе КДБ и 10 баллов – в группе контроля. По шкале mMRC у 45 (68,2 %) пациентов выраженность одышки оценена на 1 балл, у 21 (31,8 %) – на 2 балла. Различия между группами не выявлены (p>0,05).
Динамика спирометрических показателей
До начала лечения легкая степень обструктивных нарушений вентиляции (% ОФВ1 от должного значения после пробы с сальбутамолом (пост-ОФВ1) >80 %) выявлена у 35 (53 %) пациентов, обструкция средней степени тяжести (пост-ОФВ1 50–80 %) – у 25 (37,9 %), тяжелое течение ХОБЛ (пост-ОФВ1 30–50 %) – у 6 (9,1 %). При этом значимых различий по тяжести бронхообструкции между группами не выявлено (p>0,05). Также не было межгрупповых отличий по постбронходилатационным показателям жизненной емкости легких (пост-ЖЕЛ) и форсированной ЖЕЛ (пост-ФЖЕЛ) (р>0,05). Соотношение пост-ОФВ1/ФЖЕЛ (индекс Тиффно) при исходной оценке во всех группах и у 100 % пациентов составило <0,7 (табл. 4).
После предоперационной подготовки с применением ТБ и КДБ наблюдалось значимое увеличение постбронходилатационных показателей ОФВ1, ФЖЕЛ и ЖЕЛ относительно исходных данных. Несмотря на отсутствие значимых отличий между группами ТБ и КДБ на предоперационном этапе (p>0,05), в группе ТБ по сравнению с группой КДБ отмечен более выраженный прирост значения пост-ОФВ1– 0,21 и 0,1 л соответственно. Вместе с этим, полученные результаты в группах ТБ и КДБ значимо не отличались от исходных данных группы контроля (табл. 4).
Через 6 нед после операции во всех группах выявлено значимое снижение показателей пост-ОФВ1, пост-ФЖЕЛ и пост-ЖЕЛ относительно предоперационного этапа (p<0,05). При этом значение пост-ЖЕЛ% в группе ТБ было значимо более низким по сравнению с группой КДБ – 69 и 77 % соответственно (p=0,019), хотя обе группы не показали значимых различий с группой контроля. По показателю пост-ФЖЕЛ% группа ТБ демонстрировала значимо более низкие результаты (65 %) по сравнению с группой КДБ (76 %) (р=0,004) и с группой контроля – 72 % (p=0,042) (табл. 4). Полученные результаты могут быть объяснены исходно более низкими значениями пост-ЖЕЛ% и
пост-ФЖЕЛ% в группе ТБ, а также большим числом выполненных пневмонэктомий относительно групп КДБ и контроля.
Вентиляционные нарушенияпо данным бодиплетизмографии
До начала лечения медианы значений общей емкости легких (ОЕЛ), остаточного объема легких (ООЛ) и функциональной остаточной емкости легких (ФОЕ) во всех группах значимо не различались (p>0,05) (табл. 4). В каждой из групп были пациенты с признаками «воздушных ловушек» (повышенное значение отношения ООЛ/ОЕЛ%): в группе ТБ – у 16 (76,2 %) пациентов, в группе КДБ – у 13 (65 %) и в группе контроля – у 15 (78,9 %) (межгрупповое p>0,05). По показателю бронхиального сопротивления (Rtot) исходно группы ТБ, КДБ и контроля также значимо не отличались – 106, 102 и 107 % соответственно.
В результате бронхолитической терапии на предоперационном этапе медианы показателя бронхиального сопротивления (Rtot) уменьшились относительно исходных данных: в группе ТБ – со 106 до 98 % (p=0,002), в группе КДБ – со 102 до 97 % (p>0,05), демонстрируя при этом значимо более низкие величины (благоприятный результат фармакотерапевтической поддержки), чем в группе контроля, – 107 % (p<0,05), в которой подготовка ингаляционными бронхолитиками перед операцией не проводилась (табл. 4).
В послеоперационном периоде, через 6 нед после вмешательства в каждой группе зафиксировано значимое снижение показателей ООЛ, ОЕЛ и ФОЕ. Более низкие значения ООЛ и ОЕЛ в группе ТБ были, по нашему мнению, в большей мере обусловлены объемом выполненных операций (табл. 3). Установлено, что в группе ТБ разница между значениями медиан ОЕЛ и ФОЕ до и после операции значимо отличалась от показателей в группах КДБ и контроля (р<0,05). Полученные данные свидетельствуют как о сокращении объема легочной паренхимы в результате резекции, так
и о положительном эффекте бронхолитической терапии в виде снижения гиперинфляции легких и сокращения количества «воздушных ловушек». Кроме того, проведение бронхолитической терапии в послеоперационном периоде способствовало уменьшению бронхиального сопротивления во всех группах больных: в группе ТБ медиана показателя Rtot значимо снизилась относительно данных до операции с 98 до 86 % (р=0,001) и была значимо лучше, чем послеоперационные показатели в группах КДБ – 93 % (р=0,03) и контроля – 101,5 % (р=0,02).
Оценка состояния легочной паренхимы на основании КТВР
Известно, что НМРЛ, возникающий на фоне эмфиземы, обладает более агрессивным характером течения и чаще рецидивирует [4]. В связи с этим очень важной является количественная оценка выраженности эмфиземы [12]. По данным КТВР эмфизема легких выявлена у подавляющего большинства пациентов: в группе ТБ – у 21 (95,4 %), в группе КДБ – у 18 (85,7 %), в группе контроля – у 19 (82,6 %).
Плотность легочной ткани, измеренная на вдохе, исходно и перед операцией в сравниваемых группах существенно не отличалась (р>0,05).
Однако через 6 нед после операции данный показатель в группе ТБ был значимо выше (-844 HU) по сравнению с группами КДБ (-870,5 HU, р=0,022) и контроля (-870,5 HU, р=0,019) (табл. 4). Данный факт обусловлен снижением степени выраженности эмфиземы легких за счет пролонгированной бронхолитической терапии с применением длительно действующего тиотропия бромида.
Плотность паренхимы легких на выдохе при предоперационной бронхолитической терапии в группах ТБ и КДБ повышалась, что свидетельствует о положительном эффекте в виде снижения гиперинфляции легких. При этом результаты в группе ТБ были значимо лучше (-785 HU) относительно групп КДБ (-816 HU, р=0,028) и контроля (-855 HU, р<0,049). В послеоперационном периоде в группе ТБ сохранялись значимо лучшие показатели, чем в группах КДБ и контроля (р<0,05), в которых бронхолитическая терапия проводилась с использованием короткодействующей комбинации ипратропия бромида/фенотерола (табл. 4).
В результате предоперационной бронхолитической терапии в группах ТБ и КДБ инспираторный объем участков эмфиземы снижался относительно исходных данных (табл. 4). Следует отметить, что в группе ТБ был достигнут наиболее выраженный эффект, который значимо отличался от группы КДБ
(р=0,006) – медиана объема эмфизематозных участков уменьшилась на 635 и 107 см3 соответственно. После операции во всех группах зафиксировано резкое снижение данного параметра, при этом показатели в группе ТБ (220 см3) были значимо лучше, чем в группах КДБ (1025 см3, р<0,001) и контроля (1002 см3, р=0,002).
При анализе объема эмфизематозных участков на выдохе установлено, что после бронхолитической терапии перед операцией в группах ТБ и КДБ зафиксировано снижение показателей относительно исходных данных – на 359 и 80 см3 соответственно (значимость межгруппового отличия р=0,015), что подтверждает положительное влияние пролонгированной антихолинергической терапии на состояние легочной паренхимы при ХОБЛ. Через 6 нед после операции в сравниваемых группах отмечено выраженное сокращение объема эмфизематозных участков на выдохе. Следует отметить, что данный показатель был наименьшим в группе ТБ (34 см3) и значимо отличался от группы КДБ (219 см3, р=0,001) и контроля (327 см3, р<0,001).
После хирургического лечения большое внимание уделялось особенностям течения послеоперационного периода. В течение 6 нед после операции частота обострений ХОБЛ была значимо меньшей в группе ТБ – у 1 (4,6 %) пациента – по сравнению с группой КДБ – у 9 (42,9 %) и контроля – у 12 (52,2 %) больных соответственно. Пневмонии в послеоперационном периоде возникли у 15 (22,7 %) больных, во всех 3 группах без значимых различий между ними (р>0,05).
Список литературы Влияние бронхолитической терапии на функцию внешнего дыхания и состояние легочной паренхимы при хирургическом лечении больных немелкоклеточным раком легкого в сочетании с хронической обструктивной болезнью легких
- Young R.P., Hopkins R.J., Christmas T., Black P.N., Metcalf P., Gamble G.D. COPD prevalence is increased in lung cancer, independent of age, sex and smoking history. Eur Respir J. 2009; 34(2): 380–6. doi: 10.1183/09031936.00144208.
- Kondo R., Yoshida K., Eguchi T., Kobayashi N., Saito G., Hamanaka K., Shiina T., Kurai M. Clinical features of lung cancer in smokers with light and mild chronic obstructive pulmonary disease: a retrospective analysis of Japanese surgical cases. Eur J Cardiothorac Surg. 2011; 40(6): 1439–43. doi: 10.1016/j.ejcts.2011.03.017.
- Vermaelen K., Brusselle G. Exposing a deadly alliance: novel insights into the biological links between COPD and lung cancer. Pulm Pharmacol Ther. 2013; 26(5): 544–54. doi: 10.1016/j.pupt.2013.05.003.
- Murakami J., Ueda K., Sano F., Hayashi M., Nishimoto A., Hamano K. Pulmonary emphysema and tumor microenvironment in primary lung cancer. J Surg Res. 2016; 200(2): 690–7. doi: 10.1016/j.jss.2015.09.004.
- Добнер С.Ю., Федосенко С.В., Родионов Е.О., Яровой Н.Д., Петров В.А., Тузиков С.А., Старовойтова Е.А., Самыкина И.А. Рак легкого у больных ХОБЛ и факторы, ассоциированные со снижением их выживаемости. Бюллетень сибирской медицины. 2022; 21(3): 41–9. [Dobner S.Yu., Fedosenko S.V., Rodionov E.O., Yarovoy N.D., Petrov V.A., Tuzikov S.A., Starovoitova E.A., Samykina I.A. Lung cancer in patients with COPD and factors associated with reduced survival. Bulletin of Siberian Medicine. 2022; 21(3): 41–9. (in Russian)]. doi: 10.20538/1682-0363-2022-3-41-49.
- Brunelli A., Kim A.W., Berger K.I., Addrizzo-Harris D.J. Physiologic evaluation of the patient with lung cancer being considered for resectional surgery: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013; 143(5 s): 166–90. doi: 10.1378/chest.12-2395. Erratum in: Chest. 2014; 145(2): 437.
- Белялова Н.С., Дворниченко В.В., Менг А.А., Моклоков А.В., Лелявин Б.И., Сокольников М.В., Улыбин П.С., Хаматов Р.К. Факторы риска хирургии легких: возраст и респираторная функция. Российский онкологический журнал. 2009; (1): 48–9. [Belyalova N.S., Dvornichenko V.V., Meng A.A., Moklokov A.V., Lelyavin B.I., Sokolnikov M.V., Ulybin P.S., Khamatov R.K. Risk factors from lung surgery: age and respiratory function. Russian Journal of Oncology. 2009; (1): 48–9. (in Russian)].
- Adcock I.M., Caramori G., Barnes P.J. Chronic obstructive pulmonary disease and lung cancer: new molecular insights. Respiration. 2011; 81(4): 265–84. doi: 10.1159/000324601.
- Roy E., Rheault J., Pigeon M.A., Ugalde P.A., Racine C., Simard S., Chouinard G., Lippens A., Lacasse Y., Maltais F. Lung cancer resection and postoperative outcomes in COPD: A single-center experience. Chron Respir Dis. 2020; 17. doi: 10.1177/1479973120925430.
- Venkatesan P. GOLD COPD report: 2023 update. Lancet Resp Med. 2022; 11(1). doi: 10.1016/S2213-2600(22)00494-5.
- González J., Henschke C.I., Yankelevitz D.F., Seijo L.M., Reeves A.P., Yip R., Xie Y., Chung M., Sánchez-Salcedo P., Alcaide A.B., Campo A., Bertó J., Del Mar Ocón M., Pueyo J., Bastarrika G., de-Torres J.P., Zulueta J.J. Emphysema phenotypes and lung cancer risk. PLoS One. 2019 Jul 25; 14(7). doi: 10.1371/journal.pone.0219187.
- Akira M., Toyokawa K., Inoue Y., Arai T. Quantitative CT in chronic obstructive pulmonary disease: inspiratory and expiratory assessment. Am J Roentgenol. 2009; 192(1): 267–72. doi: 10.2214/AJR.07.3953.


