Влияние церия и алюминия на растворимость кислорода в жидкой стали
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 2 т.13, 2013 года.
Бесплатный доступ
Построены поверхности растворимости компонентов в металлических расплавах для системы Fe-Ce-Al-O. Показано, что в области достижимых концентраций кислорода, церия и алюминия возможно блокирование поверхности химически активных неметаллических включений. Выполнен анализ сравнительной раскислительной способности церия и алюминия путем построения диаграмм расходов активных металлов на рафинирование стали. Установлена большая раскислительная способность церия по отношению к алюминию.
Алюмоцерий, диаграммы, неметаллические включения
Короткий адрес: https://sciup.org/147156829
IDR: 147156829 | УДК: 669.18.046.552
Текст научной статьи Влияние церия и алюминия на растворимость кислорода в жидкой стали
Лигатуры с церием обычно вводятся в предварительно глубоко раскисленный алюминием металл. В этом случае возможна реализация процессов комплексного раскисления стали алюминием и церием. Эта ситуация в теоретическом плане в литературе не рассматривалась. Поэтому при последовательном рассмотрении процессов, протекающих при введении церия в металл, необходимо определить координаты поверхности растворимости компонентов в жидком металле (ПРКМ) для системы Fe–Ce–Al–O и Fe–Ce–Al–С–O.
При термодинамическом анализе фазовых равновесий для условий взаимодействия алюминия и церия с кислородом в жидком железе была установлена возможность существования области составов металла, равновесного с оксидным расплавом (FeO, Al2O3, CeO2, Ce2O3) переменного состава, твердыми оксидами алюминия и церия (трех- и четырехвалентного), герцинитом, и алюминатами церия (Ce2O3·Al2O3, Ce2O3·11Al2O3). В присутствии углерода возможно образование газовой фазы (CO, CO2). Температурные зависимости констант равновесия приведены в табл. 1.
Активности составляющих оксидного расплава (FeO, Al 2 O 3 , Ce 2 O 3 ) рассчитывали по теории субрегулярных растворов [1]. Найденные энергетические параметры приведены в табл. 2. В приближении теории совершенных растворов была ранее рассчитана диаграмма состояния системы FeO–Ce2O3. Активность CeO2 в оксидном расплаве приравнивали к ионной доле катионов церия четырехвалентного. Активности компонентов металлического расплава рассчитывали по теории Вагнера с использованием параметров взаимодей-
Таблица 1
Зависимость констант равновесия от температуры
|
Реакция |
lg K = – A / T + B |
|
|
A |
B |
|
|
(FeO) = [Fe] + [O] |
6320 |
4,734 |
|
(Al 2 O 3 ) = 2[Al] + 3[O] |
58 320 |
18,02 |
|
(CeO 2 ) = [Ce] + 2[O] |
39 540 |
11,99 |
|
(Ce 2 O 3 ) = 2[Ce] + 3[O] |
64 128 |
17,37 |
|
|Al 2 O 3 | = 2[Al] + 3[O] |
64 000 |
20,48 |
|
|CeO 2 | = [Ce] + 2[O] |
43 694 |
13,55 |
|
|Ce 2 O 3 | = 2[Ce] + 3[O] |
68 500 |
19,60 |
|
|FeO·Al 2 O 3 | = [Fe] + 2[Al] + 4[O] |
74 580 |
26,37 |
|
|Ce 2 O 3 ·Al 2 O 3 | = 2[Ce] + 2[Al] + 6[O] |
161 590 |
53,54 |
|
|Ce 2 O 3 ·11Al 2 O 3 | = 2[Ce] + 22[Al] + 36[O] |
742 720 |
223,44 |
|
{CO} = [C] + [O] |
1168 |
–2,07 |
|
{CO 2 } = [C] + 2[O] |
9616 |
2,51 |
Таблица 2
Параметры теории субрегулярных ионных растворов FeO–Al 2 O 3 –Ce 2 O 3
|
Система |
Энергетические параметры, кал/моль |
||
|
FeO–Al 2 O 3 |
Q 1112 = 661 |
Q 1122 = –16 329 |
Q 1222 = –4917 |
|
Al 2 O 3 –Ce 2 O 3 |
Q 2224 = –2800 |
Q 2244 = –24 314 |
Q 2444 = –14 966 |
Параметры взаимодействия ei j , T = 1600 °С, растворитель – жидкое железо [2]
На рис. 1 представлены результаты расчета координат ПРКМ в виде проекций на плоскость составов при 1600 °С. В областях, ограниченных контрастными линиями, нанесены составы металла, равновесного с указанными оксидными фазами. Тонкими линиями показаны изокислородные сечения (в логарифмической шкале). Следует отметить на рис. 1 наличие двух зон составов металла, равновесного с оксидными расплавами. В области I оксидный расплав обогащен FeO, в области VII – содержится значительное количество Ce 2 O 3 . Из рис. 1 видно, что при содержании алюминия больше 0,0001 мас. % образование фазы CeO2 уже вряд ли возможно. Для образования включений CeO2 необходимо иметь в металле бóльшую концентрацию кислорода, порядка сотых долей процента, и низкую концентрацию церия.
Добавление в систему углерода (рис. 2) приводит к тому, что в равновесии с металлом при концентрации церия порядка сотых долей процента и алюминия около тысячных долей процен- та устойчивой оксидной фазой может быть только Ce2O3 или Ce2O3 с равновесным с ним оксидным расплавом. Область IX характеризует постоянное содержание кислорода (lg[O] = –2,17 или [O] ≈ 0,0067 мас. %), которое определяется концентрацией углерода ([С] = 0,4 мас. %) и общим давлением ( Pобщ = 1 атм).
Для дальнейшего анализа процессов взаимодействия церия и алюминия с кислородом, альтернативной оценки их участия в процессе раскисления необходимо установить связь между добавками алюминия и церия в сталь, глубиной раскисления и фазовым составом образующихся неметаллических включений, т. е. построить так называемые диаграммы расхода рафинирующих компонентов.
Связь между составом металла, составами равновесных с ним неметаллических фаз и составом сплава для раскисления может быть установлена при решении балансовых уравнений. Расчет проводился на 1 т исходного металла (до раскисления). Допустим, что раскисление алюмоцерием следует провести таким образом, чтобы в равновесии
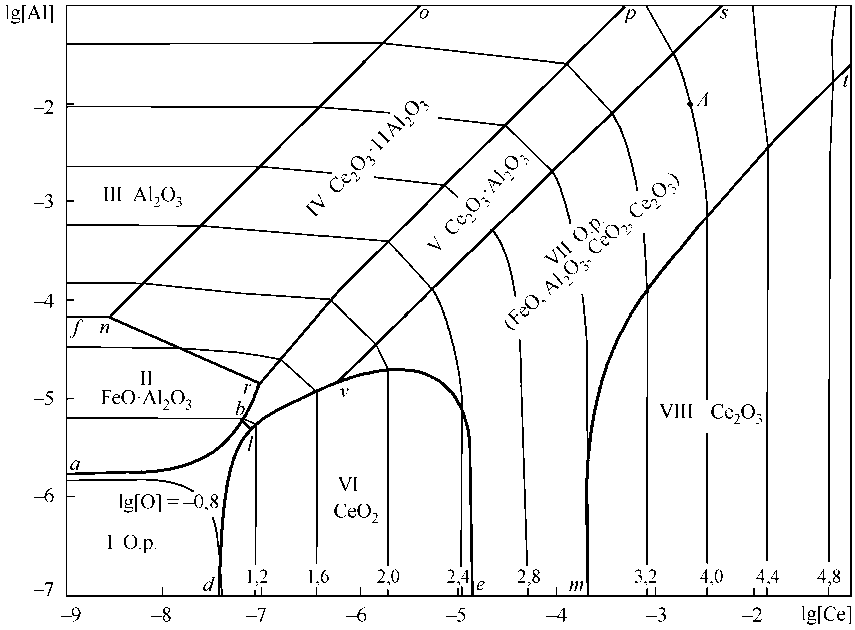
Рис. 1. ПРКМ системы Fe–Ce–Al–O, Т = 1600 °C
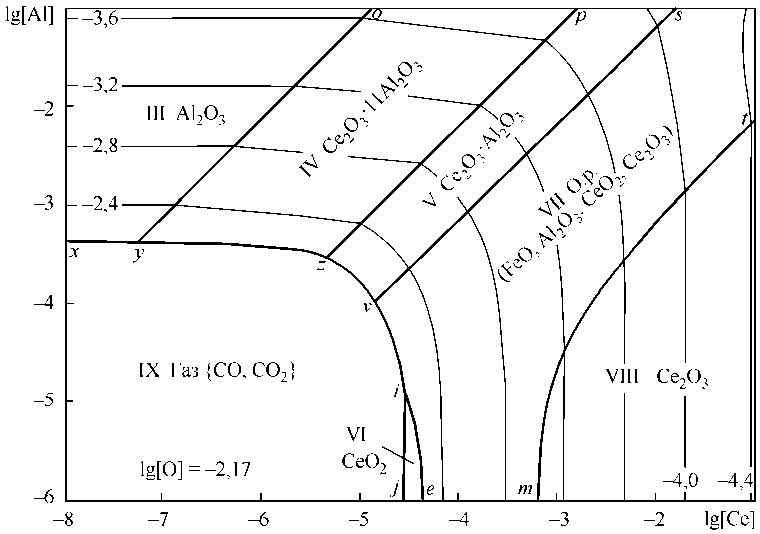
Рис. 2. ПРКМ системы Fe–Ce–Al–С–O, Т = 1600 °C, P общ = 1 атм, [С] = 0,4 мас. %
с металлом находились жидкие неметаллические включения (FeO, Al2O3, CeO2, Ce2O3). Для составления балансовых уравнений, кроме этого, необходимо знать химический состав металла перед раскислением, состав металла после раскисления и состав неметаллических включений. Для каждого из элементов рассматриваемой системы Fe–Al–Ce–O можно записать следующие балансовые уравнения
для получения при раскислении оксидного расплава:
1000 [ FeL _ [ Fe ] v . ( FeO,% ) M Fe v ; (1)
100 100 y 1 100 M FeO y 2 ;
1000 [ 0 ] исх [ О ] v +( ( FeO,% ) + 3 ( Al 2 O 3 ,% ) +
У + + +
100 100^ 1 ( M FeO M A1 2 O 3
M – молярные массы соединений и элементов.
В балансовом уравнении (3) для алюминия учтена возможность предварительного раскисления металла алюминием, церий вводится в предварительно раскисленный металл.
Состав жидкого металла и оксидной фазы после раскисления определен по результатам расчета равновесия (см. рис. 1), состав исходного металла задан ( I А1 ] исх = 0, [ О ] исх = 0,01-0,001 мас. %). Уравнения (1)–(4) позволяют найти величины z Al , z Ce , y 1 и y 2 . Зная эти величины, можно опреде-
лить, какое количество введенного в металл алю-
+
2 ( CeO2,% ) 3 ( Ce2O3,% ) ) Moy2 _^_------^ .-------- "-_ ;
миния расходуется непосредственно на связывание кислорода (раскисление)
M CeO2 M Ce2O3v г +1000[AlL |A'I . Al 100 100 y1
2 ( А12Оз,% ) Mai +
100M Al2O3
_ [ Ce ] z Ce 100 y 1
;
z
p
Al —
2 ( AI 2 O 3 ) M ai 100 M Al 2 O 3
y 2 ,
какое – на легирование стали
z Al — z Al -
2 ( AI 2 O 3 ) M ai 100 M Al2O3 y 2 .
(
+ ■
( CeO2,% ) + 2 ( Ce2O3,% ) ) M
V где [K]исх
M CeO2
M Ce 2 O 3 J
Ce y ;
100 2
и [ K ] - концентрации компонентов в
исходном и раскисленном металле, мас. %; (K) – концентрации компонентов в оксидном расплаве, мас. %; z Al , z Ce – расход церия и алюминия на раскисление и легирование 1000 кг исходного
жидкого металла, кг; y 1 и y 2 – количество металлической и оксидной фаз после раскисления, кг;
Результаты балансовых расчетов приведены в табл. 4 для условий равновесия, заданных точкой А (см. рис. 1), с указанием состава металла и равновесной оксидной фазы.
Баланс приведен для различных степеней исходной окисленности металла. С уменьшением степени окисленности исходной стали величина z Al z Ce увеличивается, что свидетельствует о бóльшей раскислительной способности церия.
В табл. 4, к сожалению, можно привести лишь результаты точечных расчетов. Более полную информацию о связи количества введенных модификаторов и раскислителей можно получить при построении диаграмм расхода добавок. На рис. 3–5
построены так называемые диаграммы расхода
Расход компонентов для раскисления стали алюмоцерием
|
[ 0 ] исх ,% |
Лигатура |
Баланс по раскислителям, кг/т |
|||||
|
z Al z Ce |
z Al , кг/т |
z Ce , кг/т |
Алюминий |
Церий |
|||
|
z Aрl, кг/т |
z Aрl , % |
z Cрe, кг/т |
z C р e , % |
||||
|
0,010 |
0,264 |
0,1246 |
0,4719 |
0,0246 |
19,74 |
0,4493 |
9,552 |
|
0,005 |
0,458 |
0,1122 |
0,2449 |
0,0122 |
10,87 |
0,2224 |
9,079 |
|
0,001 |
1,612 |
0,1022 |
0,0634 |
0,0022 |
2,526 |
0,0408 |
6,441 |
Примечание. Состав металла ([O] = 0,0001, [Al] = 0,01, [Ce] = 0,002 мас. %); состав оксидного распла- ва (О.р.) x = 0,0001; x = 0,2215; x = 0,0045; x = 0,7739 определяется координатами
( Fe2 + ) ( Al3 +) ( Ce4 + ) ( Ce3 +)
т. А (см. рис. 1)
раскисляющих и модифицирующих компонентов. По оси абсцисс отложен полный расход церия (на раскисление и легирование), по оси ординат – полный расход алюминия в кг/т.
На рис. 3–5 показано, при каких расходах в кг/т церия и алюминия реализуется соответственное фазовое равновесие. Тонкими линиями нанесены изокислородные сечения диаграммы расходов, контрастными выделены области фазовых равновесий. Обозначения областей на рис. 3 согласованы с обозначениями областей фазовых равновесий на рис. 1 (области I – VIII). Рис. 4 – укрупненная часть рис. 3. На рис. 4 видно, что при ничтожных расходах церия область равновесий с корундом практически не проявляется. При добавках церия 40–50 г/т в равновесии с металлом обра- зуется фаза Ce2O3·11Al2O3. В области V заданы составы металла, равновесного с Ce2O3·Al2O3. Такое соединение можно получить в качестве неметаллических включений при одновременном расходе алюминия 500 г/т и церия ~300 г/т. При бóльших расходах церия можно получить либо шлакокристаллические включения (оксидный расплав + Ce2O3·Al2O3), либо жидкоподвижные включения в составе (FeO, Al2O3, Ce2O3) со следами CeO2. Фаза Ce2O3 может быть получена в качестве неметаллических включений при расходах церия больше 500 г/т металла и малом содержании алюминия в металле. На рис. 5 приведена диаграмма расхода алюминия и церия при исходном содержании кислорода в металле 0,001 мас. %. Видно, что для этих условий при обычных расходах церия
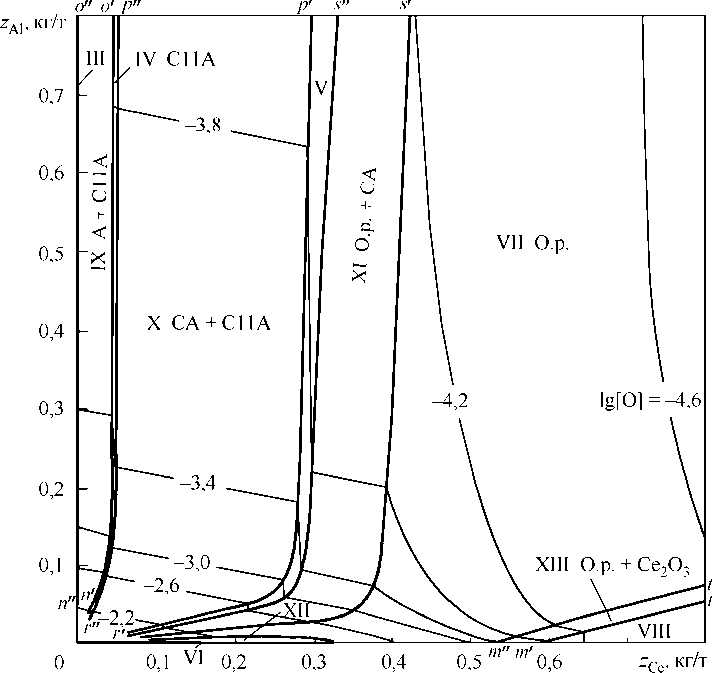
Рис. 3. Диаграмма расхода алюминия и церия, [O] исх = 0,01 мас. % СА – Ce 2 O 3 ·Al 2 O 3 , С11А – Ce 2 O 3 ·11Al 2 O 3
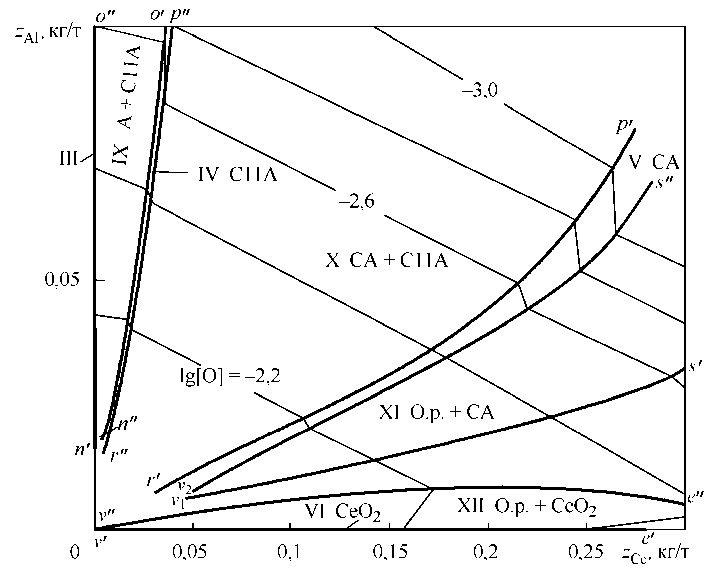
Рис. 4. Диаграмма расхода алюминия и церия, [O] исх = 0,01 мас. %. Дополнение к рис. 3
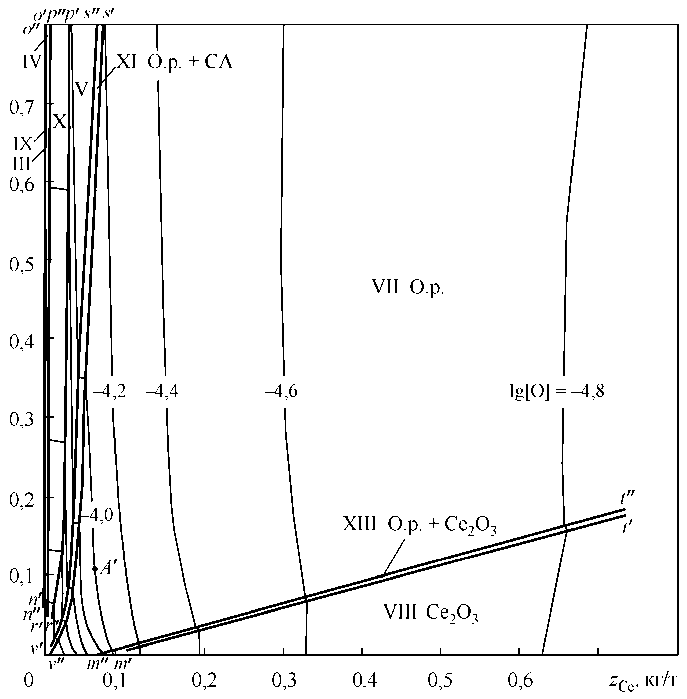
Рис. 5. Диаграмма расхода алюминия и церия, [O] исх = 0,001 мас. %
на раскисление и модифицирование и при малых расходах алюминия (до 100 г/т) возможно образование Ce2O3. При расходах алюминия порядка 300–500 г/т и расходах церия 200–300 г/т равновесной с металлом фазой будет оксидный расплав (FeO, Al 2 O 3 , Ce 2 O 3 ).
Выводы. Построены поверхности растворимости компонентов в металлических расплавах для системы Fe–Ce–Al–O. Показано, что в области достижимых концентраций кислорода, церия и алюминия возможно блокирование поверхности химически активных неметаллических включений. Выпол- нен анализ сравнительной раскислительной способности церия и алюминия путем построения диаграмм расходов активных металлов на рафинирование стали. Установлена большая раскислительная способность церия по отношению к алюминию.
Работа выполнена в рамках Государственного задания Министерства образования и науки РФ и частично поддержана грантом РФФИ № 13-08-12167.
Список литературы Влияние церия и алюминия на растворимость кислорода в жидкой стали
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Издат. Дом МИСИС. -2009. -519 с.
- Bůžek Z. Základní termodynamické údaje o metalurgických reakcích a o interakdch prvků v sous-tavách významných pro hutnickou teorii a praxi/Z. Buzek//Hutnicke listy. -1979. -Т. 20, № 1-2. -S. 3-111.


