Влияние цисплатина на показатели гемостаза экспериментальных животных
Автор: Филонова Мария Васильевна, Федорова Елена Павловна, Дубская Татьяна Юрьевна, Неупокоева Оксана Владимировна, Чурин Алексей Александрович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.19, 2020 года.
Бесплатный доступ
Введение. Одно из лидирующих мест среди причин смерти онкологических больных занимают тромботические осложнения, вызванные как самой опухолью, так и последствиями ее лечения. Разработка модели патологии гемостаза, в частности избыточного патологического тромбообразования у экспериментальных животных на фоне введения противоопухолевых препаратов, в перспективе позволит провести поиск новых патогенетически обоснованных фармакологических способов коррекции нарушений в системе свертывания крови. Целью исследования явилось изучение влияния цисплатина на показатели коагуляционного звена гемостаза экспериментальных мышей и крыс. Результаты. В эксперименте на аутбредных мышах было показано, что на 10-е сут после введения цисплатина в максимально переносимой дозе (10 мг/кг) наблюдалось снижение показателей активированного парциального тромбопластинового времени (АПТВ, сек), протромбинового времени (ПВ, сек), международного нормализованного отношения (MHO), а также возрастание концентрации фибриногена. На 15-е сут исследования отмечалось значимое уменьшение ПВ, МНО и АПТВ только у самок мышей. Введение цисплатина аутбредным крысам в максимально переносимой дозе 4 мг/кг также вызывало снижение ПВ и МНО, АПТВ и повышение концентрации фибриногена на 10-е сут. У крыс на 15-е сут исследования наблюдалось значимое снижение показателей ПВ и АПТВ как у самок, так и у самцов. Заключение. Изменение показателей ПВ и МНО, АПТВ в сторону уменьшения, а также увеличение концентрации фибриногена свидетельствуют о запуске процессов тромбообразования.
Цисплатин, аутбредные мыши, аутбредные крысы, коагуляционный гемостаз, тромбообразование
Короткий адрес: https://sciup.org/140254343
IDR: 140254343 | УДК: 616-006-08-06:615.28:616.151.5]-092.9 | DOI: 10.21294/1814-4861-2020-19-3-109-115
Текст научной статьи Влияние цисплатина на показатели гемостаза экспериментальных животных
Одной из основных причин смертности онкологических больных являются последствия нарушений свертывающей системы крови, в частности тромбозы. Показано, что при онкологических заболеваниях риск тромбоза повышается в 4,1 раза. Известно, что раковые клетки оказывают про-тромботическое действие на их микроокружение напрямую вследствие высвобождения прокоагулянтов и косвенно за счет выделения цитокинов и других соединений, активирующих тромбоциты, лейкоциты и эндотелиальные клетки [1, 2].
Применение химиотерапии увеличивает риск тромботических осложнений в 6,5 раз, причем этот показатель зависит от схемы химиотерапии и ряда других факторов [3, 4]. Возникновение тромбозов у онкологических больных приводит к отсроченному проведению химиотерапии, а в некоторых случаях и к отказу от нее [2, 3].
Во многих схемах лечения онкологических заболеваний различной локализации используется цисплатин, побочными эффектами которого являются нефротоксические, гепатотоксические, кардиотоксические, нейротоксические и аллергические реакции, а также миелосупрессия, ото- и гастротоксичность [5–7]. Цисплатинсодержащие схемы химиотерапии могут являться одним из факторов риска нарушения свертываемости крови, вызывая тромбозы артерий и/или вен [5, 6, 8, 9].
Анализ литературы позволяет сделать заключение, что цисплатин можно использовать для моделирования процессов тромбообразования на фоне химиотерапии. Данная модель позволит провести поиск путей фармакологической коррекции нарушений системы гемостаза, что будет способствовать оптимизации лекарственной терапии онкологических больных.
Цель исследования – изучить влияние цисплатина на показатели коагуляционного звена гемостаза экспериментальных мышей и крыс.
Материал и методы
Исследование проведено на 40 мышах (самцы и самки) линии CD 1 массой 20–30 г и 40 крысах (самцы и самки) стока SD массой 200–300 г (питомник НИИФиРМ им. Е.Д. Гольдберга, сертификат здоровья имеется). Мышей содержали в неполной барьерной системе в соответствии с правилами, принятыми Европейской Конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей [10]. Содержание животных и дизайн экспериментов были одобрены Комиссией по биоэтике НИИФиРМ им. Е.Д. Гольдберга.
Для моделирования нарушений свертывающей системы крови цисплатин (Cisplatin-LANS, ЛЭНС-ФАРМ ООО, Россия) вводили внутрибрюшинно однократно в максимально переносимой дозе (МПД): мышам – 10 мг/кг и крысам – 4 мг/кг. Контрольным животным в аналогичных условиях в эквивалентном объеме вводили физиологический раствор. Величину МПД установили в предварительных исследованиях.
Исследование показателей проводилось на 5, 10, 15-е сут после введения цитостатика. Забор крови осуществлялся в пластиковые пробирки путем пункции сердца. В качестве стабилизатора крови использовался 3,8 % раствор цитрата натрия в соотношении 9:1. Кровь центрифугировали для получения плазмы в течение 15 мин на 3000 об/мин. Исследование показателей системы коагуляционного гемостаза выполнялось на полуавтоматическом коагулометре Helena C-4 (Helena Biosciences Europe, Великобритания) с использованием реактивов фирмы «Технология-Стандарт» (г. Барнаул, Россия). Нарушение активности коагуляционного звена системы гемостаза определяли по изменению следующих показателей: активированное парциальное тромбопластиновое время (АПТВ, сек), протромбиновое время (ПВ, сек), международное нормализованное отношение (MHO), концентрация фибриногена, г/л.
Анализ полученных результатов исследования проводился с применением описательной статистики с расчетом среднего значения и стандартной ошибки среднего. Статистическая обработка полученных результатов проводилась с использованием пакета программ Statistica 6. Оценка межгрупповых различий проводилась с помощью непараметрического критерия Манна–Уитни. Различия определялись при 0,05 % уровне достоверности и обозначены маркером – *.
Результаты
При введении цисплатина в МПД у мышей-самок на 10-е сут исследования наблюдалось значимое увеличение содержания фибриногена на 103 % в сравнении с контрольными величинами (рис. 1). В этот же период исследования было отмечено сокращение АПТВ на 51 % в сравнении с соответствующим показателем группы контроля. Показатели ПВ и МНО на 10-е сут были снижены на 27 и 28 % соответственно. Со стороны ПВ и МНО наиболее выраженное снижение значений показателей было отмечено на 15-е сут исследования – на 30 и 34 %, тогда как АПТВ снизился на 42 % относительно контрольных значений.
При введении цисплатина мышам-самцам в МПД значимые отличия от показателей контроля выявлялись только на 10-е сут (рис. 2). В данный период исследования наблюдалось увеличение концентрации фибриногена на 82 % относительно значений контрольных животных. Также отмечалось снижение ПВ и МНО на 32 % и 34 % в сравнении с соответствующими показателями группы контроля. Значение показателя АПТВ на 10-е сут было ниже контрольных величин на 24 %.
У крыс при введении цисплатина в динамике показателей наблюдалась тенденция, сходная с таковой у мышей. При использовании цисплатина у крыс-самок в МПД на 10-е сут наблюдалось зна- чимое увеличение концентрации фибриногена – на 40 % по сравнению с контрольными показателями (рис. 3). В указанный период исследования также было выявлено уменьшение значений ПВ и МНО на 42 % и 47 % относительно показателей группы контроля. Значение АПТВ на 10-е сут сократилось на 30 % по сравнению с контрольными значениями. На 15-е сут значение ПВ практически не изменилось, и снижение составило также 40 %, значение МНО было ниже контрольных значений, однако значимых отличий не наблюдалось. Показатель АПТВ на 15-е сут также практически не изменился, и снижение составило 29 % относительно показателей контроля.
При введении цисплатина крысам-самцам на 10 и 15-е сут было отмечено достоверное снижение ПТ – на 24 % и 42 %, МНО – на 29 % и 48 % в сравнении с соответствующими показателями группы контроля (рис. 4). Уменьшение значения АПТВ на 24 % наблюдалось как на 10-е, так и на 15-е сут в сравнении с соответствующими показателями группы контроля.
Обсуждение
Цитостатическое действие цисплатина основано на способности сшивать пуриновые основания ДНК, вмешиваясь в механизмы репарации и повреждая ДНК, впоследствии вызывая апоптотиче-скую гибель клеток [6, 11]. Цисплатин усваивается и накапливается преимущественно в клетках печени и почек, вызывая каскады воспалительного и окислительного стресса, индуцируя образование активных форм кислорода (АФК) [6, 12].
Ферменты печени CYP450, участвуя в биотрансформации цитостатиков, играют важную роль в вызываемом лекарственными средствами развитии гепатотоксичности и нефротоксичности. Главным образом CYP2E1 из семейства цитохромов P450 за счет взаимодействия с цисплатином
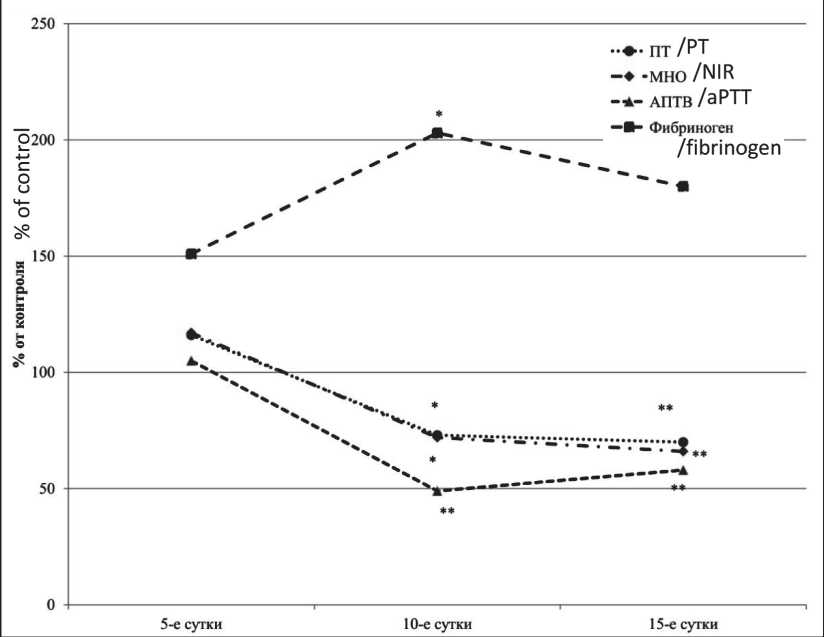
Рис. 1. Влияние цисплатина при однократном введении в МПД на показатели гемостаза самок мышей
-
Fig. 1. The effect of cisplatin after a single injection in the MPD on hemostasis indicators of female mice
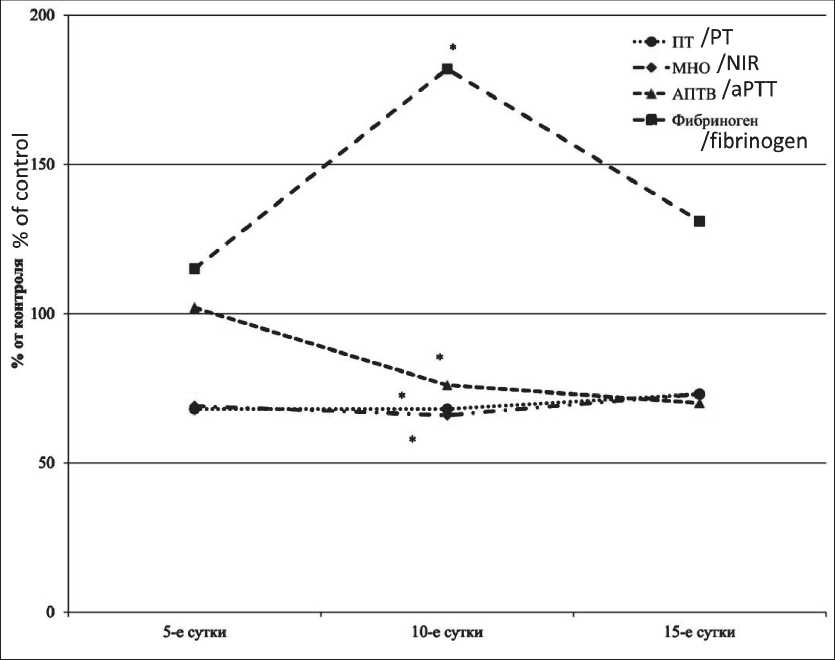
Рис. 2. Влияние цисплатина при однократном введении в МПД на показатели гемостаза самцов мышей
-
Fig. 2. The effect of cisplatin after a single injection in the MPD on hemostasis indicators of male mice
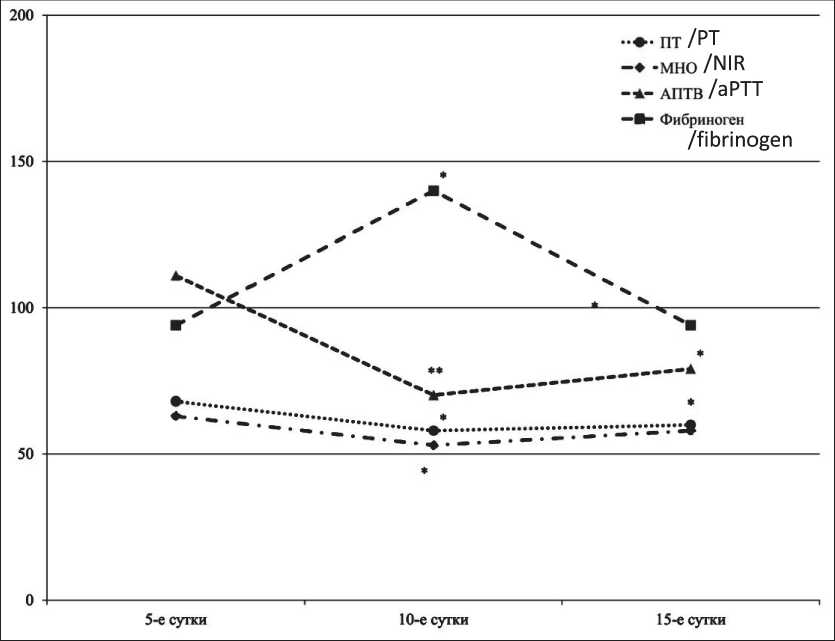
Рис. 3. Влияние цисплатина при однократном введении в МПД на показатели гемостаза самок крыс
-
Fig. 3. The effect of cisplatin after a single injection in the MPD on hemostasis indicators in female rats
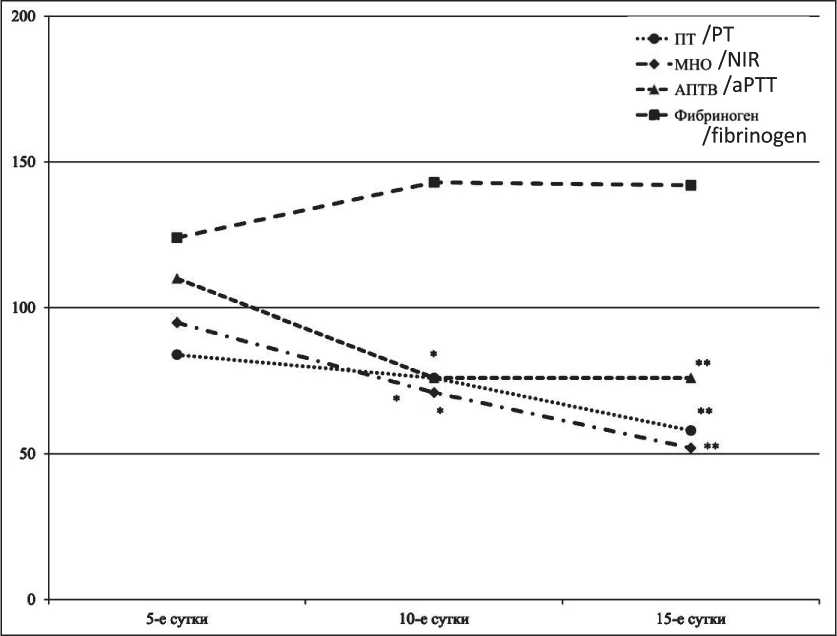
Рис. 4. Влияние цисплатина при однократном введении в МПД на показатели гемостаза самцов крыс
-
Fig. 4. Effect of cisplatin after a single injection in the MPD on hemostasis rates in male rats
вызывает образование АФК [13], что усиливает гепатотоксичность цисплатина [6]. Печень является местом синтеза фибриногена, факторов II, V, VII, IX, X, XI, XII, а также VIII, поэтому токсическое действие цисплатина на печень приводит также к сложным комплексным нарушениям в системе гемостаза [14], в частности к повышенной гиперкоагуляции и образованию тромбов.
Помимо гепатотоксичности (стеатоз и холестаз) [15], цисплатин вызывает повреждение эндотелия, приводящее к дисфункции эндотелиальных клеток и повышению уровня фактора Виллебранда в плазме, а также к снижению фибринолитической активности [16], что влечет за собой комплексные нарушения системы гемостаза. Чрезмерная продукция АФК вследствие введения цисплатина вызывает дисбаланс антиоксидантов, стимуляцию перекисного окисления липидов и повреждение клеток, в частности кровеносных сосудов [11, 17]. Следствием этого является выделение в кровь тканевого фактора, который активирует фактор VII, что приводит к активации фактора X и запускает процессы свертывания крови [18]. Этот «внешний» путь активации отражают показатели ПВ и МНО, снижение уровня которых указывает на гиперреактивность факторов свертывания (что может быть обусловлено гиперфибриногенемией) и свидетельствует о гиперкоагуляции и риске тромбозов.
Снижение АПТВ характеризует ускоренное образование активного комплекса протромбиназы, под влиянием которой происходит превращение II фактора из неактивной формы (протромбин) в активную (тромбин), что соответствует внутреннему механизму коагуляции. При повреждении эндотелия кровеносных сосудов запускается внутренний механизм вследствие активации плазмен- ного фактора ХII на мембране тромбоцитов. Таким образом, активация каскада плазменных факторов (XI, IX, VIII) приводит к активизации фактора X, дальнейшее развитие механизма свертывания идет по одному пути [18]. В проведенном исследовании снижение ПВ и АПТВ указывает на активацию как «внешнего», так и «внутреннего» механизма свертывания крови. В результате образующийся тромбин катализирует превращение фибриногена в фибрин, который составляет основу кровяного сгустка [18]. Таким образом, повышение концентрации фибриногена, так же как и снижение ПВ и АПТВ, свидетельствует о претромботическом состоянии и высоком риске развития тромбооб-разования на фоне действия цисплатина.
Список литературы Влияние цисплатина на показатели гемостаза экспериментальных животных
- Donnellan E., KhoranaA.A. Cancer and Venous Thromboembolic Disease: A Review. Oncologist. 2017; 22(2): 199-207. doi: 10.1634/ theoncologist.2016-0214.
- Сомонова О.В., Маджуга А.В., Елизарова А.Л. Тромбозы и тромбоэмболии в онкологии. Современный взгляд на проблему. Злокачественные опухоли. 2014; 3(10): 172-176. [Somonova O.V., MajugaA.V., ElizarovaA.L. Thrombosis and thromboembolism in oncology. A modern view of the problem. Malignant Tumors. 2014; 3(10): 172176. (in Russian)].
- KhoranaAA,KudererN.M., CulakovaE.,LymanG.H.,FrancisC.W. Development and validation of a predictive model for chemotherapy-associated thrombosis. Blood. 2008; 111(10): 4902-07. doi: 10.1182/ blood-2007-10-116327.
- OlgunD.C., Bakan S., Samanci C., Tutar O., Demiryas S., Korkma-zerB., Kantarci F. Simultaneous thrombosis of superior mesenteric artery and superior mesenteric vein following chemotherapy: MDCT findings. Jpn J Radiol. 2014 Feb; 32(2): 113-6. doi: 10.1007/s11604-013-0273-x.
- Khosla S., Kennedy L., Abdulaal Y. Cisplatin induced acutemes-enteric ischaemia: Acase report and review of the literature. International journal of surgery case reports. 2017; 41: 347-351. doi: 10.1016/j. ijscr.2017.11.007.
- Dasari S., Tchounwou P.B. Cisplatin in cancer therapy: molecular mechanisms of action. Eur J Pharmacol. 2014; 740: 364-78. doi: 10.1016/j. ejphar.2014.07.025.
- Topal i., OzbekBilgin A., Keskin Qimen F., Kurt N., Suleyman Z., Bilgin Y., OzfifekA., Altuner D. The effect of rutin on cisplatin-induced oxidative cardiac damage in rats. Anatol J Cardiol. 2018 Sep; 20(3): 136-142. doi: 10.14744/AnatolJCardiol.2018.32708.
- Lu C.F., Yu H.J., Hou J.X., Zhou J. Increased procoagulant activity of red blood cells in the presence of cisplatin. Chin Med J (Engl). 2008; 121(18): 1775-80.
- Sato C., Okuda K., Tamiya H., Yamamoto K., Hoshina K., Naru-moto O., Urushiyama H., Noguchi S., Amano Y., Watanabe K., Mitani A., Kage H., Tanaka G., Yamauchi Y., Takai D., Nagase T. Acute Arterial Thrombosis during Postoperative Adjuvant Cisplatin-based Chemotherapy for Completely Resected Lung Adenocarcinoma. Intern Med. 2018 Feb 15; 57(4): 557-561. doi: 10.2169/internalmedicine.8996-17.
- European Convention for the Protection of Vertebrate Animals used for Experimental and Other Scientific Purposes [Internet]. URL: https://www.coe.int/ru/web/conventions/full-list/conventions/ rms/090000168007a67b (cited 30.04.2019).
- GongC., QianL., YangH., JiL.L., WeiH., Zhou W.B., Qi C., WangC.H. Hepatotoxicity and pharmacokinetics of cisplatin in combination therapy with a traditional Chinese medicine compound of Zengmian Yiliu granules in ICR mice and SKOV-3-bearing nude mice. BMC Complement Altern Med. 2015 Aug 18; 15: 283. doi: 10.1186/s12906-015-0799-9.
- OmarH.A., Mohamed W.R., ArabH.H., Arafa el-S.A. Tangeretin Alleviates Cisplatin-Induced Acute Hepatic Injury in Rats: Targeting MAPKs and Apoptosis. PLoS One. 2016; 11(3): e0151649. doi: 10.1371/ journal.pone.0151649.
- Quintanilha J.C.F., de Sousa V.M., Visacri M.B., Amaral L.S., Santos R.M.M., Zambrano T., Salazar L.A., Moriel P. Involvement of cytochrome P450 in cisplatin treatment: implications for toxicity. Cancer Chemother Pharmacol. 2017 Aug; 80(2): 223-233. doi: 10.1007/s00280-017-3358-x.
- Минов А.Ф., Дзядзько А.М., Руммо О.О. Нарушения гемостаза при заболеваниях печени. Вестник трансплантологии и искусственных органов. 2010; 12(2): 82-91. [MinovA.F, Dzyadzko A.M., Rummo O.O. Hemostatic disorders in liver diseases. Russian Journal of Transplantology and Artificial Organs. 2010; 12(2): 82-91. (in Russian)..
- Floyd J., Mirza I., Sachs B., Perry M.C. Hepatotoxicity of chemotherapy. Semin Oncol. 2006 Feb; 33(1): 50-67. doi: 10.1053/j. seminoncol.2005.11.002.
- Heinrich N., Born M., Hoebert E., Verrel F., Simon A., Bode U., Fleischhack G. Aortobifemoral embolism in an 18-year old patient following cisplatin and 5-fluorouracil chemotherapy for nasopharyngeal carcinoma. Vasa. 2010 Aug; 39(3): 271-3. doi: 10.1024/0301-1526/a000042.
- DkhilM.A., Al-Quraishy S, ArefAM, OthmanM.S., El-DeibK.M., AbdelMoneim A.E. The potential role of Azadirachta indica treatment on cisplatin-induced hepatotoxicity and oxidative stress in female rats. Oxid Med Cell Longev. 2013; 2013: 741817. doi: 10.1155/2013/741817.
- Галстян ГМ., Суханова Г.А. Введение в гемостаз, современные препараты крови и их влияние на коагуляцию. Медицинский совет. 2013; 5-6: 11-16. [Galstyan G.M., Sukhanova G.A. Introduction to hemo-stasis, modern blood products and their effect on coagulation. Meditsinskiy sovet = Medical Council. 2013; 5-6: 11-16. (in Russian)].


