Влияние цвета освещения на состав белков крови молоди сибирского осетра Acipenser baerii
Автор: Ручин А.Б., Дудко А.А.
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Биохимия и физиология человека и животных
Статья в выпуске: 2, 2008 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14719003
IDR: 14719003
Текст статьи Влияние цвета освещения на состав белков крови молоди сибирского осетра Acipenser baerii
Молодь сибирского осетра была получена из ГУДП «Конаковский завод товарного осетроводства». После доставки в лабораторию при кафедре зоологии Мордовского государственного университета, где проходили эксперименты, рыбы выдерживались в общем аква риуме 20 дней при круглосуточном освещении люминесцентными лампами белого света (освещенность 50 лк). Затем для опытов рыб случайным образом отлавливали и помещали в проточные (2 л/час) аквариумы объемом 30—40 л с регулируемой температурой воды 21 ± 1°С и принудительной аэрацией (содержание кислорода 7,0—7,5 мг / л). В каждый аквариум помещали различное количество рыб (л), которых в начале и конце опыта взвешивали с точностью до 1 мг на весах Acculab. Вода поступала в аквариумы из одной «головной» емкости, где отстаивалась (дехлорировалась) не менее суток. Все опыты проведены в двукратной повторности.
Освещение над экспериментальными аквариумами создавали с помощью люминесцентной лампы марки ДБ. Спектр данной лампы, в котором присутствует весь набор длин волн, принимался за контроль. В опыте свет с помощью определенных стандартных фильтров разлагали на отдельные монохроматические зоны, которые условно обозначались по преобладающему цвету пропускания. Характеристики всех светофильтров и зоны их пропускания приведены ранее [10; 14].
Кровь брали после перерезания хвостовой артерии и вены [2]. Для изучения фракционного состава белков брали пробу крови в одну пробирку от двух особей из каждого варианта. В качестве антикоагулянта использовали гепарин. Белковый состав оценивали при помощи электрофореза в присутствии додецил-сульфоната натрия в денатурирующих условиях по методу Леммли [13]. Разделение белков проводили в мини-гелях толщиной 0,3 см. В качестве разделяющего геля использовали 15 % полиакриламидный гель, а в качестве концентрирующего — 7 % полиакриламидный гель. В качестве стандартов использовали окрашенные белки-маркеры с широким* диапазоном молекулярных масс (Prestained SDS-PAGE Standarts, Broad Range, Bio-Rad, Шв е © А. Б. ручин, А. А. Дудко, 2008
ция). Для сравнения применяли молекулярные маркеры фирмы Sigma (США, набор NMF — ND — 500): b-Lactalbumin (14,20 кДа); Albumin Chicken Egg (45,00 кДа) и Carbonic Anhydrase (29.00 кДа). Анализ протеиног-рамм проводили по относительной электрофоретической подвижности белковых фракций (Rf). Для анализа полученных результатов использовали пакет программ Gel Explorer (Copyright 2000, версия 1.0), содержащий программу Gel Imager, предназначенную для ввода и обработки изображений с устройства видеоввода, и программу Gel Analysis. Белок определяли стандартным методом по Бредфорду. Статистическая обработка цифрового материала проведена по общепринятой схеме с использованием /-критерия Стьюдента [3].
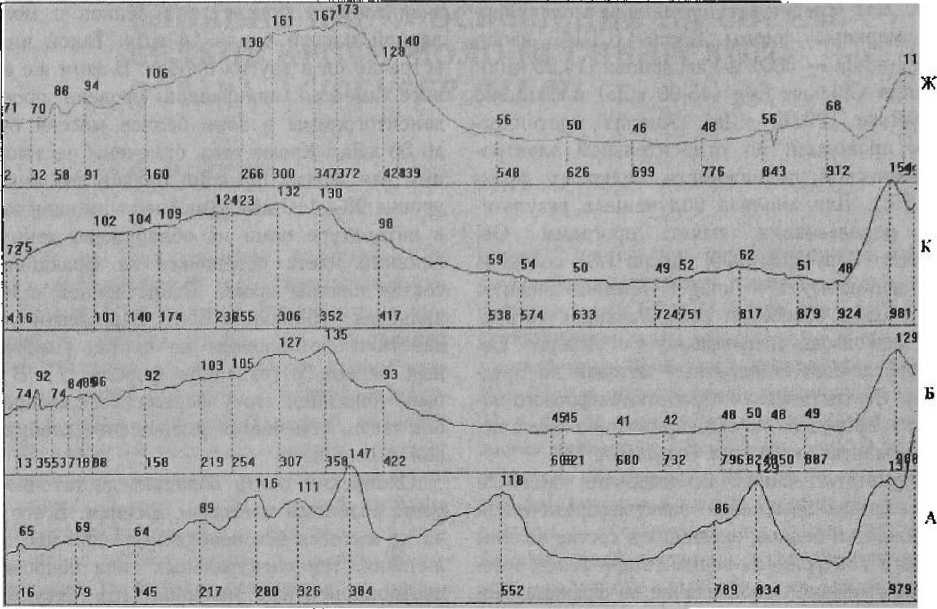
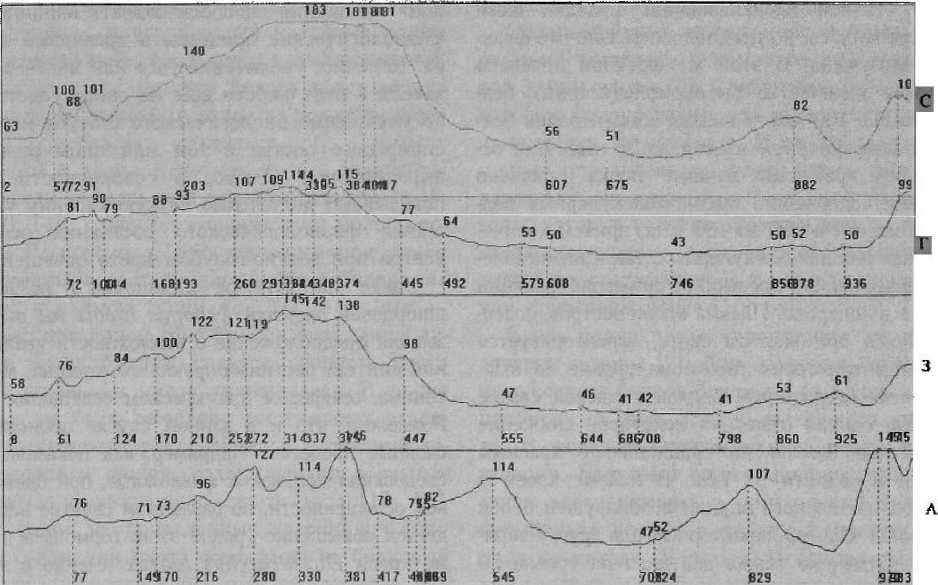
Результаты наших исследований выявили определенное изменение электрофоретической подвижности белков, входящих в состав плазмы крови. В контрольном варианте при белом освещении отмечено преобладание во фракции белков с молекулярной массой около 50—60 кДа (рис). Точной идентификации фракций нами не проводилось, но предположительно это фракция альбумина. В этой же фракции отмечено высокое количество высокомолекулярных белков свыше 100 кДа и низкая концентрация белков с молекулярной массой до 25 кДа. При освещении красными лучами также отмечено высокое содержание высокомолекулярных белков с массой от 50 до 100 кДа, причем количество как высокомолекулярных, так и низкомолекулярных белков превышает суммарно фракции белков в контроле. Плазма крови осетров, содержавшихся при желтом свете, характеризуется денситометрическим пиком на уровне 38 кДа, высоким содержанием белков с массой свыше 50 кДа, однако отмечено некоторое снижение количества белков по сравнению с красным светом в области 97 кДа. В плазме крови у осетров из зеленого варианта обнаружен белок массой 41 кДа, не характерный для других вариантов. Отмечено также два пика на уровне 50 и 55 кДа и постепенное снижение фракционных зон белков массой от 55 до 100 кДа.
При голубом освещении плазма характеризуется низким содержанием фракционных белков массой 50 кДа, причем количество белков и их концентрация самые низкие из всех приводимых проб. Синее освещение оказало другое влияние: в данной пробе отмечено значительное присутствие белков с молекулярной массой около 14 кДа. Такой пик не встречается в других пробах. В этом же варианте имеется одинаковой уровень профиля денситограммы в зоне белков массой от 49 до 56 кДа. Кроме того, отмечены нестандартные для других фракций белков два пика на уровне 98—ПО кДа. Как мы упоминали выше, в литературе нами не обнаружено данных о влиянии цвета освещения на фракционный состав плазмы крови. Единственной работой является публикация С. Я. Варгезовой о воздействии фотопериода на состав сывороточных белков у годовиков форели [1]. В ней было показано, что у форели, содержавшейся без света, отмечается уменьшение глобулиновой фракции.
Сибирский осетр обладает достаточно хорошо развитым цветовым зрением. В его сетчатке имеется все необходимое для цветораз-личения: три спектральных типа колбочек и цветооппонентные нейроны [15]. Результаты наших опытов показывают, что определенный цвет освещения способен оказать влияние на физиологические процессы в организме осетра. Конечно, увеличение того или иного показателя в отдельности еще не свидетельствует об улучшении биологического статуса молоди сибирского осетра в том или ином режиме выращивания. Однако в совокупности они показывают достаточно четкую картину улучшения физиологического состояния особей осетра при зелено-голубом цвете освещения.
Ранее на примере личиночного развития шпорцевой лягушки Xenopus laevis мы высказывали предположение о возможности увеличения синтеза ростингибирующего гормона, мелатонина, эпифизом при красном освещении [8]. Возможно, что и в данном случае происходят сходные процессы. Например, как показали исследования испанских физиологов, при одинаковой освещенности, но различном спектре наблюдается повышение уровня этого гормона в плазме крови Dicentrarchus lab rax именно в этом световом режиме по сравнению с зеленым и синим светом [11]. На нильской тиляпии было показано, что при голубом освещении после стрессового воздействия содержание кортизола в плазме становится несколько меньше и не увеличивается, как при обычном освещении [17]. То есть, в данном случае голубая зона спектра выступает в качестве стресс снимающего агента.
Рисунок
Фракционный состав белков плазмы крови молоди сибирского осетра, выращенного при различном монохроматическом освещении. (Цифры в нижней части графиков показывают электрофоретическую активность фракций (Rf); над графиками — указывают на процентное (в % от нуля) содержание той или иной фракции).
Варианты: Л — маркерные белки; Б — контроль; К — красный; Ж — желтый;
-
3 — зеленый; Г — голубой; С — синий
БИЛИОГРАФИЧЕСКИЙ СПИСОК
-
1, Варгезова С. А. Состав сывороточных белков у годовиков радужной форели при разной длительности освещения / С. А. Варгезова Н Сб. науч, тр. ГосНИОРХ. 1985. Вып. 229. С. 63—72.
-
2. Иванова И. Т. Атлас клеток крови рыб / Т. Н. Иванова. М. : Легк. и пищ. пром-ть, 1983. 184 с.
-
3. Лакин Г. Ф. Биометрия. / Г. Ф. Лакин. М. : Высш, школа, 1980. 293 с.
-
4. Протасов В. Р. Поведение рыб. (Механизмы ориентации рыб и их использование в рыбоводстве) / В. Р. Протасов М. : Пищ. пром-сть, 1978. 296 с.
-
5. Протасов В, Р. Электрофизиологическое изучение зрения у рыб / В. Р. Протасов / / Труды совещания по физиологии рыб. 1958. С. 111—114.
-
6. Радеико В. Н. Влияние различных световых режимов на эффективность заводского выращивания личинок пеляди Coregonus peled L. / В. Н. Радеико, П. В. Терентьев // Биология сиговых рыб. М. ; Наука, 1988. С. 216—225.
-
7. Раденко В. Н., Значение температуры и света для роста и выживаемости личинок белого толстолобика Hypophtalmichiis moUtrix / В. Н. Раденко, И. А. Алимов // Вопр. ихтиологии. 1991. Т. 31, вып. 4, С. 655—663.
-
8. Ручин А. Б. Влияние монохроматического света на рост и развитие личинок шпорцевой лягушки, Xenopus laeuts / А. Б. Ручин // Зоол. журнал. 2002. Т, 81, № 6. С. 752—756.
-
9. Ручин А. Б. Влияние светового режима на эффективность использования пищи и скорость роста рыб / А. Б. Ручин // Гидробиолог, журн. 2004. Т. 40, № 3. С. 48—52.
-
10. Ручин А. Б. Рост и интенсивность питания молоди карпа при различном постоянном и переменном монохроматическом освещении / А. Б. Ручин, В, С. Вечканов, В. А. Кузнецов / / Вопр. ихтиологии. 2002. Т. 42, № 2. С. 236—241.
-
11. Bayarri М. J. Influence of light intensity, spectrum and orientation on sea bass plasma and ocular melatonin / M. J. Bayarri, J. A. Madrid, F. J. Sanchez-Vazquez // J. Pineal Res. 2002. V. 32. P. 34—40.
-
12. Downing G. Impact of spectral composition on larval haddock, Melanogrammas aegleflrtus L., growth and survival / G. Downing // Aquacult. Intern. 2002. V. 33, № 2. P. 251—259.
-
13. Laemmli U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 / U. K. Laemmli // Nature. 1970. V. 227, № 5259. P. 680—685. '
-
14. Ruchin A. B. Influence of colored light on growth rate of juveniles of fish / A. B. Ruchin / / Fish Phys. Biochem. 2004. V. 30, № 2. P. 175—178.
-
15. Spectral characteristics of photoreceptors and horizontal cells in the retina of the Siberian sturgeon Acipenser baeri Brandt / V. I. Govardovskii, A. L. Byzov, L. V. Zueva. N. A. Polisczuk. E. A. Baburina / / Vision Res. 1991. V. 31, M 12. P. 2047—2056.
-
16. Stefansson S. O, The effect of spectral composition on growth and smelting in atlantic salmon (Salmo salar) and subsequent growth in sea cages / S. O. Stefansson, T. Hansen / / Aquaculture. 1989. V. 82, № 2. P. 155—162.
-
17. Volpato G. L Environmental blue light prevents stress in the njle tilapia / G. L. Volpato, R. E. Barreto // Brazil. J. Med. Biol. Res. 2001. V. 34. P. 1041—1045.
Поступила 04.02.08.
Список литературы Влияние цвета освещения на состав белков крови молоди сибирского осетра Acipenser baerii
- Варгезова С. А. Состав сывороточных белков у годовиков радужной форели при разной длительности освещения/С. А. Варгезова//Сб. науч. тр. ГосНИОРХ. 1985. Вып. 229. С. 63-72.
- Иванова Н. Т. Атлас клеток крови рыб/Т. Н. Иванова. М.: Легк. и пищ. пром-ть, 1983. 184 с.
- Лакин Г. Ф. Биометрия./Г. Ф. Лакин. М.: Высш. школа, 1980. 293 с.
- Протасов В. Р. Поведение рыб. (Механизмы ориентации рыб и их использование в рыбоводстве)/В. Р. Протасов М.: Пищ. пром-сть, 1978. 296 с.
- Протасов В. Р. Электрофизиологическое изучение зрения у рыб/В. Р. Протасов//Труды совещания по физиологии рыб. 1958. С. 111-114.
- Раденко В. Н, Влияние различных световых режимов на эффективность заводского выращивания личинок пеляди Coregonus peled L./В. Н. Раденко, П. В. Терентьев//Биология сиговых рыб. М.: Наука, 1988. С. 216-225.
- Раденко В. Н., Значение температуры и света для роста и выживаемости личинок белого толстолобика Hypophtalmichtis molitrix/В. Н. Раденко, И. А. Алимов//Вопр. ихтиологии. 1991. Т. 31, вып. 4. С. 655-663.
- Ручин А. Б. Влияние монохроматического света на рост и развитие личинок шпорцевой лягушки, Xenopus laevis/А. Б. Ручин//Зоол. журнал. 2002. Т. 81, № 6. С. 752-756.
- Ручин А. Б. Влияние светового режима на эффективность использования пищи и скорость роста рыб/А. Б. Ручин//Гидробиолог, журн. 2004. Т. 40, № 3. С. 48-52.
- Ручин А. Б. Рост и интенсивность питания молоди карпа при различном постоянном и переменном монохроматическом освещении/А. Б. Ручин, В. С. Вечканов, В. А. Кузнецов//Вопр. ихтиологии. 2002. Т. 42, № 2. С. 236-241.
- Bayarri М. J. Influence of light intensity, spectrum and orientation on sea bass plasma and ocular melatonin/M. J. Bayarri, J. A. Madrid, F. J. Sanchez-Vazquez//J. Pineal Res. 2002. V. 32. P. 34-40.
- Downing G. Impact of spectral composition on larval haddock, Melanogtammus aegiefiritis L., growth and survival/G, Downing//Aquacult. Intern. 2002. V. 33, № 2. P. 251-259.
- Laemmli U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4/U. K. Laemmli//Nature. 1970. V. 227, № 5259. P. 680-685.
- Ruchin A. B. Influence of colored light on growth rate of juveniles of fish/A. B. Ruchin//Fish Phys. Biochem. 2004. V. 30, № 2. P. 175-178.
- Spectral characteristics of photoreceptors and horizontal cells in the retina of the Siberian sturgeon Acipenser baeri Brandt/V. I. Govardovskii, A. L. Byzov, L. V. Zueva, N. A. Polisczuk,E. A. Baburina//Vision Res. 1991. V. 31, № 12. P. 2047-2056.
- Stefansson S. O. The effect of spectral composition on growth and smolting in atlantic salmon (Salmo salar) and subsequent growth in sea cages/S. O. Stefansson, T. Hansen//Aquaculture. 1989. V. 82, No 2. P. 155-162.
- Volpato G. L. Environmental blue light prevents stress in the nile tilapia/G. L. Volpato, R. E. Barreto//Brazil. J. Med. Biol. Res. 2001. V. 34. P. 1041-1045.


