Влияние дегидроабиетиновой кислоты на термоиндуцированные структурные переходы мембран клеток крови
Автор: Борисова Александра Григорьевна, Суханова Галина Антоновна, Рожков Сергей Павлович, Горюнов Андрей Сергеевич
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 2 (92), 2008 года.
Бесплатный доступ
Методами равновесного термогемолиза и дифференциальной сканирующей микрокалориметрии исследовано взаимодействие дегидроабиетиновой кислоты с мембранами клеток крови человека и форели. Показано, что механизм воздействия состоит в детергентной деструктуризации липидного бислоя мембраны, приводящей к гемолизу эритроцита, модификации контактов фосфолипидов с мембранными и цитоскелетными белками и их дестабилизации.
Эритроцит, мембрана, дегидроабиетиновая кислота, термогемолиз, дифференциальная сканирующая калориметрия
Короткий адрес: https://sciup.org/14749399
IDR: 14749399 | УДК: 577.352.2:57.044:57.088.5
Текст научной статьи Влияние дегидроабиетиновой кислоты на термоиндуцированные структурные переходы мембран клеток крови
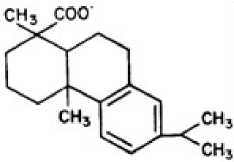
Рис. 1. Структура дегидроабиетиновой кислоты (С19Н29СОО–)
Абиетиновая кислота – соединение, относящееся к классу природных трициклических дитерпенов с общей формулой С 19 Н 29 СООН. Это одна из самых распространенных в природе смоляных кислот, которые составляют основную часть живицы, канифоли, талового масла.
Дегидроабиетиновая кислота (ДГАК) – основной низкомолекулярный токсикант, обычно обнаруживаемый в стоках целлюлозно-бумажного
производства и в окружающей среде в высоких концентрациях [1]. Одна из главных физиологических проблем, возникающих при воздействии ДГАК на организм, – гемолиз эритроцитов и выход из них гемоглобина, из которого образуется билирубин, накапливающийся в плазме и приводящий к развитию желтухи. Считается, что гемолиз происходит в результате нарушения функционирования плазматической мембраны [2]. В случае радужной форели, часто подверженной воздействию ДГАК при заводском разведении, снижение клеточной АТФ при накоплении ДГАК в эритроцитах сопровождается нарушением регуляции концентрации внутриклеточных ионов и гемолизом [2–4]. Имеются данные о биоаккумуляции ДГАК в плазме: очень высокое содержание в плазме (>200 мг/л) этой смоляной кислоты наблюдалось у радужной форели, подверженной сублетальным концентрациям ДГАК [5]. Одна из предполагаемых причин накопления билирубина и ДГАК в плазме – это конкуренция за мембрано-связанную анионтранспортную систему, поскольку билирубин, ДГАК и их производные выступают как анионы при физиологических рН [6, 7].
Влияние многих токсических агентов среды на клетки крови является опосредованным и может быть связано, например, со сдвигом коллоидно-осмотического баланса в сыворотке. Однако поверхностно-активные вещества и лекарства, являющиеся такими веществами, зачастую воздействуют на структуру мембраны и механические свойства клеток непосредственно [8–19]. Гемолитические свойства смоляных кислот могут быть обусловлены тем, что молекулы ДГАК способны растворяться в липидном бислое, увеличивая его проницаемость, и вызывать разрушение мембраны и клетки [3]. Поскольку многие амфифильные соединения воздействуют на функционирование и целостность клеточных мембран [20–22], возможно, что ДГАК – также амфифильное соединение – имеет сходный механизм активности.
Исследования методом ЭПР спиновых меток взаимодействия ДГАК с мембранами эритроцитов человека показали существенную зависимость параметров подвижности и порядка липидного бислоя мембран и спектра ЭПР спин-меченых белков цитоскелета от концентрации ДГАК, эффект которой на структурнодинамическое состояние цитоскелетных белков определен как первичный [23]. Таким образом, вопрос о способе взаимодействия ДГАК с клеточной мембраной, о том, является ли гемолиз результатом прямого детергентного воздействия ДГАК на липидный бислой или обусловлен влиянием на другие мембранные процессы, остается открытым. Поэтому в настоящей работе внимание сосредоточено на изучении в первую очередь мембранотропного механизма действия дегидроабиетиновой кислоты, тем более что установленный факт ее токсичности по отно- шению к эритроцитам позволяет использовать эти клетки как систему для изучения взаимодействия ДГАК с мембраной. Параллельные исследования гемолиза и структурных характеристик мембран эритроцитов форели способны существенно дополнить представления о механизме действия ДГАК и других ПАВ.
Цель настоящей работы – изучение влияния ДГАК на термические превращения и свойства мембран эритроцитов человека и форели, отражающие их структурное состояние: термогемолиз эритроцитов, термостабильность и термоиндуцированные переходы мембранных и цитоскелет-ных белков. В сравнительном аспекте изучены лимфоциты человека для выяснения особенностей взаимодействия ДГАК с клеточной мембраной. С этой целью в работе использовались методы равновесного термогемолиза эритроцитов и дифференциальной адиабатической сканирующей микрокалориметрии (ДАСМ).
МАТЕРИАЛЫ И МЕТОДЫ
Использовалась водорастворимая дегидроабиетиновая кислота (ДГАК) (Sigma, > 85 % содержания изоформ в препарате).
Термогемолиз эритроцитов (равновесный вариант) . Термостабильность эритроцитов в изотоническом буферном растворе при воздействии ДГАК оценивалась по степени гемолиза эритроцитов. Для этого суспензия эритроцитов инкубировалась при температуре 36-62 ° C в течение времени т , охлаждалась, выдерживалась при 4 ° C 3-4 часа и центрифугировалась (700 g в течение 10 мин.); затем в надосадочной жидкости определялось количество высвободившегося гемоглобина по поглощению при 540 нм (спектрофотометр Specoll 11, Carl Zeiss). Степень гемолиза рассчитывалась как отношение количества вышедшего в раствор гемоглобина к общему количеству гемоглобина, которое определялось в исходной суспензии также спектрофотометрически. Скорость 50 %-ного лизиса красных клеток суспензии k50= 1/ т 50 (мин-1), где т 50 -время 50 %-ного лизиса, определялась путем нелинейного регрессионного анализа на основе сигмоидной модели кривых лизиса и использовалась как показатель термоустойчиво сти эритроцитов. Кроме того, в качестве показателя термостабильности эритроцитов использовалась энергия активации (Е акт ) термогемолиза, полученная из аррениусовских графиков скорости гемолиза k 50 .
Дифференциальная сканирующая микрокалориметрия. Термические свойства мембран эритроцитов отражают общее конформационное состояние белковой компоненты – белковой глобулы или фибриллы в целом. Регистрацию температурных кривых избыточного удельного теплопоглощения эритроцитов человека и форели и мембран (теней) эритроцтов в суспензии проводили на микрокалориметре ДАСМ–4 (ИБП РАН). Термоиндуцированные структурные переходы в эритроцитах и тенях эритроцитов регистрировались согласно процедуре, описанной в работах [24, 25] в диапазоне температур 15-100°C. Суспензии интактных эритроцитов или их теней (эритроцитов, освобожденных от внутриклеточного содержимого) помещались в платиновые ячейки микрокалориметра объемом 0,464 мл. Скорость сканирования составляла 1 К/мин. Уровень шума и воспроизводимость базовой линии были 0,5 и 3 цВт соответственно. Избыточное давление 2 атм поддерживалось в измерительных ячейках во время регистрации термограмм во избежание возможной дегазации образцов при нагревании. Базовая линия, получаемая при заполнении обеих ячеек буферным раствором, вычиталась из каждой экспериментальной термограммы. Для оценки обратимо сти тепловых переходов проводился повторный нагрев и сканирование тех же образцов после их охлаждения в ячейках микрокалориметра. Эта повторная калориметрическая запись вычиталась из первой для получения температурной зависимости удельного избыточного теплопоглоще-ния ΔCp эритроцитов, их теней и лимфоцитов для последующего анализа и графического представления. Температуры термоиндуцированных структурных переходов мембран определялись как температуры максимумов избыточного теплопоглощения образцов ΔCp.
Получение эритроцитов и суспензий их мембран (теней). Консервированная кровь человека, отобранная в гемоконсервант (2 %-ный раствор цитрата натрия в 3 %-ном растворе глюкозы), отмывалась от плазмы и трижды центрифугировалась (3000 g, 30 минут) в изотоническом фосфатно-солевом буферном растворе (0,01 М натрий-фосфатный буферный раствор (рН 7,4), 0,15 М NаСl). В результате получался осадок эритроцитов, который разводился в буферном растворе до концентрации суспензии 0,2–2 % объемных.
Эритроциты радужной форели Salmo irideus изучались при двух температурах акклиматизации (4 и 19 ° C), близких к границам интервала температур обитания для форели. Эти температуры определяют различные физиологические состояния рыб, соответствующие зимнему и летнему типам метаболизма. Кровь отбиралась из хвостовой вены в раствор гепарина (5000 ед/мл), чтобы предотвратить коагуляцию (100 ц л / 10 мл крови), немедленно центрифугировалась (700 g), и после удаления плазмы и слоя лейкоцитов эритроциты отмывались трижды раствором Кортланда без глюкозы (124 мM NaCl, 5 мM KCl, 1,6 мM CaCl 2 , 1 мM MgSO 4 , 3 мM NaH 2 PO 4 , 12 мM NaHCO 3 , pH 8,0). К осадку эритроцитов добавлялся десятикратный избыток изотонического буферного раствора (145 мM NH 4 Cl, 4 мM KCl, 10 мM
NaHCO 3 , 5 мM CaCl 2 , 1 мM MgSO 4 , 15 мM Hepes, 1 мM PMSF, pH 7,5), и смесь выдерживалась при 0оС 15–20 минут. Гемолизат центрифугировали при 20000 g 30 минут при 4оС в том же буфере трижды [26, 27].
Получение лимфоцитов и их суспензий. Лимфоциты выделялись из крови здоровых доноров по методике [28]. Кровь, взятая с антикоагулянтом, отстаивалась в течение 40 минут; затем надосадочная жидкость вместе с белой пленкой лейкоцитов отбиралась, разводилась фосфатносолевым буферным раствором (рН 7,4) и наслаивалась на градиент фиколл-верографин (ρ = 1,077 г/мл) в объемном соотношении 1:3. Пробирки центрифугировали при 400 g 30 минут. Слой клеток между градиентом и буфером содержал взвесь лимфоцитов, которые трижды отмывались в фосфатно-солевом буферном растворе при 400 g 5 минут. Взвесь клеток разводилась до концентрации (0,75–1)·107 кл/мл; подсчет велся в камере Горяева.
Содержание мембран в образцах контролировался путем высушивания суспензий при 100°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Термогемолиз эритроцитов. Для изучения влияния ДГАК на устойчивость эритроцитов к температурному лизису проводили термогемолиз при различных температурах и концентрациях ДГАК. В концентрации 2·10-5 М при комнатной температуре (22 ºС) ДГАК не вызывала гемолиза эритроцитов человека в течение 24 часов. В присутствии 4·10-4 М ДГАК константа скорости гемолиза составила k 50 = 9·10-4 мин-1.
При 58ºС выход сигмоидных кривых термогемолиза на плато в присутствии ДГАК наступал раньше, чем в контрольной суспензии. Существенное усиление гемолитического эффекта наблюдалось уже при концентрации ДГАК выше 4·10-5 М. Эти данные подтверждают существующее представление о том, что ДГАК способна вызывать деструкцию мембраны эритроцита, которая приводит к гемолизу. Степень гемолиза зависит как от концентрации ДГАК, так и от температуры, при которой инкубировались клетки.
Дифференциальная сканирующая микрокалориметрия.
Эритроциты. На рисунке 2 показаны термограммы избыточного теплопоглощения суспензии теней эритроцитов форели, акклиматизированной при разных температурах. На кривой для 14 ° C отчетливо видны пять термоиндуцированных структурных переходов мембраны теней и отсутствует переход ядра эритроцита форели благодаря высокой степени обратимости этого перехода. Эта общая – с пятью пиками – форма термограммы ДСК для эритроцитов выглядит в значительной степени аналогично полученным для различных видов млекопитающих (человек, крыса, свинья, собака) и рыб (форель) [24, 25, 29–32].
При этом температуры и относительная интенсивность переходов могут различаться. Распознавание отдельных переходов может быть проведено на основании взаимного соответствия их температур и общего сходства формы термограмм. Аналогия в последовательности переходов, их числе и относительных положениях позволяет связать их с соответствующими группами мембранных белков, отталкиваясь от термограмм для мембран эритроцитов человека (таблица 1).
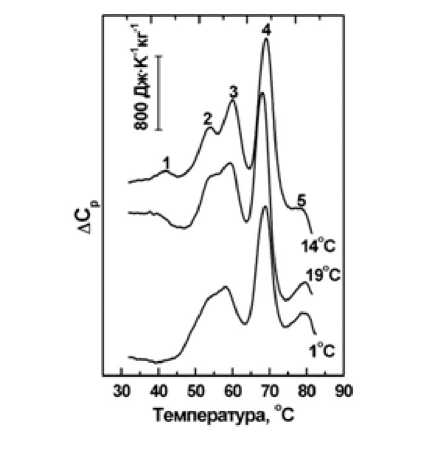
Рис. 2. Температурные зависимости избыточного удельного теплопоглощения ΔCp суспензий мембран (теней) эритроцитов форели при различных температурах акклиматизации: 1, 14, 19°C
Таблица 1
Температуры термоиндуцированных переходов ( ° С) для различных групп белков интактных эритроцитов человека и форели
|
№ пика |
Цельные эритроциты |
Эритроцитарные мембраны (тени) |
|||
|
Форель |
Человек ** |
Форель |
Человек ** |
Группа белков |
|
|
1 |
43,5– 44,0 |
50,0 |
40,0–42,0 |
49,5 |
а , р -спектрин -актин |
|
2 |
47,5– 48,0 |
56,8 |
53,0–55,0 |
56,0 |
анкирин, п.4.1 и 4.2 |
|
3 |
57,0– 58,0* |
63,8 |
59,0–60,0 |
62,0 |
цитоплазматический домен п.3 |
|
4 |
62,0– 64,0* |
72,4 * |
68,0–70,0 |
68,0 |
мембранный домен п.3 |
|
5 |
76,0 |
^^^^^в |
78,0–79,0 |
78,0 |
тропомиозин |
* денатурационный переход гемоглобина
** данные для эритроцитов человека взяты из работ [25, 30, 32]
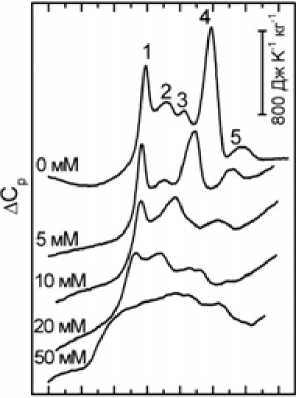
Рисунки 3 и 4 иллюстрируют влияние ДГАК на термоиндуцированные переходы (термопереходы) в мембранных белках эритроцитов форели, акклиматизированной при разных температурах, и человека. Для интактных эритроцитов человека и форели необратимые термопереходы на калориметрических кривых обусловлены тепловой денатурацией (нарушением упорядоченной трехмерной структуры, характерной для нативной молекулы, с разрывом критического числа нековалентных связей, фиксирующих эту структуру) молекул мембранных белков эритроцитов. Интегральная интенсивность пиков, соответствующих переходам, отражает энтальпию денатурации ΔH d . Под действием ДГАК уменьшается интегральная интенсивность пиков всех термопереходов вплоть до их полного исчезновения. Это указывает на то, что при взаимодействии ДГАК с мембраной происходит частичная химическая денатурация белков, в результате которой снижается энтальпия ΔH d термопереходов. Зависимости температуры термопереходов от концентрации ДГАК представлены на рисунках 5 и 6 для эритроцитов человека и форели. Видно, что температура термопереходов, которая отражает температуру денатурации соответствующих белков, значительно понижается под действием ДГАК, что указывает на термодестабилизацию белков цитоскелета эритроцитов в результате их химической денатурации в присутствии ДГАК.
20 30 40 50 60 70 80 90
Температура. °C
Рис. 3. Температурные зависимости избыточного удельного теплопоглощения A C p суспензии мембран (теней) эритроцитов человека при различных концентрациях дегидроабиетиновой кислоты – 0, 5, 10, 20 и 50 мМ. Пики отражают тепловые переходы различных участков мембраны, включая белок и соответствующую область липидного бислоя. Отнесение пиков – в таблице 1
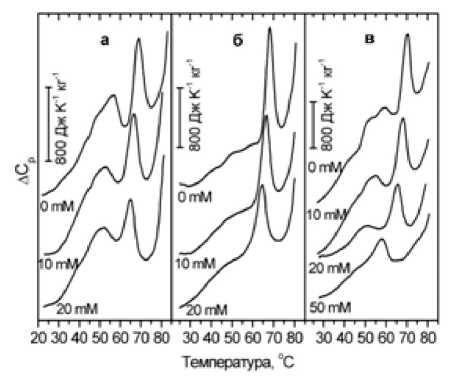
Рис. 4. Температурные зависимости избыточного удельного теплопоглощения A Cp суспензии мембран (теней) эритроцитов форели при концентрациях ДГАК 0, 10, 20 и 50 мМ и температурах акклиматизации (окружающей воды)
4 ° C (а), 10 ° C (б) и 19 ° C (в)
ДГАК существенно модифицирует мембрану эритроцита начиная с концентрации 5 - мМ, воздействуя в первую очередь на мембранный домен анионтранспортного канала (белок полосы 3) (пик 4 на рис. 2–4): при концентрации ДГАК 20 - мМ происходит чрезвычайно значительное снижение температуры перехода – сдвиг максимума пика достигает ~ 15 ° C у эритроцитов человека (рис. 5) и ~ 4 ° C - у эритроцитов форели (рис. 6), а также наиболее значительное из всех переходов уменьшение энтальпии (примерно в два раза у эритроцитов человека уже при 5 - мМ) и в меньшей степени у эритроцитов форели при всех температурах акклиматизации.
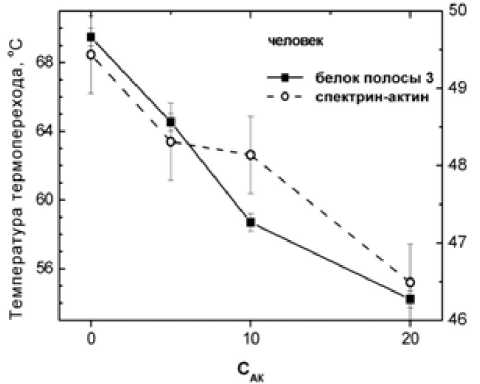
Рис. 5. Зависимость температуры термоиндуцированных переходов белков мембраны эритроцитов человека от концентрации (мМ) ДГАК. Левая ось температур – для мембранного домена белка полосы 3, правая – для цитоскелетно-го белкового комплекса спектрин-актин-полоса 4.1
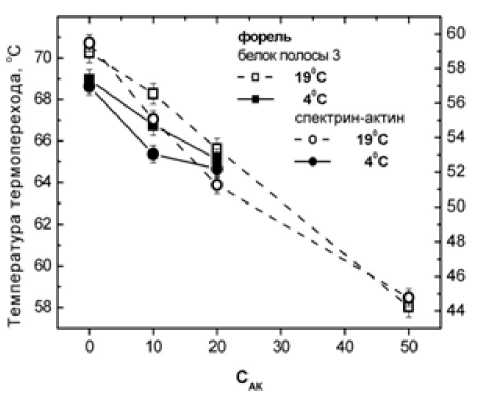
Рис. 6. Зависимость температуры термоиндуцированных переходов белков мембраны эритроцитов форели от концентрации (мМ) ДГАК при температурах акклиматизации 4 и 19 оС. Левая ось температур – для мембранного домена белка полосы 3, правая – для цитоскелетного белкового комплекса спектрин-актин-полоса 4.1
Аналогичный, но значительно меньший эффект ДГАК наблюдается в отношении термоперехода комплекса спектрин-актин (пик 1): как для человека, так и для форели изменения в области этого термоперехода менее заметны. В случае эритроцитов человека температура термодестабилизации понижается лишь на ~3 ° C, а интенсивность пиков комплекса уменьшается незначительно.
Характер изменения формы термопереходов других мембранных белков – белков полос 2.1, 4.1, 4.2, 5 (термопереходы серии 2) и цитоплазматического домена белка полосы 3 (термопереход 3) менее очевиден, чем переходов 1 и 4. Однако на рис. 3 и 4 можно видеть, что в области переходов 2 и 3 изменения под действием ДГАК незначительны. В случае эритроцитов человека эти изменения при концентрации ДГАК 5 - мМ имеют примерно тот же порядок, что и для комплекса спектрин-актин (пик 1). При дальнейшем повышении содержания ДГАК переходы объединяются с пиком 4, а затем и с пиком 1, что может указывать на образование большого комплекса этих белков, когда их термопревращения перестают быть сколько-нибудь независимыми процессами. В случае эритроцитов форели изменения в области пиков 2 и 3 также менее выражены по сравнению с пиком 4, объединения с которым в этом случае вообще не происходит. Выраженность изменений в области пиков 2 и 3 отличается при высокой (19 ° C) и низкой (4 ° C) температурах акклиматизации.
Приведенные результаты показывают, что гемолитический эффект ДГАК наблюдается методом равновесного термогемолиза при концентрациях (4·10-5 М), гораздо меньших, чем те, при которых проявляется эффект ДГАК на мембранные белки, регистрируемый с помощью термографии (5⋅мМ). Это указывает на то, что механизм гемолитического действия ДГАК обусловлен воздействием ДГАК в первую очередь на липидный бислой мембраны эритроцита, а не на мембранные белки, модификация которых в присутствии ДГАК, очевидно, является вторичным эффектом по отношению к гемолитическому.
Полученные данные также свидетельствуют о том, что преобладающий эффект ДГАК на мембранные белки состоит в наиболее существенной модификации мембранного домена белка полосы 3 по сравнению с другими белками.
Мембранный домен белка полосы 3, являясь трансмембранной частью анион-транспортного белкового канала, погружен в липидный бислой мембраны эритроцита и частично экспонирован как во внеклеточную, так и внутриклеточную среду. Благодаря этому способ его взаимодействия с экзогенными химическими агентами может отличаться от способа взаимодействия с другими белками, регистрируемыми термографически (спектрин-актин, анкирин, цитоплазматический домен белка полосы 3), которые экспонированы исключительно во внутриклеточную среду и имеют лишь ограниченные контакты с фосфолипидами мембраны. Это обусловливает существенно большую подверженность мембранного домена белка полосы 3 действию ДГАК за счет влияния на его структуру при нарушении липидного микроокружения белкового домена в результате деструкции липидного бислоя. Судя по меньшей чувствительности остальных белков к действию ДГАК, они подвергаются модификации только после разрушения мембраны и гемолиза при проникновении ДГАК в разрушенную клетку в результате изменения контактов с липидным бислоем при его деструкции. Кроме того, меньшая чувствительность этих белков к влиянию ДГАК может объясняться их интегрированностью в цитоске-летный каркас клетки, что способно стабилизировать их структуру, и меньшей площадью контакта с липидным бислоем, что делает зависимость их состояния от деструкции бислоя менее значительной.
На термограммах для эритроцитов человека видна тенденция к совмещению и объединению в один широкий всеохватывающий переход всех пиков при концентрации ДГАК 50⋅мМ. В случае эритроцитов форели такого объединения не происходит в исследованном диапазоне концентраций ДГАК. Объединение пиков свидетельствует об образовании высокомолекулярных агрегатов мембранных белков, которое хорошо известно для случаев окислительной деградации мембран эритроцитов [25]. В составе агрегатов белковые домены претерпевают изменение своей конформации. При этом они остаются связанными с мембраной, т. к. нам не удалось обна- ружить каких-либо белков или их агрегатов в супернатанте. Степень перекрывания пиков на термограммах отражает интенсивность межмолекулярного взаимодействия и/или указывает на нивелирование отличий в характере взаимодействия белков с микроокружением – белковым, липидным и водным – в результате изменения их конформационного состояния под влиянием ДГАК.
Известно, что цитоскелетная сеть эритроцитов форели гораздо более развитая и содержит больше актиновых структур. Это может препятствовать комплексообразованию белков цитоскелета мембраны при разрушении липидного бислоя под действием ДГАК.
Однако общее снижение температуры термопереходов всех серий указывает на единый механизм воздействия ДГАК на структуру всех белков мембраны. Это воздействие, видимо, состоит в ослаблении внутримолекулярных контактов элементов третичной структуры внутри каждого из белков при одновременном усилении межмолекулярного взаимодействия между белками. Усиление взаимного перекрывания отдельных пиков и уменьшение их разрешенности, очевидно, отражает снижение кооперативности денатурационных термопереходов, отвечающих плавлению отдельных мембранных белков или их структурных доменов.
Cнижение температуры термопереходов и интенсивности пиков отдельных мембранных белков (энтальпии денатурации ΔHd) однозначно указывает на уменьшение термостабильности (свободной энергии стабилизации ΔGd) этих макромолекул под действием ДГАК.
Характер зависимости температуры термопереходов мембранных белков эритроцитов форели не зависит решающим образом от температуры акклиматизации животных, однако выраженность изменения в области переходов 2, 3 отличается у эритроцитов форели, акклиматизированной при 4 и 19 оС (рис. 4). Известно, что липидный состав мембран эритроцитов форели претерпевает существенные сезонные вариации, и, следовательно, характер белок-липидных контактов и их вклад в свободную энергию стабилизации мембранных белков может отличаться при разных температурах акклиматизации. Эффект разрыва этих контактов для термопереходов соответствующих белков под действием ДГАК будет в таком случае различным.
Отсутствие зависимости температуры термопереходов от температуры акклиматизации рыб указывает на то, что устойчивость мембранных белков эритроцитов форели к действию ДГАК не зависит от липидного состава мембраны. Вероятно, структурное состояние белков определяется микроокружением, в котором роль липидов не является решающей.
Лимфоциты. На рисунках 7 и 8 представлены результаты изучения воздействия ДГАК на мембрану лимфоцитов методом дифференци- альной сканирующей микрокалориметрии. На рисунке 7 показана термограмма интактных лимфоцитов в суспензии, не содержащей и содержащей разные концентрации ДГАК.
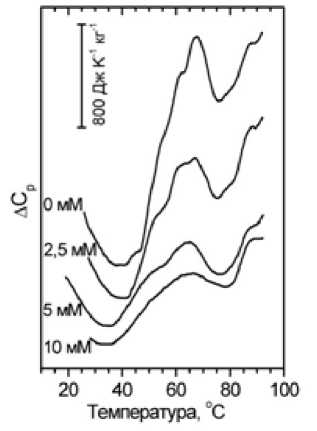
Рис. 7. Температурные зависимости избыточного удельного теплопоглощения Δ Cp суспензии мембран лимфоцитов человека при различных концентрациях ДГАК – 0, 2,5, 5 и 10 мМ (сверху вниз). Пики отражают тепловые переходы различных участков мембраны, включая белок и соответствующую область липидного бислоя
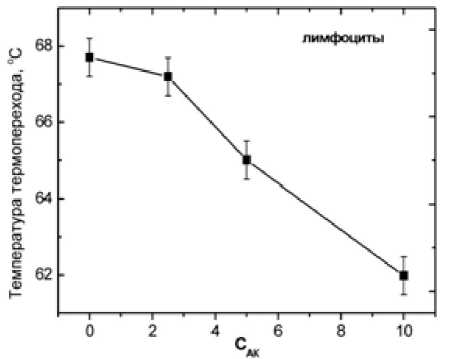
Рис. 8. Зависимость температуры главного максимума термоиндуцированных переходов интактных лимфоцитов человека от концентрации (мМ) ДГАК
Форма термограмм лимфоцитов человека под влиянием ДГАК изменяется в целом аналогично тому, как это происходит в случае эритроцитов. Данные об отнесении термопереходов в мембранах лимфоцитов к определенным видам мембранных белков в литературе отсутствуют. Исключение составляет только наиболее высокотемпературный пик. Он соответствует температуре 87–88 ºС, так же как и у эритроцитов.
Поэтому его можно идентифицировать с термопереходом в ядре лимфоцита, обусловленном плавлением хроматинового комплекса [33]. Обратимость этого перехода у лимфоцитов, очевидно, существенно меньше, чем у эритроцитов.
Остальные пики уменьшаются по интенсивности (энтальпии перехода) и сдвигаются в сторону низких температур. Зависимость температуры главного максимума термограммы лимфоцитов от концентрации ДГАК представлена на рисунке 8. Эти данные показывают, что воздействие на лимфоциты ДГАК вызывает термодестабилизацию белковой компоненты мембраны.
Степень перекрытия пиков возрастает с увеличением содержания ДГАК. Таким образом, в присутствии ДГАК в суспензии лимфоцитов термостабильность белков мембраны и цитоскелета также снижается: уменьшается температура денатурационного перехода, снижается энтальпия денатурации и кооперативность соответствующих структурных переходов.
ЗАКЛЮЧЕНИЕ
Термотропные свойства мембран клеток крови (эритроцитов и лимфоцитов) отражают общее (глобальное) конформационное состояние белковой компоненты – состояние белковой глобулы или фибриллы в целом. Воздействие ДГАК на мембрану (липидный бислой) существенным образом изменяет как гемолитическую устойчивость интактных эритроцитов, так и термотропные свойства плазматических мембран клеток, модифицируя структуру как мембранных, так и цитоскелетных белковых доменов. Полученные результаты позволяют считать, что в основе гемолитического эффекта ДГАК по отношению к эритроцитам лежат ее детергентные свойства как амфифильного соединения: молекулы ДГАК способны вызывать разрушение мембраны, воздействуя в первую очередь на липидный бислой. Эффект термодестабилизации мембранных белков вторичен и проявляется при более высоких концентрациях ДГАК, когда молекулы ДГАК, находясь в результате лизиса эритроцита уже как во внутри-, так и во внеклеточной среде, встраиваются в липидный бислой мембраны и разрушают как бислой, так и естественное липидное микроокружение мембранных и, в меньшей степени, цитоскелетных белковых доменов, что приводит к их дестабилизации. В наибольшей степени такое воздействие оказывается на мембранный домен белка полосы 3 ввиду того, вероятно, что объем его липидного микроокружения наибольший. Внутримолекулярные взаимодействия в белках мембраны эритроцитов и лимфоцитов под влиянием ДГАК ослабляются, а межмолекулярные усиливаются.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, грант № 08-04-98825.
Список литературы Влияние дегидроабиетиновой кислоты на термоиндуцированные структурные переходы мембран клеток крови
- Oikari A. Acute lethal toxicity of some reference chemicals to freshwater fishes of Scandinavia//Bull.Environ.Contam.Toxicol. 1987. V. 39. N. 1. P. 23-28.
- Pitchard J. B., Walden R., Oikari A. Dehydroabietic acid, a major anionic contaminant of pulp mill effluent, reduces both active p-aminohippurate transport and passive membrane permeability in isolated renal membranes//J.Pharm.Exp.Therapeut. 1991. V. 259. N. 1. P. 156-163.
- Bushnell P. G., Nikinmaa M., Oikari A. Metabolic effects of dehydroabietic acid on rainbow trout erythrocytes//Comp.Biochem.Physiol. 1985. V.81C. P. 391-394.
- Matsoff L., Nikinmaa M. Effects of plasma proteins on the dehydroabietic acid-induced red cell breakdown//Ecotoxicol. Environ. Saf. 1987. V. 14. N. 2. P. 157-163.
- Oikari A., Anäs E., Kruzynski G., Holmbom B. Free and conjugated resin acids in the bile of rainbow trout, Salmo gairdneri//Bull. Environ. Contam. Toxicol. 1984. V. 33. N. 2. P. 233-240.
- Klaassen C. D., Watkins J. B. 3rd. Mechanisms of bile formation, hepatic uptake, and biliary excretion//Pharmacol. Rev. 1984. V. 36. N. 1. P. 1-67.
- Matsoff L., Oikari A. Acute hyperbilirubinaemia in rainbow trout (Salmo gairdneri) caused by resin acids//Comp. Biochem. Physiol. C. 1987. V. 88. N. 2. P. 263-268.
- Rаdnоvа N. A., Ророv Ch. S. Studies on the hemolytic effect of chlorpromazine//Proc. Bulgarian. Acad.. Sci. 1978. V. 31. N. 5. P. 595-598.
- dе Вruijnе A.W., vаn Stеvеninсk J. The effect of anesthetics and heart treatment on deformability and osmotic fragility of red blood cells//Biochem. Pharmacol. 1979. V. 28. N. 2. P. 177-182.
- Butikofer P., Brodbeck U., Ott P. Modulation of erythrocyte vesiculation by amphiphilic drugs//Biochim. Biophys. Acta. Biomembranes. 1987. V. 901. N. 150. P. 291-295.
- Fujii T., Sato T., Tamura A., Wakatsuki M., Kahano Y. Shape changes of human erythrocytes induced by various amphiphatic drugs acting on the membrane of the intact cell//Biochem. Pharmacol. 1979. V. 28. P. 613-620.
- Fоgt A., Hägerstrand H., Isomaa B. Effects of N,N'-bisdimetyl-1,2-thanediamine dichloride, a doublechain surfactant, on membrane-related functions in human erythrocytes//Chem. Biol. Interact. 1995. V. 94. P. 147-155.
- Tragner D., Csordas A. Biphasic interaction of Triton detergents with the erythrocyte membrane//Biochem. J. 1987. V. 244. N. 3. P. 605-609.
- Constantinescu A., Frangopor P. T., Mdrgineau D. G. Temperature dependence of the tertiary amines effects on the osmotic properties of human erythrocytes//Cent. Inst. Phys. (Rept.). NRB. 1985. V. 16. P. 55-65.
- Шпакова Н. М., Бондаренко В. А. Действие хлорпромазина на температурную и осмотическую чувствительность эритроцитов//Биохимия. 1991. Т. 56. № 12. С. 2125-2130.
- Бладергрен В. Физическая химия в медицине и биологии. М.: Изд-во Иностранной литературы, 1951. 600 c.
- Мицеллообразование, солюбилизация и микроэмульсии./Миттел К. М.: Мир, 1980. 600 c.
- Lее А. G. Т. Effects of charged drugs on the phase transition temperatures of phospholipid bilayers//Вiосhim. Вiорhуs. Асtа. 1978. V. 514. N. 1. Р. 95-104.
- Jоhnsоn R. М. The kinetics of resealing of washed erythrocyte ghosts//J. Меmbr. Вiоl. 1975. V. 22. N. 3-4. Р. 231-253.
- Seeman P. The membrane actions of anesthetics and tranquilizers//Pharmacol. Rev. 1972. V. 24. N. 4. P. 583-655.
- Isomaa B., Hagerstrans H., Paatero G., Engblom A. C. Permeability alterations and antihaemolysis induced by amphiphiles in human erythrocytes//Biochim. Biophys. Acta. 1986. V. 860. P. 510-524.
- Hagerstrans H., Isomaa B. Vesiculation induced by amphiphilies in erythrocytes//Biochim. Biophys. Acta. 1989. V. 982. P. 179-186.
- Butterfield D. A., Trad C. H., Hall N. C. Effects of dehydroabietic acid on the physical state of cytosceletal proteins and the lipid bilayer of erythrocyte membranes//Biochim. Biophys. Acta. 1994. V.1192. P. 185-189.
- Zhadan G. G., Cobaleda C., Jones A. L., Leal F., Villar E., Shnyrov V. L. Protein involvement in thermally induced structural transitions of pig erythrocyte ghosts//Biochem. Mol. Biol. Int. 1997. V. 42. P. 11-20.
- Akoev V. R., Matveev A. V., Belyaeva T. V., Kim Y. A. The effect of oxidative stress on structural transitions of human erythrocyte ghost membranes//Biochim. Biophys. Acta. 1998. V. 1371. P. 284-294.
- Romano L., Passow H. Characterization of anion transport system in trout red blood cell//Am. J. Physiol. 1984. V. 246. P. 330-338.
- Fievet B., Perset F., Gabillat N., Guizouarn H., Borgese F., Ripoche P., Motais R. Transport of uncharged organic solutes in Xenopus oocytes expressing red cell anion exchangers (AE1s)//Proc. Natl. Acad. Sci. USA. 1998. V. 95. N. 18. P. 10996-10001.
- Berger C. L., Edelson R. L. Comparison of lymphocyte function after isolation by ficoll-hypaque flotation or elutriation//J. Invest. Dermatol. 1979. V. 73. N. 3. P. 231-235.
- Shnyrov V. I., Orlov S. N., Zhadan G. G., Pokudin N. I. Thermal inactivation of membrane proteins, volume-dependent Na+,K+-cotransport, and protein kinase C activator-induced changes of the shape of human and rat erythrocytes//Biomed. Biochim. Acta. 1990. V. 49. P. 445-453.
- Brandts J. F., Erickson K., Lysko K., Schwartz A. T., Taverna R. D. Саlоrimеtriс studiеs оf thе struсturаl trаnsitiоns оf thе humаn еrуthrосуtеs mеmbrаnе. Тhе invоlvеmеnt оf sресtrin in thе А trаnsitiоn//Biochemistry. 1977. V. 16. P. 3450-3454.
- Акоев В. Р., Бобровский Р. В., Жадан Г. Г., Салия Ц. Х., Багелева Я., Шныров В. Л. Калориметрическое исследование структурных переходов в мембранах эритроцитов собаки//Биол. мембраны. 1991. Т. 8. С. 78-84.
- Lysko K., Carlson R., Taverna R., Snow J., Brandts J. F. Рrоtеin invоlvеmеnt in struсturаl trаnsitiоns оf erуthrосуtе ghоsts. Usе оf thеrmаl gеl anаlуsis tо dеtесt prоtеin aggrеgаtiоn//Вiосhеmistrу. 1981. V. 20. N. 19. Р. 5570-5576.
- Topchishvili L. S., Barbakadze S. I., Khizanishvili A. I., Majagaladze G. V., Monaselidze J. R. Microcalorimetric study of iodized and noniodized cells and C-phycocyanin of Spirulina platensis//Biomacromolecules. 2002. V. 3. N. 3. P. 415-420.


