Влияние диет на состав микрофлоры кишечника и на иммунные процессы в организме человека
Автор: Правосудова Н.А., Марфина О.В., Мельников В.Л.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2024 года.
Бесплатный доступ
Диеты через формирование доминирующего микробного ядра влияют на метаболические процессы в организме, что определяет изменения в иммунном ответе индивидуума. В статье рассмотрено влияние основных диетических режимов на разнообразие и состав микрофлоры кишечника. У веганов и вегетарианцев обнаруживается большее разнообразие видов из группы Bacteroidetes, увеличивается количество молочнокислых бактерий, таких как Ruminococcus, E. rectale и Roseburia, и уменьшается количество видов Clostridium и Enterococcus. Этот тип питания способствует усилению протективных свойств кишечника за счет повышения количества бактерий, активирующих иммунные механизмы. Кетогенная диета увеличивает количество Bacteroides и Akkermansia muciniphila, с уменьшением численности протеобактерий Вifidobacteria, E. rectale, Dialister. Как результат, она меняет баланс про- и противовоспалительных механизмов в кишечнике. Безглютеновая диета вызывает снижение Bifidobacterium, Lactobacillus, Clostridium lituseburense, Faecalibacterium prausnitzii, Veillonellacea, Ruminicoccus bromii, Roseburia и увеличение доли Enterobacteriacea (в том числе Escherichia coli), Victivallaceae, Clostridiaceae и Coriobacteriaceae. Этот тип питания способствует чрезмерному росту условно-патогенных микроорганизмов и ослабляет защиту хозяина от инфекций и хронических воспалений. Диета с низким содержанием короткоцепочечных углеводов (FODMAP) может привести к уменьшению количества бифидо-, пропионибактерий, F. prausnitzii, Akkermansia, Ruminococcus и повышению популяции Clostridiaceae (Peptostreptococcus spp.) и, как результат, снижает активность иммунных механизмов. Западный тип питания приводит к снижению Bifidobacteria, Roseburia, Eubacterium, Ruminococcus, Lactobacillus, Prevotella и увеличению количества Enterobacteria, Alistipes, Bacteroides; за счет изменения состава нормальной микрофлоры увеличивает тенденцию к ожирению и ослаблению защитных свойств. При средиземноморской диете происходит увеличение концентрации F. prausnitzii, Bifidobacterium, Lactobacillus, Ruminococcus, Bacteroides и снижение количества Clostridium, E. coli. Это вызывает уменьшение количества оппортунистических микроорганизмов и активацию иммунных механизмов.
Микрофлора кишечника, веганская и вегетарианская, кетогенная, безглютеновая, средиземноморская диеты, диета с низким содержанием короткоцепочечных углеводов (fodmap), западный тип питания, иммунные механизмы
Короткий адрес: https://sciup.org/147244922
IDR: 147244922 | УДК: 579.61 | DOI: 10.17072/1994-9952-2024-2-190-204
Текст обзорной статьи Влияние диет на состав микрофлоры кишечника и на иммунные процессы в организме человека
Микробиом кишечника представлен миллионами микроорганизмов и является наиболее многочисленным и разнообразным.
Кишечник млекопитающих заселен микроорганизмами, принадлежащими к сотням различных видов. Микробиом толстой кишки составляет около 70% всех микроорганизмов тела человека. Вирусы, простейшие, гельминты составляют около 1% микрофлоры толстого кишечника. Метагеномные исследования микрофлоры показали, что бактериальная популяция принадлежит к четырем типам: Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria . Tипы Firmicutes и Bacteroidetes составляют более 80% бактериальной популяции в толстой кишке. При этом группа Firmicutes представлена родами Clostridium, Ruminococcus, Eubacterium, Roseburia (IV и XIVa типы клостридий), а также Lactobacillus . Группа Bacteroidetes включает грамотрицательные палочки, относящиеся к Bacteroides и P revotella . Представители типов Actinobacteria и Proteobacteria практически всегда присутствуют в составе микробиоты в относительно невысоком содержании (1–3%). Наиболее важным представителем типа Actinobacteria является род Bifidobacterium . К типу Proteobacteria относится семейство Enterobacteriaceae (вид E. coli ).
Кроме основных видов, в небольшом количестве в составе кишечного микробиома выделяются Fuso-bacteria, Verrucomicrobia (вид Akkermansia muciniphilla ) [Кожевников и др., 2017; Milani et al., 2017; Карпеева и др., 2020; Hosoda et al., 2020].
Микробиота кишечника рассматривается как жизненно важный орган, связанный с работой других органов посредством иммунных, нервных, эндокринных путей [Shi et al., 2017; Singh et al., 2017; Ивашкин, Зольникова, 2019; Стома, 2020; Lum, Olson, Hsiao, 2020; Afzaal et al., 2022; Almeida et al., 2023]. Микроорганизмы кишечника человека (в основном непатогенные) имеют симбиотические отношения с хозяином и обычно связаны с иммунитетом хозяина для защиты от патогенной инвазии.
Кроме прямого антагонистического действия на патогены, кишечная микробиота синтезирует метаболиты (короткоцепочечные жирные кислоты, вторичные желчные кислоты, нейротрансмиттеры и др.), которые играют ключевую роль в созревании и регуляции иммунных клеток [Габидуллин и др., 2009; Smith et al., 2013; Otálora-Otálora et al., 2023].
Например, гранулоциты контролируются сигналами бактерий-комменсалов, чьи медиаторы имеют эффект в том числе на клетки костного мозга человека. NOD-опосредованное воздействие мезодиамино-пимелиновой кислоты (продукта расщепления пептидогликана бактерий) способствует усилению нейтрофильной реакции на патогены (Staphylococcus aureus и Streptococcus pneumoniae). В эксперимен- тах у изначально стерильных мышей мезодиаминопимелиновая кислота появлялась в крови и костном мозге в течение 3 сут. после колонизации E. coli, тем самым показывая, что бактериальные лиганды из просвета кишечника характеризуются системным распределением и, следовательно, приводят к системным эффектам. Функция, миграция антиген-презентирующих дендритных клеток, продукция интерлейкинов, уровни иммуноглобулинов, количество Т-клеток и продукция γ-ИФН также зависит от бактерий микробиоты [Singh et al., 2017; Оганезова, 2018; Карпеева и др., 2020].
Короткоцепочечные жирные кислоты (КЦЖК), такие как ацетат, пропионат и бутират, влияют на иммунные процессы, целостность гематоэнцефалического барьера, обеспечивают энергетическими субстратами клетки кишечника и регулируют важнейшие функции кишечника [Tomova et al., 2019; Sakkas et al., 2020]. КЦЖК оказывают значительное воздействие на иммунные клетки: вызывают хемотаксис нейтрофилов [Nilsson et al. 2003; Vinolo et al., 2011a, b, c], снижают выработку хемокина (MCP-1) макрофагами (особенно бутират) [Cox et al., 2009]. Кроме того, присутствие данных метаболитов модулирует синтез медиаторов воспаления иммунными клетками. КЦЖК оказывают противовоспалительный эффект за счет увеличения концентрации противовоспалительных цитокинов (IL-10, TNF-α) и снижения активности провоспалительных (IL-12) медиаторов моноцитами человека [Säemann et al., 2000; Tedelind et al., 2007; Vinolo et al., 2011a, b, c; Ивашкин, Зольникова, 2019]. Кроме того, бутират снижает воспалительные реакции в нейроглии [Huuskonen et al., 2004].
Общее влияние микрофлоры на физиологические изменения в иммунном ответе организма человека представлены в таблице.
Роль основных представителей микрофлоры в иммунном ответе
[The role of the main representatives of microflora in the immune response]
|
Бактерия |
Влияние на физиологические изменения в иммунном ответе |
|
Bifidobacterium spp. |
Выработка короткоцепочечных жирных кислот (КЦЖК). Защита от кишечных патогенов с помощью прямой конкуренции, активности гидролазы желчных кислот, модуляции локального иммунного ответа и способности создавать высокую пристеночную концентрацию вблизи кишечного эпителия [Singh et al., 2017; Hiippala et al., 2018] |
|
Bacteroides: Bacteroides spp ., В. fragilis |
Активация CD4+ Т-клеток [Johnson, Jones, Cobb, 2015] Выработка КЦЖК (ацетата, пропионата), которые участвуют в регуляции дифференциации эпителиальных клеток кишечника, созревании и стимуляции иммунной системы [Wrzosek et al., 2013] |
|
Lactobacillus spp. |
Продукция КЦЖК; противовоспалительная и противораковая активность [Thananimit, Pahumunto, Teanpaisan, 2022] |
|
Candidatus spp. (сегментированные нетевидные бактерии) |
Участвуют в стимулировании генерации Тh-17 клеток и снижению продукции ИЛ-17, ИЛ-21, ИЛ-22, а также фактора, стимулирующего рост колоний гранулоцитарных макрофагов (GM-CSF) [Gaboriau-Routhiau et al., 2009; Lécuyer et al., 2014]. |
|
Roseburia spp. |
Производство КЦЖК [Tamanai-Shacoori et al., 2017] Противовоспалительный эффект [Zhu et al., 2018; Shen et al., 2018] |
|
Eubacterium spp. |
Производство бутирата [Louis et al., 2010] |
|
Faecalibacterium prausnitzii |
Продукция КЦЖК; противовоспалительные эффекты [Sokol et al., 2008; Miquel et al., 2013; Moon et al., 2023] |
|
Akkermansia muciniphila |
Выработка КЦЖК, противовоспалительное действие [Shin et al., 2014; Dunn et al., 2016; Ansaldo et al., 2019] Противоопухолевое действие [Routy et al., 2018; Jiang et al., 2023] |
|
Ruminococcus spp. |
Синтез веществ с антибактериальной активностью [Balty et al., 2019; Chiumento et al,. 2019] Модулирование иммунных реакций (противо- или провоспалительный эффект в зависимости от условий и штамма) [Crost et al., 2023] |
|
Escherichia coli |
Активация Toll-подобных рецепторов (TLR) и активация синтеза провоспали-тельных медиаторов [Bäckhed et al., 2003] |
Следовательно, нарушение кишечной микробиоты может приводить к различным заболеваниям человека, такими как тревога, депрессия, гипертония, сердечно-сосудистые заболевания, ожирение, диабет, воспалительные заболевания кишечника и рак. Механизм, приводящий к развитию заболевания, имеет решающую корреляцию с микробиотой кишечника, продуктами метаболизма и иммунным ответом хозяина у человека. Понимание механизмов положительного или вредного воздействия на микробиоту кишечника остается в значительной степени неопределенным. Однако многие недавние клинические исследования, проведенные во всем мире, демонстрируют связь конкретных видов микробов и эубиоза в норме и при заболеваниях. Питание оказывает непосредственную роль на состав кишечной микрофлоры.
В медицинской научной литературе на сегодняшний день описан ряд пищевых привычек и диет, способных изменять микробный состав. Диеты оказывают влияние на микробиоту кишечника посредством изменения содержания различных питательных и биологически активных веществ.
Целями данной работы были анализ результатов исследований по влиянию различных диет на микробное разнообразие кишечника, а также рассмотрение воздействия микробного профиля на иммунные процессы организма.
Материалы и методы
Был проведен обзор литературы в электронных базах Googl Academia и Connectedpapers. Для работы были выбраны основные диетические режимы: веганская и вегетарианская, кетогенная, безглютеновая, средиземноморская диеты, диета с низким содержанием короткоцепочечных углеводов (FODMAP), а также западный тип питания. В исследование были включены только работы, содержащие информацию об изменении микробиоты в результате использования различных режимов питания, а также влияние микрофлоры на различные защитные механизмы.
Веганская и вегетарианская диеты
Рацион вегетарианцев и веганов исключает мясо и морепродукты. Кроме того, веганы не употребляют в пищу и продукты животного происхождения: яйца, молоко и молочные продукты, а также мед.
У веганов и вегетарианцев наблюдается изменение кишечного микробиома по сравнению с лицами, использующими продукты животного происхождения. У веганов и вегетарианцев обнаруживается большее разнообразие видов из группы Bacteroidetes , для которых основным питательным субстратом являются сложные углеводы [Martens et al., 2009; Zafar, Saier, 2021]. Клетчатка (т.е. неперевариваемые углеводы, содержащиеся исключительно в растениях) увеличивает количество молочнокислых бактерий, таких как Ruminococcus , E. rectale и Roseburia , и уменьшает количество видов Clostridium и Enterococcus . Полифенолы, также широко представленные в растительной пище, увеличивают количество бифидобактерий и лактобактерий, которые обеспечивают антагонистическое действие по отношению к патогенной микрофлоре, а также противовоспалительное действие и защиту сердечно-сосудистой системы. Высокое потребление клетчатки также способствует росту видов, которые ферментируют клетчатку в метаболиты в виде короткоцепочечных жирных кислот (КЦЖК).
Растительные волокна и КЦЖК (ацетат и бутират) стимулируют продукцию и секрецию слизи в кишечнике. Bacteriodes – активные продуценты ацетата и бутирата [Zafar, Saier, 2021], способствуют дифференциации бокаловидных клеток кишечника и экспрессии генов, ответственных за синтез муцина. Также растительные волокна способны механически стимулировать выделение слизи эпителием кишечника. КЦЖК играют важную роль в репарации тканей кишечника, что важно при воспалительных процессах. Также КЦЖК регулируют дифференцировку остеокластов и ингибируют резорбцию кости. Бутират может вызывать метаболические изменения в остеокластах путем окислительного фосфорилирования, что снижает экспрессию генов остеокластов, таких как TRAF6 и NFATc, что приводит к снижению дифференцировки остеокластов и замедлению резорбции кости [Wrzosek et al., 2013].
Бактериоды стимулируют продукцию ангиогенина-4 клетками Панета в слизистой оболочке тонкого кишечника. Ангиогенин-4 обладает антимикробным спектром в отношении как грамотрицательных, так и грамположительных бактерий [Hooper et al., 2001; Walker et al., 2013].
Диета с высоким содержанием растительной клетчатки увеличивает плотность комменсальных бактерий микробиома и таким образом ограничивает доступ патогенных бактерий к кишечному эпителию. КЦЖК могут стимулировать секрецию иммуноглобулинов класса А [Стома, 2020].
Кроме того, короткоцепочечные жирные кислоты влияют на ряд важных физиологических функций: снижают pH толстой кишки, уровень холестерина, улучшают толерантность к глюкозе, ингибируют рост Enterobacteriaceae ( Salmonella spp. , Escherichia coli ), стимулируют всасывание воды и абсорбцию натрия, обеспечивают энергией эпителиальные клетки толстой кишки, ингибируют пролиферацию раковых клеток [Sakkas et al., 2020]. Механизм действия сводится к тому, что короткоцепочечные жирные кислоты выступают в роли лиганда для G белков (GPCR), стимулируют гистонацетилтрансферазы, ингибируют гистондеацетилазы и стабилизируют индуцируемый гипоксией фактор (HIF). Таким образом, они влияют на пролиферацию, дифференцировку, экспрессию генов, отвечающих за продукцию цитокинов [Данилова и др., 2019].
Сильное воздействие на иммунную систему оказывают представители отдела Firmicutes , а именно лактобактерии . Lactobacillus rhamnosus GG (LGG) продуцирует антимикробные факторы, которые подавляют активность таких микроорганизмов, как Clostridium spp., Pseudomonas spp., Salmonella spp., Escherichia coli, Staphylococcus и Streptococcus spp. Несмотря на то, что LGG активно подавляет рост кишечных патогенов, в отношении других симбионтов/комменсалов этот штамм демонстрирует пацифизм, не конкурируя с ними и не вытесняя другие лактобациллы, а также положительно влияет на адгезию бифидобактерий.
Рецептором для Lactobacillus rhamnosus GG на клеточной поверхности эпителиальных, макрофагальных и других клеток иммунной системы являются TLR 2-го типа, которые стимулируют сигнальный каскад через фактор транскрипции NF-kB, что ведет к экспрессии широкого спектра цитокинов. Даже термически обработанные микроорганизмы повышают продукцию иммунокомпетентными клетками IL-4 и IL-10, а также дозозависимо снижают продукцию TNF-α, индуцируемую микробными липополисахаридами (ЛПС). Установлено, что LGG подавляют экспрессию генов, кодирующих субъединицы опосредующего аллергию высокоаффинного рецептора IgE (allergy-related high-affinity IgE receptor — FCER1) и H4-рецептор гистамина на тучных клетках, выделенных из периферической крови человека. Перечисленные механизмы определяют противовоспалительный и противоаллергический эффекты рассматриваемых микроорганизмов [Оганезова, 2018].
Следовательно, веганская и вегетарианская диеты увеличивают биоразнообразие кишечной микрофлоры, повышают количество той части бактериального микробиома, которая отвечает за стимуляцию защитных механизмов кишечника.
Кетогенная диета
Кетогенная диета – низкоуглеводная диета с высоким содержанием жиров и умеренным содержанием белков. Она используется для лечения эпилепсии и синдрома дефицита транспортера глюкозы 1 типа (GLUT1) [Neal et al., 2009; Christensen, Damsgaard, Fink-Jensen, 2021]. В настоящее время диета активно применяется для борьбы с лишним весом. Однако, помимо плюсов, диета имеет свои недостатки. В ходе исследований было установлено, что кетодиета может привести к возникновению неалкогольной жировой болезни печени или способствовать развитию резистентности к инсулину [Kosinski, Jornayvaz, 2017]. Кроме того, данная диета значительно влияет на состав микробиоты организма. Низкое содержание углеводных компонентов кетогенной диеты снижает биоразнообразие кишечной микрофлоры, т.к. сложные углеводы являются основными субстратами для микроорганизмов. Изучение микробиоты детей после трехмесячной кетогенной диеты показало смещение микробного ядра в сторону Bacteroides и Akker-mansia muciniphila , с уменьшением численности протеобактерий, Вifidobacteria, E. rectale, Dialister [Xie et al., 2017; Olson et al., 2018; Paoli et al., 2019; Donatella, Aurelio, 2020].
-
A. muciniphila влияет на накопление жировой ткани, изменяя липидный и углеводный обмен [Everard et al., 2013; Depommier et al., 2019]. Кроме того, эта бактерия оказывает противовоспалительное действие при болезни Крона [Dunn et al., 2016] за счет увеличения количества противовоспалительных регуляторных Т-клеток (Treg) [Shin et al., 2014] и снижения уровня провоспалительного IL-8 [Zhai et al., 2019]. Этот микроорганизм продуцирует КЦЖК, которые контролируют концентрацию и функции регуляторных Т-лимфоцитов [Smith et al., 2013]. A. muciniphila влияет на гуморальный иммунный ответ, увеличивая количество В-лимфоцитов [Katiraei et al., 2020] и индуцирует синтез IgG1 [Ansaldo et al., 2019].
Снижение уровня бифидобактерий опосредовано повышенным производством кетоновых тел, в первую очередь бета-гидроксибутирата. Данное явление приводит к снижению уровня провоспалитель-ных Th17 в кишечнике и висцеральном жире [Ang et al., 2020].
Таким образом, кетогенная диета значительно изменяет микробиом, а следовательно, баланс противо-и провоспалительных механизмов в кишечнике.
Безглютеновая диета
Безглютеновая диета широко применяется в терапии целиакии (аутоиммунного заболевания, вызванного непереносимостью глютена). Изучение микробиоты здоровых людей после месяца безглютеновой диеты продемонстрировало снижение Bifidobacterium, Lactobacillus, Clostridium lituseburense, F. prausnitzii, Veillonellacea, Ruminicoccus bromii и Roseburia и увеличение доли Enterobacteriacea (в том числе Escherichia coli ), Victivallaceae, Clostridiaceae и Coriobacteriaceae [De Palma et al., 2009; Sanz, 2010; Bonder et al., 2016].
При понижении концентрации лактбактерий и бифидобактерий наблюдается снижение концентрации короткоцепочечных жирных кислот, что нарушает поддержание метаболизма и иммунных функций. В частности, штаммы Bifidobacterium (B. longum) могут стимулировать секрецию противовоспалительного IL-10. По-видимому, безглютеновая диета приводит к генерализованному снижению бактериально-индуцированной продукции цитокинов в результате снижения общей бактериальной нагрузки толстого кишечника [De Palma et al., 2009; Sanz, 2010].
-
E. coli может проникать в эпителиальные клетки, размножаться в макрофагах и способствовать формированию гранулемы. Адгезивно-инвазивная E. coli LF82 использует для адгезии к эпителиальным клеткам кишечника пили типа 1, которые взаимодействуют с гликопротеином CEACAM6. Жгутики участвуют в инвазии и вызывают секрецию провоспалительного цитокина IL-8 и хемокина CCL20 эпителиальных клетках кишечника. К месту воспаления мигрируют макрофаги и дендритные клетки, которые в дальнейшем вместе с лимфоцитами синтезируют INFγ и TNFα, что приводит к экспрессии CEACAM6. Помимо способности к адгезии и инвазии, E. coli LF82 может проходить через М-клетки пейеровых бляшек. В фагосоме макрофага в кислой среде создаются благоприятные условия для ее дальнейшего размножения. Непрерывная репликация этого микроорганизма в макрофагах приводит к секреции высоких уровней TNFα без индукции гибели клеток-хозяев. Этим объясняется воспаление и образование гранулем [Martinez-Medina, Garcia-Gil, 2014].
Таким образом, в результате использования безглютеновой диеты популяции обычно считающихся здоровыми бактерий уменьшились ( Bifidobacterium и Lactobacillus ), в то время как популяции потенциально вредных бактерий увеличились (штаммы E. coli и общего числа Enterobacteriaceae , которые обладают провоспалительной активностью [Bäckhed et al., 2003]). Это свидетельствует о нарушении хрупкого баланса между хозяином и его кишечной микробиотой (дисбактериоз), что может способствовать чрезмерному росту условно-патогенных микроорганизмов и ослабить защиту хозяина от инфекции и хронического воспаления из-за возможного изменения иммунитета слизистой оболочки кишечника.
В то же время, за счет внесения изменений в структуру микробиоты, безглютеновая диета может способствовать уменьшению провоспалительных сигналов в кишечнике и снижению хронического воспаления при целиакии [De Palma et al., 2009; Sanz, 2010].
Диета с низким содержанием FODMAP
В 2004 г. Университет Монаса ввел термин “FODMAP”, обозначающий короткоцепочечные углеводы (олигосахариды, дисахариды и моносахариды и близкие по строению сахароспирты — полиолы), которые плохо и не полностью всасываются в тонком кишечнике человека и приводят к повышенному газообразованию. Ограничение FODMAP-веществ помогает облегчить функциональные симптомы нарушений ЖКТ пациентов с синдромом раздраженного кишечника (СРК), а именно вздутие живота, боли, послабление стула. Однако долгосрочное применение диеты проблематично из-за ограничений в поступлении нормального количества растительной пищи. Как следствие, диета с низким содержанием короткоцепочечных углеводов может привести к снижению концентрации пребиотиков (галактоолигосахаридов, фруктоолигосахаридов), а значит, и к уменьшению количества бактерий. Этот тип питания приводит к снижению популяция бифидо-, пропионибактерий, F. prausnitzii, Akkermansia, Ruminococcus. При этом популяция и разнообразие представителей семейства Clostridiaceae ( Peptostreptococcus spp.) увеличились [Staudacher, Whelan, 2017].
На фоне снижения содержания бифидо- и лактобактерий повышается проницаемость эпителиального барьера кишечника для макромолекул пищи и дефицит секреторного IgA, что может приводить к развитию заболеваний кишечника и к частым синубронхиальным инфекциям, а в конечном итоге — к предрасположенности к атопии и прогрессированию аутоиммунного компонента заболеваний [Бухарин и др., 2015].
Сокращение популяции F. prausnitzii приводит к снижению противовоспалительной защиты за счет уменьшения продукции КЦЖК [Miquel et al., 2013; Moon et al., 2023].
Снижение популяции Ruminococcus влияет на антибактериальный иммунитет, т.к. эти микроорганизмы продуцируют антибактериальное соединение руминококкцин С, активный против патогенных клостридий [Balty et al., 2019; Chiumento et al., 2019].
Снижение синтеза цитозольных и мембранных белков межклеточных плотных контактов способствует повышению проницаемости слизистой оболочки, активации кишечной иммунной системы и развитию в кишке воспаления «низкой степени активности» (Low-grade mucosal inflammation). В воспалительном инфильтрате содержится значительное количество лимфоцитов, тучных клеток и 5-гидрокситриптамин-секретирующих энтерохромаффинных клеток. Тучные клетки при таком воспалении локализуются преимущественно в зоне нервных окончаний, а их медиаторы (гистамин, триптаза и др.), активно выделяемые при дегрануляции клеток, регулируют чувствительность рецепторов желудочно-кишечного тракта, способствуя развитию висцеральной гиперчувствительности. В ряде исследований была установлена корреляция между степенью инфильтрации тучными клетками слизистой оболочки и характером клинических проявлений, включая боль в животе и метеоризм, а также с характером психоэмоциональных нарушений [Piche et al., 2008; Staudacher, Whelan, 2017].
Следовательно, диета с низким содержанием короткоцепочечных углеводов может быть использована для снижения симптомов СРК. При этом снижение количества бактерий, отвечающих за стимуляцию защитных реакций, можно скорректировать приемом пробиотиков [Staudacher, Whelan, 2017].
Западный тип питания
Западный тип питания предполагает употребление пищи обогащенной жирами, белками животного происхождения и рафинированными сахарами [Стома, 2020]. В структуре микробного сообщества определяется общее снижение Bifidobacteria, Roseburia, Eubacterium, Ruminococcus, Lactobacillus, Prevotella. При этом увеличивается количество Enterobacteria, Alistipes, Bacteroides . Их влияние на организм оказывается доминирующим [Кожевников и др., 2017; Singh et al., 2017; Карпеева и др., 2020; Стома, 2020] .
За счет снижения популяции Eubacterium, Lactobacillus, Bifidobacteria и Roseburia – продуцентов бутирата, КЦЖК, положительно влияющих на кишечный гомеостаз и снижающий активность воспалительных процессов, возможно возникновение воспалительных заболеваний кишечника и синдрома раздраженного кишечника [Zhu et al., 2018; Shen et al., 2018; Clemente-Suárez et al., 2023].
Кроме того, лактобактерии положительно влияют на липидный обмен [Rodrigues et al., 2021]. Тенденция относительного снижения лакто- и бифидобактерий может указывать на повышение риска развития ожирения в дальнейшем, а также риска аллергических заболеваний. [Кожевников и др., 2017; Singh et al., 2017; Карпеева и др., 2020; Стома, 2020].
Повышение численности руминококков ассоциируется с накоплением жировой ткани [Lozano et al., 2022; Yan et al., 2022]. Соответственно, эти микроорганизмы могут вносить вклад в развитие ожирения при западном типе питания.
Таким образом, западный тип питания за счет изменения состава нормальной микрофлоры увеличивает тенденцию к ожирению, различным метаболическим нарушениям и ослаблению защитных механизмов [Kopp, 2019; Clemente-Suárez, et al., 2023].
Средиземноморская диета
Средиземноморская диета основана на регулярном потреблении мононенасыщенных жирных кислот и полиненасыщенных жирных кислот, полифенолов и других антиоксидантов, повышенном потреблении пребиотических волокон и углеводов с низким гликемическим индексом, а также на большем потреблении растительных, а не животных белков. В результате диеты возрастает биоразнообразие микрофлоры кишечника, увеличивается концентрация F. prausnitzii , Bifidobacterium, Lactobacillus, Ruminococcus, Bac-teroides и снижается количество Clostridium, E. coli [De Filippis et al., 2016; Mitsou et al., 2017; Garcia-Mantrana et al., 2018; Merra et al., 2020] .
-
F. prausnitzii оказывает противовоспалительный эффект за счет снижения активности клеток, синтезирующих провоспалительный IL-17 [Moon et al., 2023], а также за счет метаболитов, способных блокировать активацию NF-κB и IL-8 [Sokol et al., 2008].
Повышение Bifidobacterium приводит к выработке КЦЖК, улучшению слизистого барьера кишечника и снижению уровня ЛПС в кишечнике; некоторые представители Bifidobacteria spp . могут усиливать встасывание витамина D, уменьшать дифференцировку остеокластов, тем самым предотвращая потерю костной ткани [Бухарин и др., 2015; Стома, 2020]
Lactobacillus стимулируют продукцию КЦЖК, оказывающих противовоспалительную и противораковую активность [Thananimit, Pahumunto, Teanpaisan, 2022].
Bacteroides активируют CD4+ Т-клетки, что определяет противовоспалительный эффект диеты [Johnson, Jones, Cobb, 2015].
-
E. coli может ингибировать трансляцию м-РНК IL-2, IL-4, IL-5 и TNF-a у полиморфно-ядерных нейтрофилов, стимулированных митогеном [Габидуллин и др., 2009], и, следовательно, снижать активность нейтрофилов и эозинофилов.
Таким образом, средиземноморская диета приводит к формированию устойчивого микробиома кишечника, увеличению секреции микробных метаболитов (КЦЖК), снижению количества оппортунистических микроорганизмов и, как результат, к активации иммунных механизмов.
Заключение
Человек может влиять на биоразнообразие кишечной микробиоты, на состав доминирующего микробного ядра за счет коррекции питания (рисунок). Микробиом кишечника, в свою очередь, может изменять метаболические процессы как в самом кишечнике, так и в организме в целом. Таким образом, понимание механизмов становления микрофлоры человека, ее влияния на защитные реакции открывает перспективы для коррекции различных заболеваний. Модификация кишечной микробиоты может стать терапевтическим и профилактическим подходом для профилактики метаболических нарушений, ожирения, инфекционных, аутоиммунных заболеваний.
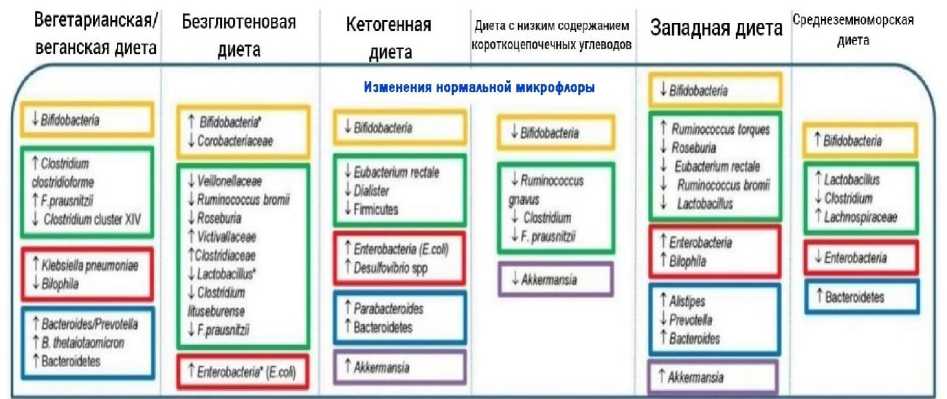
Влияние диеты на микробиоту кишечника [The effect of diet on the intestinal microbiota]
Список литературы Влияние диет на состав микрофлоры кишечника и на иммунные процессы в организме человека
- Бухарин О.В. и др. Роль бифидобактерий в формировании иммунного гомеостаза человека // Журнал микробиологии, эпидемиологии и иммунобиологии. 2015. № 6. С. 98-104.
- Габидуллин З.Г. и др. Взаимодействие бактерий семейства Enterobacteriaceae с антигенпрезенти-рующими клетками иммунной системы организма // Медицинский вестник Башкортостана. 2009. Т. 4, № 5. С. 78-86.
- Данилова Н.А. и др. Маркеры дисбиоза у пациентов с язвенным колитом и болезнью Крона // Терапевтический архив. 2019. Т. 91, №. 4. С. 13-20.
- Ивашкин В.Т., Зольникова О.Ю. Синдром раздраженного кишечника с позиций изменений микро-биоты // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2019. Т. 29, № 1. С. 84-92.
- Карпеева Ю.С. и др. Микробиота и болезни человека: возможности диетической коррекции // Российский вестник перинатологии и педиатрии. 2020. Т. 65, № 5. С. 116-125.
- Кожевников А. А. и др. Кишечная микробиота: современные представления о видовом составе, функциях и методах исследования // РМЖ. 2017. Т. 25, № 17. С. 1244-1247.
- Оганезова И.А. Кишечная микробиота и иммунитет: иммуномодулирующие эффекты Lactobacillus rhamnosus GG // РМЖ. 2018. Т. 26, № 9. С. 39-44.
- Стома И.О. Микробиом в медицине. Руководство для врачей. М: ГЭОТАР-Медиа, 2020. 320 с.
- Afzaal M. et al. Human gut microbiota in health and disease: Unveiling the relationship // Frontiers in microbiology. 2022. Vol. 13. P. 999001. DOI: 10.3389/fmicb.2022.999001.
- Almeida C. et al. The potential links between human gut microbiota and cardiovascular health and disease-is there a gut-cardiovascular axis? // Gut. 2023. Vol. 24. P. 25. DOI: 10.3389/fgstr.2023.1235126.
- Ang Q.Y. et al. Ketogenic diets alter the gut microbiome resulting in decreased intestinal Th17 cells // Cell. 2020. Vol. 181, №. 6. P. 1263-1275.e16. DOI: 10.1016/j.cell.2020.04.027.
- Ansaldo E. et al. Akkermansia muciniphila induces intestinal adaptive immune responses during homeostasis // Science. 2019. Vol. 364. P. 1179-1184. DOI: 10.1126/science.aaw7479.
- Backhed F. et al. Structural requirements for TLR4-mediated LPS signalling: a biological role for LPS modifications // Microbes and infection. 2003. Vol. 5, № 12. P. 1057-1063. DOI: 10.1016/S1286-4579(03)00207-7.
- Balty C. et al. Ruminococcin C, an anti-clostridial sactipeptide produced by a prominent member of the human microbiota Ruminococcus gnavus // Journal of Biological Chemistry. 2019. Vol. 294, № 40. P. 1451214525. DOI: 10.1074/jbc.RA119.009416.
- Bonder M.J. et al. The influence of a short-term gluten-free diet on the human gut microbiome // Genome medicine. 2016. Vol. 8. P. 1-11. DOI: 10.1186/s13073-016-0295-y.
- Chiumento S. et al. Ruminococcin C, a promising antibiotic produced by a human gut symbiont // Science advances. 2019. Vol. 5, № 9. Art. eaaw9969. DOI: 10.1126/sciadv.aaw9969.
- Christensen M.G., Damsgaard J., Fink-Jensen A. Use of ketogenic diets in the treatment of central nervous system diseases: a systematic review // Nordic Journal of Psychiatry. 2021. Vol. 75, №. 1. P. 1-8. DOI: 10.1080/08039488.2020.1795924.
- Clemente-Suarez V.J. et al. Global Impacts of Western Diet and Its Effects on Metabolism and Health: A Narrative Review // Nutrients. 2023. Vol. 15, № 12. P. 2749. DOI: 10.3390/ nu15122749.
- Cox M.A. et al. Short-chain fatty acids act as antiinflammatory mediators by regulating prostaglandin E(2) and cytokines // World journal of gastroenterology: WJG. 2009. Vol. 15, № 44. P. 5549-5557. DOI: 10.3748/wjg.15.5549.
- Crost E.H. et al. Ruminococcus gnavus: friend or foe for human health // FEMS microbiology reviews. 2023. Vol. 47, № 2. Art. fuad014. DOI: 10.1093/femsre/fuad014.
- De Filippis F. et al. High-level adherence to a Mediterranean diet beneficially impacts the gut microbiota and associated metabolome // Gut. 2016. Vol. 65, № 11. P. 1812-1821. DOI: 10.1136/gutjnl-2015-309957.
- De Palma G. et al. Effects of a gluten-free diet on gut microbiota and immune function in healthy adult human subjects // British journal of nutrition. 2009. Vol. 102, № 8. P. 1154-1160. DOI: 10.1017/S0007114509371767.
- Depommier C. et al. Supplementation with Akkermansia muciniphila in overweight and obese human volunteers: a proof-of-concept exploratory study // Nature medicine. 2019. Vol. 25, №. 7. P. 1096-1103. DOI: 10.1038/s41591-019-0495-2.
- Donatella P., Aurelio C. Ketogenic diet and gut microbiota // PharmacologyOnLine. Special issue. 2020. Vol. 3. P. 175-181.
- Dunn K.A. et al. Early changes in microbial community structure are associated with sustained remission after nutritional treatment of pediatric Crohn's disease // Inflammatory bowel diseases. 2016. Vol. 22, №. 12. P. 2853-2862. DOI: 10.1097/MIB.0000000000000956.
- Everard A. et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity // Proceedings of the national academy of sciences. 2013. Vol. 110, №. 22. P. 9066-9071. DOI: 10.1073/pnas.1219451110.
- Gaboriau-Routhiau V. et al. The key role of segmented filamentous bacteria in the coordinated maturation of gut helper T cell responses // Immunity. 2009. Vol. 31, № 4. P. 677-689. DOI: 10.1016/j.immuni.2009.08.020.
- Garcia-Mantrana I. et al. Shifts on gut microbiota associated to mediterranean diet adherence and specific dietary intakes on general adult population // Frontiers in microbiology. 2018. Vol. 9. P. 890. DOI: 10.3389/fmicb.2018.00890.
- Hiippala K. et al. The Potential of Gut Commensals in Reinforcing Intestinal Barrier Function and Alleviating Inflammation // Nutrients. 2018. Vol. 10, № 8. P. 988. DOI: 10.3390/nu10080988.
- Hooper L.V. et al. Molecular analysis of commensal host-microbial relationships in the intestine // Science. 2001. Vol. 291, № 5505. P. 881-884. DOI: 10.1126/science.291.5505.881.
- Hosoda S. et al. Revealing the microbial assemblage structure in the human gut microbiome using latent Dirichlet allocation // Microbiome. 2020. Vol. 8, №1. P. 95. DOI: 10.1186/s40168-020-00864-3.
- Huuskonen J. et al. Regulation of microglial inflammatory response by sodium butyrate and short-chain fatty acids // British journal of pharmacology. 2004. Vol. 141, № 5. P. 874-880. DOI: 10.1038/sj.bjp.0705682.
- Jiang Y. et al. Acetyltransferase from Akkermansia muciniphila blunts colorectal tumourigenesis by reprogramming tumour microenvironment // Gut. 2023. Vol. 72, № 7. P. 1308-1318. DOI: 10.1136/gutjnl-2022-327853.
- Johnson J.L., Jones M.B., Cobb B.A. Polysaccharide A from the capsule of Bacteroides fragilis induces clonal CD4+ T cell expansion // Journal of Biological Chemistry. 2015. Vol. 290, № 8. P. 5007-5014. DOI: 10.1074/jbc.M114.621771.
- Katiraei S. et al. Akkermansia muciniphila exerts lipid-lowering and immunomodulatory effects without affecting neointima formation in hyperlipidemic APOE*3-Leiden. CETP mice // Molecular nutrition & food research. 2020. Vol. 64, № 15. Art. 1900732. DOI: 10.1002/mnfr.201900732.
- Kopp W. How western diet and lifestyle drive the pandemic of obesity and civilization diseases // Diabetes, metabolic syndrome and obesity: targets and therapy. 2019. P. 2221-2236. DOI: 10.2147/DMSO.S216791.
- Kosinski C., Jornayvaz F.R. Effects of ketogenic diets on cardiovascular risk factors: evidence from animal and human studies // Nutrients. 2017. Vol. 9, №. 5. P. 517. DOI: 10.3390/nu9050517.
- Lecuyer E. et al. Segmented filamentous bacterium uses secondary and tertiary lymphoid tissues to induce gut IgA and specific T helper 17 cell responses // Immunity. 2014. Vol. 40, № 4. P. 608-620. DOI: 10.1016/j.immuni.2014.03.009.
- Louis P. et al. Diversity of human colonic butyrate-producing bacteria revealed by analysis of the butyr-yl-CoA: acetate CoA-transferase gene // Environmental microbiology. 2010. Vol. 12, № 2. P. 304-314. DOI: 10.1111/j.1462-2920.2009.02066.x.
- Lozano C.P. et al. Associations of the Dietary Inflammatory Index with total adiposity and ectopic fat through the gut microbiota, LPS, and C-reactive protein in the Multiethnic Cohort-Adiposity Phenotype Study // The American Journal of Clinical Nutrition. 2022. Vol. 115, № 5. P. 1344-1356. DOI: 10.1093/ajcn/nqab398.
- Lum G.R., Olson C.A., Hsiao E.Y. Emerging roles for the intestinal microbiome in epilepsy // Neurobiology of Disease. 2020. Vol. 135. Art. 104576. DOI: 10.1016/j.nbd.2019.104576.
- Martens E.C. et al. Complex glycan catabolism by the human gut microbiota: the Bacteroidetes Sus-like paradigm // Journal of Biological Chemistry. 2009. Vol. 284, № 37. P. 24673-24677. DOI: 10.1074/jbc.R109.022848.
- Martinez-Medina M., Garcia-Gil L.J. Escherichia coli in chronic inflammatory bowel diseases: An update on adherent invasive Escherichia coli pathogenicity // World journal of gastrointestinal pathophysiology. 2014. Vol. 5, № 3. P. 213. DOI: 10.4291/wjgp.v5.i3.213.
- Merra G. et al. Influence of mediterranean diet on human gut microbiota // Nutrients. 2020. Vol. 13, № 1. P. 7. DOI: 10.3390/nu13010007.
- Milani C. et al. The first microbial colonizers of the human gut: composition, activities, and health implications of the infant gut microbiota // Microbiology and molecular biology reviews. 2017. Vol. 81, № 4. P. 10-128. DOI: 10.1128/MMBR.00036-17.
- Miquel S. et al. Faecalibacterium prausnitzii and human intestinal health // Current opinion in microbiology. 2013. Vol. 16, № 3. P. 255-261. DOI: 10.1016/j.mib.2013.06.003.
- Mitsou E.K. et al. Adherence to the Mediterranean diet is associated with the gut microbiota pattern and gastrointestinal characteristics in an adult population // British Journal of Nutrition. 2017. Vol. 117, № 12. P. 1645-1655. DOI: 10.1017/S0007114517001593.
- Moon J. et al. Faecalibacterium prausnitzii alleviates inflammatory arthritis and regulates IL-17 production, short chain fatty acids, and the intestinal microbial flora in experimental mouse model for rheumatoid arthritis // Arthritis Research & Therapy. 2023. Vol. 25, № 1. P. 130. DOI: 10.1186/s13075-023-03118-3.
- Neal E.G. et al. A randomized trial of classical and medium-chain triglyceride ketogenic diets in the treatment of childhood epilepsy // Epilepsia. 2009. Vol. 50, № 5. P. 1109-1117. DOI: 10.1111/j.1528-1167.2008.01870.x.
- Nilsson N.E. et al. Identification of a free fatty acid receptor, FFA2R, expressed on leukocytes and activated by short-chain fatty acids // Biochemical and biophysical research communications. 2003. Vol. 303, № 4. P. 1047-1052. DOI: 10.1016/s0006-291x(03)00488-1.
- Olson C.A. et al. The gut microbiota mediates the anti-seizure effects of the ketogenic diet // Cell. 2018. Vol. 173, № 7. P. 1728-1741.e13. DOI: 10.1016/j.cell.2018.04.027.
- Otalora-Otalora B.A. et al. Host transcriptional regulatory genes and microbiome networks crosstalk through immune receptors establishing normal and tumor multiomics metafirm of the oral-gut-lung axis // International Journal of Molecular Sciences. 2023. Vol. 24, № 23. Art. 16638. DOI: 10.3390/ijms242316638.
- Paoli A. et al. Ketogenic diet and microbiota: friends or enemies? // Genes. 2019. Vol. 10, № 7. P. 534. DOI: 10.3390/genes10070534.
- Piche T. et al. Mast cells and cellularity of the colonic mucosa correlated with fatigue and depression in irritable bowel syndrome // Gut. 2008. Vol. 57, № 4. P. 468-473. DOI: 10.1136/gut.2007.127068.
- Rodrigues R.R. et al. Transkingdom interactions between Lactobacilli and hepatic mitochondria attenuate western diet-induced diabetes // Nat. Commun. 2021. Vol. 12. P. 101. DOI: 10.1038/s41467-020-20313-x.
- Routy B. et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors // Science. 2018. Vol. 359, № 6371. P. 91-97. DOI: 10.1126/science.aan3706.
- Säemann M.D. et al. Anti-inflammatory effects of sodium butyrate on human monocytes: potent inhibition of IL-12 and up-regulation of IL-10 production // The FASEB Journal. 2000. Vol. 14, № 15. P. 2380-2382. DOI: 10.1096/fj.00-0359fje.
- Sakkas H. et al. Nutritional status and the influence of the vegan diet on the gut microbiota and human health // Medicina. 2020. Vol. 56, № 2. P. 88. DOI: 10.3390/medicina56020088.
- Sanz Y. Effects of a gluten-free diet on gut microbiota and immune function in healthy adult humans // Gut Microbes. 2010. Vol. 1, № 3. P. 135-137. DOI: 10.4161/gmic.1.3.11868.
- Shen Z. et al. Insights into Roseburia intestinalis which alleviates experimental colitis pathology by inducing anti-inflammatory responses // Journal of gastroenterology and hepatology. 2018. Vol. 33, № 10. P. 1751-1760. DOI: 10.1111/jgh.14144.
- Shi N. et al. Interaction between the gut microbiome and mucosal immune system // Military Medical Research. 2017. Vol. 4. P. 1-7. DOI: 10.1186/s40779-017-0122-9.
- Shin N.R. et al. An increase in the Akkermansia spp. population induced by metformin treatment improves glucose homeostasis in diet-induced obese mice // Gut. 2014. Vol. 63, № 5. P. 727-735. DOI: 10.1136/gutjnl-2012-303839.
- Singh R.K. et al. Influence of diet on the gut microbiome and implications for human health // Journal of translational medicine. 2017. Vol. 15, № 1. P. 1-17. DOI: 10.1186/s12967-017-1175-y.
- Smith P.M. et al. The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis // Science. 2013. Vol. 341, № 6145. P. 569-573. DOI: 10.1126/science.1241165.
- Sokol H. et al. Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients // Proceedings of the National Academy of Sciences. 2008. Vol. 105, № 43. P. 16731-16736. DOI: 10.1073/pnas.0804812105.
- Staudacher H.M., Whelan K. The low FODMAP diet: recent advances in understanding its mechanisms and efficacy in IBS // Gut. 2017. Vol. 66, № 8. P. 1517-1527. DOI: 10.1136/gutjnl -2017-313750.
- Tamanai-Shacoori Z. et al. Roseburia spp.: a marker of health? // Future microbiology. 2017. Vol. 12, № 2. P. 157-170. DOI: 10.2217/fmb-2016-0130.
- Tedelind S. et al. Anti-inflammatory properties of the short-chain fatty acids acetate and propionate: a study with relevance to inflammatory bowel disease // World journal of gastroenterology: WJG. 2007. Vol. 13, № 20. Art. 2826. DOI: 10.3748/wjg.v13.i20.2826.
- Thananimit S., Pahumunto N., Teanpaisan R. Characterization of short chain fatty acids produced by selected potential probiotic Lactobacillus strains // Biomolecules. 2022. Vol. 12, № 12. P. 1829. DOI: 10.3390/biom12121829.
- Tomova A. et al. The effects of vegetarian and vegan diets on gut microbiota // Frontiers in nutrition. 2019. Vol. 6. P. 47. DOI: 10.3389/fnut.2019.00047.
- Vinolo M.A. et al. SCFAs induce mouse neutrophil chemotaxis through the GPR43 receptor // PloS one. 2011a. Vol. 6, № 6. Art. e21205. DOI: 10.1371/journal.pone.0021205.
- Vinolo M.A. et al. Suppressive effect of short-chain fatty acids on production of proinflammatory mediators by neutrophils // The Journal of nutritional biochemistry. 2011b. Vol. 22, № 9. P. 849-855. DOI: 10.1016/j.jnutbio.2010.07.009.
- Vinolo M.A. et al. Regulation of inflammation by short chain fatty acids // Nutrients. 2011c. Vol. 3, № 10. P. 858-876. DOI: 10.3390/nu3100858.
- Walker C.R. et al. Intestinal intraepithelial lymphocyte-enterocyte crosstalk regulates production of bactericidal angiogenin 4 by Paneth cells upon microbial challenge // PLoS One. 2013. Vol. 8, № 12. Art. e84553. DOI: 10.1371/journal.pone.0084553.
- Wrzosek L. et al. Bacteroides thetaiotaomicron and Faecalibacterium prausnitzii influence the production of mucus glycans and the development of goblet cells in the colonic epithelium of a gnotobiotic model rodent // BMC biology. 2013. Vol. 11, № 61. P. 1-13. DOI: 10.1186/1741-7007-11-61.
- Xie G. et al. Ketogenic diet poses a significant effect on imbalanced gut microbiota in infants with refractory epilepsy // World Journal of Gastroenterology. 2017. Vol. 23, № 33. P. 6164-6171. DOI: 10.3748/wjg.v23.i33.6164.
- Yan H. et al. Gut microbiome alterations in patients with visceral obesity based on quantitative computed tomography // Frontiers in Cellular and Infection Microbiology. 2022. Vol. 11. Art. 823262. DOI: 10.3389/fcimb.2021.823262.
- Zafar H., Saier Jr M. H. Gut Bacteroides species in health and disease // Gut microbes. 2021. Vol. 13, № 1. Art. 1848158. DOI: 10.1080/19490976.2020.1848158.
- Zhai R. et al. Strain-specific anti-inflammatory properties of two Akkermansia muciniphila strains on chronic colitis in mice // Frontiers in cellular and infection microbiology. 2019. Vol. 9. P. 239. DOI: 10.3389/fcimb.2019.00239.
- Zhu C. et al. Roseburia intestinalis inhibits interleukin-17 excretion and promotes regulatory T cells differentiation in colitis // Molecular medicine reports. 2018. Vol. 17, № 6. P. 7567-7574. DOI: 10.3892/mmr.2018.8833.


