Влияние диоксида кремния «Ковелос-Сорб» на параметры роста Rhododendron roseum (Loise.) Rehder в культуре in vitro
Автор: Немцова Е. В., Харин А. В., Разлуго И. А.
Журнал: Вестник Нижневартовского государственного университета @vestnik-nvsu
Рубрика: Экология растений
Статья в выпуске: 1, 2020 года.
Бесплатный доступ
В настоящей работе описано стимулирующее действие синтетического аморфного диоксида кремния на параметры роста мериклонов Rhododendron roseum (Loisel.) Rehder, размножаемого в культуре in vitro . Целью работы являлось определение оптимального состава питательных сред на основе аморфного кремнезема «Ковелос-Сорб», используемых для клонального микроразмножения рододендронов. Установлено, что оптимальным для стимуляции роста побегов мериклонов Rhododendron roseum (Loisel.) Rehder являлось добавление в питательную среду Андерсона 100 мг/л аморфного диоксида кремния. Для стимуляции размножения и получения большого количества посадочного материала оптимальным являлось использование среды Андерсона, содержащей 50 мг/л аморфного кремнезема. Для укоренения растений-регенерантов Rhododendron roseum (Loisel.) Rehder в культуре in vitro оптимальным являлось использование среды Андерсона, содержащей синтетический аморфный диоксид кремния в количестве 50-150 мг/л в сочетании с ИУК в количестве 1,5 мг/л.
Аморфный диоксид кремния "ковелос-сорб", клональное микроразмножение
Короткий адрес: https://sciup.org/14117204
IDR: 14117204 | УДК: 58.085 | DOI: 10.36906/2311-4444/20-1/08
Текст научной статьи Влияние диоксида кремния «Ковелос-Сорб» на параметры роста Rhododendron roseum (Loise.) Rehder в культуре in vitro
Применение соединений кремния при культивировании растений in vitro представляет перспективу для производства оздоровленного посадочного материала, легко адаптирующегося к неблагоприятным условиям среды. Известно, что соединения кремния, в том числе диоксид кремния, осуществляют огромное количество функций в жизни растений, как в обычных, так и в стрессовых условиях. Роль аморфного диоксида кремния можно сравнить с ролью вторичных органических метаболитов, выполняющих в растениях защитные функции [4].
Добавление аморфного диоксида кремния в питательную среду при культивировании in vitro стимулирует органогенез, эмбриогенез, влияет на ростовые процессы, морфологические, анатомофизиологические характеристики, повышает толерантность к низкой температуре и солености, защищает клетки от токсичности металлов, предотвращает окислительное фенольное потемнение и снижает частоту гипергидрации у различных растений [9]. Аморфный диоксид кремния обладает значительным потенциалом для применения в широком спектре исследований культуры тканей растений, таких как криоконсервация, органогенез, микропропагация, соматический эмбриогенез и производство вторичных метаболитов.
В ходе экспериментов с аморфным диоксидом кремния в культуре in vitro было выявлено, что он увеличивает устойчивость каллуса винограда к низким температурам [6]. Это показывает, что аморфный диоксид кремния может быть использован в качестве криопротектора и включен в криопротекторную смесь для минимизации токсичности других криопротекторов.
Добавление диоксида кремния в питательную среду приводит к замедлению роста болезнетворных микроорганизмов и увеличивает регенеративный потенциал мериклонов пасленовых, культивируемых in vitro [8].
Установлено, что аморфный диоксид кремния в культуре in vitro уменьшает солевой стресс у некоторых видов растений, ограничивая поглощение хлорида натрия, а также поддерживает ультраструктуру устьиц, улучшает фотосинтетическую активность, уменьшает содержание свободного пролина и активизирует синтез антиоксидантных ферментов [7].
Известно, что использование аморфного диоксида кремния в культуре in vitro повышает засухоустойчивость, снижает токсичность свинца, алюминия и других металлов, повышает устойчивость к радиационным и температурным стрессам [3].
Изучены оптимальные количества аморфного кремнезема, стимулирующие рост мериклонов in vitro . Добавление аморфного кремнезема в питательную среду в количестве 100 мг/л приводило к увеличению некоторых параметров роста мериклонов яблони (длина побега, коэффициент размножения, масса сухого вещества), повышало содержание хлорофилла [2]. Использование аморфного кремнезема в составе питательной среды Мурасиге-Скуга количеством 100 мг/л (1,66 мМ в пересчете на метакрем-ниевую кислоту) приводило к увеличению коэффициента размножения бананов на 50%. Адаптация таких мериклонов проходила эффективнее при добавлении в питательный субстрат аморфного кремнезема в количестве 2 г/кг, – растения характеризовались большей устойчивостью к недостатку влаги и фузариозу [5].
Целью данной работы являлось определение оптимального состава питательных сред на основе аморфного кремнезема «Ковелос-Сорб», используемых для клонального микроразмножения рододендронов (на примере Rhododendron roseum (Loisel.) Rehder).
Научная новизна настоящего исследования заключается в определении количества аморфного диоксида кремния, обладающего стимулирующим влиянием на рост корней и побегов растений регенерантов Rhododendron roseum (Loisel.) Rehder в культуре in vitro.
Разработанная методика использования аморфного диоксида кремния для размножения рододендронов в культуре in vitro может применяться для создания протоколов клонального микроразмножения других сельскохозяйственных культур. Результаты исследования могут быть использованы для создания технологии применения аморфного диоксида кремния в качестве регулятора роста растений.
Методика и материалы исследования
Изучали влияние аморфного диоксида кремния на морфометрические показатели, коэффициент размножения и укореняемость растений-регенерантов Rhododendron roseum (Loisel.) Rehder (гибридный сорт, белоцветковая форма), размножаемых в культуре in vitro с использованием питательной среды Андерсона для размножения и укоренения [1]. В состав среды вводили синтетический аморфный диоксид кремния «Ковелос-Сорб» в количестве 50, 100 и 150 мг/л (производство OOO «Экокремний»). В состав среды для укоренения включали 1,5 мг/л ИУК (индолилуксусная кислота).
Побеги рододендронов, размножаемых микроклонально, отделяли от первичного эксплантата, делили на 2–3-х пазушные черенки и переносили на питательную среду согласно схеме опыта. Все эксперименты проводили в трехкратной повторности, на каждый вариант опыта приходилось по 30-40 микропобегов.
Культивирование микропобегов осуществляли при 25°С под лампами дневного света при 16часовом фотопериоде. Длительность субкультивирования составляла 8 недель. Определяли длину побегов и корней, число корней и коэффициент размножения. Статистическую обработку результатов исследования проводили с использованием программы Microsoft Excel 2017; отличия достоверны при p≤0,05. Работа выполнялась с использованием оборудования лаборатории ИННО-центра биотехнологии и экологии БГУ в 2016–2018 гг.
Результаты исследования
Влияние аморфного диоксида кремния на коэффициент размножения и длину побегов мериклонов Rhododendron roseum (Loisel.) Rehder
Выявлено стимулирующее рост и размножение мериклонов Rhododendron roseum (Loisel.) Rehder действие синтетического аморфного диоксида кремния, вводимого в состав среды Андерсона (табл. 1, рис. 1). Оптимальным для стимуляции роста побегов мериклонов являлось применение питательной среды Андерсона для размножения рододендронов, содержащей 100 мг/л аморфного кремнезема (рис. 2) – в этом случае средняя длина побегов составляла 2,29±0,24 см, что в 2,1 раза больше показателя контрольного варианта (1,09±0,16 см). При использовании диоксида кремния в количестве 50 мг/л длина мериклонов рододендронов составляла 1,60±0,14 см, что в 1,5 раза больше длины побегов контрольного варианта (достоверно при p≤0,05).
Таблица 1
Влияние аморфного диоксида кремния на морфометрические показатели растений-регенерантов рододендронов в культуре in vitro
|
Вариант |
Контроль |
50 мг/г |
100 мг/г |
150 мг/г |
|
Длина побега, мм |
1,09±0,16 |
1,60±0,14* |
2,29±0,24* |
1,01±0,13 |
|
Коэффициент размножения, штук |
13,17±1,92 |
35,50±2,24* |
19,00±1,89* |
12,00±1,21 |
* – достоверно при p≤0,05
Включение в состав питательной среды аморфного диоксида кремния в количестве 150 мг/г не приводило к увеличению длины побега – в этом случае она составляла 1,01±0,13 см, что примерно соответствовало аналогичному показателю для растений контрольного варианта (1,09±0,16 см, отличия недостоверны при p≤0,05).
Введение в состав среды Андерсона для размножения рододендронов аморфного диоксида кремния приводило к увеличению коэффициента размножения опытных растений. Коэффициент размножения рододендронов в контрольном варианте составил 13,17±1,92, при введении диоксида кремния в количестве 50 мг/л – 35,50±2,24, что в 2,7 раза больше показателя контрольного варианта (отличия достоверны при p≤0,05, табл. 1, рис. 2).
Использование питательной среды Андерсона с диоксидом кремния в количестве 100 мг/л приводило к увеличению коэффициента размножения рододендронов в 1,4 раза по сравнению с контролем, отличия достоверны при p≤0,05. Средний показатель составил 19,00±1,89 шт. Коэффициент размножения растений регенерантов на питательной среде с содержанием диоксида кремния 150 мг/л составлял 12,00±1,21, что немного меньше по сравнению с растениями контрольного варианта (отличия недостоверны при p≤0,05).

Рис. 1. Влияние аморфного диоксида кремния на рост растений-регенерантов Rhododendron roseum (Loisel.) Rehder. Снизу вверх: контроль – среда Андерсона, вариант 1 – среда Андерсона, содержащая 50 мг/л аморфного кремнезема, вариант 2 – среда Андерсона, содержащая 100 мг/л аморфного кремнезема, вариант 3 – среда Андерсона, содержащая 150 мг/л аморфного кремнезема
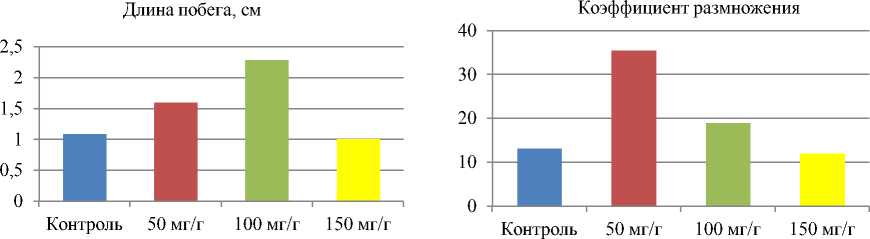
Рис. 2. Влияние аморфного кремнезема на длину побегов и коэффициент размножения растений-регенерантов Rhododendron roseum (Loisel.) Rehder
Оптимальным для увеличения числа растений-регенерантов рододендронов являлось использование 50 мг/л аморфного кремнезема, что приводило к увеличению общего количества побегов в 2,7 раза. Использование такой питательной среды предпочтительно, если цель – получение большого количества посадочного материала в краткие сроки. Однако длина побегов таких мериклонов всего в 1,5 раза превышала контрольный показатель, что, видимо, связано с недостатком питательных веществ из-за большого количества побегов в конгломерате и замедлением темпов роста.
Применение среды, содержащей 100 мг/л аморфного кремнезема, увеличивало коэффициент размножения рододендронов всего в 1,4 раза, но посадочный материал характеризовался лучшим качеством. Основным преимуществом являлось более чем двукратное увеличение длины побега по сравнению с контрольными растениями и достаточно высокий коэффициент размножения.
Влияние аморфного кремнезема на укоренение растений-регенерантов Rhododendron roseum (Loisel.) Rehder в культуре in vitro
Изучали влияние аморфного кремнезема на процессы укоренения мериклонов Rhododendron roseum (Loisel.) Rehder, культивируемого in vitro с использованием среды Андерсона для укоренения (табл. 2).
Одновременно с изучением влияния аморфного кремнезема на корнеобразование оценивали его воздействие на рост и состояние побегов, а также коэффициент размножения. Обнаружено, что внесение аморфного кремнезема в питательные среды для стимуляции корнеобразования влияло также и на коэффициент размножения и длину мериклонов, причем имелась тенденция к увеличению длины побегов укореняемых мериклонов при внесении диоксида кремния (табл. 2). Так, на питательной среде, содержащей 150 мг/л аморфного кремнезема, длина побегов рододендронов составляла 1,65±0,09, что в 1,3 раза больше аналогичного показателя контрольного варианта (достоверно при p≤0,05). Качество побегов, полученных на средах с аморфным кремнеземом, при визуальном осмотре лучше состояния контрольных растений.
Таблица 2
Влияние аморфного диоксида кремния на процессы укоренения растений-регенерантов рододендронов в культуре in vitro
|
Вариант |
Длина побега, см |
Коэффициент размножения, шт. |
Длина корня, см |
Кол-во корней, шт. |
|
Среда Андерсона |
1,27±0,05 |
1,10±0,05 |
0,95±1,09 |
1,12±0,03 |
|
Среда Андерсона+SiO 2 (50 мг/л) |
1,54±0,08 |
1,00±0,04 |
1,88±0,27* |
2,27±0,85* |
|
Среда Андерсона+SiO 2 (100 мг/л) |
1,43±0,08 |
1,22±0,1 |
1,83±0,47* |
1,33±0,21 |
|
Среда Андерсона+SiO 2 (150 мг/л) |
1,65±0,09* |
1,59±0,54* |
1,59±0,54* |
2,33±0,33* |
|
Среда Андерсона+ИУК (1,5 мг/л) |
1,88±0,05* |
1,40±0,16 |
1,01±0,09 |
3,26±0,13* |
|
Среда Андерсона+SiO 2 (50мг/л)+ИУК (1,5 мг/л) |
1,77±0,17* |
1,05±0,05 |
1,24±0,08 |
4,76±0,44* |
|
Среда Андерсона+SiO 2 (100мг/л)+ИУК (1,5 мг/л) |
1,65±0,11* |
1,00±0,03 |
1,19±0,09 |
4,38±0,61* |
|
Среда Андерсона+SiO 2 (150 мг/л)+ИУК (1,5 мг/л) |
1,95±0,12* |
1,15±0,08 |
1,87±0,09* |
4,44±0,63* |
* – достоверно при p≤0,05
Обнаружена тенденция к увеличению коэффициента размножения мериклонов рододендронов при внесении аморфного кремнезема на этапе укоренения. Введение диоксида кремния в количестве 50 мг/л в среду Андерсона не приводило к заметному увеличению числа побегов – оно составляло
1,00±0,04, что практически соответствовало контрольному показателю (1,10±0,05). Использование 100 мг/л диоксида кремния приводило к увеличению числа побегов в 1,1 раза (1,22±0,1, недостоверно при p≤0,05). Применение среды, содержащей 150 мг/л диоксида кремния, приводило к увеличению коэффициента размножения опытных растений в 1,4 раза (достоверно при p≤0,05). Количество побегов опытных растений при внесении 150 мг/л препарата составляло 1,59±0,54, контрольных – 1,10±0,05 (табл. 2).
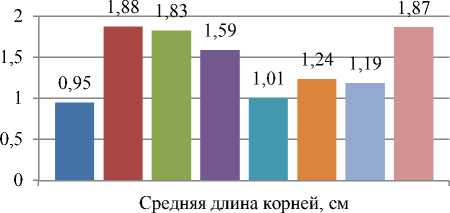
Изучали влияние внесения аморфного кремнезема в среду Андерсона на длину и количество корней. Использование питательной среды с диоксидом кремния в количестве 50 мг/л (без ИУК) приводило к двукратному увеличению средней длины корней мериклонов (рис. 3). В контрольном варианте длина корней мериклонов рододендронов составляла 0,95±1,09 см, при использовании 50 мг/л препарата – 1,88±0,27 см, 100 мг/л – 1,83±0,47 см. Использование для укоренения диоксида кремния в количестве 150 мг/л приводило к увеличению длины корней в 1,6 раза (1,59±0,54 см) по сравнению с контролем (достоверно при p≤0,05).
-
■ Среда Андерсона
-
■ Среда Андерсона + SiO2 (50 мг/л)
-
■ Среда Андерсона + SiO2 (100 мг/л)
-
■ Среда Андерсона + SiO2 (150 мг/л)
-
■ Среда Андерсона + ИУК (1,5 мг/л)
-
■ Среда Андерсона + SiO2 (50мг/л) + ИУК (1,5 мг/л)
-
■ Среда Андерсона + SiO2 (100мг/л) + ИУК (1,5 мг/л)
-
■ Среда Андерсона + SiO2 (150 мг/л) + ИУК (1,5 мг/л)
Рис. 3. Влияние состава питательной среды на длину корней растений-регенерантов Rhododendron roseum (Loisel.) Rehder
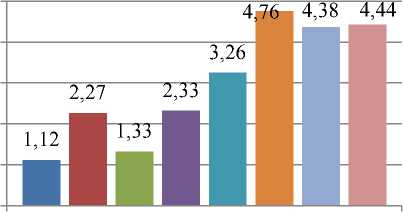
Изучали влияние препарата на среднее количество корней мериклонов рододендронов (табл. 2, рис. 4). Использование среды Андерсона, содержащей 50 мг/г аморфного кремнезема (без ИУК), приводило к увеличению числа корней в 2,3 раза по сравнению с контролем. В контрольном варианте корнеобразование слабое – число корней составляло 1,12±0,03 шт., при использовании кремнезема – 2,27±0,85 шт. (достоверно при p≤0,05).
Использование среды с содержанием диоксида кремния 100 мг/л приводило к увеличению количества корней в 1,2 раза, 150 мг/л – в 2,3 раза по сравнению с контрольным вариантом. Среднее число корней мериклонов рододендронов на питательной среде, содержащей 100 мг/л аморфного кремнезема, составило 1,33±0,21 шт., 150 мг/л – 2,33±0,33 шт. Данные оказались недостоверными при p≤0,05 при использовании 100 мг/л препарата (табл. 2, рис. 4).
Среднее число корней, шт
-
■ Среда Андерсона
-
■ Среда Андерсона + SiO2 (50 мг/л)
-
■ Среда Андерсона + SiO2 (100мг/л)
-
■ Среда Андерсона + SiO2 (150мг/л)
-
■ Среда Андерсона + ИУК (1,5 мг/л)
-
■ Среда Андерсона + SiO2 (50 мг/л) + ИУК (1,5 мг/л)
-
■ Среда Андерсона + SiO2 (100 мг/л) + ИУК (1,5 мг/л)
-
■ Среда Андерсона + SiO2 (150мг/л) + ИУК (1,5 мг/л)
Рис. 4. Влияние состава питательной среды на число корней у растений-регенерантов Rhododendron roseum (Loisel.) Rehder
Влияние аморфного кремнезема в сочетании с ИУК на укоренение растений-регенерантов Rhododendron roseum (Loisel.) Rehder в культуре in vitro
Оптимальным для стимуляции корнеобразования рододендронов являлось применение среды Андерсона, содержащей диоксид кремния в сочетании с ИУК, результаты представлены в таблице 2 и на рисунках 3–5. Выявлено, что использование данной среды приводило к формированию более качественных побегов, с большим количеством корней и листьев по сравнению с контрольным вариантом (рис. 5).
При культивировании регенерантов рододендронов на среде Андерсона, содержащей аморфный кремнезем и ИУК, длина побегов в 1,2 раза превышала аналогичный показатель при использовании среды, содержащей аморфный кремнезем без ИУК.
Введение аморфного кремнезема в среду Андерсона для укоренения, содержащую 1,5 мг/л ИУК, практически не влияло на длину побегов растений-регенерантов рододендронов и их коэффициент размножения. При использовании среды Андерсона с 1,5 мг/л ИУК средняя длина побегов рододендронов составила 1,88±0,05 см, при введении в эту среду 50 мг/л диоксида кремния – 1,77±0,1 см, 100 мг/л – 1,65±0,11 см, 150 мг/л – 1,95±0,12 см (отличия недостоверны при p≤0,05). Коэффициент размножения в контрольном варианте (среда Андерсона для размножения рододендронов + 1,5 мг/л ИУК) составлял 1,40±0,16 шт., при использовании 50 мг/л диоксида кремния и 1,5 мг/г ИУК – 1,05±0,05 шт., 100 мг/л и 1,5 мг/г ИУК – 1,00±0,03 шт., 150 мг/л диоксида кремния и 1,5 мг/г ИУК – 1,15±0,08 шт. (отличия недостоверны при p≤0,05).

Рис. 5. Влияние аморфного кремнезема на корнеобразование мериклонов Rhododendron roseum (Loisel.) Rehder в сочетании с ИУК. Сверху вниз: среда Андерсона, содержащая ИУК; среда Андерсона, содержащая ИУК и аморфный кремнезем в количестве 50 мг/л; среда Андерсона, содержащая ИУК и аморфный кремнезем в количестве 100 мг/л; среда Андерсона, содержащая ИУК и аморфный кремнезем в количестве 150 мг/л
Изучали влияние сочетанного воздействия аморфного кремнезема и ИУК на длину корней ме-риклонов рододендронов в культуре in vitro (рис. 3). Выявлено, что оптимальной являлась среда, содержащая 150 мг/л кремнезема и ИУК в количестве 1,5 мг/л – средняя длина корней составила 1,87±0,09 см, что в 1,85 раза больше по сравнению с контрольным вариантом (средняя длина корней – 1,01±0,09 см), отличия достоверны при p≤0,5. Использование среды, содержащей 50 мг/л и 100 мг/л диоксида кремния в сочетании с ИУК (1,5 мг/л), не приводило к существенным изменениям длины корней – отличия недостоверны при p≤0,05. Длина корней мериклонов рододендронов на среде, содержащей ИУК и 50 мг/л диоксида кремния, составляла 1,24±0,08 см, на среде, содержащей 100 мг/л диоксида кремния и ИУК, – 1,19±0,09 см.
Изучали влияние сочетанного воздействия аморфного кремнезема и ИУК на число корней у ме-риклонов рододендронов в культуре in vitro (рис. 4). Обнаружено, что внесение аморфного кремнезема в среду Андерсона для укоренения рододендронов, содержащую 1,5 мг ИУК, приводило к стимуляции корнеобразования. Оптимальным являлось использование среды с 50 мг/л диоксида кремния – в этом случае число корней превышало показатель контрольного варианта в 4,3 раза (достоверно при p≤0,05). При применении среды Андерсона без ИУК и аморфного кремнезема количество корней составило 1,12±0,03 шт., среды Андерсона с ИУК без аморфного кремнезема – 3,26±0,13 шт., среды, содержащей 50 мг/л диоксида кремния и ИУК – 4,76±0,44 шт.
Применение других концентраций аморфного кремнезема также стимулировало рост корней рододендронов. При использовании 100–150 мг/л кремнезема в сочетании с ИУК количество корней в 3,9 раза превышало показатель контрольного варианта и составляло 4,38±0,61 шт. и 4,44±0,63 шт. на среде, содержащей 100 мг/л и 150 мг/л кремнезема соответственно (достоверно при p≤0,05).
Использование аморфного кремнезема в сочетании с ИУК (1,5 мг/г) являлось более эффективным для стимуляции корнеобразования рододендронов по сравнению с применением сред с диоксидом кремния, не содержащих ИУК. Использование аморфного кремнезема во всех изученных концентрациях в сочетании с ИУК приводило к увеличению длины корней в 1,5–2 раза по сравнению с вариантом без использования ИУК.
Список литературы Влияние диоксида кремния «Ковелос-Сорб» на параметры роста Rhododendron roseum (Loise.) Rehder в культуре in vitro
- Anderson W. C. Propagation of rhododendrons by tissue culture. 1. Development of a culture medium for multiplication of shoots // Comb Proc Int Plant Propag Soc. 1975.
- Avestan S., Naseri L. A., Hassanzade A., Sokri S. M., Barker A. V. Effects of nanosilicon dioxide application on in vitro proliferation of apple rootstock // Journal of Plant Nutrition. 2016. Vol. 39. № 6. P. 850-855. DOI: 10.1080/01904167.2015.1061550
- Balakhnina T., Borkowska A. Effects of silicon on plant resistance to environmental stresses // International Agrophysics. 2013. Vol. 27. № 2. P. 225-232. DOI: 10.2478/v10247-012-0089-4
- Epstein E. Silicon: its manifold roles in plants // Annals of applied Biology. 2009. Vol. 155. № 2. P. 155-160. DOI: 10.1111/j.1744-7348.2009.00343.x
- Jones K. W. Silicon in banana plants: uptake, distribution and interaction with the disease fusarium wilt. 2014. DOI: 10.14264/uql.2014.470
- Moriguchi T., Kozaki I., Matsuta N., Yamaki S. Plant regeneration from grape callus stored under a combination of low temperature and silicone treatment // Plant cell, tissue and organ culture. 1988. Vol. 15. № 1. P. 67-71. DOI: 10.1007/BF00039890
- Qing W., Huiying H., Jinwen Z. Effect of exogenous silicon and proline on potato plantlet in vitro under salt stress // China Vegetables. 2005. Vol. 9. P. 16-18.
- Radovet-Salinschi D., Cachita-Cosma D. Testing the regenerative capacity of Solanum tuberosum var. Gersa explants after 24 weeks storage in living collection // Analele Universitatii din Oradea, Fascicula: Ecotoxicologie, Zootehnie si Tehnologii de Industrie Alimentara. 2012. Vol. 11. P. 423-430.
- Sivanesan I., Park S. W. The role of silicon in plant tissue culture // Frontiers in plant science. 2014. Vol. 5. P. 571. DOI: 10.3389/fpls.2014.00571


