Влияние дистресса на неоангиогенез у больных раком яичников
Автор: Генс Гелена Петровна, Олейникова Ирина Николаевна, Сирота Наталья Александровна, Моисеева Наталья Ивановна, Шикина Валентина Евгеньевна, Киркин Владимир Васильевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 т.18, 2019 года.
Бесплатный доступ
Введение. По данным экспериментальных и клинических исследований, дистресс, испытываемый онкологическими пациентами, активирует симпатическую нервную систему, в результате чего повышается уровень катехоламинов в опухолевой ткани. Катехоламины, связываясь с адренорецепторами опухолевых клеток и клеток опухолевого микроокружения, активируют процессы неоангиогенеза опухоли. Ключевую роль в процессе неоангиогенеза опухоли играет фактор роста эндотелия сосудов семейства А (VEgF a). Цель исследования - оценить взаимосвязь уровня сывороточного VEgF a с дистрессом у больных раком яичников. Материал и методы. Проведено проспективное исследование «поперечного среза», в которое включено 100 пациенток с морфологически верифицированным раком яичников I-IV стадии, медиана возраста - 56 ± 9,56 года. Определение уровня VEgF a в сыворотке крови пациенток проводили методом иммуноферментного анализа. Для выявления дистресса приме-няли «Скрининговый опросник дистресса». Результаты. Медиана показателя сывороточного VEgF a у больных раком яичников составила 325,77 пг/мл. Клинически значимый дистресс был диагностирован у 54 % пациенток. Показатель сывороточного VEgF a статистически значимо коррелировал с дистрес-сом (коэффициент ранговой корреляции Спирмена rho=0,33; 95 % ДИ=0,11-0,52, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Рак яичников, дистресс, неоангиогенез, фактор роста эндотелия сосудов семейства а, психоонкология, качество жизни
Короткий адрес: https://sciup.org/140254248
IDR: 140254248 | УДК: 618.11-006.6:616.8-009:576.385.3 | DOI: 10.21294/1814-4861-2019-18-2-22-27
Текст научной статьи Влияние дистресса на неоангиогенез у больных раком яичников
Рак яичников на ранних стадиях развития, как правило, протекает бессимптомно. Более 60 % пациенток на момент постановки диагноза имеют III–IV стадию, что отражается на прогнозе заболевания. Одногодичная летальность при раке яичников составляет 22 % [1].
Сам факт постановки диагноза, который несет в себе угрозу инвалидизации, социальной изоляции и смерти, а также процесс противоопухолевого лечения травмируют психику пациенток и являются причиной дистресса различной степени выраженности. По определению основателя коллегии по коррекции дистресса Национальной противораковой сети США Jimmie С. Holland дистресс – это мультифактори-альное, неприятное, эмоциональное переживание в психосоциальной, социальной и/или духовной сферах, которое мешает справляться с болезнью, ее симптомами и лечением [2]. Дистресс является фактором, снижающим качество жизни онкологических больных, что обусловливает необходимость его своевременной диагностики и коррекции [3, 4].
Поддержание качества жизни пациентов является второй по значимости задачей противоопухолевого лечения после общей выживаемости [5]. Согласно современному международному стандарту оказания онкологической помощи, дистресс является одним из 6 основных физиологических показателей, определяемых у онкологических больных при поступлении в стационар, наряду с пульсом, температурой тела, артериальным давлением, частотой дыхательных движений и болью [6, 7].
В экспериментальных исследованиях установлен механизм прямой связи между дистрессом и прогрессированием опухолевого процесса. Хронический дистресс, испытываемый пациентками, приводит к активации симпатической нервной системы с последующим повышением уровня катехоламинов в сыворотке крови и в опухолевой ткани. Катехоламины (адреналин, норадреналин, дофамин) связываются с адренорецепторами опухолевых клеток и клеток опухолевого микроокружения. Хроническая адренергическая стимуляция активи- рует процессы роста опухоли, инвазии и миграции опухолевых клеток, неоангиогенеза [8, 9].
Ключевую роль в процессе неоангиогенеза опухоли играет фактор роста эндотелия сосудов семейства А (VEGF A). Повышение уровня VEGF А в опухоли происходит вследствие гипоксии. Это приводит к быстрому росту кровеносных сосудов, которые снабжают опухоль кислородом и нутриентами, что крайне важно для усиления ее роста. В метаанализе 16 исследований было показано, что повышенный уровень VEGF A в сыворотке крови и опухолевой ткани у пациенток, страдающих раком яичников, является независимым фактором прогноза, связанным со снижением показателей общей и безрецидивной выживаемости [10].
В литературе нам не удалось найти исследований, посвящённых связи уровня дистресса у онкологических больных и сывороточного VEGF A.
Целью исследования является изучение взаимосвязи между уровнем сывороточного VEGF A и психологическим дистрессом у больных раком яичников.
Материал и методы
Проведено проспективное исследование «поперечного среза», в которое включено 100 пациенток с морфологически верифицированным
Таблица 1 характеристики пациенток, включенных в исследование
Для выявления дистресса применяли «Скрининговый опросник дистресса», разработанный национальной противораковой сетью США, в адаптации на русский язык И.Н. Олейниковой и соавт. [11]. Разрешение на перевод с английского языка на русский и валидацию данной методики для использования в России у женщин со злокачественными новообразованиями было получено в письменном виде у председателя Коллегии Национальной противораковой сети США по лечению дистресса Jimmie C. Holland.
Методика состоит из двух частей. Первая – термометр дистресса, на котором пациенткам предлагалось отметить по шкале от 0 до 10, насколько выраженный дистресс они испытывали за прошедшую неделю, где 0 – отсутствие дистресса, а 10 – крайне выраженный дистресс. Вторая часть – список из 39 вопросов, касающихся социальной, психической, духовной сферы и физического состояния пациентки, которые позволяют выявить причины дистресса.
Статистический анализ результатов исследования проводили с помощью программы Medcalc. Для оценки распределения (параметрическое/ непараметрическое) всех количественных признаков мы использовали критерии типа Колмогорова – Смирнова. Корреляцию непараметрических данных оценивали с помощью метода ранговой корреляции Спирмена. Регрессионный анализ проводили методом множественной регрессии.
Результаты
Уровень VEGF A у больных раком яичников находился в пределах от 29,94 пг/мл до 2240,01 пг/мл. По критерию типа Колмогорова – Смирнова данный показатель был непараметрическим (р=0,0022). Медиана показателя VEGF A составила 325,77 ± 451,69 пг/мл.
Был проведен анализ корреляции уровня сывороточного VEGF A с возрастом больных раком яичников, стадией заболевания, гистологическим подтипом и степенью дифференцировки опухоли (табл. 2). Уровень сывороточного VEGF A статистически значимо коррелировал со стадией заболевания (коэффициент ранговой корреляции Спирмена rho=0,30; 95 % ДИ=0,02–0,536, p<0,05). Корреляции с возрастом пациенток, гистологическим подтипом и степенью дифференцировки опухоли не было.
Таблица 2
Результаты корреляционного анализа между уровнем сывороточного VegF a и возрастом, стадией заболевания, гистологическим подтипом и степенью дифференцировки опухоли у больных раком яичников
|
Клинические характеристики |
Коэффециент корреляции Спирмена, rho |
95 % доверительный интервал, ДИ |
Уровень значимости, p |
|
Возраст |
0,20 |
-0,03–0,41 |
>0,05 |
|
Стадия |
0,30 |
0,02–0,54 |
<0,05 |
|
Гистологический подтип опухоли |
0,22 |
-0,07–0,47 |
>0,05 |
|
Степень дифференцировки опухоли |
-0,07 |
-0,41–0,29 |
>0,05 |
Медиана баллов по «Термометру дистресса» у пациенток, включенных в исследование, составила 4 ± 2,4 балла. Клинически значимый дистресс (отметка на «Термометре дистресса» 4 и выше) был диагностирован у 54 (54 %) пациенток. С целью определения взаимосвязи между дистрессом и клиническо-анамнестическими данными был проведен анализ корреляции между дистрессом и возрастом, образованием, семейным положением больных, стадией заболевания и типом получаемого лечения. Уровень дистресса не коррелировал с возрастом, образованием, семейным положением больных и стадией заболевания (р>0,05).
Была получена статистически значимая корреляция между уровнем дистресса и типом получаемого лечения (коэффициент корреляции Спирмена rho=-0,28; 95 % ДИ=-(0,5–0,03), р<0,05). Пациентки перед хирургическим этапом лечения испытывали более выраженный дистресс.
Уровень сывороточного VEGF A у больных РЯ значимо коррелировал с дистрессом, коэффициент корреляции Спирмена составил 0,33; 95 % ДИ=0,11–0,52, p<0,004. Также нами была выявлена статистически значимая корреляция между стадией заболевания и уровнем сывороточного VEGF A (p<0,05). При этом не было выявлено корреляции между дистрессом и стадией опухолевого процес-
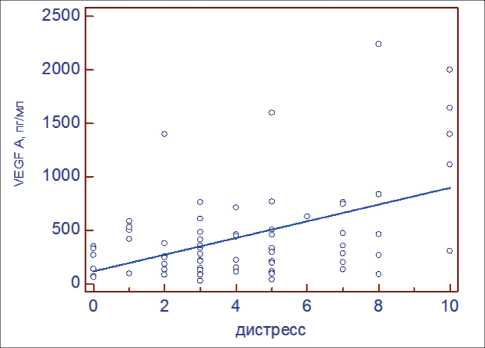
Рис. 1. Результаты регрессионного анализа взаимосвязи между сывороточным VEGF A и дистрессом у больных раком яичников са (коэффициент корреляции Спирмена rho=0,19; 95 % ДИ=-0,06–0,43, p>0,05). Методом регрессионного анализа установлено, что дистресс является независимым фактором, повышающим VEGF A в сыворотке крови больных раком яичников (p<0,05) (рис. 1).
Обсуждение
Уровень сывороточного VEGF A у больных РЯ статистически значимо коррелировал со стадией заболевания и не коррелировал с возрастом, гистотипом и степенью злокачественности опухоли. Полученные результаты подтверждают данные ранее проведенных исследований [12].
Анализ распространенности дистресса у больных раком яичников, включенных в проведенное исследование, показал, что клинически значимый дистресс был выявлен у 57,1 % пациенток, что несколько выше, чем в ранее опубликованных исследованиях. В метаанализе S. Watts et al. частота дистресса у 3623 больных раком яичников составила 20–30 % [13]. По данным T.R. Norton et al., дистресс испытывают 20 % больных РЯ [14]. В исследовании В.А. Чулковой с соавт. распространенность дистресса у больных с опухолями женской репродуктивной системы находилась в пределах от 16 до 18 % [15].
Нами не выявлено взаимосвязи между дистрессом и возрастом пациенток, их семейным положением, уровнем образования, стадией заболевания. Аналогичные данные получены в крупных зарубежных исследованиях [16, 17]. Уровень дистресса значимо коррелировал с проводимым лечением. Данное обстоятельство можно объяснить тем, что больные РЯ, анкетированные до начала лечения и перед хирургическим вмешательством, имели небольшой период времени с момента постановки диагноза и испытывали более выраженный дистресс.
Нами установлено, что дистресс является независимым фактором, повышающим VEGF A в сыворотке крови больных РЯ. Это может являться подтверждением связи процессов неоангиогенеза в опухоли и психологического статуса. Механизм влияния дистресса, испытываемого онкологическими больными, на образование новых кровеносных сосудов опухоли был изучен в проведенных ранее исследованиях. Доказано, что в норме симпатическая нервная система может запускать процессы заживления ран через стимуляцию активации процессов ангиогенеза [18].
У онкологических больных под воздействием хронического дистресса происходит активация симпатической нервной системы, что ведет к повышению концентрации катехоламинов в опухолевой ткани и ткани опухолевого микроокружения. Взаимодействие катехоламинов с бета-адренорецепторами клеток опухоли и клеток эндотелия сосудов модулирует экспрессию генов VEGF A [19]. Исследования с использованием фармакологических и генетических ингибиторов неоангиогенеза подтвердили, что индуцированная симпатической нервной системой регуляция неоангиогенеза опосредует стрессовое воздействие на рост и метастазирование опухоли in vivo [20]. Исследования на клетках рака яичников человека линий Hey-A8 и SKOV3ip1 показали, что данный механизм реализуется через аденилатциклазную систему вторичных внутриклеточных посредников [20, 21]. Важную роль в процессе неоангиогенеза опухоли играют макрофаги. Человеческие и мы- шиные макрофаги экспрессируют VEGF A и матричные металлопротеиназы при адренергической стимуляции [22]. Это, в свою очередь, индуцирует образование новых кровеносных сосудов и провоцирует появление инвазивных свойств опухоли с помощью ремоделирования экстрацеллюлярного матрикса [23].
Список литературы Влияние дистресса на неоангиогенез у больных раком яичников
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2016 году. М., 2018. 236.
- Holland J.C., Alici Y. Management of distress in cancer patients. J Support Oncol. 2010. Jan-Feb; 8 (1): 4-12.
- Олейникова И.Н., Генс Г.П., Сирота Н.А., Шикина В.Е., Садикова О.Е., Киркин В.В., Назаренко З.Н. Качество жизни и дистресс у больных раком яичников. Паллиативная медицина и реабилитация. 2017; 2: 25-7.
- Ploos van Amstel F.K., van Ham M.A., Peters E.J., Prins J.B., Ottevanger P.B. Self-reported distress in patients with ovarian cancer: is it related to disease status? Int J Gynecol Cancer. 2015 Feb; 25 (2): 229-35. DOI: 10.1097/IGC.0000000000000355
- Winer E.P., Hudis C., Burstein H.J., Chlebowski R.T., Ingle J.N., Edge S.B., Mamounas E.P., Gralow J., Goldstein L.J., Pritchard K.I., Braun S., Cobleigh M.A., Langer A.S., Perotti J., Powles T.J., Whelan T.J., Browman G.P. Outcomes of cancer treatment for technology assessment and cancer treatment guidelines American Society of Clinical Oncology. J Clin Oncol. 1996; 14 (2): 671-9. DOI: 10.1200/JCO.2002.06.020


