Влияние длительного кормления диспергированной пищей на цитометрические параметры печени белых крыс в онтогенезе
Автор: Кузнецова Т.И.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 4, 2020 года.
Бесплатный доступ
Цель работы - изучить влияние длительного питания мелко измельченной пищей на динамику цитометрических параметров гепатоцитов белых крыс в постнатальном онтогенезе. Материалы и методы. На 21-е сут постнатального онтогенеза 100 самцов белых крыс были разделены на контрольную и две опытные группы (опыт I и опыт II). Животных контрольной группы содержали на естественном для грызунов корме, а животные опытных групп получали аналогичную по качественному и количественному составу пищу, но после тщательного механического измельчения. Для оценки обратимости воздействия питания диспергированной пищей животных II опытной группы со 120-х по 240-е сут переводили на питание кормом контрольных животных. Исследовали участки печени, морфометрию клеток которой проводили на стандартно окрашенных гистологических срезах. Измеряли площадь сечения ядер и цитоплазмы гепатоцитов, вычисляли ядерно-цитоплазматическое отношение, на стандартной площади среза подсчитывали количество гепатоцитов, в т.ч. двуядерных. Результаты. Выявлено, что длительное потребление диспергированной пищи оказывает воздействие на постнатальный морфогенез паренхимы печени. С 21-х по 120-е сут интенсивность роста гепатоцитов и количество двуядерных клеток опытных животных превышает таковые значения контрольных, а с 120-х по 240-е сут интенсивность роста гепатоцитов опытных животных существенно уступает показателям контрольных животных, вследствие чего количество клеток на стандартную площадь среза увеличивается. При переходе к питанию пищей с естественными механическими свойствами со 120-х по 240-е сут постнатального онтогенеза наблюдается тенденция к восстановлению цитометрических параметров гепатоцитов, однако полного восстановления не происходит.
Печень, гепатоцит, диспергированная пища
Короткий адрес: https://sciup.org/14117591
IDR: 14117591 | УДК: 591.436.2:599.3234(021) | DOI: 10.34014/2227-1848-2020-4-142-152
Текст научной статьи Влияние длительного кормления диспергированной пищей на цитометрические параметры печени белых крыс в онтогенезе
Введение. Одной из фундаментальных задач биологии является изучение процессов морфогенеза органов и систем органов животных в условиях нормы и патологии. Онтогенез и филогенез пищеварительной системы тесно взаимосвязаны со средой обитания и пищевой специализацией животных [1]. Характер потребляемой пищи, её состав могут оказывать влияние на развитие органов пищеварения. В современной литературе имеется множество публикаций, посвященных изучению влияния химического состава пищи, а именно соотношения её макро- и микронутриентов, пищевых волокон, на функционирование и строение печени [2–4]. Однако характер воздействия механических свойств потребляемой пищи на постнатальный морфогенез печени остается практически не изученным, в то время как уже показано влияние питания дис- пергированной (тщательно механически измельченной) пищи на онтогенез ряда органов пищеварительной системы [5–7]. С учетом тесной интеграции всех органов пищеварительного тракта весьма вероятным представляется воздействие питания диспергированной пищей на строение и функционирование печени. Особенно интересным представляется процесс адаптации печени животных, питающихся диспергированной пищей на ранних этапах онтогенеза, к питанию кормом с неизмененными механическими свойствами.
Цель исследования. Изучение влияния длительного питания мелко измельченной пищей на динамику цитометрических параметров гепатоцитов белых крыс в постнатальном онтогенезе.
Материалы и методы. Исследование проводилось на 100 самцах белых неинбред- ных крыс, которые на 21-е сут постнатального онтогенеза были произвольно разделены на три группы: контрольную (контроль) и две опытные (опыт I и опыт II) (рис. 1).
Животные контрольной группы (41 особь) с 21-х по 240-е сут постнатального онтогенеза питались естественной для грызунов пищей, основу которой составляли цельные зерна злаков и подсолнечника, крупно нарезанные овощи. Рацион питания составлялся с учетом пищевой ценности и сбалансированности всех его компонентов. Животные первой опытной группы (41 самец) с 21-х по 240-е сут постна- тального онтогенеза получали пищу того же количественного состава, но после тщательного механического измельчения (дисперга-ции). Для оценки адаптивных возможностей печени животные второй опытной группы (18 особей) с 21-х по 120-е сут постнатального онтогенеза содержались на питании диспергированной пищей, а затем со 120-х по 240-е сут постнатального периода были переведены на питание кормом, применяющимся для кормления контрольных животных. Животным обеспечивался свободный доступ к воде и пище в любое время суток.
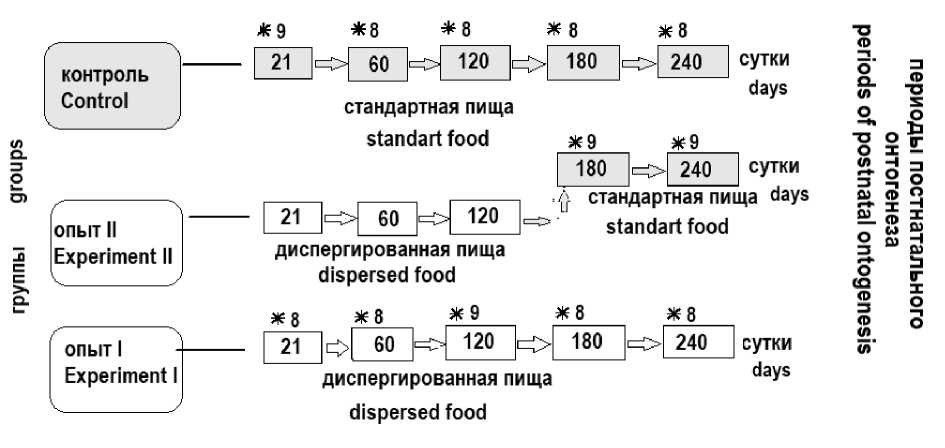
Рис. 1. Дизайн эксперимента (* – количество животных, выведенных из эксперимента в данном возрастном периоде)
Fig. 1. Experiment design
(* – the number of animals withdrawn from the experiment at a given period)
Другие условия были идентичными. Содержание животных в виварии проводилось в соответствии с «Санитарными правилами по устройству, оборудованию и содержанию экспериментально-биологических клиник» от 6.04.1973 и приказом Минздрава России от 1.04.2016 № 199н «Об утверждении правил надлежащей лабораторной практики».
Непосредственным объектом исследования послужила печень, участки которой брали у контрольных и опытных животных (опыт I) на 21-е (поздний молочный период), 60-е (ранний пубертатный период), 120-е (поздний пубертатный период), 180-е (репродуктивный период), 240-е сут (период возмужания) [8]. Животные второй опытной группы (опыт II) выводились из эксперимента только на 180-е и 240-е сут (рис. 1). Все болезненные манипуляции с животными проводились в соответствии с приказом Минздрава СССР от 12.08.1977 № 755 «О гуманном обращении с экспериментальными животными», а также положениями Хельсинкской декларации Всемирной медицинской ассоциации от 1964 г., дополненной в 2013 г.
Для гистологического исследования кусочки печени размером 5–7 мм фиксировали в 10 % нейтральном формалине, после чего их заливали в парафин. Срезы толщиной 5 мкм окрашивали гематоксилин-эозином [9]. Морфометрию структур печени проводили с помощью компьютерной видео-тест-системы, включающей световой микроскоп Carl Zeiss, цифровую фотокамеру Canon и компьютерную программу денситофотометрии Mecos-C1. В процессе изучения гистопрепаратов измеряли площадь сечения (мкм2) ядер и цитоплазмы гепатоцитов, для оценки функциональной активности гепатоцитов определяли их ядерно-цитоплазматическое отношение (%). Для подсчета количества гепатоцитов на стандартной площади среза применяли квадратносетчатую окулярную вставку, подсчет производили при 280-кратном увеличении на площади 10 000 мкм2 [10].
Полученные морфометрические данные подвергали статистическому анализу, применяя критерий Стьюдента t (р<0,05), с помощью лицензионных компьютерных программ обработки статистических данных SPSS 13.0 for Windows, Statistica 6 (USA, Statsoft. Inc.).
Результаты и обсуждение. Динамика изменения размеров ядер гепатоцитов белых крыс контрольной и опытной групп в постнатальном онтогенезе характеризуется неравномерным увеличением. В период с 21-х по 120-е сут постнатального онтогенеза наблюдается наиболее интенсивный рост площади сечения ядер гепатоцитов контрольных и опытных животных (табл. 1). В последующий период, со 120-х по 180-е сут, отмечается некоторое уменьшение размеров ядер в обеих экспериментальных группах. Однако затем тенденция к увеличению возобновляется, и в период со 180-х по 240-е сут постнатального развития отмечается некоторое возрастание (р<0,05) размеров ядер гепатоцитов как контрольных, так и опытных животных: до 39,23±0,13 и 39,29±0,14 мкм2 соответственно. При этом показатели площади сечения ядер гепатоцитов 60-, 120-, 180-суточных опытных животных оказываются статистически значимо меньше (р<0,05) аналогичных показателей контрольных животных, тогда как со 180-х по 240-е сут это различие утрачивается и размеры ядер гепатоцитов опытных животных достигают размеров ядер гепатоцитов животных контрольной группы.
Динамика изменения размеров цитоплазмы гепатоцитов животных контрольной группы в постнатальном онтогенезе также характеризуется неравномерным ростом: от позднего молочного до репродуктивного периода постнатального онтогенеза наблюдается постепенное возрастание размеров цитоплазмы гепатоцитов. В этот период отмечается увеличение площади сечения цитоплазмы с 105,25±0,48 до 225,45±0,93 мкм2 (р<0,05). Следующим периодом изменений размеров цитоплазмы в постнатальном онтогенезе является период от репродуктивного до зрелого возраста, который характеризуется уменьшением (р<0,05) площади сечения цитоплазмы гепатоцитов до 217,48±0,89 мкм2. В опытной группе животных наблюдается постепенное возрастание площади сечения цитоплазмы гепатоцитов от позднего молочного до зрелого возраста. При этом на 60-е сут (ранний пубертатный период) размер цитоплазмы гепатоцитов животных опытной группы (179,40±1,26 мкм2) превосходит (р<0,05) аналогичный показатель контрольной группы (171,33±1,40 мкм2 ), тогда как в последующие возрастные периоды площадь сечения цитоплазмы гепатоцитов животных, питающихся диспергированной пищей, оказывается меньше соответствующих контрольных значений (р<0,05).
Отношение площади ядра клетки к площади её цитоплазмы, т.е. ядерно-цитоплазма-тическое отношение (ЯЦО), является важным показателем, указывающим на интенсивность роста, развития клетки и протекания процессов жизнедеятельности [11, 12]. Наиболее высокое значение ЯЦО наблюдается у 21-суточных животных (22,94±0,11 %), что обусловлено относительно небольшими размерами цитоплазмы и крупными размерами ядра и свидетельствует о низком уровне протекания синтетических процессов. У контрольных животных к 180-суточному возрасту значение ЯЦО снижается (17,38±0,08 %, р<0,05), что связано с увеличением площади сечения цитоплазмы гепатоцитов. Это указывает на завершение роста и развития клетки, установление интенсивного, свойственного взрослому организму уровня синтетических процессов. В последующий период (180–240-е сут) значения
ЯЦО гепатоцитов несколько возрастают (18,30±0,08 %, р<0,05), так как возрастают размеры ядра при неизменных размерах цитоплазмы. В группе опытных животных ЯЦО снижается неравномерно. Наиболее интенсивное уменьшение ЯЦО наблюдается с 21-х по 60-е сут постнатального онтогенеза. Площадь сечения цитоплазмы гепатоцитов этой группы опытных животных возрастает более интенсивно по сравнению с контрольными, поэтому значения ЯЦО оказываются ниже (19,62±0,12 %, р<0,05) соответствующего значения контрольных животных того же возраста.
Таблица 1
Table 1
Цитоморфологические характеристики гепатоцитов белых крыс в норме (контроль) и при питании диспергированной пищей (опыт I, опыт II)
Cytomorphological characteristics of white rats’ hepatocytes in norm (control) and when fed with homogenized food (experiment I, experiment II)
|
Показатель Parameter |
Группа Group |
Возраст Age |
||||
|
21-суточные 21-day old |
60-суточные 60-day old |
120-суточные 120-day old |
180-суточные 180-day old |
240-суточные 240-day old |
||
|
Площадь сечения ядра, мкм 2 Nucleus section area, 2 μm 2 |
Контроль Control |
23,45±0,09 |
37,08±0,26 + |
40,58±0,15 + |
38,05±0,14 + |
39,23±0,13 + |
|
Опыт I Experiment I |
23,45±0,09 |
34,75±0,23 +* |
39,09±0,17 *+ |
38,26±0,12 +* |
39,29±0,14 + |
|
|
Опыт II Experiment II |
- |
- |
- |
36,53±0,14 +*Δ |
40,93±0,15 +*Δ |
|
|
Площадь сечения цитоплазмы, мкм 2 Cytoplasm section area, μm 2 |
Контроль Control |
105,25±0,48 |
171,33±1,40 + |
210,47±1,15 + |
225,45±0,93 + |
217,48±0,89 + |
|
Опыт I Experiment I |
105,25±0,48 |
179,40±1,26 *+ |
186,18±0,92 *+ |
191,81±0,78 +* |
193,88±0,90 * |
|
|
Опыт II Experiment II |
- |
- |
- |
201,53±0,85 +*Δ |
211,37±0,84 +*Δ |
|
|
Ядерно-цитоплазматическое отношение, % Nuclear-cytoplasmic ratio, % |
Контроль Control |
22,94±0,11 |
21,99±0,13 + |
19,64±0,11 + |
17,38±0,08 + |
18,30±0,08 + |
|
Опыт I Experiment I |
22,94±0,11 |
19,62±0,12 *+ |
21,52±0,12 *+ |
20,10±0,08 *+ |
20,45±0,10 *+ |
|
|
Опыт II Experiment II |
- |
- |
- |
18,47±0,09 +*Δ |
19,63±0,08 +*Δ |
|
Примечание. * – статистически значимое отличие по сравнению с контрольным значением (р<0,05); + – статистически значимое отличие по сравнению с предыдущим значением (р<0,05); Δ – статистически значимое отличие по сравнению с значением I опытной группы (р<0,05).
Note. * – the differences are significant compared with the control group (p<0.05); + – the differences are significant compared with the previous group (p<0.05); Δ – the differences are significant compared with experiment group 1 (р<0.05).
Однако последующее (120–240-е сут) увеличение площадей сечения ядра и цитоплазмы гепатоцитов обусловливает снижение ядерно- цитоплазматического отношения гепатоцитов в этот период. При этом значения ЯЦО опытных животных превышают аналогичные зна- чения животных контрольной группы, что связано с меньшим размером цитоплазмы гепатоцитов животных, питающихся диспергированной пищей.
После перевода животных, питающихся от позднего молочного до пубертатного периода постнатального онтогенеза диспергированной пищей, на корм с естественными механическими свойствами наблюдается уменьшение площади сечения ядер гепатоцитов до 36,53±0,14 мкм2 (р<0,05) к пубертатному периоду с последующим возрастанием значения данного параметра до 40,93±0,15 мкм2 к зрелому возрасту, что превышает соответствующий показатель как контрольных, так и опытных животных I группы. Размеры цитоплазмы гепатоцитов животных II опытной группы с позднего пубертатного до зрелого возраста постепенно возрастают, превосходя значения опытных животных I группы и приближаясь к значениям контрольных животных. ЯЦО гепатоцитов животных II опытной группы от пубертатного до репродуктивного периода снижается (18,47±0,09 %), а к зрелому возрасту увеличивается (19,63±0,08 %, р<0,05), оказываясь в период от 180-х по 240-е сут развития меньше значений животных I опытной группы, но больше значений животных контрольной группы (табл. 1).
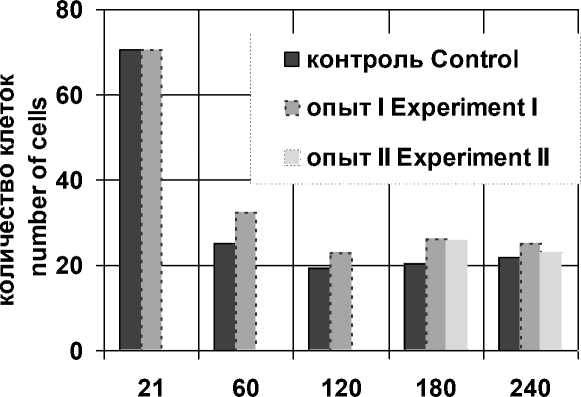
С 21-х по 60-е сут постнатального онтогенеза наблюдается значительное уменьшение количества гепатоцитов на стандартную площадь среза (10 000 мкм2) как в контрольной, так и в опытной группе. Общее количество гепатоцитов на стандартную площадь среза 21-суточных животных составляет 70,65±0,38 клетки, уменьшаясь к 60-суточному возрасту до 24,71±0,38 клетки у контрольных и до 32,87±0,67 (р<0,05) клетки у опытных животных (рис. 2). Эти изменения связаны с интенсивным ростом гепатоцитов. При этом размеры и количество клеток опытных животных несколько больше соответствующих значений контрольных животных (р<0,05). Данная временная гипертрофия и повышенное количество гепатоцитов опытных животных, вероятно, являются признаком адаптационных процессов в печени, ее реакцией на воздействие измененных физических свойств пищи.
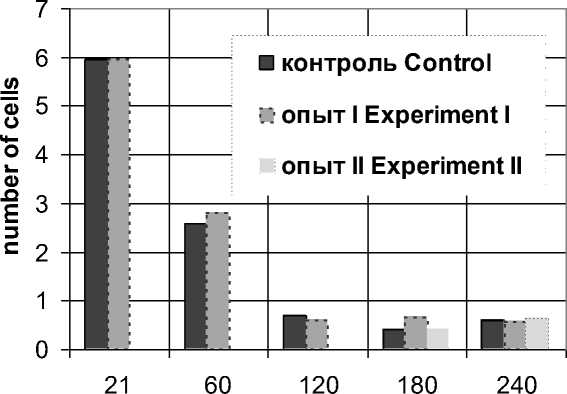
Также в этот возрастной период (с 21-х по 60-е сут) количество двуядерных гепатоцитов изменяется сходным образом, уменьшаясь с 5,95±0,20 клетки у 21-суточных животных до 2,58±0,12 и 2,81±0,12 (р<0,05) у контрольных и опытных 60-суточных животных соответственно (рис. 3, 4).
сутки days
Рис. 2. Возрастная динамика суммарного количества гепатоцитов животных контрольной (контроль) и опытной (опыт I, опыт II) групп
Fig. 2. Age-related dynamics of the total hepatocyte number in the control (control) and experimental (experiment I, experiment II) groups
сутки days
Рис. 3. Возрастная динамика абсолютного количества двуядерных гепатоцитов в печени животных контрольной (контроль) и опытной (опыт I, опыт II) групп
Fig. 3. Age-related dynamics of the total binuclear hepatocyte number in the liver in the control (control) and experimental (experiment I, experiment II) groups
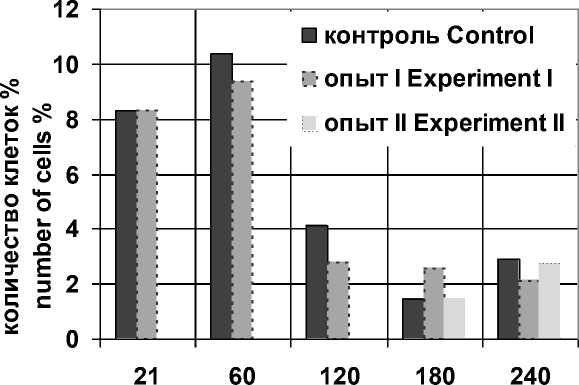
Различия в абсолютном и относительном количестве двуядерных гепатоцитов между контрольными и опытными 60-суточными животными статистически недостоверны, однако увеличение относительного (%) количества двуядерных паренхимных клеток печени у 60-суточных животных обеих эксперимен- тальных групп по сравнению с 21-суточными животными (р<0,05) свидетельствует об усилении пролиферативных процессов, обусловленных, вероятно, естественным физиологическим процессом роста органа в данном возрастном периоде.
сутки days
Рис. 4. Возрастная динамика относительного количества (%) двуядерных гепатоцитов в печени животных контрольной (контроль) и опытной (опыт I, опыт II) групп
Fig. 4. Age-related dynamics of binuclear hepatocyte relative number (%) in the liver in the control (control) and experimental (experiment I and experiment II) groups
В последующий период (60-120-е сут) наблюдается уменьшение количества гепатоцитов на единицу площади в обеих экспериментальных группах, что обусловлено возрастанием площади сечения гепатоцитов. В отличие от контрольных, гепатоциты опытных 120-суточных животных характеризуются менее интенсивным ростом площади сечения, что обусловливает повышенное количество гепатоцитов на стандартную площадь среза, достигающее 23,01±0,32 клетки, из которых 0,61±0,05 (2,80±0,23 %) - двуядерные (рис. 3, 4). В период с 60-х по 120-е сут, по сравнению с показателями контрольных животных, количество двуядерных клеток опытных животных уменьшается несколько более значительно и затем статистически значимо не изменяется в последующие возрастные этапы. Уменьшение количества двуядерных клеток в этот период, вероятно, обусловлено цитотомией двуядерных клеток, что является признаком интенсивных процессов, связанных с пролиферацией, физиологической возрастной гиперплазией и полиплоидизацией [11].
В последующем, в период со 120-х по 180-е сут постнатального онтогенеза, количество гепатоцитов животных экспериментальных групп на стандартную площадь среза начинает несколько увеличиваться. Количество паренхимных клеток печени на единицу площади 180-суточных контрольных животных возрастает до 20,42±0,34 (р<0,05), двуядерных - до 0,40±0,05 (1,47±0,18 %), при этом площадь сечения гепатоцитов животных данной группы продолжает также увеличиваться (260,41±0,93 мкм2, р<0,05). Необходимо отметить, что количество двуядерных клеток в печени контрольных животных к 180-суточному возрасту достигает минимальных значений, что, вероятно, связано с окончанием роста органа, установлением структурной зрелости его ткани и достижением базового уровня функционирования [11, 12]. В отличие от животных контрольной группы, у 180-суточных опытных животных количество двуядерных клеток остается постоянным. Общее количество гепатоцитов у них составляет 26,32±0,37 клетки, что превосходит аналогичные показатели контрольных животных того же возраста и обусловливается меньшими размерами ядер и цитоплазмы.
Со 180-х по 240-е сут у контрольных животных продолжается некоторое увеличение количества гепатоцитов на стандартную площадь, обусловленное снижением их площадей сечения, достигая к 240-суточному возрасту значения 21,70±0,38 клетки, из которых 0,59±0,05 (2,93±0,24 %) гепатоцита являются двуядерными. При этом некоторое увеличение количества двуядерных паренхимных клеток в данный возрастной период, возможно, является признаком процессов полип-лоидизации, что характерно для гепатоцитов в зрелом возрастном периоде [11]. Обратная тенденция наблюдается у 240-суточных опытных животных: общее количество гепатоцитов на стандартной площади среза печени уменьшается (р<0,05) до 25,02±0,39, а общее количество двуядерных гепатоцитов - до 0,57±0,05 клетки (2,11±0,19 %, р>0,05). Уменьшение количества клеток на стандартную площадь среза у опытных животных обусловлено увеличением объема гепатоцитов, что выражается в возрастании их площадей сечения (233,22±0,92 мкм2, р<0,05). Необходимо отметить, что количество двуядерных гепатоцитов у опытных животных меньше аналогичного показателя у контрольных животных того же возраста.
При переводе животных, питающихся от позднего молочного до пубертатного периода постнатального онтогенеза диспергированным кормом, на питание пищей с естественными физическими свойствами наблюдается увеличение количества гепатоцитов на стандартную площадь среза к 180-м сут (25,72±0,42, р>0,05) и последующее возвращение к исходным значениям (23,01±0,36, р>0,05) к 240-м сут постнатального онтогенеза. При этом данные изменения сопровождаются увеличением площади цитоплазмы гепатоцитов. Количество двуядерных гепатоцитов на стандартную площадь среза животных II опытной группы с позднего пубертатного до репродуктивного возраста постепенно снижается (0,40±0,04, р>0,05; 1,45±0,16 %, р>0,05), а затем возрастает к периоду зрелости (0,63±0,05, р>0,05; 2,72±0,22 %, р>0,05), по- вторяя динамику изменений аналогичных показателей контрольных животных.
Общие тенденции постнатального развития гепатоцитов печени белых крыс, содержащихся на естественном для грызунов рационе питания, можно охарактеризовать следующим образом: с позднего молочного по поздний пубертатный период происходит интенсивный рост паренхимы печени. Это подтверждается увеличением размера гепатоцитов, при этом их количество на стандартную площадь уменьшается, а количество двуядерных клеток возрастает, особенно у 60-суточных животных. Увеличение двуядерных клеток указывает на интенсивные процессы пролиферации и дифференцировки. В последующий период, со 120-х по 180-е сут (с позднего молочного по репродуктивный период), размеры клеток достигают максимальных значений, количество гепатоцитов на стандартную площадь уменьшается, что свидетельствует об активных синтетических процессах в цитоплазме гепатоцитов и функциональной активности клеток. Период с репродуктивного до зрелого возраста (180-е – 240-е сут) характеризуется некоторым увеличением размеров ядер и небольшими колебаниями размеров цитоплазмы гепатоцитов, а также увеличением количества двуядерных клеток, это свидетельствует о процессах их полиплоидиза-ции, что характерно для гепатоцитов зрелых животных.
Динамику постнатального развития гепатоцитов животных, получающих диспергированную пищу, можно условно разделить на два этапа. Первый этап выражается в увеличении количества и объема гепатоцитов животных, питающихся измельченной пищей, в период с 21-х по 60-е сут до значений больших, чем у контрольных животных. Это может свидетельствовать об интенсивном росте паренхимы печени, при котором происходит пролиферация и дифференцировка новых гепатоцитов, и активном протекании синтетических процессов в уже существующих клетках на фоне развития и возрастания числа их органоидов и субклеточных структур, что дает возможность клеткам усилить свою метаболическую активность в ответ на воздействие фактора [11–13].
Второй этап связан с периодом постнатального онтогенеза от раннего пубертата до возмужания и характеризуется стойкими ги-потрофическими изменениями гепатоцитов и, как следствие, увеличением их количества на стандартную площадь среза. Физиологическое увеличение размера клеток паренхимы печени в процессе роста организма белых крыс, питающихся диспергированной пищей, снижено по сравнению с контрольными животными. Период с 60-х по 120-е сут характеризуется гиперактивностью, при этом возрастает ядерно-ци-топлазматическое отношение ввиду увеличения функциональной активности и объема ядра в ответ на расходование клеткой пластических веществ в предыдущий возрастной период. Изменения размеров ядер, наступающие в результате функциональных сдвигов, предшествуют изменениям объема цитоплазмы [11, 12, 14]. В период от позднего пубертатного до зрелого возраста (120–240-е сут) размеры ядер гепатоцитов опытных животных изменяются неравномерно, тогда как цитоплазма клеток демонстрирует стойкое снижение площади сечения, при этом количество клеток на стандартную площадь увеличено, а количество двуядерных гепатоцитов снижено. Эти изменения обусловлены постоянным воздействием фактора (длительное питание диспергированной пищей), что не позволяет клетке достичь базового уровня функционирования и соответствующего объема.
После перевода животных, питающихся от позднего молочного до пубертатного периода постнатального онтогенеза диспергированной пищей, на корм с естественными механическими свойствами наблюдается увеличение количества гепатоцитов на стандартную площадь среза, уменьшение площади сечения ядер и снижение количества двуядерных гепатоцитов в период со 120-х по 180-е сут. Это свидетельствует о регенераторных процессах, связанных с цитотомией двуядерных клеток, которая приводит к увеличению их количества [11–15]. В последующем периоде (180–240-е сут) тенденция изменения размеров гепатоцитов, их суммарного количества, а также количества двуядерных клеток животных II опытной группы приближается к соответствующим контрольным значениям, но не достигает их.
Заключение. Изложенное выше позволяет сделать вывод, что длительное потребление экспериментальными животными диспергированной пищи оказывает влияние на постнатальную динамику цитометрических и ги-стометрических показателей печени, приводя к уменьшению размеров гепатоцитов и увеличению их количества на стандартную площадь среза. Возврат к питанию пищей с есте- ственными механическими свойствами со 120-х по 240-е сут постнатального онтогенеза не обеспечивает полного восстановления цитометрических параметров печени, о чем свидетельствуют пониженные значения объемов ядер и цитоплазмы гепатоцитов животных II опытной группы по сравнению с таковыми контрольных животных.
Список литературы Влияние длительного кормления диспергированной пищей на цитометрические параметры печени белых крыс в онтогенезе
- Уголев А.М. Теория адекватного питания и трофология. Л.: Наука; 1991. 272.
- Тиньков А.А., Гатиатулина Е.Р., Попова Е.В., Полякова В.С., Скальная А.А., Аглетдинов Э.Ф., Никоноров А.А., Радыш И.В., Карганов М.Ю., Скальный А.В. Влияние адипогенной диеты в раннем возрасте на содержание микроэлементов в тканях крыс. Патологическая физиология и экспериментальная терапия. 2016; 60 (4): 79-85.
- Шидаков Ю.Х.М., Шарова Е.В., Абдумаликова И.А., Машанло Т.Р., Абдулбакиев А.А. Влияние рациона кормления крыс на биохимический профиль крови и морфологию печени. Бюллетень науки и практики. 2020; 6 (2): 60-66.
- Барановский А.Ю., Тимофеева Н.М. Научные основы питания здорового и больного человека. Вестник Санкт-Петербургской медицинской академии последипломного образования. 2010; 2 (1): 66-82.
- Семенова М.А., Цыганова Н.А., Дрождина Е.П., Саенко Ю.В., Глущенко Е.С., Антонова А.В., Гальчин А.В. Некоторые морфологические и физиологические характеристики постнатального онтогенеза белых крыс в условиях длительного питания диспергированной пищей. Фундаментальные исследования. 2013; 4-5: 1144-1148
- Сыч В.Ф., Санжапова А.Ф., Слесарева Е.В. Постнатальный морфогенез слизистой оболочки фундального отдела желудка белых крыс при длительном питании диспергированной пищей. Ученые записки УлГУ. 2006; 1 (10): 80-86.
- Сыч В.Ф., Цыганова Н.А., Слесарев С.М., Курносова Н.А. Гистоморфология мышечной оболочки тощей кишки белых крыс после длительного потребления диспергированного корма. Ученые записки УлГУ. 2006; 1 (10): 86-89.
- Махинько В.И. Константы роста и функциональные периоды развития в постнатальной жизни белых крыс. В кн.: Махинько В.И., Никитин В.Н., ред. Молекулярные и физиологические механизмы возрастного развития. Киев: Наукова думка; 1975: 308-326.
- Коржевский Д.Э., Гиляров А.В. Основы гистологической техники. СПб.: Спецлит; 2010. 96.
- Ташке К. Введение в количественную цитогистологическую морфологию. Будапешт: Изд-во Академии социологии Республики Румынии; 1980. 191.
- Рябинина З.А., Бенюш В.А. Полиплоидия и гипертрофия клеток в процессах роста и восстановления. М.: Медицина; 1973. 256.
- Атякшин Д.А., Ильин Е.А., Пашков А.Н. Морфофункциональное состояние ядерного аппарата гепатоцитов монгольских песчанок после полета на космическом аппарате "Фотон-МЗ". Авиакосмическая и экологическая медицина. 2010; 44 (2): 29-34.
- Туровинина Л.П., Стрельцова Н.А. Реактивные свойства и регенеративные возможности гепатоцитов в норме и при описторхозе. Вестник СурГУ. Медицина. 2010; 3 (6): 16-21.
- Ельчанинов А.В., Большакова Г.Б. Пролиферация и клеточная гибель гепатоцитов регенерирующей печени плодов крыс. Цитология. 2012; 54 (4): 313-317.
- Блинкова Н.Б., Сазонов С.В., Леонтьев С.Л. Полиплоидия гепатоцитов в регенерации печени при хроническом гепатите у пациентов из разных возрастных групп. Екатеринбург: Юника; 2017. 106.


