Влияние добавок меди на коррозионно-электрохимическое поведение высокочистого цинка в среде электролита NaCl
Автор: Ганиев Изатулло Наврузович, Содикова Сафаргул Саидхомидовна, Саидзода Рахимджон Хамро, Алихонова Сурай Джамшедовна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 4 т.20, 2020 года.
Бесплатный доступ
Современный научно-технический прогресс способствует развитию цветной металлургии высокими темпами. В общем объеме производства цветных металлов, которые широко используются в промышленности, цинк занимает четвёртое место. Благодаря специфическим свойствам цинк и его сплавы получили широкое применение в качестве конструкционных и неконструкционных изделий. Значительная часть производимого металлического цинка расходуется для покрытия им металлических листов, изготовления полуфабрикатов и фасонных отливок. Сплавы на основе цинка в последние годы широко используются для изготовления литых протекторов, применяемых для защиты морских судов и сооружений от коррозии. Расширение областей использования цинковых изделий ставит новые задачи перед специалистами, занимающимся производством и применением новых сплавов на основе цинка. Одной из легирующих добавок цинковых сплавов является медь. Сообщается, что медь (до 0,6 мас. %) повышает твердость и ухудшает пластичность и коррозионную стойкость цинка. Содержание меди в деформируемых сплавах цинка достигает до 5,5 мас. %. В связи с противоречивыми фактами относительно влияния меди на коррозионную стойкость цинка нами исследовано влияние его добавок до 2,0 мас. % на коррозионно-электрохимическое поведение высокочистого цинка в среде электролита NaCl. Исследования проводились потенциостатическим методом (скорость развёртки потенциала 2 мВ/с) на импульсном потенциостате ПИ-50-1.1. Установлено, что легирование цинка медью до 2 мас. % увеличивает его коррозионную стойкость на 10-15 % в среде электролита NaCl. Рост коррозионной устойчивости сплавов системы Pb-Cu сопровождается сдвигом в положительном направлении оси ординат основных электрохимических потенциалов.
Цинк, сплавы цинка с медью, потенциостатический метод, среда nacl, скорость коррозии, электрохимические потенциалы
Короткий адрес: https://sciup.org/147233964
IDR: 147233964 | УДК: 669.5:620.197 | DOI: 10.14529/met200402
Текст научной статьи Влияние добавок меди на коррозионно-электрохимическое поведение высокочистого цинка в среде электролита NaCl
Наряду с известными областями использования металлического цинка сплавы на его основе также широко применяются в различных отраслях народного хозяйства как в качестве конструкционного материала, так и неконструкционного. Как конструкционный материал цинковые сплавы широко применяются в автомобильной и авиационной промышленности, в судостроении, приборостроении и полиграфии. Все это определяется физикохимическими, технологическими и эксплуатационными свойствами сплавов данной группы. Высокие литейные свойства цинковых сплавов в сочетании с их низкой температурой плавления позволяют получать отливки вы- сокой прочности, характеризующиеся хорошим качеством поверхности, не требующие дополнительной обработки. Благодаря этому доля отливок, получаемых из цинковых сплавов, в общем объеме отливок, получаемых литьём под давлением, занимает важное место [1–8].
Расширение перечня цинковых изделий ставит новые требования к их свойствам и технологические задачи перед специалистами, занимающимися производством и применением цинка и его сплавов.
Цинк и его сплавы эксплуатируются в условиях воздействия природных и искусственных сред, агрессивность которых определяется целым рядом факторов. Это прежде всего влажность, температура, содержание кислорода и других окислительных сред.
Цинк проявляет высокую коррозионную устойчивость в интервале pH = 6…12. В этой области на поверхности цинка образуется стабильный гидроксид Zn(OH) 2 . В кислых (pH < 6) и щелочных средах (pH > 12) скорость коррозии возрастает в результате уменьшения пассивируемости плёнки Zn(OH)2, растворения её и цинка с образованием ионов Zn2 + и ZnO2 2 - по реакции [8–12]
Zn2 +
Zn
Zn(OH) 2
→ ZnO2 2 - .
Имеющиеся в литературе сведения относительно влияния меди на коррозионные свойства цинка носят противоречивый характер. В связи с этим нами была поставлена цель исследовать влияние добавок меди на коррозионно-электрохимическое поведение высокочистого цинка марки ЦВ1 в среде электролита NaCl.
Экспериментальные результаты и их обсуждение
Сплавы для исследования были получены в шахтной печи электрического сопротивления СШОЛ в интервале температур 750– 800 °С путём добавления в расплав цинка расчётного количества меди марки М00. Состав полученных сплавов, которые содержали 0,1–2,0 мас. % меди, контролировался в Центральной заводской лаборатории алюминиевой компании ГУП «ТАлКо», а также взвешиванием шихты и полученных сплавов. При отклонении веса сплавов более чем на 1–2 отн. % синтез сплавов проводился заново.
Из полученных таким образом расплавов в металлический кокиль отливались цилиндрические образцы диаметром 10 мм и длиной 140 мм. Торцевая часть образцов служила рабочим электродом для исследования электрохимических свойств. Рабочие электроды перед исследованием зачищались наждачной бумагой, последовательно переходя от крупнозернистого к мелкозернистому наждаку (№2-00). Таким образом, подготовка поверхности электрода заключалась в основном в его механической обработке. На последней стадии поверхность электрода очищалась спиртом.
В настоящей работе исследования проводили в нейтральных растворах, содержащих
NaCl различной концентрации, согласно рекомендациям ГОСТ 9.017–74, т. е. в имитате морской среды с целью определения влияния хлорид-иона на коррозионно-электрохимическое поведение сплавов цинка с алюминием.
Исследование коррозионно-электрохимического поведения сплавов цинка с медью проводилось в растворе хлорида натрия с концентрацией 0,03; 0,3 и 3,0 %, с помощью потенциостата ПИ-50-1.1 с выходом на программатор ПР-8 и самописцем ЛКД-4. Температура раствора в ячейке поддерживалась постоянная (20 °С) с помощью термостата МЛШ-8. Электродом сравнения служил хлоридсеребряный, вспомогательным – платиновый электрод.
Исследование проводилось в потенцио-динамическом режиме со скоростью развёртки потенциала 2 мВ/с. Электроды потенцио-динамически анодно поляризовали от установившегося значения стационарного потенциала до резкого возрастания тока (до постоянного значения тока 2 А), затем в обратном направлении до значения потенциала –1,4 В, при котором происходит восстановление оксидной пленки. Затем образцы снова поляризовали в положительном направлении до потенциала питтингообразования ( Е п.о ). Из полученных потенциодинамических кривых определяли основные электрохимические характеристики сплавов: потенциал коррозии ( Е кор ) и ток коррозии ( i кор ), потенциалы питтингооб-разования и репассивации ( Е реп ).
Величину Е реп определяли графически как потенциал, при котором наблюдается первый перегиб на обратном ходе анодной кривой, или как потенциал, при котором происходит пересечение прямого и обратного хода анодной поляризационной кривой (рис. 1). Скорость коррозии определялась по формуле
K = iкор · k, где k – электрохимический эквивалент, численное значение которого для цинка составляет 1,22 г/А·ч. Воспроизводимость измерения электрохимических потенциалов равнялась ±5…±10 мВ, а плотность тока коррозии составляла (0,001–0,005)·10–2 А/м2. Подробная методика потенциостатического исследования сплавов приведена в работах [13–22].
Химический состав и результаты исследования анодного поведения сплавов цинка с медью приведены в табл. 1, 2 и на рис. 1–4. Приведенные в табл. 1 результаты исследования потенциала свободной коррозии сплавов
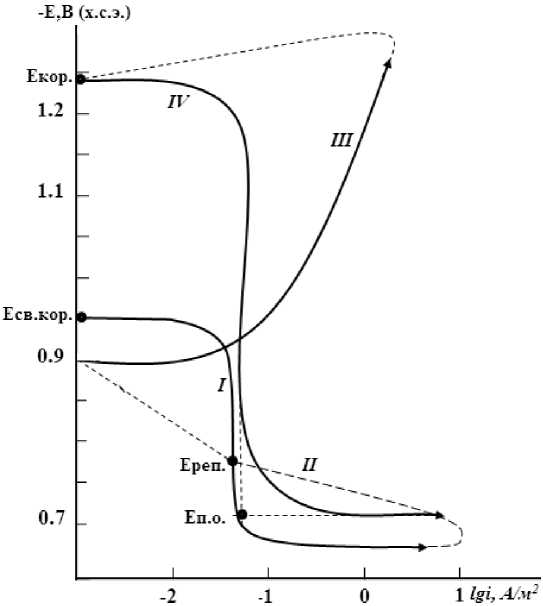
Рис. 1. Полная поляризационная (2 мВ/с) кривая сплава цинка с 4 мас. % алюминия в среде электролита 3%-ного NaCl. Е – потенциал, В; i – плотность тока, А∙м–2
цинка с медью во времени в среде электролита NaCl различной концентрации свидетельствуют, что в первые минуты погружения сплава в раствор происходит резкое смещение потенциала в положительную область. По мере роста концентрации хлорид-иона в электролите потенциал Е св.кор уменьшается, что сопровождается ростом скорости коррозии сплавов в среде электролита NaCl. Если сравнить Е св.кор для сплавов цинка с медью, можно отметить, что более положительное значение потенциала характерно для сплавов в среде электролита 0,03%-ного NaCl.
Независимо от химического состава для всех исследуемых сплавов отмечено смещение потенциала в положительную область, что характеризуется формированием защитной оксидной пленки, динамика которой завершается к 35–45 мин от начала погружения образца в электролит и зависит от химического состава сплавов. Так, после одного часа выдержки электрода в электролите, представляющем собой раствор 0,03%-ного хлорида натрия, потенциал свободной коррозии чистого цинка составляет –0,964 В, а у легированного 2,0 мас. % меди сплава составляет –0,910 В. Потенциал свободной коррозии сплавов цин- ка после одного часа выдержки в растворе 3,0%-ного хлорида натрия составляет –1,003 В, а у легированного 2,0 мас. % меди сплава – 0,943 В (см. табл. 1).
Основные коррозионно-электрохимические характеристики сплавов цинка с медью (см. табл. 2) свидетельствуют, что добавки меди в количествах 0,1–2,0 мас. % сдвигают потенциалы свободной коррозии, питтингообразо-вания и репассивации сплавов в положительную область значений. Легирование медью цинка в указанном пределе уменьшает скорость его коррозии на 15–20 % в среде электролита NaCl (см. рис. 2).
Из табл. 2 следует, что с ростом концентрации меди в цинке и уменьшении концентрации хлорид-иона в электролите потенциалы коррозии, питтингообразования и репассивации смещаются в область более положительных значений. Рост концентрации меди в цинке способствует уменьшению скорости его коррозии во всех исследованных средах. При этом повышение содержания хлорид-иона в электролите способствует росту скорости коррозии независимо от концентрации NaCl и соответственно плотности тока коррозии сплавов (см. рис. 3).
Таблица 1
Временная зависимость потенциала (х.с.э) свободной коррозии (– Е св.кор , В) сплавов цинка с медью в среде электролита NaCl
|
Электролит NaCl, мас. % |
Время выдержки, мин |
Содержание меди в цинке, мас. % |
||||
|
– |
0,1 |
0,5 |
1,0 |
2,0 |
||
|
0,03 |
0 |
1,075 |
1,039 |
1,030 |
1,018 |
1,010 |
|
0,5 |
1,007 |
0,994 |
0,990 |
0,973 |
0,966 |
|
|
2 |
0,996 |
0,980 |
0,974 |
0,959 |
0,952 |
|
|
4 |
0,985 |
0,968 |
0,960 |
0,946 |
0,937 |
|
|
5 |
0,980 |
0,962 |
0,954 |
0,940 |
0,931 |
|
|
10 |
0,976 |
0,957 |
0,948 |
0,935 |
0,925 |
|
|
30 |
0,970 |
0,950 |
0,939 |
0,929 |
0,917 |
|
|
50 |
0,966 |
0,945 |
0,934 |
0,924 |
0,912 |
|
|
60 |
0,964 |
0,944 |
0,932 |
0,922 |
0,910 |
|
|
0,3 |
0 |
1,110 |
1,058 |
1,049 |
1,035 |
1,026 |
|
0,5 |
1,048 |
1,019 |
1,005 |
0,992 |
0,986 |
|
|
2 |
1,025 |
1,003 |
0,991 |
0,978 |
0,972 |
|
|
4 |
1,010 |
0,991 |
0,979 |
0,966 |
0,960 |
|
|
5 |
1,004 |
0,985 |
0,973 |
0,961 |
0,954 |
|
|
10 |
0,998 |
0,979 |
0,967 |
0,956 |
0,949 |
|
|
30 |
0,989 |
0,970 |
0,957 |
0,948 |
0,940 |
|
|
50 |
0,982 |
0,963 |
0,950 |
0,942 |
0,932 |
|
|
60 |
0,980 |
0,960 |
0,948 |
0,940 |
0,930 |
|
|
3,0 |
0 |
1,126 |
1,070 |
1,059 |
1,048 |
1,038 |
|
0,5 |
1,060 |
1,035 |
1,022 |
1,009 |
0,999 |
|
|
2 |
1,045 |
1,023 |
1,010 |
0,997 |
0,985 |
|
|
4 |
1,033 |
1,012 |
0,998 |
0,985 |
0,973 |
|
|
5 |
1,027 |
1,007 |
0,992 |
0,980 |
0,967 |
|
|
10 |
1,021 |
1,002 |
0,987 |
0,974 |
0,961 |
|
|
30 |
1,010 |
0,994 |
0,977 |
0,964 |
0,951 |
|
|
50 |
1,005 |
0,988 |
0,969 |
0,958 |
0,945 |
|
|
60 |
1,003 |
0,986 |
0,967 |
0,958 |
0,943 |
|
Таблица 2
Коррозионно-электрохимические характеристики (х.с.э.) сплавов цинка с медью в среде электролита NaCl
|
Электролит NaCl, мас. % |
Содержание меди в цинке, мас. % |
Электрохимические потенциалы, В (х.с.э.) |
Скорость коррозии |
||||
|
-Е св.кор |
-Е кор |
– Е п.о |
– Е рп |
i кор ·102 |
K ·103 |
||
|
А/м2 |
г/м2·ч |
||||||
|
0,03 |
– |
0,964 |
1,223 |
0,700 |
0,770 |
0,074 |
88,8 |
|
0,1 |
0,944 |
1,200 |
0,685 |
0,756 |
0,070 |
84,0 |
|
|
0,5 |
0,932 |
1,190 |
0,676 |
0,747 |
0,067 |
80,4 |
|
|
1,0 |
0,922 |
1,180 |
0,667 |
0,730 |
0,065 |
78,0 |
|
|
2,0 |
0,910 |
1,170 |
0,656 |
0,722 |
0,063 |
75,6 |
|
|
0,3 |
– |
0,980 |
1,240 |
0,735 |
0,790 |
0,085 |
102,0 |
|
0,1 |
0,960 |
1,220 |
0,720 |
0,772 |
0,081 |
97,2 |
|
|
0,5 |
0,948 |
1,210 |
0,711 |
0,766 |
0,079 |
94,8 |
|
|
1,0 |
0,940 |
1,201 |
0,700 |
0,758 |
0,077 |
92,4 |
|
|
2,0 |
0,930 |
1,192 |
0,690 |
0,750 |
0,075 |
90,0 |
|
|
3,0 |
– |
1,003 |
1,300 |
0,750 |
0,800 |
0,092 |
110,4 |
|
0,1 |
0,986 |
1,260 |
0,735 |
0,786 |
0,087 |
104,4 |
|
|
0,5 |
0,967 |
1,251 |
0,726 |
0,777 |
0,084 |
100,8 |
|
|
1,0 |
0,958 |
1,240 |
0,715 |
0,768 |
0,081 |
97,2 |
|
|
2,0 |
0,943 |
1,230 |
0,705 |
0,760 |
0,079 |
94,8 |
|
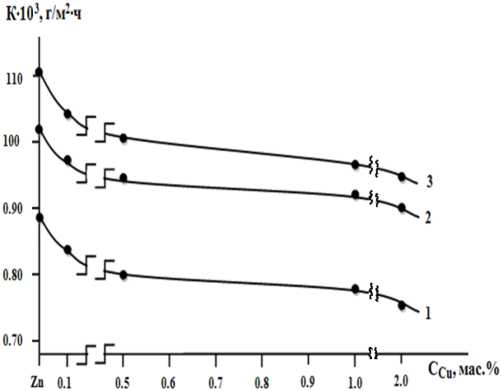
Рис. 2. Зависимость скорости коррозии цинка от концентрации меди в среде электролита: 0,03 % (1); 0,3 % (2) и 3,0%-ного (3) NaCl

Рис. 3. Зависимость плотности тока коррозии сплавов цинка (1), содержащего меди, мас. %: 0,5 (2); 1,0 (3); 2,0 (4), от концентрации NaCl
а)
б)
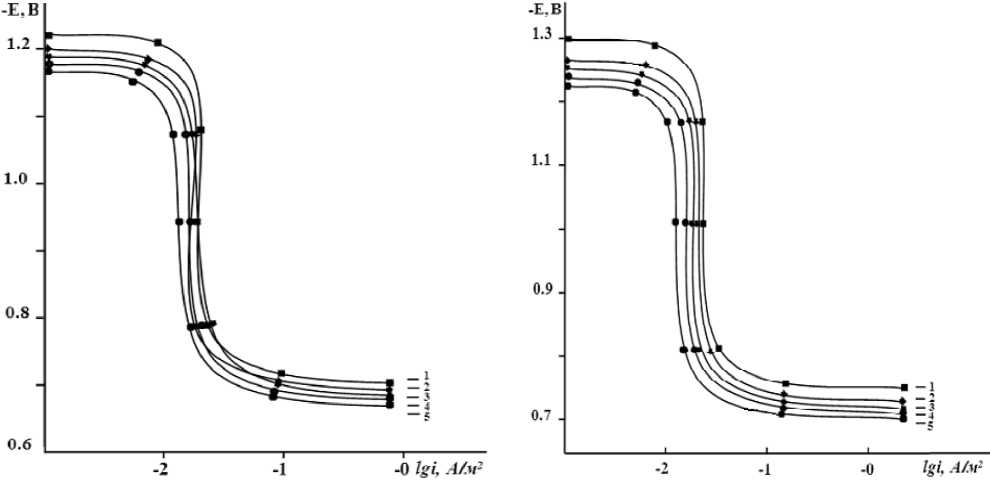
Рис. 4. Анодные поляризационные (2 мВ/с) кривые сплавов цинка (1), содержащего меди, мас. %: 0,1 (2); 0,5 (3); 1,0 (4); 2,0 (5), в среде электролита 0,03 % (а) и 3%-ного (б) NaCl
На рис. 4 представлены анодные ветви по-тенциодинамических поляризационных кривых сплавов цинка с медью в координатах E – lg i в среде электролита NaCl. Кривые 2–5, относящиеся к легированным 0,1–2,0 мас. % меди цинковым сплавам, характеризуются положительным значением потенциалов коррозии и питтингообразования по сравнению с кривой 1 для чистого цинка. Это указывает на относительно низкую скорость анодной коррозии легированных медью сплавов цинка.
Выводы
-
1. Потенциостатическим методом при скорости развёртки потенциала 2 мВ/с иссле-
- довано анодное поведение сплавов цинка с медью в среде электролита NaCl. Показано, что добавка 2,0 % меди снижает скорость коррозии цинка на 10–15 %. От концентрации электролита NaCl скорость коррозии сплавов увеличивается на 10–12 %.
-
2. Установлено, что легирование цинка медью смещает в область положительных значений потенциалов коррозии, питтингооб-разования и репассивации сплавов в среде электролита NaCl.
-
3. Улучшение коррозионной стойкости цинка на 10–15 % в результате его легирования медью до 2,0 мас. % позволяет снизить
толщину защитного покрытия на оцинкованной стали также на 10 % при одинаковых условиях эксплуатации оцинкованных изделий. При объеме использования 10 000 т цинка в год 10%-ная экономия составляет 1000 т. При стоимости 1 т цинка 4000 долл. США 10%-ная экономия цинка составляет 4 млн долл. США.
Список литературы Влияние добавок меди на коррозионно-электрохимическое поведение высокочистого цинка в среде электролита NaCl
- Kilinggeker, G. Electrochemical behaviour of zinc in chloride and acetate solutions / G. Kiling-geker, H. Galip // Protection of Metals and Physical Chemistry of Surfaces. - 2009. - Vol. 45, -P. 232-240. DOI: 10.1134/S2070205109020191
- Muller, C. Some Peculiarities in the Codeposition of Zinc-Nickel Alloys / C. Muller, M. Sarret, M. Ben-balla //Electrochim. Acta. - 2001. - No. 46 (18). - P. 2811-2817. DOI: 10.1016/s0013-4686(01)00493-5
- Rajappa, S.K. Chemical treatment of zinc surface and its corrosion inhibition studies / S.K. Rajappa, T.V. Venkatesha, B.M. Praveen // Bulletin of Materials Science. - 2008. - Vol. 31, no. 1. -P. 37-41. DOI: 10.1007/s12034-008-0007-3
- Dutra, C.A.M. Electrochemical Behavior and Corrosion Study of Electrodeposits of Zn and Zn-Fe-Co on Steel / C.A.M. Dutra, E.N. Codaro, R.Z. Nakazato //Materials Sciences and Applications. - 2012. - Vol. 3, no. 6. - P. 348-354. DOI: 10.4236/msa.2012.36050
- Electrochemical evaluation of zinc and magnesium alloy coatings deposited on electrogalvanized steel by PVD / H.L. Myeong, W.K. Yeon, M.L. Kyung et al. // Trans. Nonferrous Met. Soc. China. - 2013. - No. 23. - P. 876-880. DOI: 10.1016/s1003-6326(13)62542-x
- Алиев, Дж.Н. Цинк-алюминиевые защитные покрытия нового поколения. Физико-химические свойства цинк-алюминиевых сплавов с щелочноземельными металлами / Дж.Н. Алиев, З.Р. Обидов, И.Н. Ганиев. - Германия: Издат. дом LAP LAMBERT Acad. Publ., 2013. - 129 с.
- Обидов, З.Р. Физикохимия цинк-алюминиевых сплавов с редкоземельными металлами / З.Р. Обидов, И.Н. Ганиев. - Душанбе: Андалеб Р, 2015. - 334 с.
- Кечин, В.А. Цинковые сплавы /В.А. Кечин, Е.Я. Люблинский. -М.: Металлургия, 1986. - 247 с.
- Amini R.N., Obidov Z.R., Ganiev I.N., Mohamad R.B. Potentiodynamical research of Zn-Al-Mg alloy system in the neutral ambience of NaCl electrolyte and influence of Mg on the structure. // Journal of Surface Engineered Materials and Advanced Technology. - 2012. - Vol. 2, no. 2. - P. 110-114. DOI: 10.4236/jsemat.2012.22017
- Anodic Behavior of Zn-Al-Be Alloys in NaCl Solution and the Influence of Be on Structure / R.N. Amini, Z.R. Obidov, I.N. Ganiev, R.B. Mohamad // Journal of Surface Engineered Materials and Advanced Technology. - 2012. - Vol. 2, no. 2. - P. 127-131. DOI: 10.4236/jsemat.2012.22020
- Amini R.N., Nizomov Z., Razazi M., Ganiev I.N., Obidov Z.R. Potentiodynamical research of Zn-Al-Mg alloy system in the neutral ambience of NaCl electrolyte and influence of Mg on the structure // Oriental Journal оf Chemistry. - 2012. - Vol. 28, no. 2. - P. 841-846. DOI: 10.4236/jsemat.2012.22017
- Galfan I and Galfan II doped with calcium, corrosion resistant alloys / R.N. Amini, M.B. Irani, I.N. Ganiev, Z.R. Obidov // Oriental Journal оf Chemistry. - 2014. - Vol. 30, no. 3. - P. 969-973. DOI: 10.13005/ojc/300307
- Алиев, Дж.Н. Влияние добавок железа и никеля на твердость сплавов Zn5Al и Zn55Al / Дж.Н. Алиев, И.Н. Ганиев, З.Ф. Нарзуллоев // Политехнический вестник. Серия: Инженерные исследования. - 2018. - № 1 (41). - С. 85-91. DOI: 10.1134/s0044461819110082
- Анодное поведение сплава Al+2.18 % Fe, легированного стронцием, в среде электролита NaCl / Дж.Х. Джайлоев, И.Н. Ганиев, И.Т. Амонов, У.Ш. Якубов // Вестник Сибирского государственного индустриального университета. - 2019. - № 1 (27). - С. 42-46.
- Анодное поведение сплава АЖ5К10, модифицированного стронцием, в среде электролита NaCl / И.Н. Ганиев, У.Ш. Якубов, М.М. Сангов, А.Х. Хакимов // Вестник Сибирского государственного индустриального университета. - 2017. - № 4 (22). - С. 57-62.
- Якубов, У.Ш. Электрохимическая коррозия сплава АЖ5К10, модифицированного барием, в среде электролита NaCl / У.Ш. Якубов, И.Н. Ганиев, М.М. Сангов // Известия Санкт-Петербургского государственного технологического института (технического университета). -2018. - № 43 (69). - С. 21-25.
- Стационарные потенциалы и анодное поведение сплава АЖ 4.5, легированного висмутом / Ф.Р. Одинаев, И.Н. Ганиев, А.Г. Сафаров, У.Ш. Якубов // Известия Санкт-Петербургского государственного технологического института (технического университета). - 2017. - № 38. -С. 8-12.
- О коррозионном потенциале сплава АЖ5К10, модифицированного щелочноземельными металлами, в среде электролита НаС1 / У.Ш. Якубов, И.Н. Ганиев, М.М. Сангов, Н.И. Ганиева // Вестник Магнитогорского государственного технического университета им. Г.И. Носова. -2018. - Т. 16, № 3. - С. 109-119. DOI: 10.18503/1995-2732-2018-16-3-109-119
- Влияние добавок кальция на коррозионно-электрохимическое поведение сплава АЖ5К10 в водных растворах НаС1 / У.Ш. Якубов, И.Н. Ганиев, М.М. Сангов, Р.Н. Амини // Вестник ЮУрГУ. Серия «Металлургия». - 2018. - Т. 18, № 3. - С. 5-15. DOI: 10.14529/теГ180301
- Анодное поведение свинцового сплава ССу3 с кадмием в среде электролита НаС1 / И.Н. Ганиев, М.С. Аминбекова, Б.Б. Эшов и др. //Вестник Казанского технологического университета. - 2019. - Т. 22, № 1. - С. 42-46.
- Бердиев, А.Э. Влияние иттрия на анодные характеристики сплава АК1М2 /А.Э. Бердиев, И.Н. Ганиев, Х.Х. Ниёзов // Известия вузов. Материалы электронной техники. - 2014. - Т. 17, № 5. - С. 224-227.
- Электрохимические потенциалы цинкового сплава ЦАМг4,5-2 с лантаном в среде электролита НаС1 /И.Ш. Идиев, М.Т. Норова, И.Н. Ганиев, С.Дж. Алихонова //Вестник Казанского технологического университета. - 2019. - Т. 22, № 4. - С. 64-67.


