Влияние доксорубицина на механизмы клеточной смерти синхронизированных культур раковых клеток
Автор: Живодерников Иван Владимирович, Свеколкин Виктор Павлович, Саенко Юрий Владимирович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Фундаментальная биология и медицина
Статья в выпуске: 2, 2013 года.
Бесплатный доступ
В работе рассмотрено влияние противоопухолевого препарата доксорубицина на выживаемость раковых клеток линии НСТ-116 на различных стадиях клеточного цикла.
Клеточный цикл, некроз, апоптоз, доксорубицин, нст-116
Короткий адрес: https://sciup.org/14112899
IDR: 14112899 | УДК: 57.085.23,
Текст научной статьи Влияние доксорубицина на механизмы клеточной смерти синхронизированных культур раковых клеток
Введение. Доксорубицин – противоопухолевый антибиотик антрациклинового ряда, выделенный из культуры Streptomyces peuceticus var. caesius. Оказывает антимито-тическое и антипролиферативное действие.*
В основе противоопухолевого механизма действия доксорубицина лежит подавление синтеза ДНК и РНК путем интеркаляции в двойную спираль ДНК между парами азотистых оснований. Помимо этого, противоопухолевое действие, возможно, обусловлено изменением клеточных функций в результате связывания с липидами клеточных мембран и взаимодействием с топоизомеразой II [1].
Доксорубицин воздействует, таким образом, не только на опухолевые, но и на нормальные клетки тканей, поэтому обладает выраженными побочными действиями, в частности на органы сердечно-сосудистой, пищеварительной и нервной (особенно в комбинации с цисплазином) систем. При внутриартериальном введении в высоких дозах требуется экстракорпоральное выведение препарата [2].
На определенных стадиях клеточного цикла происходит репликация ДНК, репарация генетического материала, меняется активность топоизомеразы II, и согласно механизму действия доксорубицина его эффективность будет зависеть от интенсивности этих процессов [6].
Знание о том, в какой стадии клеточного цикла клетки наиболее восприимчивы к действию этого препарата, позволит снизить дозировку, а следовательно, и побочные воздействия.
Цель исследования . Сравнительное изучение чувствительности раковых клеток к доксорубицину на различных стадиях клеточного цикла.
Материалы и методы. В экспериментах использовали клеточную линию НСТ-116. Клетки культивировали при 37 оС, во влажной атмосфере, содержащей 5 % СО 2 . Для культивирования использовали среду DMEM/F12 с 10 % фетальной коровьей сывороткой и 0,04 % гентамицином.
Синхронизацию клеточного цикла проводили с использованием двойного тимидинового блока.
Распределение клеток по фазам клеточного цикла определяли следующим образом. Клетки фиксировались 70 % холодным (-20 оС)
этанолом через каждый час после снятия двойного тимидинового блока в течение 12 ч. После фиксации клетки отмывались буфером PBS, инкубировались с РНКазой (L) в том же буфере при 37 оС в течение 30 мин, и ДНК окрашивалось при помощи пропидия иодида. Клетки фотографировались с использованием флуоресцентного микроскопа Nikon-TiS. Количество клеток с признаками апоптоза и некроза оценивали через 18–24 ч после добавления доксорубицина с использованием флуоресцентного микроскопа и набора реагентов для определения апоптоза V-FITC Apoptosis Kit (Biolegend). Окрашивание клеток в желтый цвет являлось признаком раннего апоптоза, в красный – некроза.
Содержание ДНК в клетках определялось по интенсивности флуоресценции и анализировалось с использованием программы ImageJ.
Клетки делились на три группы по интенсивности флуоресценции. Диапазон разброса флуоресценции пропидиум иодида в клетках делился на три части следующим образом. За основу принималось минимальное значение флуоресценции (МЗФ). Значение флуоресценции меньше чем 2 х МЗФ принималось в качестве количества ДНК, соответствующего фазе G1. Количество ДНК, соответствующее S-фазе клеточного цикла, соответствовало значениям МФЗ в пределах 2 х МЗФ-3 х МЗФ. Количество ДНК, соответствующее более 3 х МЗФ, принималось в качестве ДНК, соответствующего G2/М-фазе клеточного цикла. В результате были установлены промежутки времени между фазами клеточного цикла: между S-фазой и G2/M-фазой – 4 ч, между G2/M-фазой и G1-фазой – 2 ч (рис. 1).
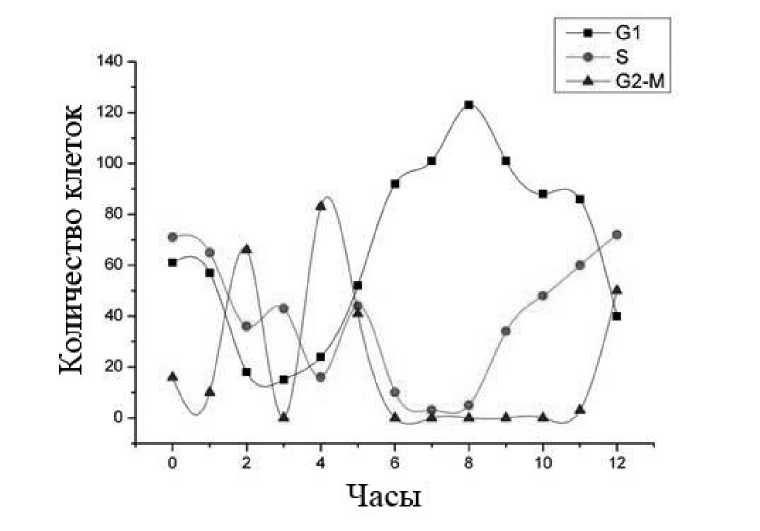
Рис. 1. Распределение клеток по фазам клеточного цикла во времени
Доксорубицин добавляли сразу после удаления тимидина из ростовой среды, через 240 мин и 360 мин, что соответствовало нахождению клеток в S-, G2/M- и G1-фазах. Инкубацию клеток с доксорубицином проводили в течение 1 или 24 ч.
Все эксперименты и определения параметров были выполнены как минимум с трехкратным повторением. Результаты выражались как М±SD. Результаты обработаны статистически с использованием критерия t Стьюдента для парных переменных. Различия между группами считали достоверными при р<0,05.
Результаты и обсуждение. На рис. 1 представлен результат синхронизации клеточного деления – количество клеток в каждой из фаз клеточного цикла через равные промежутки времени после снятия двойного тимидинового блока.
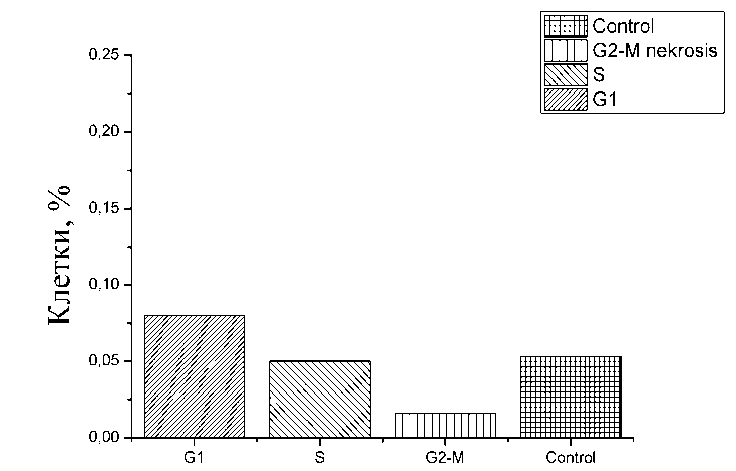
После инкубации с доксорубицином в течение 1 ч мы не наблюдали отличий от
В ходе инкубации клеток с доксируби-цином в течение 24 ч максимальное число контрольной группы (рис. 2).
апоптических и некротических клеток наблю- далось в фазе S клеточного цикла (рис. 3).
Фаза клеточного цикла
Рис. 2. Доля некротических клеток на каждой стадии клеточного цикла после 1 ч инкубации с доксорубицином
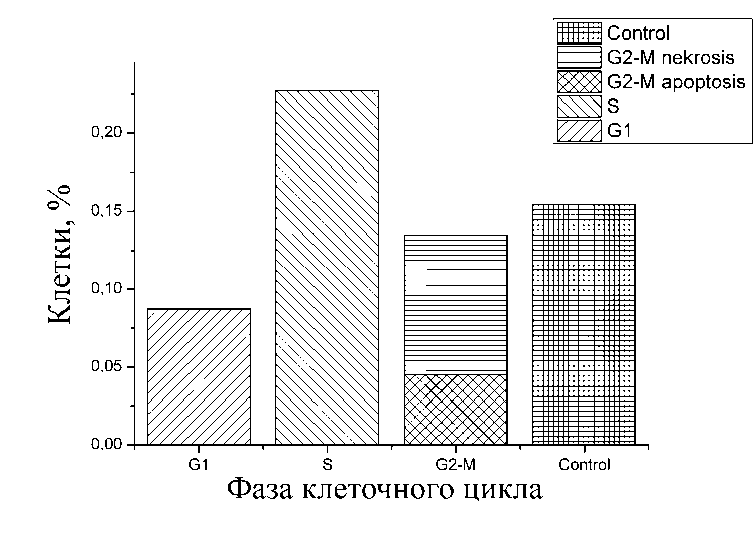
Рис. 3. Доля некротических клеток на каждой стадии клеточного цикла после 24 ч инкубации с доксорубицином
Мы предполагаем, что доксорубицин может индуцировать репарационные механизмы в раковых клетках. Низкое количество апоптических и некротических клеток при одночасовой инкубации связано с коротким промежутком времени воздействия препарата. Известно, что при повреждении генетического аппарата опухолевых клеток цитоста- тическими препаратами включается ряд репаративных систем в зависимости от характера повреждения (например, гомологичная рекомбинация или негомологичное слияние концов одиночных или двойных разрывов ДНК с участием таких ферментов, как ДНК-зависимая протеинкиназа, киназы ATM и ATR, которые взаимодействуют с большим количеством субстратов, опосредующих репаративные процессы ДНК). При этом экспрессия генов, участвующих в репарации, происходит таким образом, чтобы не индуцировать продвижение клеток по клеточному циклу, что обеспечивает защиту от апоптоза. Изменения регуляции репаративных процессов в целом позволяют опухолевой клетке относительно быстро восстанавливать разрывы и другие повреждения ДНК. Высокая выживаемость опухолевых клеток при одночасовой инкубации может быть обусловлена активацией системы транспортных белков, таких как транспортеры ABCB1 (P-гликопротеин, MDR1), ABCG2 (MXR/BCRP1), ABCC1 (MRP1), выводящих из клетки вещества экзогенного происхождения [4, 5]. Эти белки обладают широкой субстратной специфичностью. Цитохром Р450, являясь основным каталитическим элементом монооксигеназной ферментной системы, обеспечивает включение атома кислорода в структуру липофильного соединения, которое может быть более химически активным и токсичным, но легче выводится из организма [5]. Важно подчеркнуть, что, как и в случае мультитранспортеров, цитохром Р450 неспецифически взаимодействует с большим количеством экзогенных субстратов и тем самым способствует их выведению из клетки [3]. Инкубации в течение одного часа может быть недостаточно и для полноценной диффузии доксорубицина через плазмалемму.
Выводы:
I.V. Zivodernikov, V.P. Svekolkin, Y.V. Saenko
Ulyanovsk State University
Список литературы Влияние доксорубицина на механизмы клеточной смерти синхронизированных культур раковых клеток
- Переводчикова Н. И. Руководство по химиотерапии опухолевых заболеваний/Н. И. Переводчикова. -М.: Практическая медицина, 2011. -512 с.
- Самуилов В. Д. Программированная клеточная гибель/В. Д. Самуилов, А. В. Алескин, Е. М. Лагунова//Биохимия. -2000. -Т. 65, № 8. -С. 1-12.
- Свирновский А. И. Хронический лим-фоцитарный лейкоз: парадигмы и парадоксы/А. И. Свирновский//Мед. новости. -2008. -№ 13. -С. 7-19.
- Dai C. L. Sensitization of ABCG2-over-expressing cells to conventional chemotherapeutic agent by sunitinib was associated with inhibiting the function of ABCG2/C. L. Dai, Y. J. Liang, Y. S. Wang//Cancer Lett. -2009. -Vol. 279, № 1. -P. 74-83.
- Human Multidrug Resistance ABCB and ABCG Transporters: Participation in a Chemoimmu-nity Defense System/B. Sarcadi [et al.]//Physiol. Rev. -2006. -Vol. 86. -P. 1179-1236.
- The Biological Basis of Cancer/R. G. McKin-nell [et al.]. -Cambridge University Press, 1998. -378 p.


