Влияние доставки оксида азота на энергетическое обеспечение почечной ткани при проведении искусственного кровообращения: экспериментальное исследование
Автор: Тё М.А., Каменщиков Н.О., Подоксенов Ю.К., Мухомедзянов А.В., Маслов Л.Н., Козлов Б.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 т.39, 2024 года.
Бесплатный доступ
Актуальность. Острое почечное повреждение (ОПП) – распространенное осложнение кардиохирургических операций с искусственным кровообращением (ИК). Ишемически-реперфузионное повреждение (ИРП), системное воспаление, окислительный стресс и другие факторы, возникающие при проведении ИК, приводят к нарушению энергетического обеспечения и к гибели клеток почечной ткани. Доставка оксида азота (NO) является перспективным методом нефропротекции при кардиохирургических операциях в условиях ИК. Цель исследования: изучить параметры энергетического обеспечения почечной ткани при проведении ИК на фоне доставки NO в эксперименте. Материал и методы. Проспективное контролируемое экспериментальное исследование выполнено на 12 баранах. Животные включались в 2 группы в соотношении 1 : 1. В исследуемой группе выполнялась доставка NO в дозе 80 ppm сразу после интубации трахеи и в течение 90 мин ИК (основная группа, n = 6). В контрольной группе искусственная вентиляция легких (ИВЛ) и ИК выполнялись по стандартным протоколам (контрольная группа, n = 6). Через 1 ч после отлучения от ИК проводился забор биоптатов ткани почек. Оценивалось состояние энергетического обеспечения (по тканевой концентрации аденозинтрифосфата (АТФ) и лактата). Результаты. Доставка NO не сопровождалась аберрацией тканевой перфузии во время проведения ИК. Уровень свободного гемоглобина в обеих группах был статистически значимо выше через 1 ч после ИК по сравнению с этапами интубации – p < 0,000… и началом ИК – р < 0,000… Величина АТФ значимо различалась между группами и составила в контрольной группе 3,7 ± 0,62 nmol/g; в основной группе - 6,8 ± 1,11 nmol/g, р = 0,00011. Концентрация лактата статистически значимо не различалась между группами и составила в контрольной группе 12,9 ± 3,71 nmol/g; в основной группе – 10,2 ± 2,14 nmol/g, р = 0,1502. Выводы. Доставка NO приводит к улучшению энергетического обеспечения почечной ткани при проведении ИК в эксперименте.
Оксид азота, острое почечное повреждение, митохондрии, энергетическое обеспечение, искусственное кровообращение
Короткий адрес: https://sciup.org/149144777
IDR: 149144777 | DOI: 10.29001/2073-8552-2022-592
Текст научной статьи Влияние доставки оксида азота на энергетическое обеспечение почечной ткани при проведении искусственного кровообращения: экспериментальное исследование
Острое почечное повреждение (ОПП) – распространенное и серьезное осложнение кардиохирургических операций с искусственным кровообращением (ИК). ОПП в раннем послеоперационном периоде развивается у 30% пациентов, 5% из них нуждаются в заместительной почечной терапии [1]. ОПП приводит к росту частоты инфекционных осложнений, повторных госпитализаций, увеличению продолжительности госпитализации, времени пребывания в отделении реанимации и интенсивной терапии и увеличению летальности [2]. Отдаленные исходы ОПП демонстрируют увеличение рисков развития острой болезни почек, частоты развития хронической болезни почек и смертности [3].
ИК является самостоятельным фактором риска ОПП и ассоциировано с ишемически-реперфузионным повреждением (ИРП), системным воспалением и окислительным стрессом [4, 5]. Формируется дисбаланс между доставкой и потребностью в питательных субстратах и кислороде, нарушается тканевое дыхание на субклеточном уровне.
Митохондрии являются основным источником энергии в большинстве клеток организма. В процессе окислительного фосфорилирования они синтезируют молекулы аденозинтрифосфата (АТФ), принимают участие в поддержании ионного гомеостаза в клетке, осуществляют генерацию активных форм кислорода, а также могут быть триггерами апоптоза [6]. При ИРП нарушается работа электронной транспортной цепи митохондрий, в результате чего наблюдается падение содержания АТФ, увеличение концентрации лактата и протонов в ткани почек, что приводит к повреждению мембран митохондрий, разрушению митохондриальных крист и нарушению их функционального состояния [7]. В результате повреждаются и гибнут клетки с высокими потребностями в АТФ, в том числе клетки почечной ткани [8].
На данный момент не существует фармакологических препаратов и немедикаментозных стратегий с высокой степенью доказательности, способных оптимизировать энергетическое обеспечение и уменьшить степень клеточного повреждения почечной паренхимы в условиях ИК.
Интраоперационная доставка оксида азота (NO) является перспективным методом нефропротекции при кардиохирургических операциях в условиях ИК. Показано, что NO играет важную роль в механизмах прекондиционирования и адаптации клеток к ИРП за счет своих сигнальных свойств, реализуемых в митохондриях [9].
В рандомизированных клинических исследованиях было показано, что доставка экзогенного NO снижала количество эпизодов ОПП у кардиохирургических больных [10, 11]. Однако субклеточные механизмы реализации нефропротективных свойств NO остаются до конца не изученными, необходимо исследовать механизмы реализации защитных эффектов NO в кардиохирургии на клеточном и системном уровнях.
Цель исследования: изучить параметры энергетического обеспечения почечной ткани при проведении ИК на фоне доставки NO в эксперименте.
Материал и методы
В одноцентровое проспективное рандомизированное контролируемое экспериментальное исследование включили 12 баранов Алтайской породы массой 30–34 кг. Животные содержались в условиях конвенционального вивария и перед включением в эксперимент были осмотрены ветеринарным врачом. Распределение по группам производили методом конвертов в соотношении 1 : 1. В контрольную группу вошли 6 баранов, которым проводили стандартный протокол искусственной вентиляции легких (ИВЛ) и ИК. В основную группу вошли 6 баранов, которым доставляли NO в дозировке 80 ppm через модифицированный контур аппарата ИВЛ и в контур аппарата ИК.
Данная работа была выполнена в соответствии с международными стандартами гуманного обращения с животными и опиралась на Директиву 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях.
Методика обеспечения операции
Эксперимент начинали с премедикации и индукции анестезии. После достижения целевого уровня анестезии выполняли бритье и обработку операционного поля. На спонтанном дыхании производили интубацию трахеи и подключали экспериментальное животное к аппарату ИВЛ. Хирургическим путем выделяли и катетеризировали общую сонную артерию для измерения инвазивного артериального давления (АД), контроля кислотно-основного состояния крови и внутренней яремной вены для проведения инфузионной терапии, забора крови на биохимические исследования. На протяжении всего эксперимента выполняли расширенный мониторинг жизненно важных функций: анализ электрокардиограммы, капнометрию, пульсоксиметрию, инвазивное измерение АД, чреспищеводную термометрию. Операционный доступ к магистральным сосудам выполняли путем правосторонней торакотомии в 4–5-м межреберье.
Подключение аппарата ИК осуществляли по бикавальной схеме «аорта – верхняя полая вена – нижняя полая вена». ИК проводили в условиях нормотермии в непульсирующем режиме с перфузионным индексом 2 л/мин/м2. Площадь поверхности тела барана считали равной 1,1 м2. Среднее АД во время ИК поддерживали на уровне 65 мм рт. ст. Продолжительность ИК составила 90 мин, после чего экспериментальные животные были отлучены от ИК. После 1 ч собственного кровообращения животных выводили из эксперимента.
Методика доставки оксида азота
Синтез и подачу NO, мониторинг концентрации NO/NO2 в основной группе на всех этапах проводили с помощью образца установки плазмохимического синтеза NO «Тианокс». В основной группе сразу после интубации трахеи и до перевода животного на экстракорпоральное кровообращение осуществляли подачу NO в модифицированный контур ИВЛ в дозе 80 ppm. Для этого на линию вдоха встраивали 2 гидрофобных вируснобактериальных фильтра с разъемом Люэра: через проксимальный производили подачу NO, через дистальный –– анализ NO/NO 2 (рис. 1).
ICU ventilator
Аппарат ИВЛ
Exhale
Линия выдоха
Experimental animal Экспериментальное животное
"У" adaoter
"У' образный адартер
Гидрофобный фильтр Hydrophobic fitter
Линия вдоха Inhale
Линия подачи NO Feed line NO
Gas mixture analysis line Линия анализа газовой смеси
NO and NO, monitoring unit Блок мониторинга NO и NO>
Block cleaning from NO. Блок очистки от NO,
Converter
Нейтрализатор
Generator NO
Генератор NO
АИТ-NO-Ol (Тианокс) Tianox
Рис. 1. Схема доставки оксида азота в модифицированный контур аппарата искусственной вентиляции легких
-
Fig. 1. Scheme of NO delivery to the modified circuit of the artificial ventilation of the lungs
Note: NO - nitric oxide.
Сразу после начала ИК и до перехода на собственное кровообращение в основной группе осуществляли доставку NO в модифицированный контур экстракорпоральной циркуляции в дозе 80 ppm. Для этого в линию подачи газовоздушной смеси встраивали 2 переходника ¼ с разъемом Люэра: через проксимальный производили подачу NO, через дистальный – анализ NO/NO 2 (рис. 2).
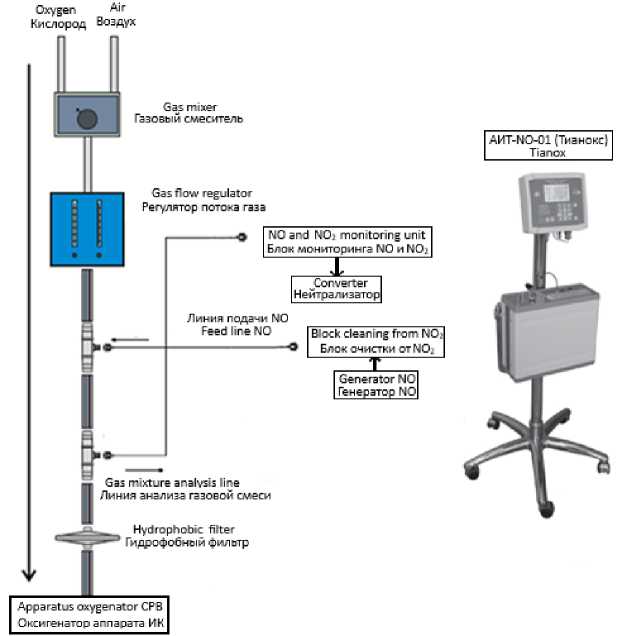
Рис. 2. Схема доставки оксида азота в модифицированный контур аппарата искусственного кровообращения
-
Fig. 2. Scheme of NO delivery to the modified circuit of the cardiopulmonary bypass
Note: NO - nitric oxide.
После отлучения от ИК в основной группе подачу NO осуществляли через модифицированный контур ИВЛ в течение 1 ч.
Животные, вошедшие в контрольную группу, в предперфузионном, перфузионном и постперфузионном периодах получали в контуры ИВЛ и оксигенатор аппарата ИК стандартную кислородо-воздушную смесь, не содержащую NO.
Методика определения адекватности проведения искусственного кровообращения
Забор крови для биохимических исследований проводили из центральной вены на этапах: сразу после интубации трахеи, на начало ИК, через 1 ч после отлучения от ИК. Оценивали сатурацию центральной венозной крови (SvO2), веноартериальный градиент (delta pCO2), уровень лактата, свободного гемоглобина (fHb), а также контролировали кислотно-основное состояние крови с помощью прибора Stat Profile Critical Care Xpress (Nova Biomedical, США).
Метод забора биоматериала для оценки энергетического обеспечения почечной паренхимы
Забор биоматериала проводили на фоне спонтанного кровообращения, через1 ч после отлучения от ИК. Так мы смоделировали состояние митохондрий в условиях продленного ИК. Часть почки, взятой для исследования, замораживали в жидком азоте. Полученные образцы гомогенизировали в жидком азоте, добавляя 2 мл 3% трихлоруксусной кислоты (ТХУ), охлажденной до 2 ºС. Гомогенат центрифугировали 10 мин при 3000 g и температуре 2 ºС на центрифуге SL 16R (Thermo Scientific, США). Надосадочную жидкость отбирали, нейтрализовали 1M Trizma base (Sigma-Aldrich, США) и доводили объем образца деионизованной водой до 2 мл.
Методика определения АТФ
Определение АТФ проводили с использованием биолюминесцентного набора «ATP Bioluminescent Assay Kit» (Sigma-Aldrich, США) на хемилюминометре Lucy-2 (Anthos Labtec Instruments, Австрия).
Методика определения лактата
Определение лактата проводили иммуноферментным методом с использованием набора «L-Lactate Assay Kit» (Sigma-Aldrich, США) на многофункциональном микропланшетном ридере Infinite 200 (Tecan, Австрия).
Статистический анализ полученных данных проводили с использованием пакета программ STATISTICA 10. Проверку согласия с нормальным законом проводили с помощью критерия Шапиро – Уилка. При описании количественных показателей использовали среднее значение (M) и стандартное отклонение (SD). Для выявления статистически значимых различий количественных показателей в независимых группах использовали критерий Стьюдента для независимых групп, для попарных сравнений средних значений показателей в динамике в каждой из исследуемых групп применяли парный критерий Стьюдента. Все статистические критерии применялись при пороговом уровне значимости р = 0,05.
Результаты
Среднее время терапии NO в основной группе составило 189 мин ( mean ± SD = 189,7 ± 8,06). Уровни delta pCO 2 , SvO 2 % и лактата оставались в пределах референсных значений на всех этапах исследования. Данные по уровням delta pCO 2 , SvO 2 %, лактата и fHb на этапах исследования представлены в таблице 1.
Таблица 1. Delta pCO2, SvO2 %, лактат и fHb в основной и контрольной группах на этапах экспериментального исследования. Межгрупповое сравнение
Table 1. Delta pCO2, SvO2 %, lactate и fHb in the main and control groups at the stages of the experimental study. Intergroup comparison
|
Этапs исследования Research phases |
Контрольная группа Control group ( mean ± SD ) |
Основная группа Main group ( mean ± SD ) |
|
delta pCO 2 на этапах экспериментального исследования delta pCO 2 at the stages of the experimental study |
||
|
Интубация трахеи, delta pCO 2 , мм рт. ст. Tracheal intubation, delta pCO 2 , mmHg |
2,8 ± 1,47 |
3,0 ± 1,54 |
|
Начало ИК, delta pCO 2 , мм рт. ст. Start CPB, delta pCO 2 , mmHg |
2,7 ± 1,366 |
3,7 ± 2,16 |
|
1 ч после отлучения от ИК, delta pCO 2 , мм рт. ст 1 hour after end of CPB, delta pCO 2 , mmHg |
3,5 ± 1,64 |
4,0 ± 1,78 |
|
SvO 2 , % на этапах экспериментального исследования SvO 2 , % at the stages of the experimental study |
||
|
Интубация трахеи, SvO 2 , % Tracheal intubation, SvO 2 , % |
70 ± 3,28 |
75,5 ± 3,33 |
|
Начало ИК, SvO 2 , % Start CPB, SvO 2 , % |
71,7 ± 2,42 |
74,7 ± 2,65 |
|
1 ч после отлучения от ИК, SvO 2 , % 1 hour after end of CPB, SvO 2 , % |
71 ± 2,52 |
78,7 ± 6,43 |
|
Лактат на этапах экспериментального исследования Lactat at the stages of the experimental study |
||
|
Интубация трахеи, лактат, ммоль/л Tracheal intubation, lactat, mmol/l |
1,7 ± 0,76 |
1,4 ± 0,52 |
|
Начало ИК, лактат, ммоль/л Start CPB, lactat, mmol/l |
1,7 ± 0,64 |
1,4 ± 0,41 |
|
1 ч после отлучения от ИК, лактат, ммоль/л 1 hour after end of CPB, lactat, mmol/l |
3,6 ± 0,71 |
3,5 ± 0,61 |
|
fHb на этапах экспериментального исследования fHb at the stages of the experimental study |
||
|
Интубация трахеи, fHb, г/л Tracheal intubation, fHb, g/l |
6,5 ± 2,07 |
6,1 ± 2,79 |
|
Начало ИК, fHb, г/л Start CPB, fHb, g/l |
8,0 ± 3,69 |
7,7 ± 2,73 |
|
1 ч после отлучения от ИК, fHb, г/л 1 hour after end of CPB, fHb, g/l |
47,5 ± 6,44 |
49,5 ± 4,18 |
Примечание: delta pCO 2 – веноартериальный градиент, SvO 2 , % – сатурация центральной венозной крови, fHb – уровень свободного гемоглобина.
Note: delta pCO2 – arterio-venous PCO2 difference, SvO2, % –– venous oxygen saturation, fHb – free haemoglobin.
Между этапами интубации, начала ИК и 1 ч после отлучения от ИК уровень delta pCO 2 статистически значимо не различается между контрольной и основной группами ( р = 0,89; р = 0,56; р = 0,94 соответственно). Между этапами интубации, начала ИК и 1 ч после отлучения от ИК уровень SvO2 % статистически значимо не различается между контрольной и основной группами ( р = 0,14; р = 0,13; р = 0,11 соответственно). Статистически значимых различий по уровню лактата между основной и контрольной группами на этапах интубации, начала ИК и 1 ч после ИК нет ( р = 0,86; р = 0,74; р = 0,99 соответственно). На этапах интубации и начала ИК уровень лактата сыворотки статистически значимо не различается в обеих группах ( р = 0,68; р = 0,6. На этапе 1 ч после отлучения от ИК уровень лактата сыворотки статистически значимо больше по сравнению с этапами интубации и начала ИК в контрольной ( р < 0,000…; р < 0,000…) и основной группах ( р = 0,003; р = 0,001).
На этапе 1 ч после отлучения от ИК уровень fHb в обеих группах статистически значимо увеличился по сравнению с этапами интубации и начала ИК ( p < 0,000…; р < 0,000… соответственно).
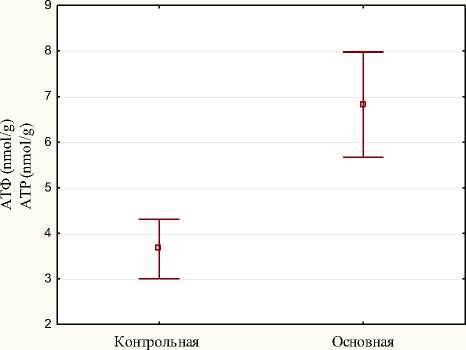
Межгрупповые различия в концентрации АТФ (nmol/g) в биоптатах почек через 1 ч после отлучения от ИК в основной и контрольной группах представлены на рисунке 3.
группа группа
Control group Main group
Группа □ Mean
Group I 0,95 Conf. Interval
Рис. 3. Диаграмма средних значений и их 95% доверительных интервалов для показателя концентрация аденозинтрифосфата (nmol/g) в биоптатах почек через 1 ч после отлучения от искусственного кровообращения в основной и контрольной группах
-
Fig. 3. Diagram of mean values and their 95% confidence intervals for the indicator ATP concentration (nmol/g) in kidney biopsy specimens 1 hour after weaning from CPB in the main and control groups
Note: ATP - adenosine triphosphate, CPB - cardiopulmonary bypass.
Концентрация АТФ в биоптатах почек через 1 ч после отлучения от ИК составила в контрольной группе 3,7 ± 0,62 nmol/g; в основной группе - 6,8 ± 1,11 nmol/g. Статистически значимые различия выявлены между основной и контрольной группами. В основной группе отмечено статистически значимо большая концентрация АТФ в биоптатах почек через 1 ч после отлучения от ИК ( р = 0,00011).
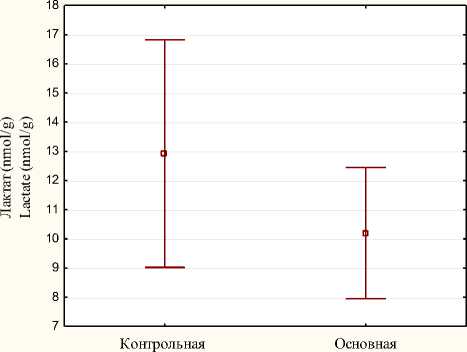
Межгрупповые различия в концентрации лактата (nmol/g) в биоптатах почек через 1 ч после отлучения от ИК в основной и контрольной группах представлены на рисунке 4.
группа группа
Control group Main group
Группа Group
Рис. 4. Диаграмма средних значений и их 95% доверительных интервалов для
□ Mean
I 0,95 Сonf. Interval показателя концентрация лактата (nmol/g) в биоптатах почек через 1 ч после отлучения от искусственного кровообращения в основной и контрольной группах
-
Fig. 4. Diagram of mean values and their 95% confidence intervals for the indicator lactate concentration (nmol/g) in kidney biopsy specimens 1 hour after weaning from CPB in the main and control groups
Note: CPB - cardiopulmonary bypass.
Концентрация лактата в биоптатах почек через 1 ч после отлучения от ИК составила в контрольной группе 12,9 ± 3,71 nmol/g; в основной группе - 10,2 ± 2,14 nmol/g, статистически значимой разницы нет ( р = 0,1502).
Обсуждение
Мы провели проспективное рандомизированное контролируемое исследование для оценки адекватности механической перфузии и энергетического обеспечения почечной паренхимы на фоне доставки NO при проведении ИК в эксперименте.
Мониторинг адекватности проведения ИК имеет определяющее значение для снижения частоты и выраженности послеоперационных осложнений.
Европейское общество сердечно-сосудистых хирургов и Европейское общество кардиоторакальных анестезиологов рекомендуют мониторинг delta pCO2, SvO 2 % и концентрации лактата во время проведения ИК [12]. Высокий delta pCO2, высокая пиковая концентрация лактата и низкая SvO2 ассоциированы с большей тяжестью состояния, оцениваемой в баллах SOFA [13]. Изменения данных показателей коррелируют с микроциркуляторным дистрессом, по данным сублингвальной микроскопии, даже при нормальном сердечном выбросе [14]. В настоящее время указанная стратегия является общепризнанной, отражающей глобальный кислородный бюджет организма во время операций с ИК и позволяет прогнозировать развитие органной дисфункции у кардиохирургических пациентов [12].
Согласно представленным результатам, delta pCO2, SvO2 и концентрация лактата оставались в пределах референсных значений на всех этапах исследования. Данные факты указывают на адекватный режим кровообращения в органах спланхнического бассейна и почек на этапах экспериментального исследования, в том числе на фоне кондиционирования NO.
Полученные нами данные показывают, что уровень свободного гемоглобина значительно вырос через 1 ч после отлучения от ИК в обеих группах. Проведение ИК при кардиохирургических вмешательствах приводит к развитию внутрисосудистого гемолиза в результате травмы эритроцитов при аспирации крови из операционной раны, окклюзии магистралей, развития турбулентного кровотока в местах сужения магистралей, в оксигенаторе и т. д. [15]. Выделившийся свободный гемоглобин превосходит железосвязывающую способность сыворотки крови и связывает синтезируемый эндотелием NO, уменьшая его биодоступность и вызывая расстройства микроциркуляции, что усугубляет ИРП [16]. Таким образом, улучшение почечной функции при доставке NO в ряде рандомизированных клинических исследований [10, 11] может быть связано с возмещением дефицита эндогенного NO, улучшением функции сосудистого русла в органах спланхнического бассейна и почках.
При воздействии повреждающих стимулов, в частности во время ИРП почечной паренхимы, формируется дисбаланс между доставкой и потребностью органов в кислороде и питательных веществах, нарушается работа электронной транспортной цепи митохондрий, в результате чего наблюдается падение содержания АТФ в различных органах, в том числе в ткани почек. В результате недостатка кислорода и субстратов происходит перестройка энергетического метаболизма на анаэробный гликолиз. Активация гликолиза приводит к накоплению лактата и протонов. Метаболические изменения, наблюдающиеся в органах и тканях при ИРП, приводят к повреждению митохондрий и нарушению их функционального состояния [7]. Митохондрии играют решающую роль в восстановлении функции органа после ИРП [17].
Наша работа показала, что донация экзогенного NO улучшила показатели энергетического обеспечения, что выражалось в увеличении концентрации АТФ в почечной паренхиме. Мы не получили статистически значимой разницы по концентрации тканевого лактата в почечной паренхиме, поскольку во время проведения исследования поддерживался адекватный режим кровообращения в органах спланхнического бассейна и почек, соблюдалась адекватная доставка кислорода к тканям, и переход на анаэробный гликолиз не произошел. Тем не менее, концентрация лактата в основной группе имела тенденцию к снижению.
Данные факты указывают на улучшение энергетического обеспечения почечной паренхимы на фоне интраоперационной доставки NO, полученного методом плазмохимического синтеза при проведении ИК в эксперименте.
Выводы
Доставка NO приводит к улучшению энергетического обеспечения почечной ткани при проведении ИК в эксперименте.
Список литературы Влияние доставки оксида азота на энергетическое обеспечение почечной ткани при проведении искусственного кровообращения: экспериментальное исследование
- Kiers H.D., van den Boogaard M., Schoenmakers M.C., van der Hoeven J.G., van Swieten H.A., Heemskerk S. et al. Comparison and clinical suitability of eight prediction models for cardiac surgery-related acute kidney injury. Nephrol. Dial. Transplant. 2012;28(2):345-351. https://doi.org/10.1093/ndt/gfs518.
- Bedford M., Stevens P.E., Wheeler T.W.K., Farmer C.K.T. What is the real impact of acute kidney injury? BMC Nephrol. 2014;15(1):95. https://doi.org/10.1186/1471-2369-15-95.
- Rydén L., Sartipy U., Evans M., Holzmann M.J. Acute kidney injury after coronary artery bypass grafting and long-term risk of end-stage renal disease. Circulation. 2014;130(23):2005-2011. https://doi.org/10.1161/circulationaha.114.010622.
- Bellomo R., Auriemma S., Fabbri A., D’Onofrio A., Kats N., McCullough P.A. et al. The pathophysiology of cardiac surgery-associated acute kidney injury (CSA-Aki). Int. J. Artif. Organs. 2008;31(2):166-178. https://doi.org/10.1177/039139880803100210.
- Kumar A.B., Suneja M. Cardiopulmonary bypass-associated acute kidney injury. Anesthesiology. 2011;114(4):964-970. https://doi.org/10.1097/aln.0b013e318210f86a.
- Nelson D.L. Lehninger principles of biochemistry; 8th edit. New York: W.H. Freeman. 2021:1248.
- Pabla N., Bajwa A. Role of mitochondrial therapy for ischemic-reperfusion injury and acute kidney injury. Nephron. 2021;146(3):253-258. https://doi.org/10.1159/000520698.
- Ma H., Guo X., Cui S., Wu Y., Zhang Y., Shen X. et al. Dephosphorylation of AMP-activated protein kinase exacerbates ischemia/reperfusion-induced acute kidney injury via mitochondrial dysfunction. Kidney Int. 2022;101(2):315-330. https://doi.org/10.1016/j.kint.2021.10.028.
- Shvedova M., Anfinogenova Y., Popov S.V., Atochin D.N. Connexins and nitric oxide inside and outside mitochondria: Significance for cardiac protection and adaptation. Front. Physiol. 2018;9:479. https://doi.org/10.3389/fphys.2018.00479.
- Kamenshchikov N.O., Anfinogenova Y.J., Kozlov B.N., Svirko Y.S., Pekarskiy S.E., Evtushenko V.V. et al. Nitric oxide delivery during cardiopulmonary bypass reduces acute kidney injury: A randomized trial. J. Thorac. Cardiovasc. Surg. 2022;163(4):1393-1403.e9. https://doi.org/10.1016/j.jtcvs.2020.03.182.
- Lei C., Berra L., Rezoagli E., Yu B., Dong H., Yu S. et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. Am. J. Respir. Crit. Care Med. 2018;198(10):1279-1287. https://doi.org/10.1164/rccm.201710-2150OC.
- Wahba A., Milojevic M., Boer C., De Somer F.M.J.J., Gudbjartsson T., van den Goor J. et al. 2019 EACTS/EACTA/EBCP guidelines on cardiopulmonary bypass in adult cardiac surgery. Eur. J. Cardiothorac. Surg. 2020;57(2):210-251. https://doi.org/10.1093/ejcts/ezz267.
- Møller M.H., Cecconi M. Venous-to-arterial carbon dioxide difference: An experimental model or a bedside clinical tool? Intensive Care Med. 2015;42(2):287-289. https://doi.org/10.1007/s00134-015-4181-7.
- Ospina-Tascón G.A., Umaña M., Bermúdez W.F., Bautista-Rincón D.F., Valencia J.D., Madriñán H.J. et al. Can venous-to-arterial carbon dioxide differences reflect microcirculatory alterations in patients with septic shock? Intensive Care Med. 2015;42(2):211-221. https://doi.org/10.1007/s00134-015-4133-2.
- Vercaemst L. Hemolysis in cardiac surgery patients undergoing cardiopulmonary bypass: A review in search of a treatment algorithm. J. Extra Corpor. Technol. 2008;40(4):257-267.
- Kato G.J., Steinberg M.H., Gladwin M.T. Intravascular hemolysis and the pathophysiology of sickle cell disease. J. Clin. Invest. 2017;127(3):750- 760. https://doi.org/10.1172/jci89741.
- Teodoro J.S., Da Silva R.T., Machado I.F., Panisello-Roselló A., Roselló-Catafau J., Rolo A.P. et al. Shaping of hepatic ischemia/reperfusion events: The crucial role of mitochondria. Cells. 2022;11(4):688. https://doi.org/10.3390/cells11040688.


