Влияние доступности почвенной влаги на свойства растворенного органического вещества и содержание микробного углерода в ризосфере Poa pratensis L.
Автор: Данилин И.В., Холодов В.А., Зиганшина А.Р., Данченко Н.Н., Буряк А.Д., Фарходов Ю.Р., Ярославцева Н.В.
Журнал: Бюллетень Почвенного института им. В.В. Докучаева @byulleten-esoil
Рубрика: Спецвыпуск по результатам молодежной конференции
Статья в выпуске: S1, 2024 года.
Бесплатный доступ
Цель работы заключалась в оценке изменения содержания микробного углерода и свойств растворенного органического вещества (РОВ) ризосферы мятлика полевого (Poa pratensis L.) в ответ на воздействие иссушения и переувлажнения почв. В работе использовали метод вегетационного эксперимента с вариантами без растений и со сплошным посевом в вегетационных сосудах на черноземе типичном (Haplic Chernozem). Свойства растворенного органического вещества оценивали на основании изучения водоэкстрагируемого органического вещества (ВЭОВ), для которого определяли оптические свойства методами UV-Vis спектрометрии и спектрофлуориметрии. Для оценки микробной биомассы почву фумигировали и проводили экстракцию водой. Показано, что содержание микробного углерода во внекорневом черноземе не зависит от влажности почвы, в то время как в ризосфере - увеличивается при иссушении и уменьшается при оптимальной и избыточной влажности. На свойства ВЭОВ внекорневого чернозема в большей степени влияет влажность почвы, а ризосферы - жизнедеятельность растения. Содержание микробного углерода в ризосфере больше, по сравнению с внекорневой почвой, только при иссушении, что связано с адаптацией растения к абиотическому стрессу. При оптимальном и избыточном увлажнении содержание микробного углерода во внекорневой почве больше, по сравнению с ризосферой, что может быть связано с более активной реакцией микроорганизмов чернозема на краткосрочное увлажнение, по сравнению с ризосферными микроорганизмами, а также регулирующим влиянием растения. Несмотря на меньшую микробную биомассу, по сравнению с внекорневой почвой, микробиом ризосферы мятлика способен на более интенсивную трансформацию органического вещества почвы. Динамичность свойств ризосферы мятлика обеспечивает ее более активное и устойчивое функционирование.
Абиотический стресс, водоэкстрагируемое органическое вещество, uv-vis спектрометрия, спектрофлуориметрия, вегетационный эксперимент
Короткий адрес: https://sciup.org/143183584
IDR: 143183584 | УДК: 631.4 | DOI: 10.19047/0136-1694-2024-SPYC-73-104
Текст статьи Влияние доступности почвенной влаги на свойства растворенного органического вещества и содержание микробного углерода в ризосфере Poa pratensis L.
Исследование выполнено за счет гранта Российского научного фонда № 23-26-00107,
The studies were carried out with the financial support of the Russian Science Foundation, scientific project No. 23-26-00107,
ФИЦ “Почвенный институт им. В.В. Докучаева”, Россия, 119017, Москва, Пыжевский пер, 7, стр. 2, *, e-mail:
7 Bld. 2 Pyzhevskiy per., Moscow 119017, Russian Federation, *, e-mail:
Ризосфера – часть почвенного пространства, на которую непосредственно воздействует корневая система растений (Hiltner, 1904, цит. по Hartmann et al., 2008). Это своеобразный микрокосм, условия обитания в котором отличаются от внекорневой почвы (Kuzyakov, Blagodataskaya, 2015; Андронов и др., 2016). Ризосфера рассматривается как устойчивая система, включающая в себя корни, почвенные микроорганизмы и почву (твердую, жидкую, газо- образную фазы); компоненты этой системы – биотические и абиотические – находятся в активном непрерывном динамическом взаимодействии (Gobran et al., 1998; Dessaux et al., 2009). Существенную роль в этой системе играют симбиотические связи между растением и микроорганизмами. Показано, что симбиоз с микроорганизмами помогает растениям справляться с абиотическими стрессами (Xue, 2017; Kang et al., 2022; Aslam et al., 2022; Chen et al., 2022; Etesami, 2021; Solomon et al., 2024). Однако разнообразие микроорганизмов в ризосфере может быть меньше по сравнению с внекорневой почвой, а типы питания обычно различаются: в ризосфере доминируют копиотрофы, а во внекорневой почве – оли-готрофы; при этом ризосфера обогащена генами, отвечающими за трансформацию органического вещества и азотный цикл (Ling et al., 2022). Общая микробная биомасса в ризосфере обычно выше, чем во внекорневой почве (Kumar, Garkoti, 2022), но она подвержена существенным колебаниям в зависимости от сезона года, доступности питательных веществ и воздействия неблагоприятных абиотических факторов (Lange et al., 2024). Основным механизмом воздействия растений на ризосферу является выделение корневых экссудатов. Экссудаты действуют на микроорганизмы как регуляторы роста и источники энергии, и, кроме того, влияют на физические и химические свойства почвы (Матвеева и др., 2020; Chen et al., 2022; Aslam et al., 2022). Таким образом, отличия между ризосферой и внекорневой почвой выражаются, прежде всего, в качественном и количественном составе микроорганизмов и свойствах растворенного органического вещества (РОВ), состав и свойства которого неразрывно связаны с активностью почвенной биоты (Холодов и др., 2023; Караванова, 2013; Gmach et al., 2020).
Сведения об изменении свойств ризосферы в условиях абиотического стресса, особенно свойств РОВ, весьма ограничены и противоречивы. Меньшее видовое разнообразие ризосферы может приводить к меньшей устойчивости микрокосма, но при этом взаимодействия микроорганизмов и растений весьма динамичны, поэтому потенциал ризосферы к адаптационным изменениям значительно больше по сравнению с внекорневой почвой. Одним из наиболее значимых факторов абиотического стресса в сельском хозяйстве является нарушение водного режима, которому свойственна кратковременность воздействий – от пары дней до нескольких недель.
Целью работы была оценка изменения свойств растворенного органического вещества и содержания микробного углерода в условиях кратковременного водного стресса (недостаток и избыток влаги) в вегетационном эксперименте.
ОБЪЕКТЫ И МЕТОДЫ
Вегетационный эксперимент
Одной из наибольших трудностей при изучении ризосферы является отделение зоны влияния корней от внекорневой почвы. Для преодоления этого затруднения в работе использовали метод вегетационного эксперимента с вариантами без растений и со сплошным посевом в вегетационных сосудах. В эксперименте использовали типичный чернозем (Классификация и диагностика почв СССР, 1977) – Haplic Chernozem (World Reference Base for Soil Resources, 2022), отобранный в 2019 г. на полях многолетних полевых опытов ФГБНУ “Курский федеральный аграрный научный центр” (п. Черемушки, Курский район, Курской области). Образцы отбирали в варианте “шестипольный зерно-паро-пропашной севооборот с внесением минеральных удобрений через ротацию”. Свойства почвы: pH водной суспензии – 6.3 ± 0.1, Cорг – 3.55 ± 0.06%, N общ – 0.29 ± 0.03% (среднее арифметическое ± стандартное отклонение). Образцы почвы хранились до востребования в воздушно-сухом состоянии в герметичной полимерной таре при комнатной температуре (18-25 °C) в сухом темном месте.
Эксперимент проводили в июне 2023 г. в климатической камере при температуре воздуха 18 °С и влажности воздуха 45%. Программа освещения состояла из двух временных сегментов: дневного (10 часов) и ночного (14 часов). Во время ночного периода освещение отсутствовало. При закладке эксперимента на перфорированное дно 48 пластиковых вегетационных контейнеров объемом 200 мл помещали слой кварцевого песка 0.5 см в качестве дренажа и слой агротекстиля (spunbond) толщиной 1 мм, про- ницаемого для воды и воздуха. Оставшийся объем каждого контейнера был заполнен почвой. Почву во всех контейнерах увлажняли до 80% от наименьшей влагоемкости (НВ), после чего отбирали случайным образом 36 контейнеров и помещали на их поверхность семена мятлика лугового (Poa pratensis L.) из расчета 5–10 шт/см2. Контейнеры накрывали увлажненным агротекстилем на 8 дней до прорастания семян. Затем в течение 12 дней после прорастания влажность почвы во всех контейнерах поддерживали на уровне 80% от НВ. По прошествии этого времени в течение 14 дней моделировали условия доступности влаги: 35% (недостаток), 80% (оптимум), 200% от НВ (избыток). Каждый из перечисленных режимов увлажнения реализовывался для 12 контейнеров с растениями и 4 контейнеров с почвой без растений. Полив осуществляли вручную дистиллированной водой.
После завершения эксперимента растения извлекали вместе с корневой системой и закрепленной на ней почвой. Ризосферой считали объем почвы, закрепленный в пределах 3–5 мм от поверхности корней после встряхивания. Отбор почвы из контрольного опыта без растений (далее – внекорневая почва) проводили после механического удаления верхнего слоя почвы (5 мм), содержащего корку почвенных водорослей.
Отобранные образцы лиофильно высушивали под вакуумом, удаляли крупные растительные остатки, растирали в фарфоровой ступке, просеивали через сито 0.25 мм и хранили при -20 °С до использования.
Фумигация и получение водных вытяжек из почвы
Для оценки содержания микробного углерода в образцах использовали метод фумигации (Jenkinson, Powlson, 1976; Alessi et al., 2011; Oren et al., 2018): обработку почвы парами хлороформа, ведущую к лизису микробных клеток, вследствие чего их содержимое становится доступно для экстракции водой (Swenson et al., 2015).
Фумигацию проводили в вакуумном эксикаторе в присутствии очищенного на оксиде алюминия хлороформа в темном месте в течение 24 ч. Более подробное описание методики фумига- ции почвы приводится в работе (Холодов и др., 2022). Разница между содержанием углерода в водной вытяжке из почвы без и после фумигации считается пропорциональной микробной биомассе (Jenkinson, Powlson, 1976; Alessi et al., 2011; Oren et al., 2018) и далее в тексте будет называться “микробным углеродом”, несмотря на, возможно, неполный лизис микробных клеток, а также частичное растворение твердофазного почвенного органического вещества (ПОВ) и десорбцию сорбированного ОВ (Alessi et al., 2011). Тем не менее, вклад этих факторов в ошибку оценки микробной биомассы во всех вариантах данного опыта можно считать одинаковым. В данной работе микробный углерод рассчитывали как разницу между содержанием водоэкстрагируемого углерода (мг/кг почвы) после фумигации и без фумигации без применения пересчетных коэффициентов.
Для оценки свойств РОВ изучали водоэкстрагируемое органическое вещество (ВЭОВ). К навескам почвы (без и после фумигации) массой 2 г в полипропиленовых пробирках приливали 8 мл деионизированной воды ASTM тип 1 (Biopak® Polisher CDUFBI001, Merck) и оставляли на орбитальном шейкере (PSU-20i, Biosan) в течение 1 ч. при 180 оборотах в минуту и температуре 4 °С. По истечении этого времени суспензии центрифугировали при 2 500 × g в течение 10 мин. (Centrifuge 5810, Eppendorf), полученную надосадочную жидкость фильтровали через мембранный фильтр (ацетат целлюлозы) с диаметром пор 0.45 мкм. Водную вытяжку хранили при +4 °С не более 48 ч.
Определение концентрации органического углерода в водных вытяжках почв
Содержание водоэкстрагируемого органического углерода в вытяжках измеряли на анализаторе TOC-L CSN (Shimadzu) в режиме NPOC (нелетучий органический углерод). Прибор калибровали с помощью стандартных растворов гидрофталата калия, разбавленных до различных концентраций в соответствии с предварительной оценкой содержания C в образцах.
UV-Vis спектроскопия водных вытяжек почв
УФ-видимые спектры поглощения регистрировали на спектрофотометре UV-1800 (Shimadzu) в диапазоне длин волн 200– 800 нм с шагом в 1 нм при постоянной ширине щели 1 нм, скорость съемки 1 500 нм/мин, в кварцевой кювете с длиной оптического пути 1 см. Спектры поглощения снимали относительно деионизированной воды тип 1 (сопротивление ≥18 MOм), помещенной во второй оптический канал двухлучевого прибора. Для расчета оптических показателей единицы оптической плотности были переведены в коэффициенты поглощения (Hu et al., 2002).
Спектрофлуориметрия водных вытяжек почв
Трехмерные спектры флуоресценции (в виде матриц зависимости интенсивности излучения от координат: длина волны возбуждения, длина волны эмиссии, EEM) регистрировали на спектрофлуориметре RF-6000 (Shimadzu). Параметры измерений: длины волн возбуждения 220–480 нм, шаг измерений 2 нм, ширина щели 5 нм, длины волн эмиссии 300–550 нм, шаг измерений 5 нм, ширина щели 5 нм, скорость развертки 2 000 нм/мин., чувствительность – низкая. В начале, середине и конце съемки каждый раз измеряли флуоресценцию деионизированной воды ASTM тип 1 (сопротивление ≥18 MOм). Разбавление производили таким образом, чтобы сумма оптических плотностей образца при минимальных длинах волн возбуждения (220 нм) и эмиссии (300 нм) была немного меньше 1.5 (Kothawala et al., 2013).
Обработка EEM была проведена с применением пакета StaRdom (Pucher et al., 2019) в свободной программной среде R (R Development Core Team, 2023). Обработка включала вычитание спектра растворителя (деионизированная вода ASTM тип 1), коррекцию на внутренний фильтр по данным спектров поглощения, перевод в Рамановские единицы, вычитание рамановского и рэлеевского рассеяния, интерполяцию и расчет дескрипторов. На основе спектров поглощения и обработанных EEM были рассчитаны следующие показатели:
-
1. SUVA254, далее в тексте – SUVA (specific ultra-violet absorption) – поглощение при 254 нм, нормированное на
содержание углерода. Используется как метрика, прямо пропорциональная ароматичности ВЭОВ (Helms et al., 2008);
-
2. S R (slope ratio), отношение спадов поглощения на участках
275–295 нм и 350–400 нм; этот параметр обратно пропорционален средневзвешенной молекулярной массе ОВ (Helms et al., 2008);
-
3. HIX (humification index), отношение интенсивности эмиссий флуоресценции на участках 435–480 нм к 300–345 нм при длине волны возбуждения 254 нм; пропорционален степени гумификации РОВ (Ohno, 2002);
-
4. BIX (biological index), отношение интенсивности эмиссий флуоресценции при 380 нм к 430 нм при длине волны возбуждения 310 нм, прямо пропорционален доле новообразованного ОВ в составе РОВ (Huguet et al., 2009);
-
5. FI (fluorescence index), отношение интенсивности эмиссий флуоресценции при 450 нм к 500 нм при длине волны возбуждения 370 нм. Согласно авторской интерпретации (McKnight et al., 2001), показатель FI = 1.9 свидетельствует о преимущественно микробном происхождении ОВ, показатель FI = 1.4 – растительном/почвенном происхождении.
Кроме того, индивидуальные флуоресцирующие компоненты ВЭОВ выявляли методом параллельного факторного анализа (PARAFAC). Создание модели PARAFAC проводили с применением пакета StaRdom для языка программирования R (Pucher et al., 2019). Split-half analysis и Resudial analysis использовали для валидации модели. Спектры возбуждения и эмиссии полученных компонентов сопоставляли с опубликованными в базе данных OpenFluor (Murphy et al., 2014). Для каждого компонента рассчитывали относительный вклад во флуоресценцию, нормируя вклад компонента на сумму вкладов всех компонентов.
Статистическая обработка данных
Статистическую обработку и визуализацию данных проводили с использованием языка R (R Development Core Team, 2023)
и пакетов ggplot2 (Wickham, 2016), staRdom (Pucher et al., 2019). Уровень значимости во всех статистических анализах принимали за 5%. Дисперсионный анализ проводили методом Краскелла– Уоллиса. Множественное сравнение средних проводили методом Данна с поправкой Холма.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Содержание водоэкстрагируемого углерода
Содержание углерода в ВЭОВ и микробного углерода в зависимости от вариантов эксперимента показано на рисунках 1–2.
В настоящее время не существует унифицированной методики выделения почвенного раствора и водорастворимого углерода из почв, а также высушивания и хранения почвенных проб (Chow et al., 2022). Согласно Moody (2020), лиофильное высушивание может как значительно изменять, так и не изменять свойства РОВ. С целью изучения влияния способа высушивания и хранения почвенных проб на свойства ВЭОВ был проведен предварительный методический эксперимент (данные не опубликованы). Результаты эксперимента показали, что способ высушивания и хранения образцов почвы оказывает слабое влияние на свойства ВЭОВ, но минимальное проявление артефактов при анализе свойств водных вытяжек соответствует лиофильному высушиванию с последующим хранением при -20 °С.
Содержание водоэкстрагируемого углерода в ризосфере было значимо больше по сравнению с внекорневой почвой при всех уровнях влажности (рис. 1), что связано с влиянием жизнедеятельности растений: поступлением экссудатов, краевых клеток корня и других ризодепозитов (Соколова, 2015; Xue et al., 2017; Chen et al., 2022; Aslam et al., 2022). Влажность почвы также оказывает значимое влияние на содержание водоэкстрагируемого углерода во всех вариантах опыта (рис. 1). Во внекорневой почве оно монотонно растет при увеличении влажности, а в ризосфере – увеличивается при оптимальной влажности по сравнению с недостаточной и избыточной, что может быть связано с активным выделением экссудатов растением в условиях физиологического оптимума и менее активным – в состоянии стресса.
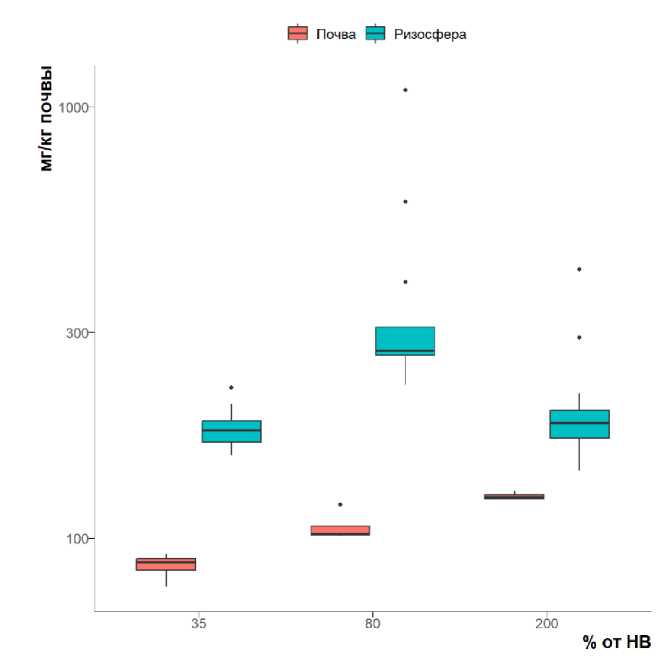
Рис. 1. Содержание водоэкстрагируемого углерода (мг/кг почвы, логарифмическая шкала) в ризосфере мятлика и во внекорневом черноземе при разных уровнях влажности.
Fig. 1. Water-extractable carbon content (mgC/kg of soil, logarithmic scale) in the Poa rhizosphere and bulk chernozem at different moisture levels.
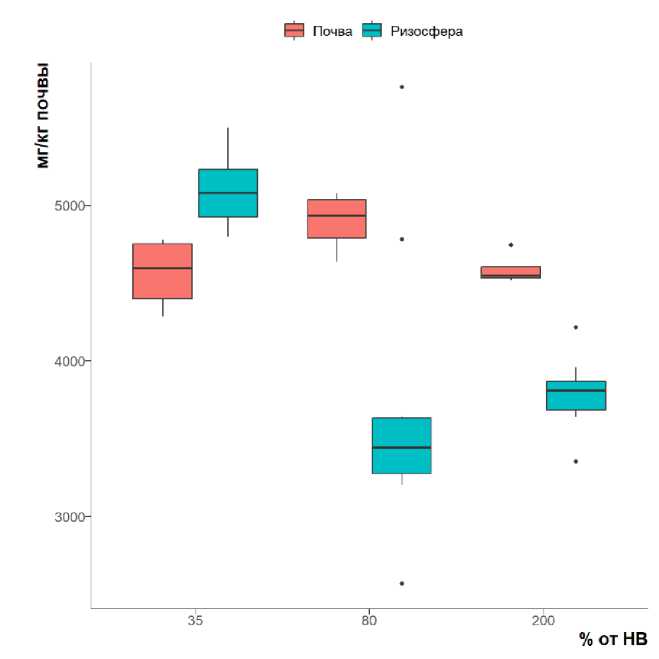
Рис. 2. Содержание микробного углерода (мг/кг почвы) в ризосфере мятлика и внекорневом черноземе при разных уровнях влажности.
Fig. 2. Microbial carbon content (mgC/kg of soil, logarithmic scale) in the Poa rhizosphere and bulk chernozem at different moisture levels.
Содержание микробного углерода
В данной работе экстракцию водоэкстрагируемого углерода без и после фумигации проводили дистиллированной водой, что может приводить к лизису клеток и недооценке содержания микробного углерода, а также менее полной экстракции углерода по сравнению с солевыми растворами. Однако на примере сравни- тельного анализа различных экстрагентов показано, что вода является наиболее эффективным экстрагентом почвенных метаболитов и не приводит к значительному искажению результатов, по сравнению с традиционными солевыми вытяжками (Swenson et al., 2015), в то время как присутствие легкорастворимых солей в почвенных вытяжках может изменять их оптические свойства (Kholodov et al., 2024).
Количество микробного углерода во внекорневой почве значимо не изменяется по градациям влажности (рис. 2), что свидетельствует об устойчивости микробиома типичного чернозема к кратковременным засухам и переувлажнениям. Черноземы формируются в условиях семиаридного климата, и для них в течение года характерны как периоды переувлажнения, так и засухи, что может приводить к формированию микробного сообщества, устойчивого к относительно кратким периодам недостаточного или избыточного увлажнения (Hueso et al., 2011; Etesami, 2021; Canarini et al., 2015).
В ризосфере мятлика содержание микробного углерода значимо изменяется при изменении влажности почвы. Максимальных величин оно достигает при влажности 35% от НВ, что соответствует недостатку влаги, и при этом значимо превышает содержание микробного углерода внекорневой почвы (рис. 2). Недостаток влаги обычно приводит к осмотическому стрессу, разрушающему клетки микроорганизмов, а также уменьшает количество элементов питания, в том числе, растительных экссудатов, служащих субстратом для микробиома ризосферы (Xue et al., 2017; Chen et al., 2022). Так как нет оснований считать, что растворимость ОВ чернозема увеличилась после краткосрочного иссушения, причина увеличения микробной биомассы в ризосфере при недостаточной влажности почвы может быть связана с действием компенсирующих механизмов в ризосфере. Известно, что растения и ризосферные микроорганизмы в условиях стресса способны активно выделять во внешнюю среду экзополисахариды, изменяющие структурные свойства почвы и удерживающие в ней влагу, а также молекулы-осмолиты: пролин, глутамин, трегалозу, сукрозу, 5-деоксиинозитол и др. (Etesami, 2021; Aslam et al., 2022; Kang et al.,
2022; Chen et al., 2022). За счет выделения этих веществ в ризосфере при недостаточном увлажнении могут формироваться более благоприятные условия для размножения микроорганизмов по сравнению с внекорневой почвой (Xue et al., 2017). Это наблюдение согласуется с работами других авторов (Sanaullah et al., 2011; Mganga et al., 2019).
Содержание микробного углерода при оптимальной влажности в ризосфере значимо меньше по сравнению с внекорневой почвой. При этом считается, что микробная биомасса ризосферы больше микробной биомассы внекорневой почвы (Kuzyakov, Blagodatskaya, 2015; Соколова, 2015), а сама ризосфера отличается высокой устойчивостью химических и биологических свойств к негативным факторам внешней среды (Etesami, 2021; Zia et al., 2021; Chen et al., 2022; Hossain et al., 2016). Одно из объяснений может быть связано с проводимыми в ходе эксперимента циклами полива, на которые микроорганизмы внекорневого чернозема реагируют более активным размножением, по сравнению с микроорганизмами ризосферы, вследствие особенностей своей адаптивной стратегии. Другое объяснение связано с тем, что растение способно регулировать не только качественный, но и количественный состав микробиома ризосферы. Также уменьшение микробной биомассы может быть следствием выделения антибиотических веществ с целью предотвращения заражения патогенами, а также развитием конкурентных взаимоотношений между ризосферными микроорганизмами, что приводит к уменьшению их общей биомассы. В условиях, максимально приближенных к оптимальным, такое квази-равновесие может поддерживаться неопределенно долго. Кроме того, содержание микробного углерода при оптимальной влажности в ризосфере было значимо меньше по сравнению с ризосферой при недостаточной влажности. Это говорит в пользу выше высказанного предположения о природе некоторого снижения численности микроорганизмов при оптимизации условий существования ризосферы. Методика пробоподготовки, которая применялась в данном исследовании, могла частично исказить количественную оценку содержания микробного углерода, т. к. исследование проводили на высушенных и растертых образцах, что было необходимо для обеспечения воспроизводимости анализа оптических свойств водных вытяжек. Однако исходные свойства почвы в данном исследовании были одинаковы во всех вариантах опыта, вследствие чего возможными искажениями при сравнительном анализе ризосферы и внекорневой почвы можно пренебречь.
При избыточной влажности почвы содержание микробного углерода в ризосфере значимо больше по сравнению с ризосферой при оптимальной влажности, но меньше по сравнению с внекорневой почвой. Вероятно, биомасса микроорганизмов регулируется растением как ответ на стресс от переувлажнения; также нельзя исключать возможность интенсификации размножения анаэробных микроорганизмов, имеющих конкурентные преимущества в данных условиях. Прояснение этого вопроса требует дальнейших исследований.
Таким образом, биомасса микроорганизмов ризосферы отзывается на краткосрочные изменения статуса влаги в почве, а тот же показатель во внекорневой почве на подобное воздействие не реагирует. Микроорганизмы внекорневой почвы относятся к микрофлоре рассеяния (Заварзин, 2003). Для их экологической стратегии характерно относительно низкое требование к доступности питательных веществ и высокая устойчивость к неблагоприятным воздействиям окружающей среды на фоне низкой способности к межвидовой конкуренции. Микроорганизмы ризосферы, напротив, способны успешно конкурировать за ресурсы, но нуждаются в большом количестве доступных источников энергии и питательных веществ, при этом они сильно зависят от условий окружающей среды, которые в данном случае регулируются растением и его реакцией на факторы стресса. Вследствие этого в рамках эксперимента наблюдался явно выраженный отклик микроорганизмов ризосферы, но не внекорневой почвы.
Оптические свойства водной вытяжки
Для оценки характера изменений, происходящих в РОВ ризосферы при разных режимах влаги, были оценены оптические свойства ВЭОВ (рис. 3).
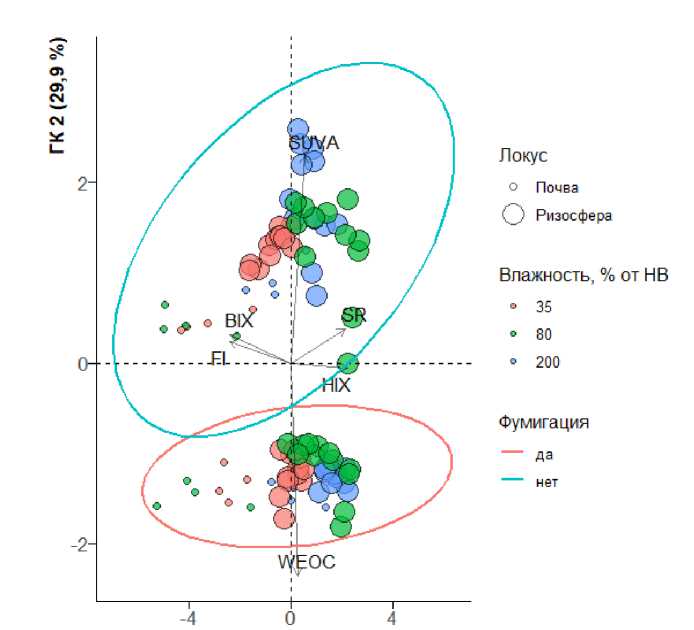
ГК 1 (57,7 %)
Рис. 3. Классификация объектов по оптическим индексам их ВЭОВ и содержанию водоэкстрагируемого углерода (WEOC – водоэкстрагируемый углерод).
Fig. 3. Classification of objects according to the optical indices of their WEOM and the water-extractable carbon content (WEOC – water-extractable organic carbon).
На рисунке 3 приведена классификация объектов по оптическим индексам их ВЭОВ и содержанию водоэкстрагируемого углерода. Первая главная компонента (ГК 1) описывает 58% различий, вторая (ГК 2) – 30%; таким образом, первые две ГК практически полностью описывают дисперсию объектов в рассматриваемом пространстве признаков. По первой ГК ризосфера хорошо дискриминируется от внекорневой почвы: ВЭОВ ризосферы занимает положительную часть ГК 1, а ВЭОВ внекорневой почвы – отрицательную. Кроме того, по ГК 1 разделяются свойства ВЭОВ в зависимости от доступности влаги: видно, что объекты сдвигаются в отрицательную область при снижении заданной влажности почвы в эксперименте. Сдвиг объектов в положительную область по ГК 1 обусловлен увеличением S R (SR на рис. 3) и HIX, а в отрицательную – увеличением BIX и FI.
Это свидетельствует о накоплении в ризосфере относительно низкомолекулярных соединений ароматического строения, которые могут быть как вторичными метаболитами растения (Aslam et al., 2022; Chen et al., 2022), так и наиболее химически устойчивыми продуктами деструкции растворенных гуминовых веществ. Уменьшение индекса BIX в ризосфере относительно внекорневой почвы свидетельствует о быстрой минерализации наиболее легкодоступного растворенного ОВ ризосферными микроорганизмами. В условиях дефицита влаги BIX в ризосфере уменьшается до уровня внекорневой почвы, несмотря на бо ́ льшую биомассу (рис. 1, рис. 3), что согласуется с предположением о связи BIX не с биомассой, а с ферментативной активностью. Во внекорневой почве наблюдается увеличение индексов BIX и FI, что свидетельствует об увеличении доли растворенного ОВ микробного происхождения и о накоплении продуктов микробной трансформации ПОВ. Таким образом, согласно анализу свойств ВЭОВ, во внекорневой почве, несмотря на большую микробную биомассу, процессы трансформации ПОВ протекают медленнее, чем в ризосфере.
Влажность оказывает значимое влияние на все спектральные индексы ВЭОВ во всех вариантах опыта. При увеличении влажности от 35 до 200% от НВ в ризосфере и внекорневой почве уменьшаются индексы BIX, FI и увеличиваются индексы HIX,
SUVA, S R (рис. 3). Индексы BIX, FI также уменьшаются, а индексы HIX, SUVA, S R увеличиваются в ризосфере по сравнению с вмещающей почвой (рис. 3). Вероятно, эти изменения связаны с увеличением интенсивности микробной трансформации ВЭОВ при увеличении содержания доступной влаги и при выделении растением корневых экссудатов. Стоит отметить, что увеличение активности микроорганизмов внекорневой почвы при кратковременном переувлажнении приводит к приближению свойств ВЭОВ чернозема к свойствам ВЭОВ ризосферы, но не за счет увеличения микробной биомассы, а вследствие увеличения ее активности.
По ГК 2 явно дискриминируется ВЭОВ из фумигированных и нефумигированных образцов (рис. 3). ВЭОВ нефумигированных почв занимает положительную область ГК 2, а фумигированных – отрицательную. Основной вклад в сдвиг в отрицательную область вносит увеличение содержания водоэкстрагируемого углерода и уменьшение SUVA вследствие разрушения клеток микроорганизмов и увеличения доли алифатических компонентов в составе ВЭОВ во всех вариантах опыта.
Компонентный состав флуорофоров водных вытяжек почв
Трехмерные спектры флуоресценции были обработаны с применением метода параллельного факторного анализа (parallel factor analysis, PARAFAC) с целью выделения и идентификации флуоресцирующих компонентов ВЭОВ (Murpy et al., 2013; Pucher, et al., 2019). В составе водной вытяжки было обнаружено 4 типа флуорофоров; они были сопоставлены с базой данных OpenFluor (similarity score = 97.5%), что позволило сделать предположение об их природе и свойствах (табл. 1). Компонент C1 был отнесен к предшественникам гуминовых веществ, C2 и C3 – к гуминовым веществам, а C4 – к протеиноподобным веществам.
Увеличение влажности внекорневого чернозема от 35 до 80% НВ не влияет на содержание флуорофоров в водной вытяжке, в то время как увеличение влажности до экстремальных величин (200% от НВ) приводит к накоплению во внекорневой почве компонентов С1–С3 (рис. 4).
Таблица 1. Описание флуоресцирующих компонентов, идентифицированных методом PARAFAC
Table 1. Description of fluorescent components identified by the PARAFAC method
|
Компонент |
Максимум возбуждения, нм |
Максимум эмиссии, нм |
Описание |
Ссылки |
|
С1 |
310 |
420 |
Гуминовые вещества микробного происхождения |
Gao et al., 2016, Murphy et al., 2006, Yamashita et al., 2010 |
|
С2 |
285 |
505 |
Гуминовые вещества |
Eder et al., 2021, Wauhty et al., 2018, Yamashita et al., 2010 |
|
С3 |
265, 365 |
455 |
Гуминовые вещества |
Gao et al., 2016, Walker et al., 2013, Yamashita et al., 2021 |
|
С4 |
275 |
320 |
Протеиноподобные вещества (триптофан в составе продуктов деградации белков) |
Ren et al., 2021, Yamashita et al., 2011, Zhuang et al., 2021 |
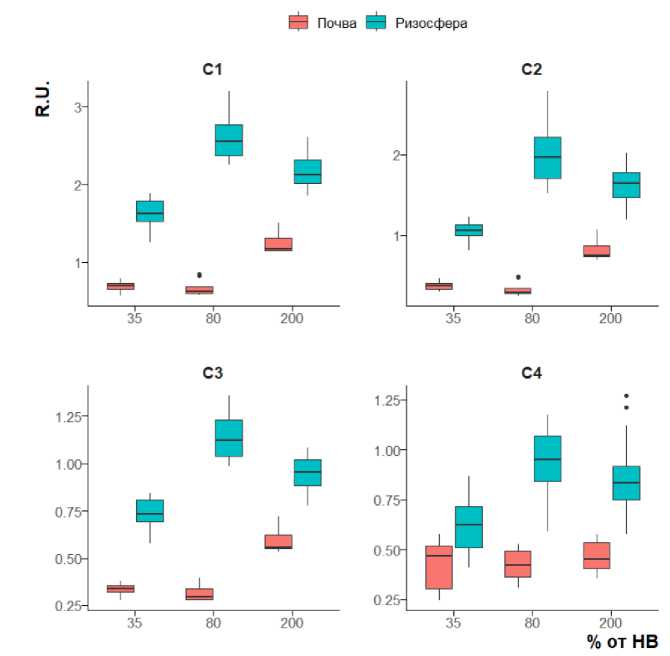
Рис. 4. Содержание флуоресцирующих компонентов (С1–С4) в ВЭОВ ризосферы мятлика и внекорневого чернозема при разных уровнях влажности (R.U. – рамановские единицы).
Fig. 4. Fluorescent components (C1–C4) content in the Poa rhizosphere WEOM and the bulk chernozem WEOM at different moisture levels (R.U. – Raman Units).
Накопление флуорофоров гуминовой природы в составе ВЭОВ, вероятнее всего, связано с их переходом в жидкую фазу из твердой за счет частичной микробиологической деструкции. Од- нако этот эффект не наблюдается при сравнении с образцами почвы с недостаточной и оптимальной влажностью. Возможно, при влажности 200% от НВ происходит гидратация ОВ, что увеличивает его растворимость.
В ризосфере содержание всех флуорофоров (в т. ч. С4, в отличие от внекорневой почвы) увеличивается в ряду: 35% < 200% < 80% от НВ (рис. 4); в этом же ряду уменьшается влияние абиотического стресса на растения, что подтверждает предположение о ведущей роли растения, а не влажности, в регуляции активности ризосферных микроорганизмов.
Несмотря на увеличение микробной биомассы в ризосфере при недостаточной влажности, в условиях иссушения почвы ризосферные микроорганизмы в наименьшей степени способны к деструкции твердофазного ПОВ по сравнению с остальными градациями влажности. При влажности 80% от НВ ризосферные микроорганизмы начинают активнее разлагать твердофазное ПОВ, вероятно, вследствие “затравочного эффекта” от корневых экссудатов, максимальное выделение которых соответствует оптимальной влажности (рис. 1).
ЗАКЛЮЧЕНИЕ
Содержание микробного углерода во внекорневом черноземе не зависело от влажности почвы вследствие устойчивости микробиома чернозема к водному стрессу. В ризосфере мятлика максимальное содержание микробной биомассы наблюдается при недостаточной влажности. Это предположительно связано с действием механизмов защиты от абиотического стресса. При оптимальном поливе величина микробной биомассы минимальна. Это, в свою очередь, может быть связано с регуляцией растением численности микроорганизмов в ризосфере. Этими же причинами объясняется меньшее содержание микробного углерода в ризосфере мятлика, по сравнению с внекорневой почвой, при оптимальной и избыточной влажности и большее – при недостаточной.
Свойства растворенного органического вещества в ризосфере в большей степени определяются жизнедеятельностью растения: в условиях недостаточной для нормального функционирова- ния растения влажности почвы оптические свойства водной вытяжки из ризосферы близки к свойствам водной вытяжки из внекорневой почвы, а при влажности, оптимальной для растения, их различия максимальны. Таким образом, если во внекорневой почве интенсивность микробной трансформации органического вещества напрямую связана с влажностью, то в ризосфере эта связь опосредована через растение. Увеличение влажности внекорневой почвы приводит к интенсификации трансформации ПОВ, но в ризосфере при всех градациях влажности этот процесс протекает более быстро и полно.
Список литературы Влияние доступности почвенной влаги на свойства растворенного органического вещества и содержание микробного углерода в ризосфере Poa pratensis L.
- Андронов Е.Е., Иванова Е.А., Першина Е.В., Орлова О.В., Круглов Ю.В., Белимов А.А., Тихонович И.А. Анализ показателей почвенного микробиома в процессах, связанных с почвообразованием, трансформацией органического вещества и тонкой регуляции вегетационных процессов // Бюллетень Почвенного института имени В.В. Докучаева. 2015. Вып. 80. С. 83-94. https://doi.org/10.19047/0136-1694-201580-83-94.
- Егоров В.В., Иванова Е.Н., Фридланд В.М. Классификация и диагностика почв СССР. М.: Колос, 1977. 223 с.
- Заварзин Г.А. Лекции по природоведческой микробиологии М.: Наука, 2003. 348 с.
- Караванова Е.И. Водорастворимые органические вещества: фракционный состав и возможности их сорбции твердой фазой лесных почв (обзор литературы) // Почвоведение. 2013. № 8. С. 924-936.
- Матвеева Н.В., Милановский Е.Ю., Хайдапова Д.Д., Рогова О.Б. Краевой угол смачивания как интегральный показатель физикохимических свойств черноземов Каменной степи // Бюллетень Почвенного института имени В.В. Докучаева. 2020. Вып. 101. С. 76-123. https://doi.org/10.19047/0136-1694-2020-101-76-123.
- Соколова Т.А. Специфика свойств почв в ризосфере: анализ литературы // Почвоведение. 2015. № 9. С. 1097-1111.
- Холодов В.А., Рогова О.Б., Лебедева М.П., Варламов Е.Б., Волков Д.С., Зиганшина А.Р., Ярославцева Н.В. Органическое вещество и минеральная матрица почв: современные подходы, определения терминов и методы изучения (обзор) // Бюллетень Почвенного института имени В.В. Докучаева. 2023. Вып. 117. С. 52-100. https://doi.org/10.19047/0136-1694-2023-117-52-100.
- Холодов В.А., Фарходов Ю.Р., Ярославцева Н.В., Данченко Н.Н., Ильин Б.С., Лазарев В.И. Водоэкстрагируемый и микробный углерод черноземов разного вида использования // Бюллетень Почвенного института им. В.В. Докучаева. 2022. Вып. 112. С. 122-133. https://doi.org/10.19047/0136-1694-2022-112-122-133.
- Alessi D.S., Walsh D.M., Fein J.B. Uncertainties in determining microbial biomass C using the chloroform fumigation-extraction method // Chem. Geol. 2011. Vol. 280. P. 58-64.
- Aslam M.M., Okal E.J., Idris A.L., Qian Zh., Xu W., 2, Karanja J.K., Wani Sh.H., Yuan W. Rhizosphere microbiomes can regulate plant drought tolerance // Pedosphere. 2022. Vol. 32. No. 1. P. 61-74.
- Canarini A., Dijkstra F.A. Dry-rewetting cycles regulate wheat carbon rhizodeposition, stabilization and nitrogen cycling // Soil Biol Biochem. 2015. Vol. 81. P. 195-203.
- Chen Y., Yao Z., Sun Y., Wang E., Tian Ch., Sun Y., Liu J., Sun Ch., Tian L. Current Studies of the Effects of Drought Stress on Root Exudates and Rhizosphere Microbiomes of Crop Plant Species // International Journal of Molecular Sciences. 2022. Vol. 23. No. 4. 2374.
- Chow A. T-S., Ulus Y., Huang G., Kline M.A., Cheah W-Y. Challenges in quantifying and characterizing dissolved organic carbon: Sampling, isolation, Idstorage, and analysis // Journal of Environmental Quality. 2022. Vol. 51. P. 837-871.
- Dessaux Y., Hinsinger P., Lemanceau P. Rhizosphere: So many achievements and even more challenges // Plant and Soil. 2009. Vol. 321. No. 1-2. P. 1-3.
- Eder A., Weigelhofer G., Pucher M., Tiefenbacher A., Strauss P., Brandl M., Blöschl G. Pathways and composition of dissolved organic carbon in a small agricultural catchment during base flow conditions // Ecohydrology and Hydrobiology. 2021. Vol. 22. No. 1. P. 96-112.
- Etesami H. Potential advantage of rhizosheath microbiome, in contrast to rhizosphere microbiome, to improve drought tolerance in crops // Rhizosphere. 2021. Vol. 20. 100439.
- Gao Z., Guéguen C. Size distribution of absorbing and fluorescing DOM in Beaufort Sea, Canada Basin // Deep Sea Res 1 Oceanogr Res Pap. 2016. Vol. 121. P. 30-37.
- Gmach M.R., Cherubin M.R., Kaiser K., Cerri C.E.P. Processes that influence dissolved organic matter in the soil: A review // Scientia Agricola. 2020. Vol. 77. No. 3. e20180164.
- Gobran G.R., Clegg S., Courchesne F. Rhizospheric Processes Influencing the Biogeochemistry of Forest Ecosystems // Biogeochem. 1998. Vol. 42. P. 107-120.
- Hartmann A., Rothballer M., Schmid M. Lorenz Hiltner, a pioneer in rhizosphere microbial ecology and soil bacteriology research // Plant and Soil. 2008. Vol. 312. No. 1-2. P. 7-14.
- Helms J.R., Stubbins A., Ritchie J.D., Minor E.C. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter // Limnol. Oceanogr. 2008. Vol. 53. No. 3. P. 955-969.
- Hossain M.A., Wani Sh. H., Bhattacharjee S., Burritt D.J., Tran L.-S. P. Drought Stress Tolerance in Plants, Vol. 1. Physiology and Biochemistry. Switzerland: Springer Nature, 2016. 538 p.
- Hu C., Muller-Karger F.E., Zepp R.G. Absorbance, absorption coefficient, and apparent quantum yield: A comment on common ambiguity in the use of these optical concepts // Limnol Oceanogr. 2002. Vol. 47. No. 4. P. 1261- 1267.
- Hueso S., Hernández T., García C. Resistance and resilience of the soil microbial biomass to severe drought in semiarid soils: The importance of organic amendments // Applied Soil Ecology. 2011. Vol. 50. No. 1. P. 27-36.
- Huguet A., Vacher L., Relexans S., Saubusse S., Froidefond J.M., Parlanti E. Properties of fluorescent dissolved organic matter in the Gironde Estuary // Org. Geochem. 2009. Vol. 40. No. 6. P. 706-719.
- IUSS Working Group WRB. World Reference Base for Soil Resources. International soil classification system for naming soils and creating legends for soil maps. 4-th edition. Vienna, Austria: International Union of Soil Sciences (IUSS). 2022.
- Jenkinson D.S., Powlson D.S. The effects of biocidal treatments on metabolism in soil-i. Fumigation with chloroform // Soil. Biol Biochem. 1976. Vol. 8. P. 167-177.
- Kang J., Peng Y., Xu W. Crop Root Responses to Drought Stress: Molecular Mechanisms, Nutrient Regulations, and Interactions with Microorganisms in the Rhizosphere // International Journal of Molecular Sciences. 2022. Vol. 23. No. 16. 9310.
- Kholodov V.A., Danchenko N.N., Ziganshina A.R., Yaroslavtseva N.V., Semiletov I.P. Direct Salinity Efect on Absorbance and Fluorescence of Chernozem Water-Extractable Organic Matter // Aquatic Geochemistry. 2024. Chernozem Water-Extractable Organic Matter // Aquatic Geochemistry. 2024. Vol. 30. P. 31-48.
- Kothawala D.N., Murphy K.R., Stedmon C.A., Weyhenmeyer G.A., Tranvik L.J. Inner filter correction of dissolved organic matter fluorescence // Limnol Oceanogr Methods. 2013. Vol. 11. No. DEC. P. 616-630.
- Kumar S., Garkoti S.C. Rhizosphere influence on soil microbial biomass and enzyme activity in banj oak, chir pine and banj oak regeneration forests in the central Himalaya // Geoderma. 2022. Vol. 409. P. 115626.
- Kuzyakov Y., Blagodatskaya E. Microbial hotspots and hot moments in soil: Concept & review // Soil Biology and Biochemistry. 2015. Vol. 83. P. 184-199.
- Lange M., Azizi-Rad M., Dittmann G., Lange D.F., Orme A.M., Schroeter S.A., Simon C., Gleixner G. Stability and carbon uptake of the soil microbial community is determined by differences between rhizosphere and bulk soil // Soil Biol Biochem. 2024. Vol. 189. 109280.
- Ling N., Wang T., Kuzyakov Y. Rhizosphere bacteriome structure and functions // Nat. Commun. Nature Research, 2022. Vol. 13. No. 1. 836.
- McKnight D., Boyer E., Westerhoff P., Doran P., Kulbe T., Andersen D. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity // Limnol. Oceanogr. 2001. Vol. 46. No. 1. P. 38-48.
- Mganga K., Razavi B., Sanaullah M., Kuzyakov Y. Phenological Stage, Plant Biomass, and Drought Stress Affect Microbial Biomass and Enzyme Activities in the Rhizosphere of Enteropogon macrostachyus // Pedosphere. 2019. Vol. 29. No. 2. P. 259-265.
- Moody C.S. A comparison of methods for the extraction of dissolved organic matter from freshwaters // Water Research. 2020. Vol. 184. 116114.
- Murphy K., Ruiz G., Dunsmuir W., Waite T. Optimized parameters for fluorescence-based verification of ballast water exchange by ships // Environ Sci Technol. 2006. Vol. 40. No. 7. P. 2357-2362.
- Murphy K., Stedmon C., Graeber D., Bro R. Fluorescence spectroscopy and multi-way techniques. PARAFAC // Analytical Methods. 2013. Vol. 5. No. 23. P. 6557-6566.
- Murphy K.R., Stedmon C.A., Wenig P., Bro R. OpenFluor - an online spectral library of auto-fluorescence by organic compounds in the environment // Anal. Methods. 2014. Vol. 6. No. 3. P. 658-661.
- Ohno T. Fluorescence inner-filtering correction for determining the humification index of dissolved organic matter // Environ Sci Technol. 2002. Vol. 36. No. 4. P. 742-746.
- Oren A., Rotbart N., Borisover M., Bar-Tal A. Chloroform fumigation extraction for measuring soil microbial biomass: The validity of using samples approaching water saturation // Geoderma. 2018. Vol. 319. P. 204-207.
- Pucher M., Wünsch U., Weigelhofer G., Murphy K., Hein T., Graeber D. StaRdom: Versatile software for analyzing spectroscopic data of dissolved organic matter in R // Water (Switzerland). 2019. Vol. 11. No. 11. 2366.
- R Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing. Vienna, 2023. URL: https://www.Rproject.org.
- Ren W., Wu X., Ge X., Lin G., Zhou M., Long Z., Yu X., Tian W. Characteristics of dissolved organic matter in lakes with different eutrophic levels in southeastern Hubei Province, China // J. Oceanol Limnol. 2021. Vol. 39. No. 4. P. 1256-1276.
- Sanaullah M., Blagodatskaya, E., Chabbi A., Rumpel C., Kuzyakov Y. Drought effects on microbial biomass and enzyme activities in the rhizosphere of grasses depend on plant community composition // Applied Soil Ecology. 2011. Vol. 48. No. 1. P. 38-44.
- Solomon W., Janda T., Molnár Z. Unveiling the significance of rhizosphere: Implications for plant growth, stress response, and sustainable agriculture // Plant Physiology and Biochemistry. 2024. Vol. 206. P. 108290.
- Swenson T.L., Jenkins S., Bowen P.B., Northen R.T. Untargeted soil metabolomics methods for analysis of extractable organic matter // Soil Biol. Biochem. 2015. Vol. 80. P. 189-198.
- Walker S.A., Amon R.M.W., Stedmon C.A. Variations in high-latitude riverine fluorescent dissolved organic matter: A comparison of large Arctic rivers // J. Geophys. Res. Biogeosci. 2013. Vol. 118. No. 4. P. 1689-1702.
- Wauthy M., Rautio M., Christoffersen K.S., Forsström L., Laurion I., Mariash H.L., Peura S., Vincent W.F. Increasing dominance of terrigenous organic matter in circumpolar freshwaters due to permafrost thaw // Limnol Oceanogr Lett. 2018. Vol. 3. No. 3. P. 186-198.
- Wickham H. ggplot2: Elegant Graphics for Data Analysis. 3rd ed. New York: Springer-Verlag, 2016.
- Xue S., Yang X., Liu G., Gai L., Zhang C., Ritsema C.J., Geissen V. Effects of elevated CO2 and drought on the microbial biomass and enzymatic activities in the rhizospheres of two grass species in Chinese loess soil // Geoderma. 2017. Vol. 286. P. 25-34.
- Yamashita Y., Kloeppel B., Knoepp J., Zausen G., Jaffé R. Effects of Watershed History on Dissolved Organic Matter Characteristics in Headwater Streams // Ecosystems. 2011. Vol. 14. No. 7. P. 1110-1122.
- Yamashita Y., Kojima D., Yoshida N., Shibata H. Optical characterization of dissolved organic matter in tropical rivers of the Guayana Shield, Venezuela // J Geophys Res Biogeosci. 2010. Vol. 115. No. G1.
- Yamashita Y., Maie N., Briceño H., Jaffé R. Relationships between dissolved black carbon and dissolved organic matter in streams // Chemosphere. 2021. Vol. 271. 129824.
- Zhuang W.E., Chen W., Cheng Q., Yang L. Assessing the priming effect of dissolved organic matter from typical sources using fluorescence EEMsPARAFAC // Chemosphere. 2021. Vol. 264. 128600.
- Zia R., Nawaz M.Sh., Siddique M.J., Hakim S., Imran A. Plant survival under drought stress: Implications, adaptive responses, and integrated rhizosphere management strategy for stress mitigation // Microbiol. Res. 2021. Vol. 242. P. 126626.


