Влияние двух- и пятикомпонентной мембран на скорость регенерации хряща в эксперименте. Обоснование рационального выбора лабораторных животных для эксперимента
Автор: Белов Н.О., Раденска-лоповок С.Г., Лычагин А.В., Тимашев П.С., Кавалерский Г.М., Тельпухов В.И., Курпяков А.П., Липина М.М., Гаркави А.В., Корнеев А.А., Жидков С.В., Погосян Д.А., Лазаренко А.Н., Богатов Т.В.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 3 (53), 2023 года.
Бесплатный доступ
Актуальность. Возникновение хондральных и остеохондральных дефектов суставного хряща является значимой клинической патологией, поражающей молодое, работоспособное население. Отмечается потребность в разработке клинически эффективных отечественных конструктов.Цель исследования. Изучить влияние двух- и пятикомпонентных мембран на характер и скорость регенерации хряща в эксперименте. Проведен литературный поиск с целью обоснования рационального выбора экспериментальных животных, характеристик экспериментального дефекта хряща.Материалы и методы. Проспективное экспериментальное пилотное исследование. Было сформировано 2 группы исследования (n=13), хирургическим методом воссозданы модели остеохондральных дефектов суставной поверхности бедренной кости крысы, замещены двух- и пятикомпонентными мембранами разработки Сеченовского Университета. После выведения животных из эксперимента в сроки 7, 30, 60, 120 дней проведены макроскопическое и микроскопическое исследования образцов, измерена глубина дефектов, подсчитано усредненное значение, определено изменение глубины дефектов на каждом сроке выведения, подсчитана клеточная плотность в регенератах.Результаты. Обе мембраны продемонстрировали эффективность при замещении дефектов, отмечалось формирование хрящевой ткани по фиброзному типу.Заключение. Клинический результат удовлетворительный, дальнейшим направлением усовершенствования данных конструктов может служить применение по методу MACI.
Хондральный, дефект, лабораторное, животное
Короткий адрес: https://sciup.org/142239947
IDR: 142239947 | УДК: 617.3 | DOI: 10.17238/2226-2016-2023-3-7-17
Текст научной статьи Влияние двух- и пятикомпонентной мембран на скорость регенерации хряща в эксперименте. Обоснование рационального выбора лабораторных животных для эксперимента
Хондральные и остеохондральные дефекты хряща являются часто встречаемой патологией. Учитывая низкую способность гиалинового суставного хряща к восстановлению и возникающую необходимость применения дорогостоящих методов лечения, данная патология может рассматриваться как значимое социальное, экономическое бремя [1]. По данным западных специалистов, проведших ретроспективный анализ 31 516 артроскопических вмешательств на коленном суставе, повреждение суставного хряща наблюдалось в 63% случаев, при этом средний возраст пациентов составлял 43 года, преимущественно мужского пола [2].
Способы лечения, длительно применяемые в травматологии-ортопедии, такие как: артроскопический лаваж и дебридмент суставной поверхности, туннелизацияи микрофратуриров-ние субхондральной кости в зоне повреждения,- остаются актуальными и на настоящий момент времени, особенно в сочетании с наиболее современными методиками, например, индуцированным на матрице аутохондрогенезом, имплантацией аутологичных хондроцитов [3,4].Уже из перечисления очевидной становится тенденция к усложнению как самих методов лечения, так и применяемых в его процессе медицинских конструкций. Разработка и усовершенствование новых медицинских изделий, требуют проведения тщательных доклинических испытаний, с целью чего задействуются лабораторные животные [5].
Имплантатами с доказанной клинической эффективностью, представленными на рынке являются:
– Сhondro-gide, состоящий из коллагена свиньи I/III типа;
-
– Novocart-состоящий из коллагена I/III типа крупного рогатого скотав сочетании с хондроитинсульфатом;
-
– CaReS-cостоящий из коллагена крысы I типа. [6]
Учитывая потребность Российской Федерации в развитии собственного производства медицинских изделий, нельзя не отметить достижений отечественной медицины. К примеру, российская коллагеновая мембрана Ортософт, по данным доклинических исследований, предварительно не уступала и даже превосходила по ряду характеристик мембрану Сhondro-gide зарубежного производства, ставшую эталоном для сравнения в эксперименте по итоговому процентному соотношению образования хрящевой ткани в регенерате, распределению островков хрящевой ткани в регенерате по всей площади поверхности дефекта. [7]
Основная часть (выбор экспериментальной модели).
Проведение экспериментов на лабораторных животных, в качестве максимально приближенной модели к организму человека, всегда имело высокое значение [8], в то же время оценка полученных данных не в полной мере может быть экстраполирована на человеческий организм.
Первое противоречие при попытке экстраполяции данных с животных на человека при оценке замещения дефектов суставной хрящевой ткани заключается в разности морфологического строения суставного гиалинового хряща.
Зрелая хрящевая ткань состоит из хондроцитов и внеклеточного матрикса, имеющего в своем составе преимущественно фибриллы коллагена 2 типа, протеогликаны и гликозаминогликаны. Функция хондроцитов - анаболическая (синтез внеклеточного матрикса) и катаболическая (разрушение внеклеточного матрикса) [9].
Важно отметить, что зрелая человеческая гиалиновая суставная хрящевая ткань характеризуется значительно большей толщиной в сравнении с хрящом большинства экспериментальных животных. [10]
Соотношение содержания хондроцитов в хряще животных зачастую значительно выше такого у человека в одном и том же объеме ткани (105 на 1 мм3 –человек, кролик – больше в 10 раз, крыса-больше в 25 раз). В то время как содержание межклеточного матрикса в хрящевой суставной ткани человека значительно выше такового у животных. [11]
Таким образом, скорость полноценного восстановления хрящевой ткани человека заведомо ниже, чем у животных. Выше перечисленные условия могут особенно сильно искажать экспериментальные данные в случае попытки замещения неполнослойных дефектов хряща. [12]
Другим ограничением интерпретации результатов служит разница во временных сроках лечения после формирования дефекта хряща в эксперименте и в клинической практике. В процессе эксперимента формируется свежий ятрогенный дефект хряща с одномоментным проведением его реконструкции. В то же время в реальной клинической практике хирург сталкива- ется с хронической патологией, приводящей к комплексным изменениям гомеостаза в пораженном суставе. Соответственно, условия заживления дефекта хряща не будут сопоставимы. [13]
Немаловажным фактором является механическая нагружа-емость зоны воспроизводимого дефекта хряща. Часто задействованной зоной нанесения дефекта является межмыщелковая вырезка бедренной кости, не переносящая полной осевой нагрузки, но позволяющая значительно надежнее осуществить фиксацию имплантата. [14]
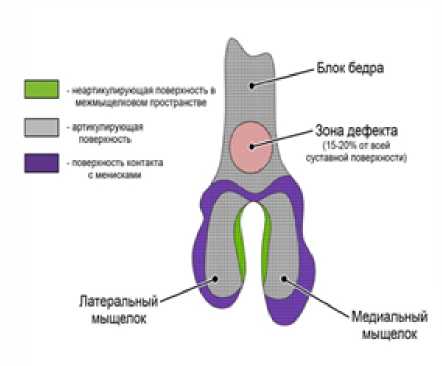
Важной задачей, облегчающей перенос экспериментальных данных доклинического исследования, является формирование дефекта критического размера. Таким дефектом считается тот, который не может зажить самопроизвольно, тем самым улучшая чистоту эксперимента. Согласно рекомендациям Американского общества по тестированию и материалам, такой дефект должен составлять 15-20 % площади суставной поверхности эпифизарного хряща или 50-60 % площади суставной поверхности мыщелка и не должен превышать по глубине 10 мм. [15]
Согласно рекомендациям FDA, ключевой задачей экспериментального доклинического исследования на животных являются:
-
– оценка биологической реакции на каждый компонент конструкта;
-
– оценка времени, необходимого для восстановления ткани, а также поведение конструкта на протяжении всего эксперимента. Рекомендуемая длительность – не менее одного года;
-
– оценка токсичности;
-
– анализ реакции на дозу;
-
– размер дефекта и его локализация должны максимально соответствовать аналогичному применению у человека. [16]
ГРЫЗУНЫ
Грызуны в качестве экспериментальной модели имеют ряд важных преимуществ. Их стоимость, экономические затраты на содержание низки. Лабораторные крысы позволяют проводить оценку биосовместимости и цитотоксичности составляющих конструктов путем имплантации в подкожно-жировую клетчатку и подкапсулярно в паренхиму почки. [17]
Кроме того, на этих моделях возможно и воссоздание дефектов хрящав пределах 0,75-3 мм, глубиной до 0,1 мм. Данные, полученные в результате экспериментов на грызунах, не могут быть экстраполированы на человека, однако достаточны для проведения пилотного эксперимента и принятия решения о дальнейшем продолжении исследований на крупных животных. [18]
КРОЛИКИ
Использование кроликов для эксперимента является незатруднительным, экономически эффективным. Лабораторные животные являются представителями чистой линии. Наиболее частой зоной оперативного вмешательства является коленный сустав в области дистальных мыщелков бедренной кости, бе-дренно-надколенникового сустава. Требуемая ширина зоны повреждения хряща – 3 мм, что составляет дефект критического размера. Рекомендуемый минимальный срок наблюдения – 6 месяцев. Подходят для проведения скрининговых заключений о биосовместимости, токсичности, морфометрического анализа. [19]
СОБАКИ
Собаки как экспериментальные животные применялись в медицине на протяжении многих лет. В настоящий время, в экспериментальной практике к применению допущены только специально выведенные лабораторные собаки.Как модель для эксперимента имеет ряд значимых ограничений. Толщина суставного хряща собаки – 0,95-1,3 мм, что уступает таковой у человека. Размер критического дефекта – 4 мм. Зрелость скелета достигается в среднем к 2 годам. Стоит отметить и негативную этическую сторону вопроса эксперимента на собаках. Однако из плюсов нельзя не упомянуть то, что собаки подвержены таким заболеваниям как остеоартрит, рассекающий остеохондрит. В силу особенностей характера вида животных, отмечается легкая коммуникация с исследователем, их выгодно выделяет послушность в процессе экспериментального лечения (возможность реабилитации плаванием, наложения иммобилизации). Отмечается возможность применения диагностических исследований (МРТ, КТ), повторные проведения диагностических артроскопий. [15,20]
ОВЦЫ
Анатомическое строение коленного сустава овцы является схожим с человеческим, что обуславливает успешность применения овец в доклинических стадиях эксперимента. Толщина хряща у овцы составляет 4-15 мм. Дефект критического размера – 6 мм. Средний срок исследований от 16 недель до 1 года. Стоит отметить, что как и большинство крупных животных, зрелость скелета овцы наступает в 2-3 года, что создает определенные ограничения при исследованиях. В силу крупного размера коленного сустава, имеется возможность имплантации конструктов как в наиболее нагружаемый медиальный мыщелок, так и в оба мыщелка бедренной кости, а также в частично нагружаемую зону-вырезку бедренной кости. [15, 21]
Цель исследования. Изучить влияние искусственно созданных двух- и пятикомпонентных мембран на характер и скорость регенерации хряща в эксперименте.
Материалы и методы исследования. Эксперимент проводился силами ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет). На базе Института регенеративной медицины были разработаны и произведены два типа конструктов из нетканых материалов:
-
1) пятикомпонентная биодеградируемая мембрана на основе поликопролактона / полилактида / хитозана / олиголактида / желатина;
-
2) двухкомпонентная биодеградируемая мембрана на основе поликопролактона / коллагена 2 типа.
Оба типа тканеинженерных конструктов были получены путем применения метода электроформования микро-/нано-размерных полимерных материалов, обладали высокопористой, волокнистой структурой. Именно такая структура позволяет способствовать адгезии и защите пролиферирующих клеток в зоне дефекта.
В дальнейшем силами кафедры травматологии, ортопедии и хирургии катастроф было проведено проспективное экспериментальное пилотное исследование. Проведение эксперимента одобрено Локальным этическим комитетом ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет). Для проведения эксперимента использовались самцы крыс линии Wistar, достигшие половой, скелетной и социальной зрелости (4 месяца, 300-500 г). На основании критериев включения, были отобраны здоровые животные, далее всем животным были выполнены оперативные вмешательства по стандартизированной методике. Размер дефекта хряща выбирался на основании выше изложенных методик (рис. 1 а, б).
а)
б)
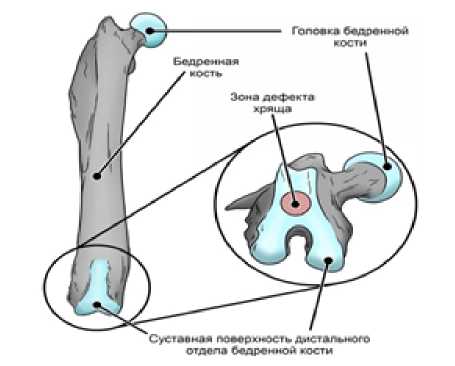
Рисунок 1.
Всем животным (n=13) были имплантированы конструкты двух разных типов: 2-ух компонентная мембрана – в проекции межмыщелковой вырезки правой бедренной кости, а 5-ти компонентная – левой бедренной кости. Были сформированы две группы (см. таблица 1).
Таблица 1.
|
группы |
количество животных |
день эксперимента |
мембрана |
|
группа 1 (правая бедренная кость) n=13 |
2 |
7 |
2-х компонентная |
|
3 |
30 |
||
|
3 |
60 |
||
|
5 |
120 |
||
|
группа 2 (левая бедренная кость) n=13 |
2 |
7 |
5-и компонентная |
|
3 |
30 |
||
|
3 |
60 |
||
|
5 |
120 |
После выполнения общей комбинированной анестезии препаратами Zoletil 100 (125 мг – 1 флакон в разведении на NaCl 0,9 % – 5 мл) в дозировке 15 мг/кг в сочетании с препаратом XylaVet (ксилазина гидрохлорид 20 мг – 1 мл во флаконах по 50 мл) в дозировке 5 мг/кг. По прошествии 5 минут после введения препаратов и достижения состояния медикаментозного сна производилось удаление волосяного покрова, трехкратная обработка операционного поля растворами антисептиков. Выполнялся кожный разрез по передней поверхности коленного сустава длиной 2 см, производилась медиальная парапател-лярная артротомия, после выполнения наружного вывиха надколенника фрезой воспроизводился остеохондральный хрящевой дефект диаметром 1,9 мм в проекции межмыщелковой вырезки бедренной кости. Производилось моделирование имплантата до размера 2 мм в диаметре. Фиксация имплантата производилась по методу пресс-фит, в ряде случаев при сомнительной состоятельности фиксации использовался фибриновый клей производителя «Сульфакрилат». Ушивание послеоперационной раны производилось послойно: капсула сустава - рассасывающимися полифиламентными нитями
(Викрил Плюс с покрытием 2-0), кожный шов - одиночными узловыми швами нерассасывающейся монофиламентной нитью (Пролен синий М3(2/0). В послеоперационном периоде животным обеспечено содержание в SPF-виварии. В течение трех суток после операции применялась медикаментозная терапия препаратами группы НПВС с целью купирования болевого синдрома, снижения уровня воспаления в области послеоперационной раны (Кеторолак 0,5 мг/кг в/м 1 раз в сутки, проводилась антибиотикопрофилактика препаратами группы цефалоспоринов 1 поколения (Цефазолин 30 мг/кг в/м через 12 часов). При послеоперационном наблюдении всем животным были обеспечены необходимые условия содержания: содержание в клетках по несколько особей (с учетом ГОСТ 33216-2014), постоянный доступ к еде и воде, регулярная замена подстилки по мере загрязнения, постоянный доступ к беговому колесу с целью послеоперационной реабилитации.
Сроки выведения составляли 7, 30, 60, 120 дней путем медикаментозной эвтаназии (Золетил 100-60 мг/кг в комбинации с Ксилазина гидрохлоридом-15 мг/кг).
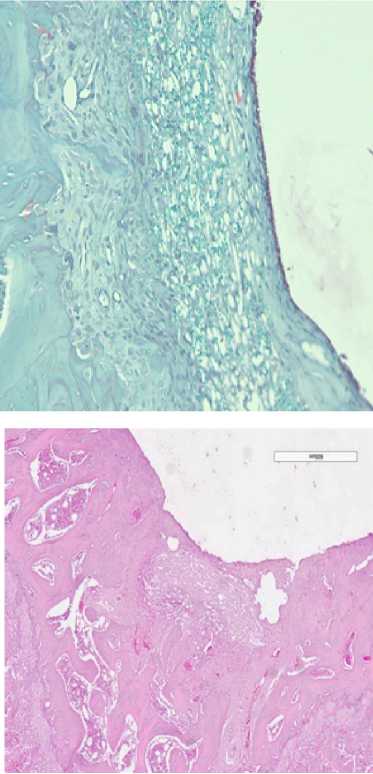
После выведения из эксперимента все полученные образцы фиксировали в 10 % нейтральном формалине, декальцинировали и заливали в парафин рутинными методами. Гистологические срезы толщиной 5 мкм окрашивали гематоксилином и эозином, пикрофуксином по ванн Гизону, сафранином О и пикросириусом с изучением в темном поле с поляризацией.
После описания выявленных изменений, проводили морфометрию следующих показателей: глубина дефекта, клеточная плотность регенерата. А также оценивались степень биодеградации конструкта, клеточный состав тканей в области дефекта. Полученные данные фиксировались в программе Microsoft Excel, проводилась статистическая обработка путем подсчета средних значений.
Результаты исследования.
Толщина хряща мыщелка крыс линии Wistar в среднем составляла 79,25 мкм. Среднее значение глубины искусственно созданных дефектов составляло 509 мкм. Края дефекта ровные, дно представлено субхондральной костью.
Таблица 2.
Глубина дефекта (мкм), клеточная плотность регенерата (средние значения)
|
Группа исследования |
Сроки (дни) |
|||||||
|
7 |
30 |
60 |
120 |
|||||
|
глубина |
Кл/ 1 мкм |
глубина |
Кл/ 1 мкм |
глубина |
Кл/ 1 мкм |
глубина |
Кл/ 1 мкм |
|
|
1 |
517,67 |
– |
436,78 |
11 |
433,84 |
17 |
310,35 |
– |
|
2 |
502,08 |
– |
429,25 |
39 |
450,0 |
12 |
310,70 |
– |
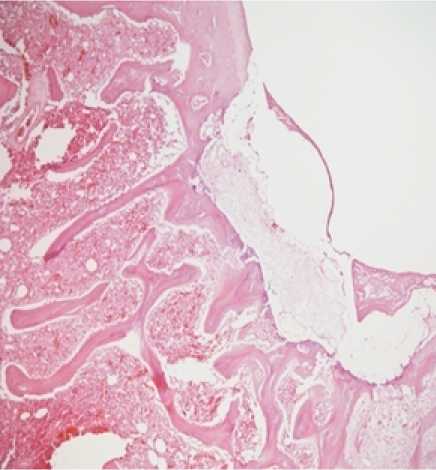
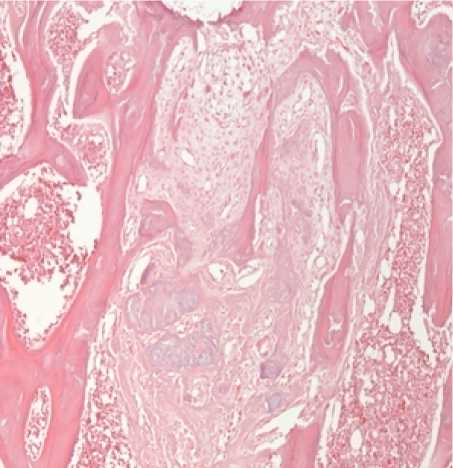
В первой группе для стимуляции регенерации использовали двухкомпонентную мембрану, фиксированную в дефект межмыщелковой ямки правой бедренной кости. Дефект хряща на 7 сутки эксперимента имел четкие края, а дно было представлено субхондральной костью. В дефекте были видны фрагменты мембраны (рис. 2 а). В межбалочном пространстве губчатой кости имелись бесструктурные фокусы (стрелка). Развивалась соединительная ткань и пролиферация хондроцитоподобных клеток (рис. 2 б). Через 30 дней определялись остатки мембраны в дне дефекта. Его границы были нечеткие, имелись неорганизованные тканевые структуры с хаотично расположенными костными балками и межклеточным матриксом (рис. 2 в). Месячное воздействие двухкомпонентной мембраны привело к развитию грануляционной ткани, с большим количеством фибробластов и тонкостенных сосудов. Ее созревание привело к формированию фиброзной ткани (рис. 2 г, д). Через 2 месяца воздействия двухкомпонентной мембраны происходило закрытием дефекта фиброзной тканью (рис. 2 е). Были видны остатки мембраны. Наиболее выраженные изменения отмечены через 2 месяца. Имелся большой фокус макрофагальных клеток, заполняющих бывший дефект хряща. Наряду с этим присутствовали клетки хондроцитарного ряда. Костные балки толстые, неправильной формы. Остеоид прослеживался неравномерно. Межбалочные пространства губчатой кости заполнены клетками гистиоцитарного ряда. Наряду с этим, мы выявили уменьшение глубины дефекта с 517,67 на 7 сутки до 436,78 и 310,35 мкм на 30 сутки и 120 сутки, соответственно.
в
‘лта
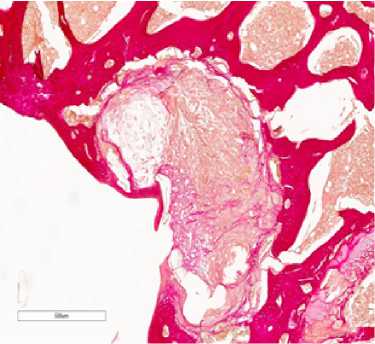
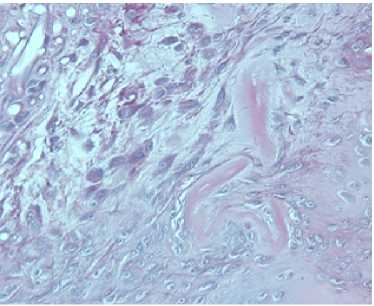
Рисунок 2. Действие двукомпонентной мембраны для активации регенерации хряща.
а, б) 7 суток эксперимента;
в, г, д) 30 суток эксперимента;
е) 60 суток эксперимента;
ж,з,и) 120 суток эксперимента.
Активные клетки гистиоцитарного ряда.
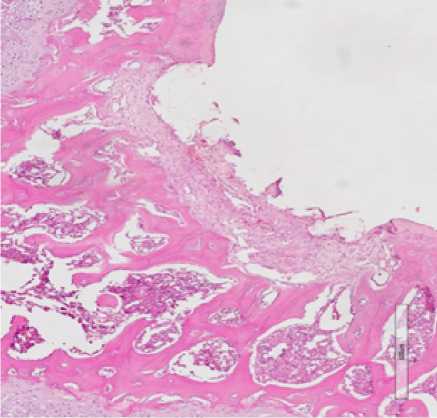
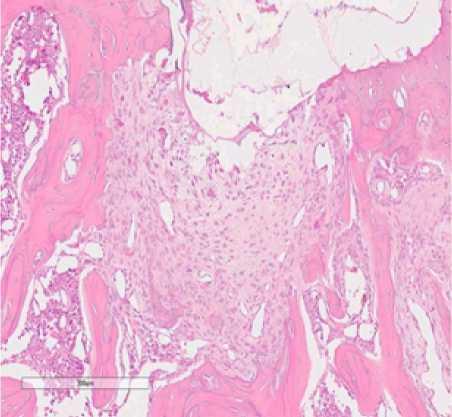
Вторая группа исследования включала препараты остео-хондрального дефекта межмыщелковой ямки левой бедренной кости с замещением пятикомпонентной. Через 7 суток от начала эксперимента дефект был заполнен фиксированной мембраной (рис. 3 а). Субхондральная кость имела четкие края, по бокам отграниченные сохранным хрящем. Месячное воздействие мембраны активировало пролиферацию макрофагов и хондробластов. Определялись большие пласты клеток, среди которых имелись липоциты (рис. 3 б, в). В остатках мембраны врастали зрелая соединительная ткань и фибробласты с формированием рубца. Губчатая кость была неправильно организована. Костные балки были толстые с хаотичным распределением линий окостенения. В одном случае имело место полное закрытие дефекта хрящом. Хондроциты были хаотично расположены, отсутствовали лакуны. Экстрацеллюлярный матрикс располагался неравномерно. Под вновь образованным хрящом отсутствовала субхондральная кость. Пласт клеток гистиоцитарного ряда отделял хрящ от губчатой кости (рис. 3 д). В конце срока исследования влияния пятикомпонентной мембраны выявили полное закрытие дефекта незрелым тонким хрящем. В нем присутствовали хондроциты с темными ядрами, а также небольшим количеством межклеточного вещества. Следует отметить, что губчатая кость не имела правильную организацию. Имелись кистозные расширения, заполнение межбалочных пространств фиброзной тканью и активными макрофагами.
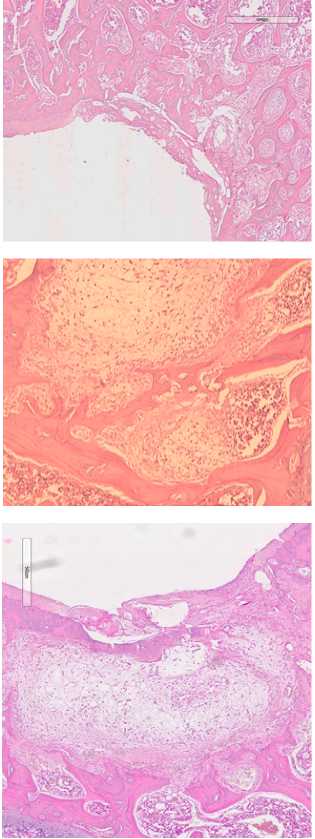
г
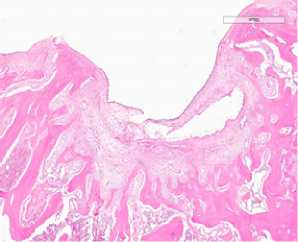
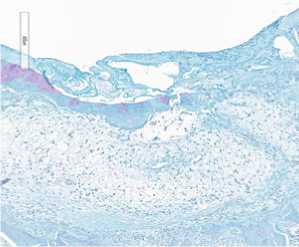
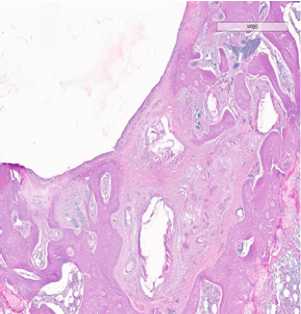
Рисунок 3. Действие пятикомпонентной мембраны на регенерацию хряща. а) 7 суток эксперимента; б, в) 30 суток эксперимента г, д) 60 суток эксперимента; е) 120 суток эксперимента.
Глубина дефекта уменьшалась от 502,08 мкм до 310,70 мкм в конце эксперимента. (таблица 2.1)
Нами была определена клеточная плотность на разных сроках исследования (таблица 2). Наибольший показатель был выявлен при использовании пятикомпонентной мембраны на 30 день ее воздействия. При этом через 60 дней этот показатель отличался незначительно в разных экспериментальных группах и составил 17 и 12 кл/на 104 мкм2, а в контрольной группе пролиферирующие клетки и макрофаги были значительно меньше.
Выводы:
Мембраны медленно рассасываются в эксперименте. Части двухкомпонентной мембраны определяется через 2 месяца, а пятикомпонентной даже через 4 месяца. Их длительное присутствие на поверхности обеспечивает пролонгированную активацию регенерации хряща.
Пятикомпонентная мембрана способствует регенерации хрящевой пластинки путем формирования активации гистиоцитов и хондроцитов. Однако, в остатки мембраны врастают фибробласты и коллагеновые волокна, которые способствуют формированию фиброзного компонента хряща. В субхондральной кости могут формироваться кистозные расширения.
Двухкомпонентная мембрана стимулирует жировую метаплазию субхондральной кости с формированием широких пластов пролифератов. Остеокласты активируются, и в межбалочных пространствах формируются очаги костного детрита.
Заключение.
Нельзя не отметить разность целеполагания специалистов: что считать успешным клиническим результатом лечения? На настоящий момент времени полноценное структурное замещение зоны дефекта хряща позволяет провести лишь метод мозаичной хондропластики. В то же время такие методики как дебридмент суставной поверхности, туннелизация и микрофратурирование субхондральной кости в сочетании с имплантацией мембран сводятся к идее обеспечения пути доступа компетентных клеток к зоне дефекта и использования имплантатов, обеспечивающих адгезию и возможность дальнейшей пролиферации мигрировавших клеток в зоне повреждения, а также синтезу внеклеточного матрикса. Такая стратегия не приводит к полноценному восстановлению суставного хряща. Неполная регенерация (субституция) хрящевой ткани, связанная с формированием в зоне повреждения грубоволокнистой хрящевой ткани, не являющейся абсолютно соответствующей по своим свойствам нативной, но при обеспечении полноценного закрытия зоны дефекта новообразованной тканью с обеспечением возможности переносить физиологические нагрузки, полноценной интеграции с окружающей неповрежденной хрящевой тканью, такой клинический клинический результат допустимо считать приемлемым.
Учитывая обнадеживающие результаты проведенного эксперимента, видится необходимым развитие полученных конструктов в направлении применения по методике MACI.
Список литературы Влияние двух- и пятикомпонентной мембран на скорость регенерации хряща в эксперименте. Обоснование рационального выбора лабораторных животных для эксперимента
- Загородний Н.В., Воротников А.А., Айрапетов Г.А., Васюков В.А. Комплексный подход к хирургическому лечению хондральных и остеохондральных дефектов коленного сустава // Opinion leader. 2021;3(44):28-35. [Zagorodnij N.V., Vorotnikov A.A., Ajrapetov G.A., Vasjukov V.A. Kompleksnyj podhod k hirurgicheskomu lecheniju hondral’nyh i osteohondral’nyh defektov kolennogo sustava // Opinion leader. 2021;3(44):28-35.]
- Curl WW, Krome J, Gordon ES, Rushing J, Smith BP, Poehling GG. Cartilage injuries: a review of 31,516 knee arthroscopies. Arthroscopy. 1997 Aug;13(4):456-60. doi: 10.1016/s0749-8063(97)90124-9. PMID: 9276052.
- Стадников А.А., Кавалерский Г.М., Архипов С.В., Павлов В.П., Макаров С.А., Макаров М.А., Роскидайло А.А. (2009). Новые методы хирургического лечения дефектов гиалинового хряща коленного сустава у больных гонартрозом]// Научно-практическая ревматология, (3), 90-93. [STADNIKOV A.A., KAVALERSKIJ G.M., ARHIPOV S.V., PAVLOV V.P., MAKAROV S.A., MAKAROV M.A., ROSKIDAJLO A.A. (2009). NOVYE METODY HIRURGIChESKOGO LEChENIJa DEFEKTOV GIALINOVOGO HRJaShhA KOLENNOGO SUSTAVA U BOL’’NYH GONARTROZOM]// NAUChNO-PRAKTIChESKAJa REVMATOLOGIJa, (3), 90-93.]
- Лазишвили Г.Д., Затикян В.Р., Шукюр-Заде Э.Р., Корнаев А.С., Акматалиев К.И., Данилов М.А. Актуальные вопросы хондропластики // Вестник РГМУ. 2013;3:13–17. [Lazishvili G.D., Zatikjan V.R., Shukjur-Zade Je.R., Kornaev A.S., Akmataliev K.I., Danilov M.A. Aktual’nye voprosy hondroplastiki // Vestnik RGMU. 2013;3:13–17.]
- Benedikt L. Proffen; Megan McElfresh; Braden C. Fleming; Martha M. Murray (2012). A comparative anatomical study of the human knee and six animal species., 19(4),0–0. doi:10.1016/j.knee.2011.07.005.
- Тельпухов Владимир Иванович, Гаркави Андрей Владимирович, Чагин Андрей Станиславович, Лычагин Алексей Владимирович, Кытько Олеся Васильевна, Жандаров Кирилл Александрович, Панюшкин Петр Вячеславович, Ибрагимова Шабнам Илдырым Кызы СОВРЕМЕННЫЕ МЕТОДЫ ХОНДРОПЛАСТИКИ И ВОЗМОЖНОСТИ СТИМУЛЯЦИИ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ СУ-СТАВНОГО ХРЯЩА (ЧАСТЬ 2) // Медицинский вестник Северного Кавказа. 2022. №4. URL: https://cyberleninka.ru/article/n/sovremennyemetody-hondroplastiki-i-vozmozhnosti-stimulyatsii-regenerativnyhprotsessov-sustavnogo-hryascha-chast-2. [Tel’puhov Vladimir Ivanovich, Garkavi Andrej Vladimirovich, Chagin Andrej Stanislavovich, Lychagin Aleksej Vladimirovich, Kyt’ko Olesja Vasil’evna, Zhandarov Kirill Aleksandrovich, Panjushkin Petr Vjacheslavovich, Ibragimova Shabnam Ildyrym Kyzy SOVREMENNYE METODY HONDROPLASTIKI I VOZMOZh-NOSTI STIMULJaCII REGENERATIVNYH PROCESSOV SUSTAVNOGOHRJaShhA (ChAST’’ 2) // Medicinskij vestnik Severnogo Kavkaza. 2022. №4. URL: https://cyberleninka.ru/article/n/sovremennye-metodyhondroplastiki-i-vozmozhnosti-stimulyatsii-regenerativnyh-protsessovsustavnogo-hryascha-chast-2.]
- Lazishvili G.D., Egiazaryan K.A., Nikishin D.V., Voroncov A.A., Shpak M.A., Klinov D.V., Sirotin I.V. EXPERIMENTAL SUBSTANTIATION OF THE USE OF COLLAGEN MEMBRANES FOR THE RECONSTRUCTION OF FULL-THICKNESS DEFECTS IN HYALINE CARTILAGE. Surgical practice. 2020;(1):45-52. (In Russ.) https://doi.org/10.38181/2223-2427-2020-1-45-52.
- Исламов Р.А. (2016). Методология эксперимента с использованием лабораторных животных. Вестник Казахского Национального медицинского университета, (1), 489-492. [Islamov R.A. (2016). Metodologija jeksperimenta s ispol’zovaniem laboratornyh zhivotnyh. Vestnik Kazahskogo Nacional’nogo medicinskogo universiteta, (1), 489-492.]
- «Клинические рекомендации «Гонартроз» (утв. Минздравом России), https://cr.minzdrav.gov.ru/recomend/667_1. [«Klinicheskie rekomendacii «Gonartroz» (utv. Minzdravom Rossii), https://cr.minzdrav.gov.ru/recomend/667_1.]
- An YH, Friedman RJ. Animal models of articular cartilage defect. Animal models in orthopaedic research. Boca Raton, FL: CRC Press LLC; 1999. Стр. 310.
- Tom Minas, Julie Glowacki, Chapter 2 - Cartilage Repair and Regeneration, Editor(s): Tom Minas, A Primer in Cartilage Repair and Joint Preservation of the Knee, W.B. Saunders, 2011, Pages 8-21, ISBN 9781416066545, https://doi.org/10.1016/B978-1-4160-6654-5.00002-X.
- Hunziker EB. Biologic repair of articular cartilage. Defect models in experimental animals and matrix requirements. Clin Orthop 1999;367(Suppl.):S135–S46.
- Reinholz GG, Lu L, Saris DB, Yaszemski MJ, O’Driscoll SW. Animal models for cartilage reconstruction. Biomaterials. 2004 Apr;25(9):1511-21. doi: 10.1016/s0142-9612(03)00498-8. PMID: 14697854.
- Hoemann C, Kandel R, Roberts S, Saris DB, Creemers L, Mainil- Varlet P et al (2011) International Cartilage Repair Society (ICRS) recommended guidelines for histological endpoints for cartilage repair studies in animal models and clinical trials. Cartilage 2(2):153–172.
- ASTM F2451–05 (2010) Standard Guide for in vivo Assessment of Implantable Devices Intended to Repair or Regenerate Articular Cartilage., ASTM International.
- Guidance for Industry Preparation of IDEs and INDs for Products Intended to Repair or Replace Knee Cartilage. https://www.fda.gov/media/82562/download
- Регенеративная медицина: учебник / под ред. П.В. Глыбочко, Е.В. Загайновой. Москва: ГЭОТАР-Медиа, 2023. – 456 с.: ил. - DOI: 10.33029/9704-7535-5-REG-2023-1-456. ISBN 978-5-9704-7535-5. Стр.191-192. [Regenerativnaja medicina: uchebnik / pod red. P.V. Glybochko, E.V. Zagajnovoj. Moskva: GJeOTAR-Media, 2023. – 456 s.: il. - DOI: 10.33029/9704-7535-5-REG-2023-1-456. ISBN 978-5-9704-7535-5.Str.191-192.]
- Chu CR, Szczodry M, Bruno S (2010a) Animal models for cartilage regeneration and repair. Tissue Eng B Rev 16(1):105–115.
- Ahern BJ, Parvizi J, Boston R, Schaer TP. Preclinical animal models in single site cartilage defect testing: a systematic review. Osteoarthritis Cartilage. 2009 Jun;17(6):705-13. doi:10.1016/j.joca.2008.11.008.
- Hurtig MB, Buschmann MD, Fortier LA, Hoemann CD, Hunziker EB, Jurvelin JS, Mainil-Varlet P, McIlwraith CW, Sah RL, Whiteside RA. Preclinical Studies for Cartilage Repair: Recommendations from the International Cartilage Repair Society. Cartilage. 2011 Apr;2(2):137-52. doi: 10.1177/1947603511401905. PMID: 26069576; PMCID: PMC4300779
- Rudert M: Histological Evaluation of Osteochondral Defects: Consideration of Animal Models with Emphasis on the Rabbit, Experimental Setup, Follow-Up and Applied Methods. Cells Tissues Organs 2002;171:229-240. doi: 10.1159/000063125.


