Влияние фактора роста нервов на количество копий онкогенов MYCC, MYCN в клетках медуллобластомы человека
Автор: Чернов А.Н.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 1 т.9, 2019 года.
Бесплатный доступ
Введение. Поиск новых молекулярных таргетных мишеней для химиотерапии онкологических заболеваний, в особенности интракраниальных опухолей у детей, является актуальной задачей современной онкологии. Экспрессия и амплификация онкогенов MYC часто представлена в опухолях мозга и является маркером неблагоприятного прогноза заболевания. Многие процессы онкогенеза контролируют ростовые факторы, в частности, фактор роста нервов (ФРН). Цель. Изучить изменение копийности MYCC- и MYCN-онкогенов в клетках медуллобластомы (МБ) при воздействии ФРН. Материалы и методы. В статье исследуется влияние ФРН на численность копий MYCC-, MYCN онкогенов в первичной культуре клеток медуллобластомы человека методом флуоресцентной in situ гибридизации. Результаты. Установлено, что воздействие ФРН снижает численность клеток МБ, содержащих 6-, 8-копий онкогена MYCN и 3-, 8 копий MYCC-онкогена. ФРН также увеличивает численность опухолевых клеток, содержащих двойной набор копий обоих онкогенов. Документирована статистически значимая (p
Медуллобластома, фактор роста нервов, численность копий, mycn-онкогены, индекс цитотоксичности
Короткий адрес: https://sciup.org/140243810
IDR: 140243810
Текст научной статьи Влияние фактора роста нервов на количество копий онкогенов MYCC, MYCN в клетках медуллобластомы человека
Введение. Поиск новых молекулярных таргетных мишеней для химиотерапии онкологических заболеваний, в особенности интракраниальных опухолей у детей, является актуальной задачей современной онкологии. Экспрессия и амплификация онкогенов MYC часто представлена в опухолях мозга и является маркером неблагоприятного прогноза заболевания. Многие процессы онкогенеза контролируют ростовые факторы, в частности, фактор роста нервов (ФРН).
Цель. Изучить изменение копийности MYCC - и MYCN -онкогенов в клетках медуллобластомы (МБ) при воздействии ФРН.
Материалы и методы. В статье исследуется влияние ФРН на численность копий MYCC -, MYCN онкогенов в первичной культуре клеток медуллобластомы человека методом флуоресцентной in situ гибридизации.
Результаты. Установлено, что воздействие ФРН снижает численность клеток МБ, содержащих 6-, 8-копий онкогена MYCN и 3-, 8 копий MYCC -онкогена. ФРН также увеличивает численность опухолевых клеток, содержащих двойной набор копий обоих онкогенов. Документирована статистически значимая (p<0,0001) отрицательная корреляция (r = –0,65) между средним числом копий MYCC -онкогена в клетках МБ и индексом цитотоксичности ФРН.
Вывод: Увеличение численности копий онкогена снижает чувствительность клеток МБ к ростовому фактору.
Наиболее распространенной злокачественной опухолью головного мозга у детей является МБ, на долю которой приходится от 15% до 20% среди всех первичных опухолей центральной нервной системы [1]. Прогресс в мультимодальных подходах к лечению позволил значительно увеличить 5-летнюю общую выживаемость [2]. Однако около 30% пациентов остаются неизлечимыми, и агрессивная терапия часто приводит к тяжелым отдаленным побочным эффектам [3]. Стратегия лечения в настоящее время основана на системе стратификации пациентов по группам риска, установленной Packer с соавт., при которой выделяются две группы: стандартного и высокого риска. Группы определяются в соответствии со следующими факторами: наличием остаточной опухоли объёмом более 1,5 см3, возрастом менее 3 лет, а также подтверждением метастазирования [4]. По классификации ВOЗ, существует, по крайней мере, пять различных гистологических типов МБ, при этом появляется все больше доказательств того, что прогноз и ответ на терапию во многом зависят от биологии опухолевых клеток. В качестве прогностических биологических маркеров выделяют многие гены и хромосомные аберрации. Так, к маркерам неблагоприятного прогноза относят, в частности, повышенную экспрессию или амплификацию генов семейства MYC, 1q+, 10q-, 17р-, 17q+ или i (17) (q10) [5, 6, 7, 8]. Экспрессия MYC-онкогенов в МБ ассоциируется с высокой злокачественностью опухоли и низким (13%) показателем пятилетней общей выживаемости пациентов [5,9], которые умирают в течение одного месяца [10]. Из-за наличия достоверной корреляции между высоким уровнем экспрессии и/или амплификации онкогенов MYCC, MYCN и неблагоприятным течением заболевания данные маркеры принято считать одним из важных факторов стратификации по группам риска [11, 12, 13]. Такое внимание онкогенам семейства MYC уделяется не случайно. Эти онкогены активируют многие процессы: апоптоз [14], пролиферацию, репликацию ДНК и вхождение в S-фазу клеточного цикла [14, 15, 16], генетическую лабильность (сочетающуюся с гетероплоидностью [17], тетрапло-идностью, анаплазией [18]), активность теломеразы [16], а также адгезию [17] и ангиогенез опухолей [16, 18] при ингибировании их дифференцировки [16]. Разнообразные механизмы обусловливают распространение регуляторных влияний онкогенов более, чем на 15% генома человека [17].
Весь спектр разнообразных эффектов на клетки опухоли оказывают ростовые факторы, из которых ФРН является наиболее хорошо изученным. Способствуя развитию и выживанию клеток нервной системы, он в тоже время обладает цитотоксическим противоопухолевым эффектом, доказанным на культурах клеток интракраниальных неоплазий, в том числе МБ. Воздействие ФРН на клетки обусловлено связыванием его с рецепторами — высокоаффинным тирозинкиназным (TrkA) рецептором и низкоаффинным, содержащим домен смерти (р75). Экспрессия перво-
А. Н. Чернов го из этих рецепторов на нейробластомах является маркером благоприятного прогноза у пациентов, поскольку способствует спонтанному перерождению опухоли в менее злокачественную ганглионеврому [19, 20].
Таким образом, можно предположить наличие внутриклеточного сигнального пути, запускаемого воздействием ФРН через TrkA, p75 рецепторы на амплификацию онкогенов MYCC , MYCN в клетках МБ. Это, возможно, позволяет снизить злокачественный потенциал опухоли и повысить ее чувствительность к химиопрепаратам. На это обстоятельство указывают данные о синергическом противоопухолевом эффекте комбинаций ФРН с химиопрепаратами по сравнению с обособленным действием цитостатических средств на клетки нейроэпителиальных опухолей человека [19]. Использование новых молекулярно-генетических маркеров позволит повысить уровень диагностики, дополнительно дифференцировать и индивидуализировать подход к терапии данной патологии у детей.
Целью работы являлось изучение изменений копийности онкогенов M YCC - и MYCN -онкогенов в клетках МБ при воздействии ФРН.
Материалы и методы
Клиническая и гистологическая характеристика
Исследование выполнено на клетках МБ, полученных из биопсийного материала, взятого от 9 пациентов (7 мальчиков и 2 девочек) в возрасте от 3 месяцев до 10 лет (медиана 6,5 лет). У всех пациентов был выявлен классический тип МБ.
Получение первичных культур клеток МБ
Материал, поступавший из клиники в течение 1 часа, в стерильных условиях ламинарного бокса (Lobconco, США) отмывали от крови, освобождали от соединительнотканных элементов в растворе Хэнкса (Sigma-Aldrich, США), содержащем 4% раствор гентамицина сульфата (РФ) и механически измельчали до мелких частиц. Клетки подвергали 10-минутной ферментативной обработке смесью 0,25% раствора трипсина и 0,02% раствора этилендиаминтетрауксусной кислоты (ЭДТА) в соотношении 1:3 (Sigma-Aldrich, США) при температуре 37°С. Действие фермента нейтрализовали путём переноса в чашки Петри, содержащие 1 мл эмбриональной телячьей сыворотки (Sigma-Aldrich, США). Обработанные клетки подсчитывали в камере Горяева и переносили (в количестве 500 тыс. клеток/мл) в чашки Петри (d=35 мм, Nunc, Дания) с 1 мл среды Игла в модификации Дульбекко (DМЕМ, Sigma-Aldrich, США), содержащей 10% эмбриональную телячью сыворотку. Клетки МБ культивировали на протяжении 2 суток в стандартных условиях в СО2 инкубаторе (Heraccell, США) при температуре 37°С, 95% влажности и 5% парциальном давлении СО2 [22] до достижения стадии логарифмического роста культуры, которую определяли визуально по резко возросшему количеству митозов и численности клеток с помощью цифровой фотокамеры Altra20, снабженной программным обеспечением Analysis getlT (Olympus, Япония) на инвертированном микроскопе НУ-2Е (Carl Zeiss, Германия) при увеличении в 312 раз.
Определение цитотоксического эффекта ФРН на культурах клеток МБ
На клетках МБ, находящихся в стадии логарифмического роста, тестировали ФРН в течение суток, используя дозу 0,1 мкг/мл, являющуюся эквивалентом физиологической в крови пациентов [22]. Для этого из посевов удаляли среду, добавляли 1 мл 0,25% раствора трипсина с ЭДТА и инкубировали в течение 5 минут при температуре 37оС. Клетки пипетировали, вносили 1-2 капли 0,2% раствора трипанового синего (Alta Aesar, Германия) и переносили 20 мкл суспензии в камеру Горяева (Минимед, РФ). Подсчитывали количество мертвых (окрашенных) и жизнеспособных (прозрачных) клеток в 15 больших квадратах по диагонали и определяли их соотношение [21].
Полученный эффект — степень подавления роста опухолевых клеток ФРН — был выражен через индекс цитотоксичности (формула 1):
где N% — индекс цитотоксичности ФРН, опыт — выживаемость клеток при действии ФРН, контроль — выживаемость клеток в контрольной группе [23].
Фиксация культуры клеток
Посевы обрабатывали ФРН в течение одних суток. Клетки обрабатывали 0,25% раствором трипсина с ЭДТА (Sigma-Aldrich, США) в соотношении 1:3 в течение 5 мин, переносили в пробирки и центрифугировали при 1500 об/10 мин. Клеточную суспензию переносили в пробирки, куда добавляли гипотонический 0,55% раствор хлорида калия и выдерживали 10 минут на водяной бане при температуре 37°С, затем центрифугировали в течение 10 мин. Супернатант отбирали, а осадок ресуспензировали в 0,5– 1 мл гипотонического раствора. В пробирки с клетками вносили трехкратно по каплям охлажденный до -20 °С фиксатор Карнуа, состоящий из смеси 96% раствора метанола и 99,5% раствора ледяной уксусной кислоты (Sigma-Aldrich, США) в пропорции 3:1.
Определение цитогенетических аберраций методом FISH
Клеточную культуру выдерживали в фиксаторе при 4 °С не меньше 2 часов, затем отмывали в новом свежеприготовленном охлажденном до -20 °С фиксаторе Карнуа и раскапывали на стекла. Качество нанесенного материала контролировали под световым микроскопом при 100-кратном увеличении. Стекла подсушивали при комнатной температуре в течение 2 часов в вытяжном шкафу и переносили в термостат на 2–3 часа при температуре 56 °С или выдерживали при комнатной температуре в течение 2–3 суток. Обработку РНКазой или протеиназой К не проводили. После «состаривания» стекла опускали в солевой натрий-цитратный буфер (0,6M хлорида и 0,06М цитрата натрия, рН=7,2 Sigma-Aldrich, США) на 30 минут при 37°С и дегидратировали в течение 2 минут в спиртах возрастающей крепости (70°, 80°, 96°), с последующей сушкой при комнатной температуре в течение 15–20 минут. На стекла с фиксированными клетками в выделенный участок наносили смесь ДНК-зонда (7 мкл Vysis LSI/WSP буфера, 2 мкл воды и 1 мкл ДНК-зонда), накрывали покровным стеклом (22×22 мм) и заклеивали клеем. Для определения примерной плоидности клеток использовали зонды VysisLSI MYCC (8q24.12 — q24.13)
А. Н. Чернов и VysisLSI MYCN (2p24), меченные флуорохромом SpectrumOrange (Abbott Molecular, США). После нанесения 0,5 мкл смеси зондов, сразу проводили денатурацию ДНК при 73 °C в течение 5 мин и ставили на гибридизацию в гибридизатор (Dako, США) во влажной атмосфере при 37°С в течение 16-18 ч. По окончании гибридизации, аккуратно снимали клей с покровных стекол.
Их опускали на 2 минуты в прогретый до 73 °С солевой раствор 0,4×натрий-цитратного буфера с добавлением 0,3% детергента нонилфенокси-полиэтоксиэтанола (NP40, Thermo scientific, США) на 2 минуты. Стекла переносили в солевой раствор натрий-цитратного буфера (0,6 M хлорида и 0,06 М цитрата натрия, рН=7,2 Sigma-Aldrich, США) с добавлением 0,1% NP40 на 10 мин. Образцы дегидратировали 2 мин в серии спиртов возрастающей крепости (70°, 80°, 96°) и сушили при комнатной температуре 15–20 минут в темноте. На высохшие стекла в отмеченную область наносили рабочий раствор 4,6-диамино-2-фенилиндолдигидрохлорида (DAPI, 1,5 мкг/мл), приготовленный на фосфатно-солевом буфере, и окрашивали 10–15 мин, покрывали покровным стеклом и анализировали.
Анализ результатов
Препараты просматривали на флуоресцентном микроскопе Leica DMLB (Германия) с соответствующими флуорохромами DAPI, TexasRed, FITC-фильтрами при общем 1000-кратном увеличении (объектив × 100 масляная иммерсия; окуляры × 10). Подсчитывали общее количество, но не менее 100 клеток в поле зрения, а также их численность с каждым набором (n) онкогенов. Из опухолевой ткани каждого пациента готовили не менее трех посевов. Образцы были зарегистрированы в соответствии с рекомендациями международной номенклатуры цитогенетики человека ISCN 2013 [24]. Проанализировано 108 посевов.
Статистическая обработка данных
Результаты представляли в виде средней арифметической ± стандартная ошибка средней для выборки (M±m). Для сравнения двух групп применяли однофакторный дисперсионный анализ
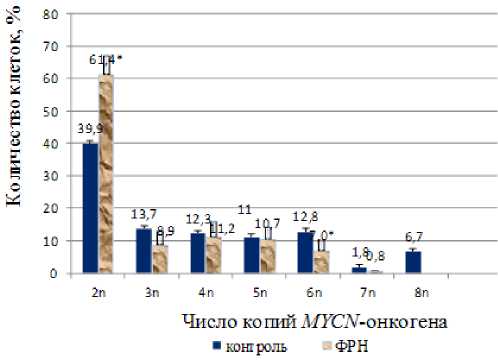
Рисунок 1. Изменение численности клеток МБ, содержащих двух-восьми-кратное количество копий MYCN -онкогена при воздействии ФРН.
Здесь и на рис. 2: знаком √ обозначены статистически значимые (p<0,05) отличия численности копий онкогена от контроля.
(ANOVA one-way) и F-критерий (критерий Фишера). Достоверным считалось различие при уровне значимости p<0,05. Для проведения описательной статистики и оценки достоверности различий между двумя группами данных использовали программу StatPlus 2005 пакета Statistica 6.0.
Результаты и обсуждение
|
Пациент, номер истории |
Индекс цитотоксичности, % |
|
15 348 |
53,4±3,6 |
|
3396 |
51,3±4,5 |
|
1731 |
49,6±3,4 |
|
2289 |
36,2±5,6 |
|
15 923 |
27,0±3,3 |
|
20 595 |
50,7±13,6 |
|
29 346 |
60,3±3,5 |
|
53 |
46,3±3,7 |
|
30 192 |
32,4±5,6 |
|
Средний ИЦ |
44,9±2,6 |
На первом этапе исследовали индекс цитотоксичности ФРН на культуры клеток МБ (табл. 1).
Изучали изменение численности копий MYCC - и MYCN -онкогенов в клетках МБ при воздействии ФРН (рис. 1, 2).
Изменения численности копий онкогенов в клетках МБ под влиянием ФРН были представлены тремя вариантами ответов: 1) снижение на 72,7±17,4% (p<0,05) численности клеток опухоли, содержащих 6-, 8 n-копий MYCN -онкогена и на 63,4±26,6% численности клеток, содержащих3-, 8п-копий MYCC -онкогена (n=39 посевов), причем воздействие ФРН нивелировало до нуля их количество с восьмью копиями обеих онкогенов;
-
2) возрастание на 78,8±12,7% (p<0,05) количества опухолевых клеток, содержащих двойной набор копий обоих онкогенов и 4-,5n копий MYCC -онкогена.
Отмечено отсутствие статистически значимых изменений численности опухолевых клеток, содержащих 3-, 4-, 5-, 7n-копий
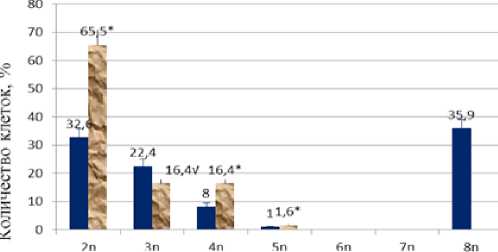
Число копий Л/УСС-онкогена
-
■ контроль -1 ФРН
Рисунок 2. Изменение численности клеток МБ, содержащих двух-восьми-кратное количество копий MYCC -онкогена при воздействии ФРН.
А. Н. Чернов
Таблица 2. Средняя численность копий MYCN -, MYCC -онкогенов в клетках МБ при воздействии ФРН
|
Серия опыта |
Количество клеток, содержащих 2–8 копий онкогенов, % |
Среднее число копий |
||||||
|
2n |
3n |
4n |
5n |
6n |
7n |
8n |
||
|
Контроль MYCN |
39,9±15,1 |
13,7±4,3 |
12,3±4,2 |
11,0±1,5 |
12,8±2,5 |
1,8±0,3 |
6,7±1,3 |
2,7±0,3 |
|
Контроль M YCC |
32,6±4,8 |
22,4±3,8 |
8,0±3,9 |
1,0±0,2 |
– |
- |
35,9±15,2 |
2,9±0,4 |
|
ФРН, MYCN |
61,4±5,0* |
8,9±2,6 |
11,2±4,8 |
10,7±3,8 |
7,0±2,2* |
0,8±0,1 |
-* |
2,5±0,2 |
|
ФРН, MYCC |
65,5±3,2* |
16,4±2,8* |
16,4±4,3* |
1,6±0,3* |
- |
- |
-* |
2,3±0,07* |
Примечание: Среднее количество копий онкогенов определяли для каждого пациента как отношение суммы произведений численности клеток, содержащих конкретный набор онкогена, на число копий онкогена к 100 % клеток в каждой серии. Знаком * обозначены статистически значимые (p<0,05) отличия количества копий онкогенов при воздействии ФРН от числа копий онкогенов в контроле
Таблица 3. Коэффициент корреляции (r) между средним количеством копий MYCC -, MYCN -онкогенов в клетках МБ и индексом цитотоксичности ФРН, гибелью клеток в контроле
|
Серия опыта |
df |
Онкоген |
Индекс цитотоксичности, гибель, % |
|||
|
MYCN |
MYCC |
|||||
|
среднее количество копий |
корреляция, r |
среднее количество копий |
корреляция, r |
|||
|
Контроль |
7 |
2,7±0,3 |
0,27 |
2,9±0,4 |
0,03 |
22,1±2,0 |
|
Фактор роста нервов |
7 |
2,5±0,2 |
–0,33 |
2,3±0,07 √ |
–0,65 p<0,0001 |
44,9±2,6 √ |
Примечание: Жирным шрифтом обозначены статистически значимые (p<0,05) значения коэффициента корреляции r при степенях свободы df=n-2. Символом √ обозначены статистически значимые отличия от контроля при p<0,05.
MYCN -онкогена. Таким образом, данные на рис. 1 и 2 показывают, что воздействие ФРН на клетки МБ статистически значимо (p<0,05) снижало численность клеток, содержащих 6-, 8n копий MYCN -онкогена и 3-, 8n копий MYCC -онкогена, но вместе с тем увеличивало (p<0,05) численность клеток, содержащих диплоидный набор обоих онкогенов.
Было рассчитано среднее количество копий MYCC -, MYCN -онкогенов в клетках МБ при воздействии ФРН (табл. 2).
Результаты исследования поставили вопрос: как чувствительность клеток МБ зависит от среднего количества копий онкогенов? Для ответа на него были рассчитаны коэффициенты корреляции между средним количеством копий онкогенов и ИЦ ФРН (табл. 3).
Результаты, представленные в табл. 3, свидетельствуют о наличии статистически значимой (p<0,0001) отрицательной корреляции (r=–0,65) между средним числом копий MYCC -онкогена и ИЦ ФРН. Этот факт доказывает участие MYCC -онкогена в изменении чувствительности клеток МБ к ФРН.
Таким образом, воздействие ФРН на клетки МБ статистически значимо снижало (p<0,05) численность клеток, содержащих 6-, 8n копий MYCN -онкогена и 3-, 8n копий MYCC -онкогена, но вместе с тем увеличивало численность клеток, содержащих диплоидный набор обоих онкогенов. Установлена статистически значимая отрицательная корреляция между средним количеством копий MYCC -онкогена в клетках опухоли и ИЦ ФРН; она показывает, что наличие онкогена в клетках опухоли повышает их резистентность к ростовому фактору.
Результаты авторов подтверждаются данными других исследователей, показывающих взаимосвязь между изменением экспрессии TrkA, p75 рецепторов и MYCC -, MYCN -онкогенов в клетках нейробластомы и их химиочувствительности.
Обнаружено подавление экспрессии TrkA-рецептора на клетках клонов LA1-15N, SMS-KCNR нейробластом с MYCN-амплифи- кацией [25, 26]. Экспозиция указанных линий с ФРН в течение 1 часа и 1 суток ингибирует через TrkA рецептор на 50–60% и на 80 % — экспрессию MYCN-онкогена, возможно, через ингибирование медиатора клеточной резистентности — пути AKT/PKB/Ras или киназы фокальной адгезии pp125FAK, активируемой митогеном протеинкиназы (МАРК), циклин-Е2-киназы, ингибитора ци-клин-зависимой киназы (р27kip1) и транскрипционного фактора E2F [26, 27]. Данный факт подтверждается тем, что экспрессия TrkA рецептора у четырех пациентов с нейробластомой, содержащих MYCN-амплификацию, коррелировало с благоприятным клиническим прогнозом и безрецидивной продолжительностью жизни до 31-го месяца [25, 28]. Однако, сверхэкспрессия TrkA рецептора на нейробластомах и МБ подавляет агрессивный рост опухолей даже с MYCN-амплификацией [25].
Предполагается воздействие ФРН на MYC -онкогены и по другому сценарию. ФРН через рецептор и MAP-2 активирует транскрипционный фактор KLF-7, запускающий аутофагию и дифференцировку клеток крысиной феохромоцитомы PC12 [29]. Аналогичный тип гибели констатирован для клеток МБ [30]. Вместе с тем экспрессия KLF-7 усиливает синтез белков cip/kip семейства ингибиторов циклин-зависимых киназ р21waf/cip и p27/cip1 [29] в коре мозга и гиппокампе крысы. Именно эти ингибиторы подавляются в результате влияния MYCC -онкогена [17].
Можно предположить, что ФРН через TrkA рецептор, репрессоры p21waf/cip и KLF-7 будет снижать активность MYCC -онкогена, стимулируя дифференцировку или аутофагию клеток МБ. Вместе с тем отмечено отсутствие зависимости между активацией MYCC -онкогена в МБ и его амплификацией (копийностью), которые реализуются через различные, пока еще не изученные механизмы [31]. Однако, существует мнение, что оценка экспрессии Mycc, Mycn белков in vitro в опухолевых клетках при воздействии химиопрепаратов может служить фактором прогноза их активности в дополнение к определению in vitro химиочувствительности клеток опухоли [32].
Выводы
-
1. Воздействие ФРН снижает на 72,7±17,4% (p<0,05) численность клеток МБ, содержащих 6-, 8- копий MYCN -онкогена и на 63,4±26,6% количества клеток, содержащих 3-, 8-копий MYCC -онкогена, но увеличивает на 78,8±12,7% (p<0,05) численность опухолевых клеток, содержащих 2 (диплоидный) набор копий обоих онкогенов. Этот факт указывает на то, что ФРН снижает количество клеток с аномальным числом копий онкогенов и повышает их численность с нормальным (двойным) набором онкогенов, модулируя численность копий онкогенов в культурах клеток опухоли.
-
2. Констатирована статистически значимая (p<0,0001) отрицательная корреляция (r=–0,65) между средним числом копий MYCC -онкогена в клетках МБ и ИЦ ФРН, воздействующего на них. Это документирует участие MYCC -онкогена в снижении чувствительности опухолевых клеток к ФРН.
Информация об авторе
THE IMPACT OF THE NERVE GROWTH FACTOR ONTHE NUMBER OF MYCC, MYCN ONCOGENE COPIES IN HUMANMEDULLOBLASTOMA CELLS
Federal State Budgetary Institution V. A. Almazov National Medical Research Center of the Ministry of Health of the Russian Federation, Saint Petersburg, Russia
Introduction: The search for new molecular targets for chemotherapy of malignancies, particularly pediatric brain tumors, is a relevant issue of modern oncology. MYC expression and amplification is often observed in brain tumors, which is an unfavorable prognostic factor. Many oncogenic processes are regulated by some growth factors including the nerve growth factor (NGF).
Purpose: To study the changes in the number of MYCC ‑ and MYCN ‑gene copies in MB cells exposed to the NGF.
Material and methods: The impact of the NGF on the number of MYCC ‑, MYCN oncogene copies in the primary human medulloblastoma cell culture was assessed using the method of fluorescence in situ hybridization.
Results: Exposure to the NGF was shown to decrease the number of MB cells containing 6, 8 copies of MYCN oncogenes and 3, 8 copies of MYCC oncogene. The NGF was also shown to increase the number of tumor cells that contain a double set of copies of both oncogenes. There was a statistically significant (p<0.0001) negative correlation (r=–0.65) between the average number of MYCC oncogene copies and the NGF cytotoxicity index.
Conclusion: The increased number of oncogene copies reduces the susceptibility of MB cells to the growth factor.
Список литературы Влияние фактора роста нервов на количество копий онкогенов MYCC, MYCN в клетках медуллобластомы человека
- Crawford J. R., MacDonald T. J., Packer R. J. Medulloblastoma in childhood: new biological advances. Lancet Neurol. 2007. Vol. 6 (12). P. 1073-1085.
- Carlotti C. G. Jr., Smith C., Rutka J. T. The molecular genetics of medulloblastoma: an assessment of new therapeutic targets. Neurosurg. Rev 2008. Vol. 31 (4). P. 359-368.
- Pizer B. L., Clifford S. C. The potential impact of tumour biology on improved clinical practice for medulloblastoma: progress towards biologically driven clinical trials. Br. J. Neurosurg. 2009. Vol. 23 (4). P. 364-375.
- Packer R. J., Cogen P., Vezina G., Rorke L. B. Medulloblastoma: clinical and biologic aspects. Neurooncol. 1999. Vol. 1 (3). P. 232-250.
- Pfister S., Remke M., Benner A. et al. Outcome prediction in pediatric medulloblastoma based on DNA copy-number aberrations of chromosomes 6q and 17q and the MYC and MYCN loci. J. Clin. Oncol. 2009. Vol. 27 (10). P. 1627-1636.
- Lamont J. M., McManamy C. S., Pearson A. D. et al. Combined histopathological and molecular cytogenetic stratification of medulloblastoma patients. Clin. Cancer Res. 2004. Vol. 10 (16). P. 5482-5493.
- Pan E., Pellarin M., Holmes E. et al. Isochromosome 17q is a negative prognostic factor in poor-risk childhood medulloblastoma patients. Clin. Cancer Res. 2005. Vol. 11 (13). P. 4733-4740.
- Lo K. C., Ma C., Bundy B. N. et al. Gain of 1q is a potential univariate negative prognostic marker for survival in medulloblastoma. Clin. Cancer Res. 2007. Vol. 13 (23). P. 7022-7028.
- Friedrich C. von Bueren A. O., von Hoff K. et al. Treatment of adult nonmetastatic medulloblastoma patients according to the paediatric HIT 2000 protocol: a prospective observational multicentre study. Eur. J. Cancer. 2012. Vol. 49 (12). P. 893-903.
- Sandberg A. A., Stone J. F. Medulloblastoma, primitive neuroectodermal tumors, and pineal tumors. The Genetics and Molecular Biology of Neural Tumors Totowa, New York: Humana Press, 2008. Ch. 8. 343-430.
- Kool M., Koster J., Bunt J. et al. Integrated genomics identifies five medulloblastoma subtypes with distinct genetic profiles, pathway signatures and clinicopathological features. PLoS One. 2008. Vol. 3 (8): e3088.
- Rutkowski S., von Bueren A., Hoff K. et al. Prognostic relevance of clinical and biological risk factors in childhood medulloblastoma: results of patients treated in the prospective multicenter trail HIT»91. Clin. Cancer Res. 2007. Vol. 13 (9). P. 2651-2657.
- Monje M., Beachy P. A., Fisher P. G. Hedgehogs, filies, Wnta and mycs: the time has come for many things in medulloblastoma. J. of Clin. Oncol. 2011. Vol. 29 (11). P. 1395-1398.
- Свирновский А. И., Пасюков В. В. Молекулярные основы феномена химио-и радиорезистентности при опухолевых процессах. Мед. новости. 2007. № 11. С. 7-19.
- von Bueren A. O., Oehler C., Shalaby T. et al. c-MYC expression sensitizes medulloblastoma cells to radio-and chemotherapy and has no impact on response in medulloblastoma patients BMC Cancer. 2011. 11: 74.
- Ponzielli R., Katz S., Barsyte-Lovejoy D. et al. Cancer therapeutics: targeting the dark side of myc. Eur. J. Cancer. 2005. Vol. 41 (16). P. 2485-2501.
- Ryan S. L., Schwalbe E. C., Cole M. et al. MYC family amplification and clinical risk-factors interact to predict an extremely poor prognosis in childhood medulloblastoma. Acta Neuropathologica. 2012. Vol. 123 (4). P. 501-513.
- Shalaby T., von Bueren A. O., Hürlimann M. L. et al. Disabling c-MYC in childhood medulloblastoma and atypical teratoid/rhabdoid tumor cells by the potent G-quadruplex interactive agent S2T1-6OTD Mol. Cancer Ther. 2010. Vol. 9 (1). P. 167-179.
- Nakagawara A. Trk receptor tyrosine kinases: a bridge between cancer and neural development. Cancer Lett. 2001. Vol. 169 (2). P. 107-114.
- Tacconelli A., Farina AR., Cappabianca L. et al. TrkA alternative splicing: a regulated tumor-promoting switch in human neuroblastoma. Cancer Cell. 2004. Vol. 6 (4). P. 347-360.
- Божкова В. П. Брежестовский П. Д., Буравлев В. П. и др. Руководство по культивированию нервной ткани. Методы. Техника. Проблемы. Под ред.: Б. П. Вепринцева, И. В. Викторова, Б. Я. Вильнера М.: Наука, 1988. 318 с.
- Калюнов В. Н. Фактор роста нервной ткани. Мн.: Наука и техника, 1984. 216 с.
- Миронов А. Н., Бунатян Н. Н., Васильева А. Н. и др. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. Под ред.: Муляра А. Г., Чиченкова О. Н. М.: Гриф и К, 2012. 944 с.
- Zitterbart K., Filkova H., Tomasikova L. et al. Low-level copy number changes of myc genes have a prognostic impact in medulloblastoma. J. Neurooncol. 2011. Vol. 102 (1). P. 25-33.
- Nakagawara A., Brodeur G. M. Role of neurotrophins and their receptors in human neuroblastomas: a primary culture study. Europ. J. Cancer. 1997. Vol. 33 (12). P. 2050-2053.
- Woo C. W., Lucarelli E., Thiele C. J. NGF activation of TrkA decreases N-myc expression via MAPK path leading to a decrease in neuroblastoma cell number. Oncogene. 2004. Vol. 23 (8). P. 1522-1530.
- Свирновский А. И., Григорович С. А. Плейотропная резистентность опухолевых клеток к терапевтическим воздействиям при В-клеточных лимфопролиферативных заболеваниях. Мед. новости. 2005. № 9. С. 5-16.
- Shimada H., Nakagawa A., Peters J. et al. TrkA expression in peripheral neuroblastic tumors: prognostic significance and biological relevance. Cancer. 2004. Vol. 101 (8). P. 1873-1881.
- Caiazzo M., Colucci-D»Amato L., Esposito M. T. et al. Transcription factor KLF7 regulates differentiation of neuroectodermal and mesodermal cell lineages. Exp. Cell Res. 2010. Vol. 316 (14). P. 2365-2376.
- Li C., Macdonald J. I., Hryciw T. et al. Nerve growth factor activation of the TrkA receptor induces cell death, by macropinocytosis, in medulloblastoma Daoy cells. J. Neurochem. 2010. Vol. 112 (4). P. 882-899.
- Rutkowski S., von Bueren A., von Hoff K. et al. Prognostic relevance of clinical and biological risk factors in childhood medulloblastoma: results of patients treated in the prospective multicenter trail HIT»91. Clin. Cancer Res. 2007. Vol. 13 (9). P. 2651-2657.
- Свирновский А. И. Резистентность опухолевых клеток к терапевтическим воздействиям как медико-биологическая проблема. Мед. новости. 2011. № 2. С. 30-38.


