Влияние факторов риска прогрессирования на результаты лечения больных раком предстательной железы
Автор: Исаргапов Руслан Маликович, Воздвиженский Михаил Олегович, Горбачев Андрей Львович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 т.20, 2021 года.
Бесплатный доступ
Цель исследования - оптимизация лечения больных раком предстательной железы группы высокого риска прогрессирования с помощью количественной оценки факторов риска и метода лечения. Материал и методы. Проведен анализ непосредственных результатов у 107 больных раком предстательной железы iii стадии (pT3a-bN0M0G2-4), проходивших лечение в Самарском областном клиническом онкологическом диспансере в 2010-12 гг. Сформировано 2 группы пациентов в зависимости от метода лечения: хирургическое лечение в монорежиме и с адъювантной лучевой терапией. Все пациенты относились к группе высокого риска прогрессирования по классификации D'Amico. У 64 пациентов выявлен 1 фактор риска, у 37 - 2 фактора риска, у 6 пациентов - 3 фактора риска. Данные подгруппы были анализированы по таким отдаленным показателям, как общая выживаемость, канцер-специфическая выживаемость, безрецидивная выживаемость. Результаты. При наличии одного и двух факторов общая, безрецидивная и канцер-специфическая выживаемости статистически выше, чем в группе пациентов с 3 факторами риска во всей когорте (p
Рак предстательной железы, адъювантная лучевая терапия, безрецидивная выживаемость, канцер-специфическая выживаемость
Короткий адрес: https://sciup.org/140254501
IDR: 140254501 | УДК: 616.65-006.6-08-036.17 | DOI: 10.21294/1814-4861-2021-20-3-48-55
Текст научной статьи Влияние факторов риска прогрессирования на результаты лечения больных раком предстательной железы
Рак предстательной железы (РПЖ) является одним из наиболее распространенных злокачественных новообразований у мужчин во всем мире, занимая второе место после рака легких [1]. В Российской Федерации в структуре онкологической заболеваемости РПЖ также занимает 2-е место, в 2018 г. в РФ выявлено 41 577 случаев впервые в жизни установленных диагнозов рак предстательной железы, из них 1165 относится к Самарской области. Клиническая стадия T3 рака предстательной железы среди всех впервые выявленных случаев в РФ составляет 21,9 %, в Самарской области – 18,6 % [2]. Больные РПЖ с T3 стадией, согласно классификации D’Amico, относится к категории высокого риска прогрессирования. В основе данной классификации, предложенной в 1998 г., лежит распределение пациентов по группам риска прогрессирования с учетом уровня ПСА, показателя по шкале Глисона и Т-стадии. К группе низкого риска прогрессирования относятся пациенты с уровнем ПСА≤10 нг/мл, Глисон <6, клиническая стадия Т1–2а; к группе среднего риска с ПСА 10–20 нг/мл или Глисон 7, клиническая стадия T2b; высокого риска – Глисон ≥8 или ПСА>20 нг/мл, клиническая стадия T2с-3а [3]. В практических рекомендациях по лечению РПЖ Российского общества клинической онкологии к группе высокого риска прогрессирования относятся пациенты с клинической стадией T3–4 или Глисон≥8, или ПСА>20 нг/мл [4]. Эти три прогностических фактора по сравнению с классификацией, основанной только на T-стадии, демонстрируют ценность с точки зрения прогнозирования клинических исходов [5]. Лечение пациентов с высоким риском прогрессирования включает хирургический и лучевой методы [6, 7].
Цель исследования – провести анализ прогностической значимости клинических, морфологических и лабораторных факторов у больных раком предстательной железы высокого риска прогрессирования в зависимости от объема противоопухолевого лечения.
Материал и методы
В ретроспективное исследование включено 107 пациентов с диагнозом рак предстательной железы III стадии (pT3a-bN0M0G2–4), проходивших лечение в Самарском областном клиническом онкологическом диспансере в 2010–12 гг. Всем пациентам проведено обследование, включая КТ органов брюшной полости и малого таза, сцинтиграфию костей скелета с целью исключения метастатического процесса. Сформировано 2 группы пациентов в зависимости от метода лечения – хирургическое лечение в объеме радикальной позадилонной простатэктомии с адъювантной лучевой терапией (АЛТ) и без неё. Таким образом, у всех пациентов, включенных в исследование, идентифицирован как минимум один фактор высокого риска прогрессирования по классификации D’Amico. При разделении относительно количества факторов риска прогрессирования у 64 пациентов выявлен 1 фактор (клиническая стадия T3), у 37 больных – 2, у 6 – 3 фактора риска.
Средний возраст пациентов, получавших хирургическое лечение в монорежиме, – 68,95 (63,30– 72,10) лет, показатель Глисона – 7,00 (6,00–7,00), уровень ПСА – 13,30 (7,00–21,00) нг/мл. В группе хирургического лечения с адъювантной лучевой терапией средний возраст – 64,00 (59,40–68,20) года, показатель Глисона – 7,00 (6,00–7,00), уровень ПСА – 12,20 (7,40–20,80) нг/мл. Значимые различия в сравниваемых группах выявлены по возрасту (p=0,004), но, учитывая тщательный отбор пациентов для хирургического лечения с оценкой сопутствующей патологии, данный параметр не являлся критерием исключения (табл. 1). При оценке отдаленных результатов проведен анализ
Таблица 1/table 1
Характеристика групп хирургического лечения с применением адъювантной лучевой терапией и без неё Characteristics of patient groups with surgery alone and surgery + radiation therapy
|
Параметр/Parameter |
Хирургическое лечение и лучевая терапия/ Surgery + radiation therapy |
Хирургическое лечение/ Surgery |
Значимость различий/ Significant of difference |
|
Возраст (лет)/ Age (years) |
64,00 (59,40–68,20) |
68,95 (63,30–72,10) |
0,004 |
|
Глисон/Glison |
7,00 (6,00–7,00) |
7,00 (6,00–7,00) |
0,752 |
|
ПСА исходный, нг/мл/ Baseline PSA, ng/ml |
12,20 (7,40–20,80) |
13,30 (7,00–21,00) |
0,987 |
Таблица 2/table 2
Показатели 8-летней общей выживаемости the 8-year overall survival
Статистический анализ данных выполняли на персональном компьютере с использованием пакета программ IBM SPSS Statistics 25 (США, лицензия № 5725-А54). Описательные статистики представлены в виде среднего и стандартного отклонения (M ± SD). Использовали критерии
Манна–Уитни–Вилкоксона, χ2 Пирсона. Анализ времени жизни проводили с помощью построения кривых Каплан–Мейера с их сравнением по лог-ранговому тесту и применения многомерного подхода с помощью модели пропорциональных рисков Кокса. Результаты считали статистически значимыми при р<0,05.
Результаты исследования
На первом этапе исследования изучены показатели выживаемости, учитывая количество факторов риска прогрессирования во всей когорте пациентов (n=107). При наличии одного фактора риска прогрессирования 8-летняя общая выживаемость
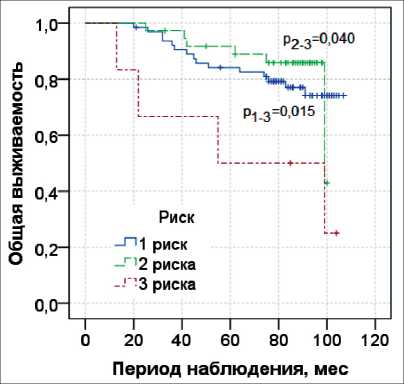
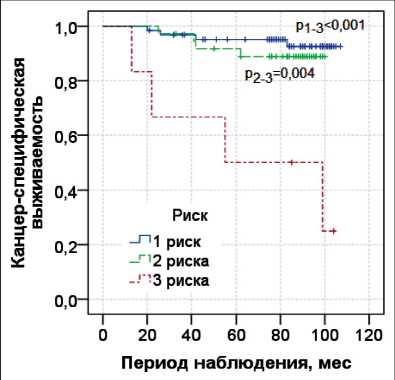
Рис. 2. Показатели 8-летней канцер-специфической выживаемости по Каплану–Мейеру с лог-ранговым тестом относительно количества факторов риска
Fig. 2. The 8-year cancer-specific survival rates according to Kaplan–Meier with a log-rank test relative to the number of risk factors
Рис. 1. Показатели 8-летней общей выживаемости по Каплану–Мейеру с лог-ранговым тестом относительно количества факторов риска
Fig. 1. The 8-year overall survival rates according to Kaplan– Meier with a log-rank test relative to the number of risk factors
составила 0,74 ± 0,06, при наличии 2 факторов – 0,86 ± 0,06, при наличии трех – 0,50 ± 0,20 (табл. 2).
По данным лог-рангового теста при наличии одного и двух факторов риска общая выживаемость статистически выше, чем в группе пациентов с тремя факторами риска (p=0,015 и p=0,040) (рис. 1).
При наличии одного фактора риска прогрессирования 8-летняя канцер-специфическая выживаемость составила 0,93 ± 0,04, при наличии двух факторов – 0,89 ± 0,05, при наличии трех – 0,50 ± 0,20 (табл. 3). По данным лог-рангового теста при наличии одного и двух факторов канцер-специфическая выживаемость статистически выше, чем в группе пациентов с тремя факторами риска (p=0,001 и p=0,004) (рис. 2).
Показатели 8-летней безрецидивной выживаемости при наличии одного фактора риска прогрессирования составили 0,76 ± 0,06, при наличии двух – 0,59 ± 0,09, при наличии трех факторов риска медиана наблюдения достигнута на 2-летнем этапе наблюдения (табл. 4). По данным лог-рангового теста при наличии одного и двух факторов безрецидивная выживаемость значимо выше, чем в группе пациентов с тремя факторами риска (p<0,001 и p<0,001) (рис. 3).
При дальнейшем анализе сравнили различные виды лечения раздельно в группах по 1, 2 или 3 факторам риска. При этом 8-летняя общая выживаемость при хирургическом лечении с АЛТ при наличии одного фактора риска составила 0,79 ± 0,07, двух факторов – 0,92 ± 0,06, трех факторов – 0,67 ± 0,27. При хирургическом лечении в монорежиме данный показатель при наличии 1 фактора риска составил 0,68 ± 0,09, при наличии двух – 0,73 ± 0,13, при наличии 3 факторов – 0,33 ± 0,27. По данным лог-рангового теста при наличии
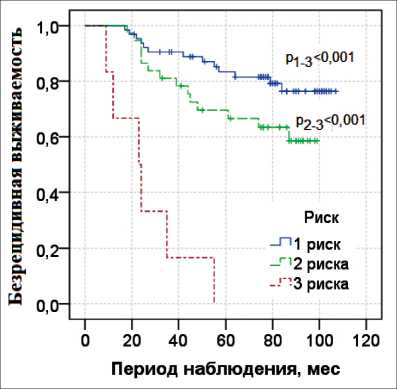
Рис. 3. Показатели 8-летней безрецидивной выживаемости по Каплану–Мейеру с лог-ранговым тестом относительно количества факторов риска
Fig. 3. The 8-year disease-free survival rates according to Kaplan-Meier with a log-rank test relative to the number of risk factors одного, двух и трех факторов риска при сравнении показателей общей выживаемости значимых различий в группах не выявлено (p=0,125, p=0,128 и p=0,302) (рис. 4).
При хирургическом лечении с АЛТ 8-летняя канцер-специфическая выживаемость при наличии
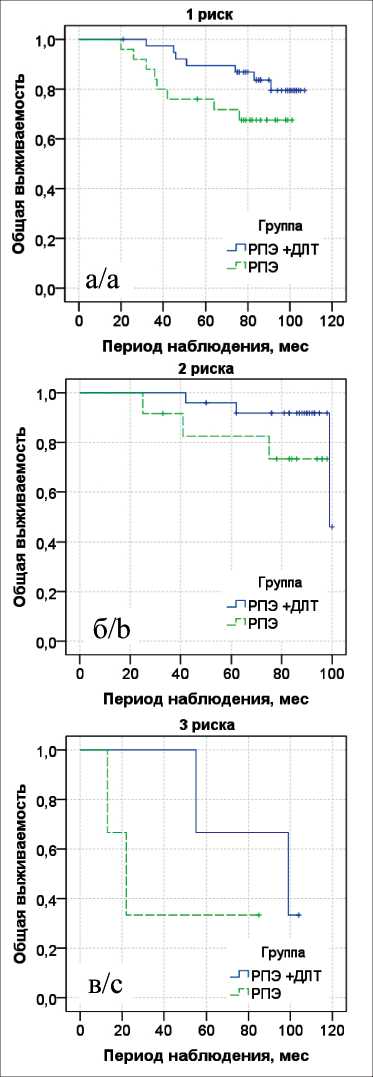
Рис. 4. Показатели 8-летней общей выживаемости по Каплану–Мейеру с лог-ранговым тестом в группах хирургического метода лечения с лучевой терапией (РПЭ + ДЛТ) и без неё (РПЭ): а – 1 фактор риска; б – 2 фактора риска; в – 3 фактора риска
Fig. 4. The 8-year overall survival according to Kaplan-Meier with a log-rank test in the group of patients treated with surgery + radiation therapy and in the group of patients treated with surgery alone: a – 1 risk factor, b – 2 risk factors, c – 3 risk factors одного фактора риска составила 0,96 ± 0,04, двух факторов – 0,92 ± 0,06, трех факторов – 0,67 ± 0,27. При хирургическом лечении – 0,87 ± 0,07; 0,83 ± 0,11 и 0,33 ± 0,27 соответственно. По данным лог-рангового теста при наличии одного, двух и трех факторов риска значимых различий данного показателя в сравниваемых группах не выявлено (p=0,092, p=0,351 и p=0,302) (рис. 5).
При хирургическом лечении с АЛТ 8-летняя безрецидивная выживаемость при наличии одного фактора риска составила 0,76 ± 0,08, двух факторов – 0,72 ± 0,09. При хирургическом лечении – 0,78 ± 0,09 и 0,21 ± 0,17 соответственно. Показатели выживаемости в данных группах достигли медианы наблюдения до наступления 8-го динамического мониторинга. По данным лог-рангового теста при
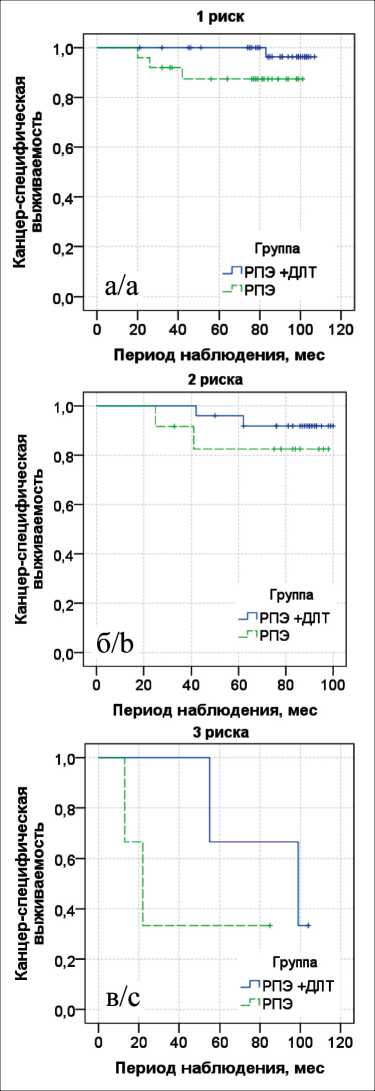
Рис. 5. Показатели 8-летней канцер-специфической выживаемости по Каплану–Мейеру с лог-ранговым тестом в группах хирургического метода лечения с лучевой терапией (РПЭ + ДЛТ) и без неё (РПЭ): а – 1 фактор риска; б – 2 фактора риска, в – 3 фактора риска
Fig. 5. The 8-year cancer-specific survival according to Kaplan-Meier with a log-rank test in the group of patients treated with surgery + radiation therapy and in the group of patients treated with surgery alone: a – 1 risk factor, b – 2 risk factors, c – 3 risk factors
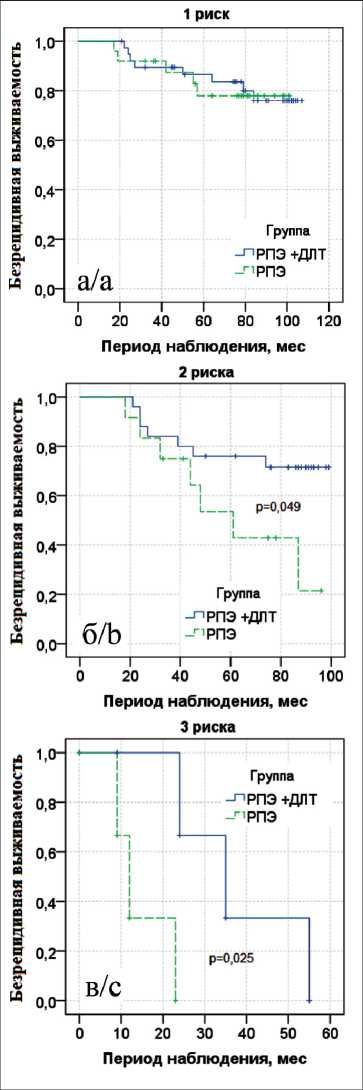
Рис. 6. Показатели 8-летней безрецидивной выживаемости по Каплану–Мейеру с лог-ранговым тестом в группах хирургического метода лечения с лучевой терапией (РПЭ + ДЛТ) и без неё (РПЭ): а – 1 фактор риска; б – 2 фактора риска; в – 3 фактора риска
Fig. 6. The 8-year progression-free survival according to Kaplan– Meier with a log-rank test in the group of patients treated with surgery + radiation therapy and in the group of patients treated with surgery alone: a – 1 risk factor, b – 2 risk factors, c – 3 risk factors
наличии одного фактора риска прогрессирования значимых различий не выявлено (p=0,920). При наличии двух и трех факторов показатели безре-цидивной выживаемости значимо выше в группе хирургического лечения с АЛТ (p=0,049, p=0,025) (рис. 6).
Построение и анализ кривых Каплана–Мейера оказались эффективными для сравнения значимости трех факторов риска прогрессирования заболевания. При дальнейшем разделении пациентов в зависимости от числа рисков сравниваемые группы в зависимости от вида лечения оказались маленькими, что снижало статистическую мощность исследования. Поэтому на следующем этапе исследования был применен многомерный подход с помощью модели пропорциональных рисков Кокса.
Двумя независимыми предикторами были число факторов рисков прогрессирования и вид лечения. При сравнении общей выживаемости относительный риск у пациентов с наличием 2 факторов риска по сравнению с больными с наличием 1 фактора составил 0,77 (95 % ДИ 0,30–2,00; p=0,592), с наличием 3 факторов риска по сравнению с наличием 1 фактора – 3,89 (95 % ДИ 1,28–11,80; p=0,016). Относительный риск при хирургическом лечении с АЛТ по сравнению с радикальной операцией составил 0,39 (95 % ДИ 0,18–0,88; p=0,024). При сравнении канцер-специфической выживаемости относительный риск группы пациентов с наличием 2 факторов риска по сравнению с группой больных с наличием 1 фактора составил 1,98 (95% ДИ 0,49–8,02; p=0,34), с наличием 3 факторов
Таблица 3/table 3
Показатели 8-летней канцер-специфической выживаемости the 8-year cancer-specific survival
|
Количество факторов риска/ Number of risk factors |
Выживаемость/ Survival |
SE (стандартная ошибка)/ SE (Standard error) |
|
1 фактор/1 factor |
0,93 |
0,04 |
|
2 фактора/2 factors |
0,89 |
0,05 |
|
3 фактора/3 factors |
0,50 |
0,20 |
|
8-летняя безрецидивная выживаемость the 8-year disease-free survival |
Таблица 4/table 4 |
|
|
Количество факторов риска/ Number of risk factors |
Выживаемость/ Survival |
SE (стандартная ошибка)/ SE standard error |
|
1 фактор/1 factor |
0,76 |
0,06 |
|
2 фактора/2 factors |
0,59 |
0,09 |
|
3 фактора/3 factors |
0,00 |
0,00 |
Таблица 5/table 5
Многомерный анализ с помощью модели пропорциональных рисков Кокса
Multivariate analysis using the Cox proportional hazards model
|
Параметр/ Parameter |
Переменные в модели/ Variables in the model |
ОР (95% ДИ)/ RR (95% CI) |
р |
|
|
Общая выживаемость/ |
Количество факторов риска/ Number of risk factors |
2 риска vs 1 риск/2 risks vs 1 risk 3 риска vs 1 риск/3 risks vs 1 risk |
0,77 (0,30–2,00) 3,89 (1,28–11,80) |
0,592 0,016 |
|
Вид лечения/Treatment |
Операция + АЛТ vs Операция/ Surgery + radiation therapy vs Surgery alone |
0,39 (0,18–0,88) |
0,024 |
|
|
Канцер-специфическая выживаемость/ Cancer-specific survival |
Количество факторов риска/ Number of risk factors |
2 риска vs 1 риск/ 2 risks vs 1 risk 3 риска vs 1 риск/ 3 risks vs 1 risk |
1,98 (0,49–8,02) 14,07 (3,48–56,84) |
0,340 <0,001 |
|
Вид лечения/ Treatment |
Операция + АЛТ vs Операция/ Surgery + radiation therapy vs Surgery alone |
0,29 (0,09–0,95) |
0,041 |
|
|
Безрецидивная выживаемость/ Disease-free |
Количество факторов риска/ Number of risk factors |
2 риска vs 1 риск/
|
2,25 (1,05–4,81) 20,29 (7,00–58,84) |
0,038 <0,001 |
|
survival |
Вид лечения/ Treatment |
Операция + АЛТ vs Операция/ Surgery + radiation therapy vs Surgery alone |
0,44 (0,22–0,91) |
0,026 |
риска по сравнению с наличием 1 фактора – 14,07 (95 % ДИ 3,48–56,84; p<0,001). Относительный риск для группы хирургического лечения с АЛТ по сравнению с операцией в монорежиме – 0,29 (95 % ДИ 0,09–0,95; p=0,041). При сравнении без-рецидивной выживаемости относительный риск у пациентов с наличием 2 факторов риска и у больных с наличием 1 фактора составил 2,25 (95 % ДИ 1,05-4,81; p=0,038), с наличием 3 факторов риска по сравнению с наличием 1 фактора – 20,29 (95 % ДИ 7,00–58,84; p<0,001). Относительный риск для группы хирургического лечения с АЛТ по сравнению с радикальной операцией – 0,44 (95 % ДИ 0,22–0,91; p=0,026) (табл. 5).
Обсуждение
По данным литературы, ряд исследований посвящен теме результатов лечения РПЖ в зависимости от факторов риска прогрессирования. Учитывая вариабельность определения высокого риска, пациентов с локализованной формой рака простаты также относят к данной группы из-за высокого показателя индекса Глиссона или уровня ПСА. Ряд крупных исследований рассматривает роль определенного единственного фактора в прогнозе ухудшения выживаемости. По данным S. Loeb et al. [8], показатель Глиссона ≥8 рассматривается как ведущий независимый предиктор безрецидивной выживаемости. В исследовании R. Hamada et al. [9] в качестве значимых предикторов биохимического рецидива после хирургическо- го лечения отмечали плотность ПСА ≥0,4 и долю положительных ядер ≥70 % в показателе Глисона. J. Walz et al. [10] cформировали подгруппы, используя 3 фактора риска (≥cT3 стадия, GS≥8, PSA>20 нг/ мл). Они выявили значительную разницу в показателях безрецидивной выживаемости между пациентами с наличием одного и двух факторов риска прогрессирования. Отличием нашего исследования является именно количественная оценка факторов риска. Наличие двух и трех факторов риска являются значимыми предикторами общей, канцер-специфической и безрецидивной выживаемости (p <0,05).
Список литературы Влияние факторов риска прогрессирования на результаты лечения больных раком предстательной железы
- Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018 Nov; 68(6): 394-424. DOI: 10.3322/caac.21492
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М., 2019; 256 c.
- D 'Amico A. V., Whittington R., Malkowicz S.B., Schultz D., Blank K., Broderick G.A., Tomaszewski J.E., Renshaw A.A., Kaplan I., Beard C.J., Wein A. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA. 1998 Sep 16; 280(11): 969-74. 10.1001/ JAMA.280.11.969. DOI: 10.1001/jama.280.11.969
- RosOncoWeb. Практические рекомендации по лечению злокачественных опухолей Российского общества клинической онкологии [Internet]. URL: https://rosoncoweb.ru/standarts/RUSS-CO/2018
- Roach M. 3rd, Weinberg V., Sandler H., Thompson I. Staging for prostate Cancer: time to incorporate pretreatment prostate-specific antigen and Gleason score? Cancer. 2007 Jan 15; 109(2): 213-20. 10.1002/ cncr.22403 DOI: 10.1002/cncr.22403
- Potters L., Klein E.A., Kattan M.W., Reddy C.A., Ciezki J.P., Reuther A.M., Kupelian P.A. Monotherapy for stage T1-T2 prostate cancer: radical prostatectomy, external beam radiotherapy, or permanent seed implantation. Radiother Oncol. 2004 Apr; 71(1): 29-33. 10.1016/j. radonc.2003.12.011. DOI: 10.1016/j.radonc.2003.12.011
- Cooperberg M.R., Cowan J., Broering J.M., Carroll P.R. Highrisk prostate cancer in the United States, 1990-2007. World J Urol. 2008 Jun; 26(3): 211-8. DOI: 10.1007/s00345-008-0250-7
- Loeb S., Schaeffer E.M., Trock B.J., Epstein J.I., Humphreys E.B., Walsh P.C. What are the outcomes of radical prostatectomy for high-risk prostate cancer? Urology. 2010 Sep; 76(3): 710-4. DOI: 10.1016/j.urol-ogy.2009.09.014
- Hamada R., Nakashima J., Ohori M., Ohno Y., Komori O., Yoshioka K., Tachibana M. Preoperative predictive factors and further risk stratification of biochemical recurrence in clinically localized high-risk prostate cancer. Int J Clin Oncol. 2016 Jun; 21(3): 595-600. 10.1007/ s10147-015-0923-3. DOI: 10.1007/s10147-015-0923-3
- Walz J., Joniau S., Chun F.K., Isbarn H., Jeldres C., Yossepowitch O., Chao Yu.H., Klein E.A., Scardino P.T., Reuther A., Poppel H.V., Graefen M., Huland H., Karakiewicz P.I. Pathological results and rates of treatment failure in high-risk prostate cancer patients after radical prostatectomy. BJU Int. 2011 Mar; 107(5): 765-770. DOI: 10.1111/j.1464-410X.2010.09594.x


