Влияние фенилфенола на активность лигнолитеческих ферментов Lentinula edodes W4
Автор: Ильюшин В.А., Плотников Е.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Биологические науки
Статья в выпуске: 3, 2018 года.
Бесплатный доступ
Ксенобиотик фенилфенол - промышленно значимое ароматическое соединение, применяемое в качестве фунгицида при обработке сельскохозяйственной про-дукции. Цель исследования - изучить влияние ксено-биотика фенилфенола на активность комплекса вне-клеточных лигнолитических ферментов Lentinula edodes и способность к биодеградации фенилфенола с помощью этого комплекса. Задачи исследования: изме-рить активность лигнолитических ферментов L. edodes в процессе культивирования при добавлении фенилфенола в различных концентрациях; оценить накопление биомассы L. edodes при добавлении фенил-фенола; установить снижение содержания фенилфено-ла в среде после культивирования. Объектом исследо-вания являлся лигнолитический гриб L. edodes W4. Культивирование проводили глубинным способом. В среду добавляли фенилфенол в концентрациях 0,01; 0,1 и 1 мМ. Изменение активности фенолокисляющих ферментов (лакказы, пероксидазы, марганец-пероксидазы) определяли в культуральной жидкости с помощью спектрофотометра, общую сумму фенольных соединений в среде определяли также спектрофото-метрически, стандартным методом Фолина-Чокальтеу. Показано, что внесение фенилфенола в среду для культивирования в концентрации 0,01 мМ увеличивало активность лакказ на 45 % по сравнению с контролем. Напротив, добавление фенилфенола инги-бировало образование Mn-пероксидаз - активность снижалась в 2,5 раза относительно контроля. Внесение фенилфенола также индуцировало образование перок-сидаз, однако уровень пероксидазной активности оста-вался незначительным. Также установлено, что лигно-литический комплекс ферментов L. edodes способен разрушать фенилфенол при концентрациях фунгицида до 0,1 мM. Полученные результаты позволяют счи-тать, что способность к деградации ксенобиотиков фенольной природы, вызываемой комплексом лигноли-тических ферментов Lentinula edodes, является пер-спективным для дальнейшего изучения.
Лигнолитические ферменты, лакказы, mn-пероксидазы, пероксидазы, фе-нилфенол
Короткий адрес: https://sciup.org/140224397
IDR: 140224397 | УДК: 577.151.54
Текст научной статьи Влияние фенилфенола на активность лигнолитеческих ферментов Lentinula edodes W4
Введение. Ксенобиотик фенилфенол, бифенил-2-ол, является распространенным промышленно значимым ароматическим соединением. Он применяется в качестве фунгицида при обработке сельскохозяйственной продукции как пищевой консервант E231, в деревообрабатывающей и текстильной промышленности, а также как антибактериальный агент в медицине [1, 2]. Широкое использование фенилфенола привело к его накоплению в различных водоемах, включая реки, грунтовые воды, водохранилища питьевого водоснабжения [3]. Проблема осложняется тем, что фенилфенол высоко токсичен для гидробионтов, а традиционные химико-технологические и физико-химические методы утилизации, такие как окисление, захоронение, адсорбция, как правило, дорогостоящи или не всегда эффективны [4, 5].
Значительное количество исследований посвящено использованию бактерий родов Sphingomonas и Pseudomonas для деструкции фенилфенола [3, 4]. Последнее время все больше исследований подтверждает возможность использования ксилотрофных грибов для деградации загрязнителей [6–8]. «Грибы белой гнили» способны осуществлять деструкцию ароматических соединений за счет внеклеточного лигнолитического ферментного комплекса (ВЛФК), который участвует в разложении лигнинового компонента древесины. В частности, показано разложение фенола мицелиальной культурой Lentinus tigrinus [9]. Также установлено, что Trametes versicolor и Pleurotus ostreatus способны разрушать фенилфенол [10].
Lentinula edodes (Berk.) Pegler (шиитаке) – биотехнологически значимый ксилотрофный базидиомицет, который ценится за способность окислять широкий спектр соединений ароматической природы [11]. Большинство экстрацеллюлярных ферментов L. edodes, участвующих в деструкции органических поллютантов фенольной природы, относится к лигнолитической группе. Наиболее значимыми являются Mn-пероксидазы (МnР, КФ 1.11.1.13) и лакказы (Lcc, КФ 1.10.3.2) [12]. Считают, что именно лакказы необходимы для удаления токсичных фенольных компонентов, образующихся при деградации лигнина или ксенобиотиков фенольной природы [7, 13].
Цель исследования : изучение влияния ксенобиотика фенилфенола на активность комплекса внеклеточных лигнолитических ферментов Lentinula edodes и способности к биодеградации фенилфенола с помощью этого комплекса.
Задачи исследования : измерить активность лигно-литических ферментов L. edodes в процессе культивирования при добавлении фенилфенола в различных концентрациях; оценить накопление биомассы L. edodes при добавлении фенилфенола; установить снижение содержания фенилфенола в среде после культивирования.
Объекты и методы исследования. В исследовании использовали лигнолитический гриб Lentinula edodes W4 (ATCC 38221), поддерживаемый в коллекции лаборатории биохимии и молекулярной биологии ТГУ. Ранее нами была подтверждена филогенетическая принадлежность штамма [14]. Гриб поддерживали на твердой среде Чапека-Докса.
Для экспериментов по влиянию фенилфенола на образование ферментов использовали жидкую среду, описанную Тсуджияма с соавторами [15], следующего состава (г/л): пептон – 6; д-глюкоза – 30; KH 2 PO 4 – 0,5; MgSO 4 ·7H 2 O – 0,5; СаCl 2 – 0,1; FeSO 4 ·7H 2 O – 0,01; Na 2 MoO 4 ·2H 2 O – 0,003; MnCl 2 – 0,003; ZnCl 2 – 0,003; CuSO 4 ·5H 2 O – 0,001; Thiamine-HCl – 0,01; рН – 5,0.
Культивирование проводили глубинным способом, для этого инкубирование экспериментальных флаконов проводили при температуре 26 °С, на орбитальном шейкере при 130 об/мин, в темноте, в течение 40 суток. Для экспериментов часть заросшей агаризованной среды (5×5 мм) вносили во флаконы объемом 100 мл с 25 мл среды Тсуджияма. В среду добавляли фенилфенол в концентрациях: 0,01; 0,1 и 1 мМ. В качестве контроля использовалась среда без добавления фенилфенола.
Изменение активности фенолокисляющих ферментов (лакказы, пероксидазы, марганец-пероксидазы) проводили каждые 4-е сутки на протяжении всего эксперимента. Активность ферментов определяли в культуральной жидкости с помощью спектрофотометра (Shimadzu UV-1650pc) по скорости разрушения о-дианизидина при 460 нм (ε460 = 29,400 M-1·cм-1), согласно стандартной методике [16].
Общую сумму фенольных соединений в среде определяли спектрофотометрически, стандартным методом Фолина-Чокальтеу [17], на 7-е, 24-е сутки и в конце эксперимента (40-е сутки). Оптическая плотность оценивали путем измерения поглощения при 750 нм на спектрофотометре (Shimadzu UV-1650pc).
В конце эксперимента определяли количество биомассы путем отделения мицелия от культуральной жидкости и фильтрования. Мицелий высушивали до сухого веса в термостате при 28 °С.
Все эксперименты проводили в пяти повторностях. Стандартное отклонение рассчитывали в Microsoft Excel 2007.
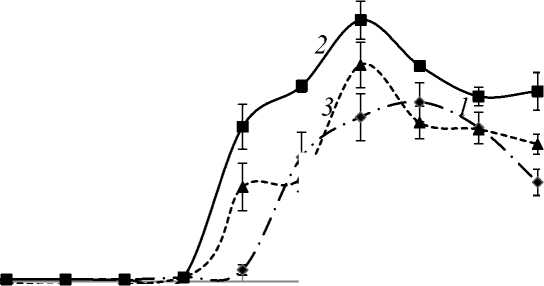
Результаты исследования и их обсуждение. Эксперименты по определению активности лигнолитических ферментов L. edodes показали, что максимум активности лакказ приходится на 28-е сутки, пероксидаз – на 20-е сутки и Mn-пероксидаз – на 36-е сутки. Внесение фенилфенола повышало активность лакказ. Так, фенилфенол в концентрации 0.01 мM увеличивал активность лакказ на 45 % (58,6 ед/мл) по сравнению с контролем, а в концентрации 0,1 мM увеличивал активность лакказ на 21,5 % (рис. 1, а). При внесении фенилфенола в концентрации 1 мM рост гриба и активность ферментов отсутствовали.
Внесение фенилфенола также повышало активность пероксидаз, однако уровень пероксидазной активности оставался незначительным и не превышал 7 ед/мл (рис 1, б). По сравнению с контролем фенилфенол в концентрации 0,01 мM увеличивал активность пероксидаз в 5,8 раз. Напротив, добавление фенилфенола (0,01 мM) ингибировало активность Mn-пероксидаз в 2,5 раза (рис. 1, в).
ед/мл 70
а
0»
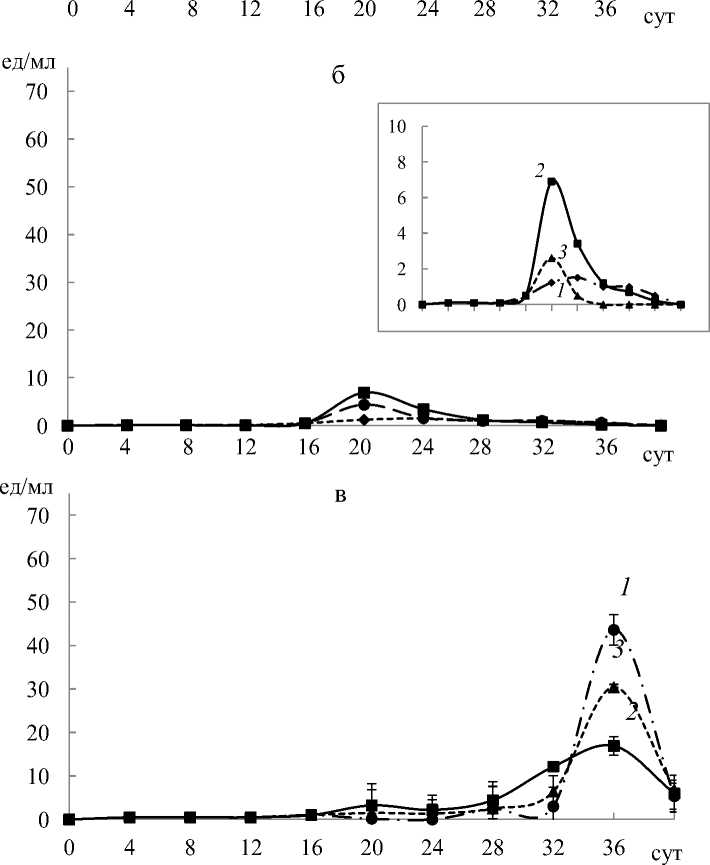
Рис. 1. Динамика активности лигнолитических ферментов при различных концентрациях фенилфенола:
1 – контроль без фенилфенола; 2 – 0,01 мM; 3 – 0,1 мM; а – лакказы; б – пероксидазы (на отдельной панели показана активность пероксидаз в увеличенном масштабе оси Y); в – Mn-пероксидазы, при концентрации 1 мM активности ферментов не наблюдали (на графиках не показана)
Полученные результаты по действию фенилфенола согласуются с данными о том, что многие ароматические, в том числе и фенольные соединения, стимулируют активность лигнолитических ферментов L. edodes [7, 18]. Так, ранее было показано, что полифенолы, гваякол, 2,4-дихлорфенол, пирокатехин, 3,4-диметоксибензиловый спирт повышали активность лакказ и пероксидаз [17].
Следует отметить, что активность пероксидаз в экспериментах была незначительна по сравнению с лакказами, образующимися ранее. Аналогичная последовательность образования ферментов была обнаружена при культивировании мицелия Lentinus tigrinus при добавлении фенола в жидкую среду [9]. Авторы связывают это с окислением фенольных субстратов в соответствующие феноксирадикалы лакказами. При этом полимеризация радикалов приводит к удалению низкомолекулярных (более токсичных) соединений из среды. По мнению авторов, первоначальное преобладание лакказ связано с их ролью в снижении фенольного барьера для гриба путем образования полимерных продуктов.
После пика активности лакказ основными лигнолити-ческими ферментами были Mn-пероксидазы. Наимень- шую активность Mn-пероксидаз наблюдали при добавлении фенилфенола в концентрации 0,01 мM, в этом же случае наблюдали и максимальную активность лакказ. Полученные результаты подтверждают гипотезу о наличии отрицательной обратной связи между активностью лакказ и Mn-пероксидаз [19]. Танесака с соавторами показал, что при внесении ионов меди Cu2+ (2 мM CuSO4·5H2O) при культивировании L. edodes происходит увеличение активности лакказ. При этом активность Mn-пероксидаз снижается. Аналогично, ингибирование активности лакказ происходило при повышении активности Mn-пероксидаз природными активаторами, полученными горячей экстрактакцией древесных опилок Castanopsis cuspidata (экстракцию проводили в автоклаве при 121 °С, давлении 101 325 Па) [19].
В ходе исследования было выявлено, что добавление фенилфенола в среду для культивирования в концентрации до 0,01 мM не вызывало снижения образования биомассы гриба L. edodes W4, внесение 1 мM полностью ингибировало образование биомассы (рис. 2).
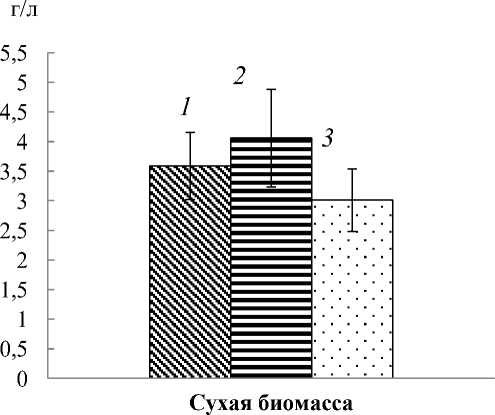
Рис. 2. Сухая биомасса мицелия L. edodes, полученная на жидкой среде в присутствии различных концентраций фенилфенола: 1 – контроль без фенилфенола; 2 – 0,01 мM;
3 – 0,1 мM; при концентрации 1 мM биомасса не образовывалась (на диаграмме не показана)
В ходе эксперимента наблюдали уменьшение концентрации фенольных соединений в питательной среде (рис. 3). Концентрация фенольных соединений в контроле практически не изменялась на протяжении всего эксперимента и составляла величину, близкую к 68 мкг/мл. При внесении фенилфенола в концентрации 0,01 мM происходило его практически полное окисление (т. е. снижение содержания фенилфенола достигало 100 %). Вероятно, что лиг-нолитический комплекс ферментов L. edodes способен разрушать фенилфенол. Лигнолитический комплекс ферментов L. edodes также способен разрушать фенилфенол при концентрациях фунгицида 0,1 мM, однако в этом случае снижение составляло 75 %.
В литературе нами были обнаружены единичные сообщения о способности к деструкции фенилфенола комплексом лигнинолитических ферментов грибов белой гнили [10]. При культивировании Trametes versicolor в жидкой среде происходило разрушение фенилфенола в концентрациях, близких к использованным нами в экспериментах с L. edodes W4. Для Pleurotus ostreatus предельная концентрация фунгицида была ниже в два раза и составляла около 0,05 мM. Другой представитель грибов белой гнили, Phanerochaete chrysosporium, оказался практически неспособным к деструкции фенилфенола.
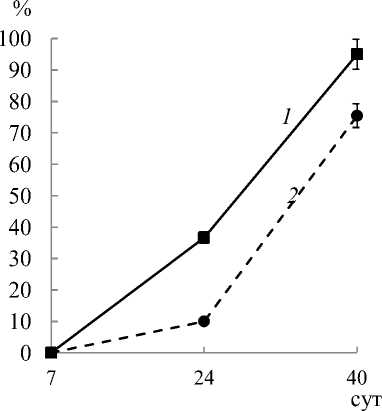
Рис. 3. Снижение суммы фенольных соединений в жидкой среде в присутствии различных концентраций фенилфенола (% к контролю без фенилфенола): 1 – 0,01 мM; 2 – 0,1 мM. В контроле и при концентрации 1 мM снижение суммы фенольных соединений не наблюдалось (на графике не показана)
Выводы . Таким образом, было проведено исследование влияния ксенобиотика фенилфенола на активность лигнолитического комплекса ферментов Lentinula edodes W4 и способности к биодеградации фенилфенола этим комплексом. Показано, что фенилфенол в концентрации 0,01 мM увеличивал продукцию лакказ, при этом уровень Mn-пероксидаз падал.
Установлено, что лигнолитический комплекс ферментов L. edodes способен разрушать фенилфенол при концентрациях фунгицида 0,1 мM. Полученные результаты позволяют считать, что способность к деградации ксенобиотиков фенольной природы комплексом лигнолитиче-ских ферментов Lentinula edodes является перспективным для дальнейшего изучения.
Список литературы Влияние фенилфенола на активность лигнолитеческих ферментов Lentinula edodes W4
- Nde С.W., Jang H.-J., Toghrol F., Bentley W.E. Toxicogenomic response of Pseudomonas aeruginosa to ortho-phenylphenol//BMC Genomics. -2008. -Vol. 9. -P. 473-491.
- Bomhard E.M., Brendler-Schwaab S.Y., Freyberger A., Herbold B.A., Leser K.H., Richter M. O-Phenylphenol and its Sodium and Potassium Salts: A Toxicological As-sessment//Critical Reviews in Toxicology. -2002. -Vol. 32 (6). -P. 551-626.
- Perruchon С., Patsioura V., Vasileiadis S., Karpouzas D. Isolation and characterisation of a Sphingomonas strain able to degrade the fungicide ortho-phenylphenol//Pest Management Science. -2016. -Vol. 72 (1). -P. 113-124.
- Bratkovskaya I., Ivanec R., Kulys J. Mediator Assisted Laccase Catalyzed Oxidation of 4 Hydroxybiphenyl//Biokhimiya. -2006. -Vol. 71 (5). -P. 681-686.
- Фазылова Г.Ф., Валинурова Э.Р., Хатмуллина Р.М. и др. Сорбционные параметры производных фенолов на различных углеродных материалах//Сорбционные и хроматографические процессы. -2013. -Т. 13. -№ 5. -С. 728-735.
- Asgher M., Bhatti H.N., Ashraf M., Legge R.L. Recent developments in biodegradation of industrial pollutants by white rot fungi and their enzyme system//Biodegra-dation. -2008. -Vol. 19. -P. 771-783.
- Piscitelli A., Giardina P., Lettera V., Pezzella C., Sannia G., Faraco V. Induction and Transcriptional Regulation of Laccases in Fungi//Current Genomics. -2011. -Vol. 12. -№ 2. -P. 104-112.
- Величко Н.А., Берикашвили З.Н. Активности окисли-тельных и целлюлолитических ферментов гриба Pleurotus astreatus//Вестн. КрасГАУ. -2008. -№ 6. -С. 320-322.
- Кадималиев Д.А., Ревин В.В., Атыкян Н.А. и др. Участие лакказы и пероксидазы гриба Lentinus (Panus) tigrinus в биодеградации высоких концентраций фенола в жидких средах//Прикладная биохимия и микробиология. -2011. -Т. 47. -№ 1. -С. 73-78.
- Karas A.P., Perruchon С., Exarhou K., Ehaliotis C., Karpouzas D. Potential for bioremediation of agro-industrial effluents with high loads of pesticides by select-ed fungi//Biodegradation. -2011. -Vol. 22. -№ 1. -P. 215-228.
- Nagai M., Sato T., Watanabe H., Saito K., Kawata M., Enei H. Purification and characterization of an extracellu-lar laccase from the edible mushroom Lentinula edodes, and decolorization of chemically different dyes//Appl. Microbiol. Biotechnol. -2002. -Vol. 60. -№ 3. -P. 327-335.
- Wong D.W.S. Structure and Action Mechanism of Ligninolytic Enzymes//Applied Biochemistry and Biotechnology. -2009. -Vol. 157. -№ 2. -P. 174-209.
- Позднякова Н.Н., Никифорова С.В., Макаров О.Е. и др. Влияние полициклических ароматических углеводородов на продукцию лакказы грибом белой гни-ли Pleurotus ostreatus D1//Прикладная биохимия и микробиология. -2011. -Т. 47. -№ 5. -С. 595-601.
- Glukhova L.B., Sokolyanskaya L.O., Plotnikov E.V., Gerasimchuk A.L., Karnachuk O.V., Solioz M., Karnachuk R.A. Increased mycelial biomass production by Lentinula edodes intermittently illuminated by green light emitting di-odes//Biotechnol. Lett. -2014. -Vol. 36. -№ 11. -P. 2283-2289.
- Tsujiyama S., Muraoka T., Takada N. Biodegradation of 2,4-dichlorophenol by shiitake mushroom (Lentinula edodes) using vanillin as an activator//Biotechnol. Lett. -2013. -Vol. 35. -№ 7. -P. 1079-1083.
- Saeki N., Takeda H., Tanesaka E., Yoshida M. Induction of manganese peroxidase and laccase by Lentinula edodes under liquid culture conditions and their isozyme detection by enzymatic staining on native-PAGE//Mycoscience. -2011. -Vol. 52. -№ 132. -P. 132-136.
- Blainski А., Lopes G.C., Mello C.P. Application and Analysis of the Folin Ciocalteu Method for the Determi-nation of the Total Phenolic Content from Limonium Brasiliense L.//Molecules. -2013. -Vol. 18. -№ 6. -P. 6852-6865.
- Plotnikov E.V., Glukhova L.B., Sokolyanskaya L.O., Karnachuk O.V., Solioz M. Effect of Tree Species on Enzyme Secretion by the Shiitake Medicinal Mushroom, Lentinus edodes (Agaricomycetes)//International Jour-nal of Medicinal Mushrooms. -2016. -Vol. 18. -№ 7. -P. 637-644.
- Tanesaka E., Saeki N., Kochi A., Yoshida M. Enzymatic Staining for Detection of Phenol-Oxidizing Isozymes In-volved in Lignin-Degradation by Lentinula edodes on Native-PAGE//Gel electrophoresis -Advanced tech-niques. InTech. -2012. -Р. 393-412.


