Влияние фотонов ближней ультрафиолетовой области на рост и развитие свеклы сахарной (Beta vulgaris L. ssp. vulgaris var. saccharifera Alef.) в условиях закрытой агробиотехносистемы
Автор: Латушкин В.В., Зеленков В.Н., Кособрюхов А.А., Новиков В.Б., Путилина Л.Н., Иванова М.И., Верник П.А., Гаврилов С.В.
Журнал: Овощи России @vegetables
Рубрика: Селекция, семеноводство и биотехнология растений
Статья в выпуске: 4 (72), 2023 года.
Бесплатный доступ
Актуальность и методология. С целью определения влияния ближнего ультрафиолетового излучения длиной волны 380 нм на рост и развитие растения свеклы сахарной гибрида Смена выращивали в течение 82 суток при светодиодном освещении фотолампами и в условиях усиления интенсивности УФА диапазона света (повышение отношения UV/PPFD (0,027) по сравнению с контролем (0,0075) при сохранении соотношения остальных участков спектра). Исследование проводили на базе цифрового программного комплекса «Синерготрон» с регулируемой внутренней средой. Результаты. Увеличение доли УФ-А в спектре освещения приводит к существенному изменению биометрических показателей растений - надземная биомасса увеличивается в 2,2 раза по сравнению с контролем, а масса подземной части (корнеплоды), наоборот, снижается на 86,9%. При этом доля корнеплодов в общей биомассе растений снижается с 60% в контроле до 30%. Изменяется морфологическая структура листового аппарата: существенно возрастает доля черешков по сравнению с листовыми пластинками (64,8% черешков в надземной биомассе, тогда как в контроле 30%). УФ-А излучение приводит к изменению химического состава корнеплодов, в частности, понижению накопления сухих веществ (на 1,58%) и снижению сахаристости (на 1,8%). Повышение доли УФ-А в спектре облучения изменяет параметры флуоресценции хлорофилла и способствует повышению максимального квантового выхода Fv/Fm, нефотосинтетического тушения флуоресценции NPQ и снижению реального квантового выхода фотосинтеза Y(II), а также скорости электронного транспорта (ETR).
Синерготрон, закрытая агробиотехносистема, свекла сахарная, ближнее ультрафиолетовое излучение, спектральный состав, флуоресценция хлорофилла, биометрические показатели
Короткий адрес: https://sciup.org/140301895
IDR: 140301895 | УДК: 633.63:581.1.043 | DOI: 10.18619/2072-9146-2023-4-49-57
Текст научной статьи Влияние фотонов ближней ультрафиолетовой области на рост и развитие свеклы сахарной (Beta vulgaris L. ssp. vulgaris var. saccharifera Alef.) в условиях закрытой агробиотехносистемы
Оригинальные статьи / Originalarticles
Свет является одним из основных факторов жизни растений, источником энергии для фото- синтеза, оказывает регуляторную роль в морфогенезе растений [1]. С точки зрения сельскохозяйственного производителя свет также наиболее важный фактор, определяющий урожайность и качество продукции в теплицах и других сооружениях защищенного грунта [2]. В этой связи проводятся многочисленные исследования по изучению влияния искусственного освещения на рост и развитие растений [3]. Различные длины волн света оказывают различное воздействие на рост и развитие растений [4,5].
Ультрафиолетовый спектр условно включает УФ-А область (315-400 нм), УФ-Б (280-315 нм) и УФ-С (100280 нм), действие которых на живые организмы сильно различаются. В диапазоне 180-200 нм УФ-облучение вызывает распад белков и нуклеиновых кислот, их фотоокисление,образование перекисей и перекисных соединений. В диапазоне 250-280 нм оно приводит к реакциям гидратации и димеризации. УФ-излучение в диапазоне 330-340 нм не имеет ярко выраженного радикального действия на нуклеиновые кислоты, однако совместно с различного рода интеркаляторами способно вызвать однонитевые и двунитевые разрывы в молекулах ДНК. Механизмы устойчивости к стрессовому воздействия УФ-излучения имеют генетическую обусловленность. Было показано, что гены, активизированные УФ-Б и УФ-С излучением, отличаются от генов, активизированных УФ-А излучением [6,7].
Одним из основных эффектов повышенного уровня УФ-радиации является снижение общей биомассы и урожайности сельскохозяйственных культур, снижение интенсивности фотосинтеза, в частности, снижается транспорт электронов в циклах фотосинтеза, ингибируются фотохимические реакции на предварительных стадиях фотосинтеза и др. [8].
Ослабление фотосинтеза часто сопровождает изменения пигментации листовой пластинки, анатомии и толщины листа [6,9]. Происходят также существенные изменения на биохимическом уровне [10,11].
Ближняя область УФ-А составляет до 98,7% ультрафиолетового излучения, достигающего поверхности земли, однако было проведено недостаточно исследований физиологических и биохимических реакций растений на УФ-А излучение [12]. Нейгард и Шрейнер (2018) указали, что реакция растений на облучение УФА может отличаться от УФ-Б и необходим индивидуальный подход к оценке эффектов [13]. Ряд данных свидетельствует о положительной роли УФ-А для роста, развития растений и повышения качества выращенной продукции. УФ-А повышает концентрацию хлорофилла и каротиноидов, увеличивает размер листьев, длину стебля, свежую и сухую массу, а также способствует накоплению биомассы в салате [14]. В работе М.С. Гинс и Н.Т. Гамбурова установлена положительная роль УФ-А излучения в повышении антиоксидантных свойств амаранта [15]. Установлено также, что УФ-А уменьшает развитие возбудителей ряда заболеваний, в частности, плесени плодов цитрусовых ( Penicillium italicum и P. digitatum ), а также индуцирует синтез ряда защитных биологически активных соединений, таких, как скопа-рон, нобилетин, гесперидин, танжеретин [16,17].
В то же время отмечены и отрицательные эффекты УФ-А излучения. Так, УФ-А воздействие ограничивало расширение площади листьев и препятствовало накоплению биомассы сои [13]. Облучение УФ-А растений салата также снижало площадь листьев и биомассу, но увеличивало содержание хлорофилла, растворимого протеина, сахаров, витамина С, ряда флавоноидов и увеличивало антиоксидантную активность [18,19]. В исследовании [21] также установлено значительное влияние УФ-А диапазона на химический состав микрозелени капустных культур (по многим культурам возрастало содержание полифенолов, аскорбиновой кислоты, антоцианов, бета-каротина и др. в большинстве случаев), в то же время часто отмечалось снижение высоты растений, сырой и сухой биомассы, площади листьев, накопление токоферолов и др. [21]. Авторы считают обязательным введение небольшого количества УФ-А в практику искусственного освещения растений для регуляции морфогенеза и минерального питания растений.
В ряде исследований изучено влияние УФ излучение на прорастание семян растений и отмечены как положительные, так и отрицательные эффекты УФ [22,23].
Таким образом, исследования по изучению УФ-А области спектра продолжают активно проводиться, так как многие вопросы остаются недостаточно изученными. В частности, практически нет исследований по корнеплодным культурам. Поэтому целью данного исследования явилось изучить реакцию роста растений Beta vulgaris L. ssp . vulgaris var. saccharifera Alef . на изменение спектрального состава света, а именно, увеличение доли ультрафиолета А с длиной волны 380 нм.
Материалы и методы исследований
Объект и условия выращивания растений
В качестве объекта исследований использовали растения сахарной свеклы ( Beta vulgaris L. ssp. vulgaris var. saccharifera Alef.) гибрида Смена. Эксперименты проводили в закрытой камере устройства «синерго-трон» модели ИСР 2.01 конструкции АНО «Институт стратегий развития» (г. Москва) [24,25]. Использовали облучение растений свеклы сахарной светом разного состава: полихромное (контроль) и полихромное с увеличенной долей в ближнем ультрафиолетовом диапазоне. Растения выращивали при 18-часовом фотопериоде, при температуре воздуха 25оС днем и 22оС ночью, относительная влажность воздуха составляла 70-80%. Спектральный состав при облучении светодиодными светильниками определяли на спектрометре PG 100 N компании UPRtek, Тайвань. Растения выращивали гидропонным методом на минераловатном субстрате. В лотках размером 1000*540 мм помещалось по 28 растений. В онтогенезе, по срокам определения, отбирали по 4 растения из каждого варианта.
Закрытая камера с искусственным микроклиматом
Синерготрон представляет собой устройство для выращивания растений на основе программно-управляемой внутренней среды, облачной обработки информации и разработанного языка описания с обратной связью по параметрам влажности, состава культивационных сред, температуры, освещения, акустических воздействий, газового состава, движения воздуха и других. Функция облучения реализована светодиодными светильниками, разработанными ЗАО «Золотой шар» (Москва, Россия) с использованием светодиодов компании Cree (США) с максимумом излучения в области от 365 до 1980 нм, т.е. от ультрафиолетового до инфракрасного излучения. Потребляемая единичная мощность от 300 до 1300 Вт. Мощность облучения в области ФАР на расстоянии 100 мм от светильников для 300-ваттного облучателя достигает 1900 мкмоль/м2·с, для 1300-ваттного – 3600 Мкмоль/м2·с. Светильники имеют программное управление 9-ю спектральными линейками, как по силе излучения определенного светового спектра, так и по их комбинированию в определённую световую гамму. В устройстве реализована возможность проведения испытаний индивидуально по 8 лоткам в рабочей секции с различной интенсивностью облучения, спектром, пульсацией.
В настоящем эксперименте, в соответствии с целью и задачами исследований, светильники запрограммированы на светодиодное облучение растений свеклы светом разного состава: полихромное (контроль) и полихромное с увеличенной долей в ближнем ультрафиолетовом диапазоне.
В экспериментах использовали комбинированный субстрат: минераловатные маты толщиной 70 мм, однако в точках посева семян вырезали отверстия диаметром 70 мм и глубиной 60 мм и заполняли подготовленным кокосовым субстратом. Посев проводили по 3 соплодия в гнездо, после появления всходов оставляли одно наиболее развитое растение. Схема посева 135мм*150мм. Полив проводили гидропонным питательным раствором следующего состава (в мг/л): N-NО 3 – 140; N-NН 4 – 5; P – 41; K – 275; Ca – 100; Mg – 24; S – 30; Fe – 0,94; Mn – 0,14; B – 0,16; Cu – 0,03; Zn – 0,13; Mo – 0,03; рН 5,5-6,0; ЕС 1,5-2.
Анализы сахаристости и накопления сухого вещества
Определение сахаристости корнеплодов проводилось во ВНИИ сахарной свеклы и сахара им. А.Л. Мазлумова способом холодного водного диспергирования в соответствии с «Инструкцией по химико-техническому контролю и учету сахарного производства»
(Киев, ВНИИСП, 1989) и ГОСТ Р 53036-2008 «Свекла сахарная. Методы испытаний». Определение проводили у растений в возрасте 82 дней от посева семян, т.е. при завершении эксперимента. Одновременно определяли содержание сухого вещества в корнеплодах по стандартной методике.
Определение динамики роста растений
В период проведения эксперимента в динамике (на 41,50,56,63,70,77 и 82 день после посева семян) проводили измерение площади листьев, высоты и биомассы растений, определяли долю массы надземной части (листьев) и подземной (корнеплоды).
Измерение параметров переменной флуоресценции.
С помощью метода переменной флуоресценции, с использованием прибора мини-ПАМ-Junior (PAM-Jnior, Heinz Walz, Germany), определяли активность фотосистемы 2 (ФС2). Листья растений экспонировали в темноте в течение 15 мин., затем освещали их вспышками света [9].
Определяли: F v /F m – показатель функционального состояния ФС2, где F v – фотоиндуцированные изменения флуоресценции; F m – максимальная флуоресценция, Y(II) - эффективный квантовый выход ФС 2 (при интенсивности измерения флуоресценции); NPQ -нефотохимическое тушение флуоресценции (NPQ), оценивает часть энергии, которая используется растением для нефотохимических реакций; ЕТR - относительная скорость транспорта электронов, косвенный показатель скорости фотосинтеза.
Статистическая обработка результатов опытов
Эксперименты выполняли в 4-кратной аналитической и 3-кратной биологической повторности. Общая закономерность не изменялась по вариантам опыта, поэтому результаты приведены по данным одной биологической повторности. Статистическую обработку результатов проводили с помощью пакета программ Exсel. На рисунках приведены средние арифметические значения ( M ) со стандартной ошибкой (±SEM). Достоверность различий определяли по t -критерию Стьюдента при P = 0,95.
Результаты исследований
На рисунке 1 приведены спектральные характеристики светодиодных облучателей при выращивании растений в камерах синерготрона.
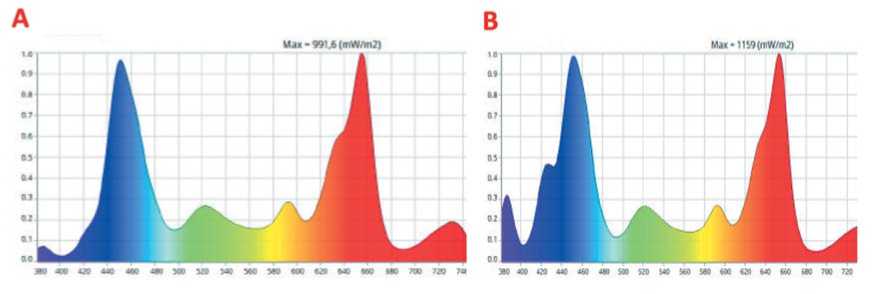
Рис.1. Спектральные характеристики светодиодных облучателей при выращивании растений в камерах синерготрона
Fig.1. Spectralcharacteristics ofLED irradiators when growing plants in synergotron chambers
Таблица 1. Анализ световых режимов выращивания сахарной свеклы (данные спектров) в камере синерготрона ИСР 2.01 Table 1. Analysis of light modes of sugar beet cultivation (spectra data) in the IPS 2.01Synergotron Camera
|
Вариант |
Интенсивность освещения по видам спектра, мкМоль/м2·с и соотношение спектров |
||||||
|
PPFD* |
PFD* |
UV |
Red |
Far red |
UV/PPFD |
FR/ Red |
|
|
Контроль |
454,4 |
503,1 |
3,4 |
212,3 |
45,9 |
0,0075 |
0,216 |
|
Опыт (УФ) |
536,6 |
600,2 |
14,5 |
236,5 |
47,9 |
0,027 |
0,202 |
|
Вариант |
Blue |
Green |
Red |
B/R |
B /G +R |
G/R |
G/B+R |
|
Контроль |
147 |
96,8 |
212,3 |
0,62 |
0,48 |
0,46 |
0,28 |
|
Опыт (УФ) |
194,3 |
107,7 |
236,5 |
0,82 |
0,56 |
0,22 |
0,25 |
* UV ультрафиолет, Blue –синий, Green – зеленый, Red – красный, Far red – дальний красный, PPFD – фотосинтетически активная радиация, PFD радиация, включает ультрафиолет + дальний красный + фотосинтетически активная радиация.
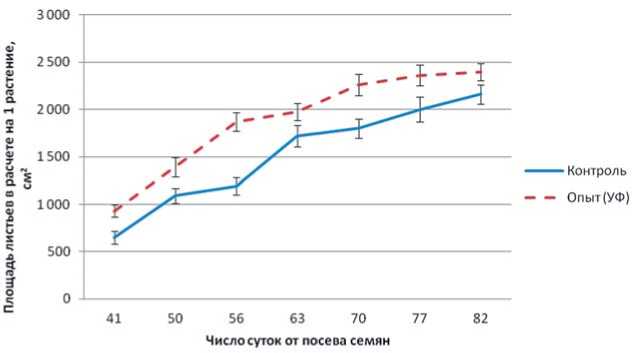
Рис.2.Динамика развития листового аппарата сахарной свеклы в зависимости от доли ультрафиолетового света в спектре освещения Fig.2.Dynamics ofthe developmentofsugar beetleafapparatus depending on the share ofUV lightrange in the spectrum oflight
вано многократное повышение отношения UV/PPFD (0,027) по сравнению с контролем (0,0075). При этом интенсивности облучения в других областях спектра (синем, зеленом, красном) были близки по вариантам, что позволяет получать сопоставимые данные и выделить влияние именно УФ - А диапазона (Таблица 1).
Изменение соотношения UV/PPFD в спектре облучения растений приводило к изменению морфологических показателей растений с течением времени. Анализ динамики развития листового аппарата растений свеклы сахарной, выращиваемой в замкнутой агробиотехносистеме, показал, что площадь листьев при освещении светом с усиленной долей УФ-А выше, чем в контрольном варианте на протяжении всего периода выращивания (рис. 2). В конце эксперимента нарас
В опытном варианте (Рис. 1В) интенсивность света в ближней ультрафиолетовой области (УФ – A, 380 нм) составляла 14,5 мкмоль/м2·с, в контроле – 3,4 мкмоль/м2·с (Рис. 1А). Интенсивность облучения по всем спектральным линиям в опыте и контроле сопоставима и составляла в контроле 454,4, в опыте 536,6 мкмоль/м2с. В результате в опытном варианте реализо- тание листовой массы в опытном и контрольном вариантах замедлилось за счет оттока ассимилянтов в корнеплоды и частичного отмирания нижних листьев.
В то же время удельная масса листовой пластинки практически не отличалась по сравнению с контролем при росте доли УФ-А света в спектре облучения (табл. 2).
Таблица 2. Удельная масса листовой пластинки свеклы сахарной в зависимости от режимов освещения, г/см2 Table 2. The specific mass of the leaf blade depending on the lighting modes, g/cm2
|
Вариант |
Сутки после посева семян |
|||||
|
50 |
56 |
63 |
70 |
77 |
82 |
|
|
Контроль – полихромное освещение |
0,0500 |
0,0592 |
0,0607 |
0,0611 |
0,0669 |
0,0671 |
|
Опыт (УФ) |
0,0500 |
0,0518 |
0,0540 |
0,0582 |
0,0591 |
0,0612 |
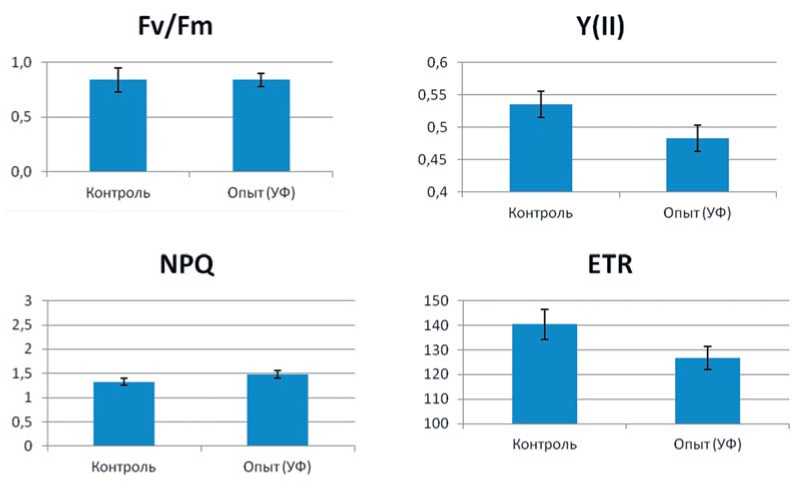
Наряду с изменениями площади листовой поверхности можно было ожидать, что растения в условиях различного спектрального состава облучения формируют фотосинтетический аппарат, различающийся по своей активности. Определение активности световой стадии фотосинтеза показало, что повышение доли ультрафиолета А в спектре облучения приводит к изменению параметров флуоресценции хлорофилла и фотосинтеза. Происходит повышение нефотосинтетического тушения флуоресценции NPQ. В то же время снижаются реальный квантовый выход фотосинтеза Y(II) и скорость электронного транспорта (ETR), изменение максимального квантового выхода Fv/Fm статистически недостоверно (Рис. 3).
При увеличении доли УФ-А света биомасса надземной части в начальный период проведения эксперимента (41-50 суток от посева семян) несколько превышала контрольный вариант (рис. 4). В дальнейшем разница между вариантами резко увеличивалась, и к концу эксперимента биомасса в опытном варианте в 2,2 раза превышала контроль. Очевидно, ближнее УФ-облучение стимулирует рост надземной части растений свеклы сахарной.
Отметим, что количество листьев в расчете на 1 растение в контроле и опытном варианте практически не отличалось. В тоже время воздействие УФ-А облучения приводило к увеличению и площади листьев, и их биомассы. Следовательно, рост листового аппарата мог происходить либо за счет увеличения размеров каждого отдельного листа, либо за счет увеличения удельной массы. Однако, согласно данным таблицы 2, удельная масса листовой пластинки в опытном и контрольном вариантах различалась незначительно. Кроме того, рост биомассы в относительных величинах выражен значительно сильнее, чем увеличе-
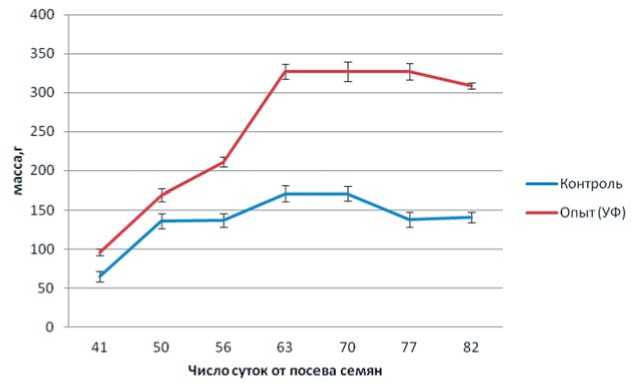
Рис.4.Динамика накопления надземной биомассы растений сахарной свеклы в зависимости от освещения Fig.4. Dynamics ofaccumulation ofabove-ground biomass ofsugar beetplants depending on the lighting
ние площади листьев в расчете на 1 растение. Рассматривалось предположение, что причина может заключаться в изменении соотношения частей листового аппарата с различающимися биометрическими показателями - листовой пластинки и черешка. Поэтому в эксперименте проводили измерение доли листовой пластинки и черешков в общей величине надземной массы. Установлена закономерность значительного роста доли черешков по сравнению с долей листовой пластинки в общей надземной биомассе (рис. 5). В конце эксперимента, на 82 сутки после посева семян, в контрольном варианте доля черешков в надземной биомассе составляла 37,8%, в опытном – 64,8%, т.е выше на 71%. Повышенная доля черешков проявлялась в течение всего периода эксперимента. Соответственно, уменьшалась доля листовой пластинки. Черешки в опытном варианте развиты значительно сильнее, чем в контроле (по размерам и биомассе). Таким образом, УФ-А облу-
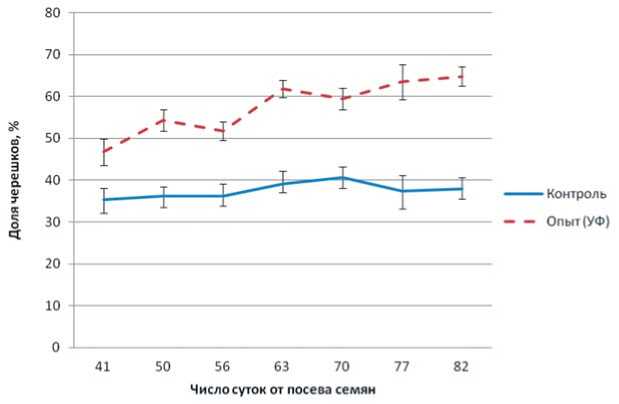
Рис.5.Изменение доли черешков в надземной биомассе растений свеклы сахарной в зависимости от доли ближнего ультрафиолетового света в спектре освещения.
Fig.5.Proportion ofleafpetiole in the generalbiomass ofsugar beetleaves depending on the lighting
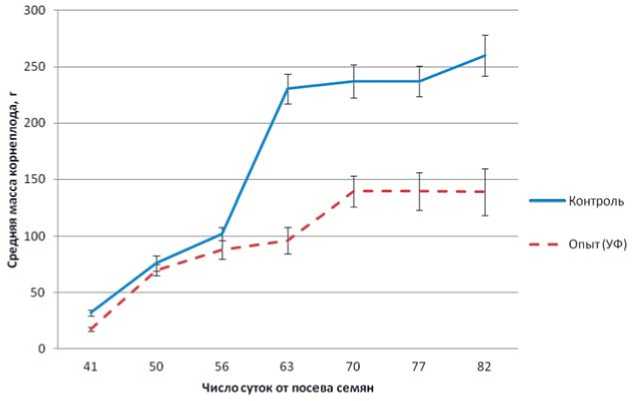
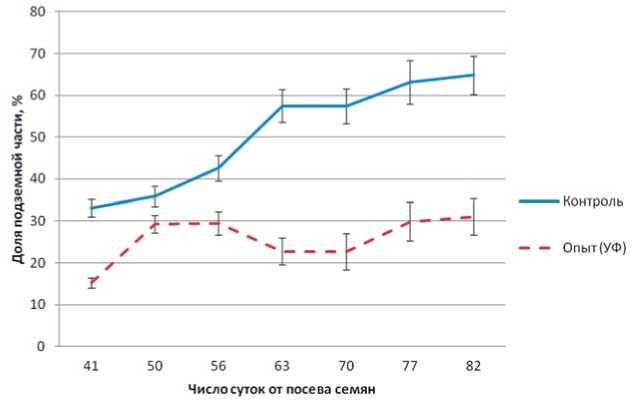
Рис.7. Доля корнеплодов (подземной части)в общей биомассе растения сахарной свеклы в зависимости от освещения
Fig.7.Proportion ofrootcrops (underground)in the generalbiomass plantof sugar beets depending on the lighting
чение способствовало росту надземной биомассы растений, но в большей части за счет роста черешков, и в меньшей -за счет увеличения площади листовых пластинок. Вероятно, вследствие этого при увеличении доли УФ-А рост площади листьев в относительных величинах был меньше, чем увеличение биомассы листьев в целом.
На рисунке 6 приведены данные по динамике роста корнеплодов свеклы сахарной. В начальный период выращивания увеличение доли УФА спектра незначительно сказывалось на биомассе корнеплодов по сравнению с контролем. Однако, начиная с 56-63 суток эксперимента, усиление интенсивности УФ-А радиации приводило к ослаблению, а затем к остановке роста корнеплодов (масса корнеплода на 82 сутки в среднем на 86,9% ниже по сравнению с контролем).
Влияние УФ-А на перераспределение потока ассимилянтов от корнеплодов к листьям показано на рис. 7. Доля корнеплодов в общей биомассе растений в контрольном варианте возрастала выше 60%, т.е. наблюдался отток пластических веществ в корнеплоды. При облучении растений спектром с увеличенной интенсивностью УФ-А доля корнеплодов составляла только порядка 30%, т.е. основная часть ассимилянтов накапливалась в надземной биомассе. Разница особенно заметна во вторую половину эксперимента, примерно с 63 суток после посева, когда наблюдался активный рост корнеплодов. Соответственно, в онтогенезе растений происходило изменение доли листьев (надземной части растения).
Таким образом, интенсивность УФ-А света приводит к существенному изменению биометрии растений свеклы сахарной и перераспределению потока ассимилянтов. По своей генетической природе современные сорта свеклы сахарной отличаются преимущественным накоплением подземной биомассы (корнеплодов), однако УФ-А приводит к изменению данной закономерности. Усиливается рост надземной части (в ущерб корнеплодам), характерно значительное усиление роста черешков по сравнению с листовой пластинкой. Очевидно, УФ-А облучение вызывает изменение экспрессии генов, определяющих основные параметры роста растений, т.е. имеет эпигенетическую природу.
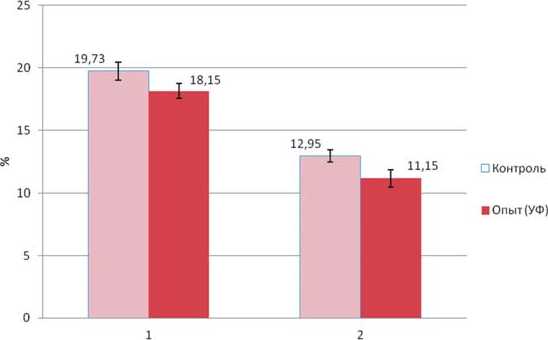
Под влиянием УФ-А радиации также происходит изменение химического состава корнеплодов свеклы сахарной. В первую половину вегетаций не установлено значительных различий опытного и контрольного вариантов по содержанию сухих веществ в корнеплодах (рис. 8). Однако при последующем активном росте корнеплода (70-77 сутки после посева семян) в корнеплодах контрольного варианта наблюдалось возрастание концентрации сухих веществ, в опытном – нет. Разница между вариантами составила 2,1% в конце периода выращивания. Таким образом, в период активного роста корне- плодов усиление интенсивности УФ-А облучения снижает накопление сухих веществ в корнеплодах. Как уже показано выше, УФ-А радиация в целом отрицательно влияет на рост и накопление биомассы корнеплода.
По данным рисунка 9, при выращивании растений с увеличенной долей ультрафиолета А в корнеплодах на 82 сутки содержалось меньше на 1,8% по сравнению с контролеме, а содержание сухих веществ – меньше на 1,58% (рис. 9). Содержание сухих веществ при анализе по стандартной методике во ВНИИ сахарной свеклы и сахара им. А.Л. Мазлумова несколько отличалось от результатов анализа при сушке на влагомере МХ-50 (рис.8), однако закономерность снижения накопления сухих веществ под воздействием спектра с увеличенной долей УФ-А сохранялась. Доля сахара в сухом веществе также была ниже в опытном варианте (на 4,2%).
Общий вид растений, выращиваемых в камере синерготрона ИСР 2.01. при облучении светом с различной долей УФ-А в спектре приведен на рисунке 10.
Обсуждение
В научной литературе наибольшее число исследований проведено в области изучения повреждающих эффектов УФ-В излучения и защитных механизмов [20]. В то же время Нейгард и Шрейнер (2018) указали, что традиционно считавшиеся вредными для сельскохозяйственных культур, недавние данные показывают, что естественные уровни ультрафиолетового излучения (УФ; 280-400 нм) в солнечном свете на самом деле могут оказывать ряд полезных эффектов на урожайность и питательные качества многих фруктов, овощей и декоративных культур [13]. А.А. Тихомиров с соавторами считают, что если УФ в диапазоне 280-320 нм оказывает отрицательное воздействие на растения, то УФ 320-400 нм играет регуляторную роль. Для нормального роста и развития растений в солнечном спектре должно присутствовать несколько процентов УФ-А. При этом на регуляцию требуется в 100-1000 раз меньше энергии, чем на фотосинтез, именно поэтому низкие дозы УФ могут быть эффективными [26].
Большинство исследователей сообщают о снижении биомассы, высоты растений и площади листьев под воздействием УФ-А облучения [12,13,18]. В то же время имеются сообщения о повышении биомассы [19]. При этом изменяется соотношение надземных и подземных органов, соотношение побег/корень снижается [27]. Сообщение о неоднозначном эффекте УФ облучения приведено также в работе [28].
В нашем эксперименте объектом исследования были корнеплодные растения (сахарная свекла), у которых селекционным путем достигнуто преобладание к моменту уборки урожая подземной биомассы. Увеличение в эксперименте интенсивности УФ-А приводило к существенному изменению биометрических показа-
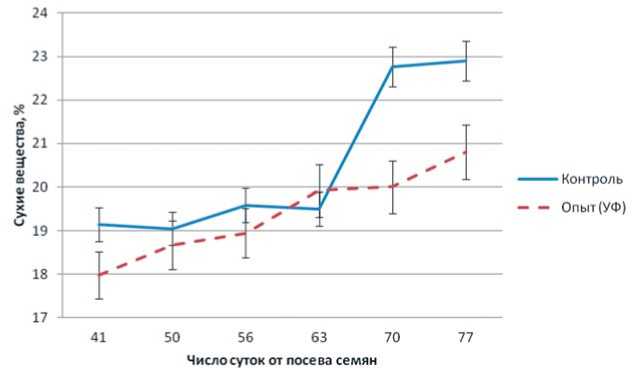
Рис.8.Динамика накопления сухих веществ в корнеплодах сахарной свеклы в зависимости от светового режима выращивания растений. Fig.8. Dynamics ofaccumulation ofdrysubstances in the leaves (overhead bio-mass)ofsugar beets depending on the lighting
1 - содержание сухого вещества, %, 2 - сахаристость, %
1 - содержание сухого вещества, %, 2 - сахаристость, %
Рис.9. Сахаристость и содержание сухого вещества в корнеплодах сахарной свеклы на 82 день после появления всходов в зависимости от освещения
82 days after the appearance ofshoots,depending on the lighting

Рис.10. Фото образцов свеклы сахарной на 82 сутки эксперимента в камере синерготрона ИСР 2.01. Слева - контрольный образец,справа -опытный образец.

Рис.11.Внешний вид синерготрона ИСР 2.01 (АНО "Институт стратегий развития",Москва)
Fig.11.Generalview ofSynergotron IPR 2.01 ("Institute of DevelopmentStrategies",Moscow)
телей растений и перераспределению ассимилянтов. Ближнее УФ-облучение стимулировало рост надземной части растений (надземная биомасса увеличивается в 2,2 раза по сравнению с контролем), и в то же время существенно снижало массу корнеплода (на 86,9%). Доля корнеплодов в общей биомассе растений снижалась с 60% в контроле до 30% в опыте, т.е. основная часть ассимилянтов накапливалась в надземной биомассе. Установлена закономерность существенного роста доли черешков по сравнению с долей листовой пластинки в общей надземной биомассе. В контрольном варианте доля черешков в надземной биомассе составляла 37,8%, в опытном – 64,8%, т.е выше на 27%. Таким образом, УФ-А облучение в эксперименте способствовало росту сырой надземной биомассы растений, но в большей степени за счет черешков, а не листовых пластинок. Поэтому прирост надземной биомассы в относительных единицах выражен значительно сильнее, чем прирост площади листовых пластинок (без черешков) в течение того же времени. В целом площадь листьев в опытном варианте превышала аналогичные показатели в контроле в течение всего периода выращивания.
Ряд исследователей отмечает изменение биометрии листьев. Так, в работе [29] установлено, что у всех изученных растений уменьшается толщина листовой пластинки. В наших исследованиях удельная масса листовой пластинки также уменьшалась при воздействии УФ-А облучения.
Ультрафиолетовое излучение, по данным исследователей, обычно приводит к снижению фотосинтеза и более высокому синтезу вторичных метаболитов растений [8,13], синтез хлорофилла и каротиноидов может возрастать [18,19 ,23]. В нашем исследовании показано изменение параметров флуоресценции хлорофилла при повышении доли УФ-А в спектре облучения. Так, происходило повышение, нефотосинтетического тушения флуоресценции NPQ и снижение реального квантового выхода фотосинтеза Y(II), а также скорости электронного транспорта (ETR), статистически достоверного изменения максимального квантового выхода Fv/Fm не было установлено.
В эксперименте УФ-А излучение приводило также к изменению химического состава корнеплодов, что в целом согласуется с указанными выше литературными данными. В частности, при увеличении УФ-А облучения по сравнению с контролем несколько уменьшалось накопление сухих веществ (на 1,58%) и снижалась сахаристость (на 1,8%).
Таким образом, ряд современных авторов считают необходимым введение небольшого количества УФ-А в практику искусственного освещения растений для регуляции морфогенеза и минерального питания растений [18,30,31]. По нашему мнению, использование УФ-А излучения перспективно как агротехнический прием для управления соотношением отдельных частей продукции, в частности, при выращивании листовых и черешковых форм овощных культур.
Заключение
Полученные в работе результаты позволяют оценить влияние УФ-А на отдельные показатели роста и развития в онтогенезе растений сахарной свеклы, активность фотосинтетического аппарата в период активного нарастания листовой поверхности. Используемый подход и полученные данные могут быть использованы при разработке систем освещения растений свеклы сахарной на разных этапах онтогенеза при выращивании в закрытых агробиотехносистемах для проведения селекционных работ в осенне-зимний-весенний периоды в контролируемых условиях.
Об авторах:
Aboutthe Authors:
Vyacheslav V. Latushkin – Cand. Sci. (Agriculture),
Leading Researcher,
,
Valery N. Zelenkov – Doc. Sci. (Agriculture),Prof.,
Senior Researcher, ,
Anatoly A. Kosobryukhov – Doc. Sci. (Biological),
Leading Researcher, ,
Vladimir B. Novikov – Head of Engineering Department, , Lyudmila N. Putilina – Cand. Sci. (Agriculture), Leading Researcher,
Maria I. Ivanova – Doc. Sci. (Agriculture), Prof.,
Senior Researcher, ,
Petr A. Vernik – Director, ,
Sergey V. Gavrilov – Head of the Telemetry Department, 9302,
Список литературы Влияние фотонов ближней ультрафиолетовой области на рост и развитие свеклы сахарной (Beta vulgaris L. ssp. vulgaris var. saccharifera Alef.) в условиях закрытой агробиотехносистемы
- Kami C., Lorrain S., Hornitschek P., Fankhauser C. Light-regulated plant growth and development. Current topics in developmental biology, Academic Press. 2010. pp. 29-66. https://doi.org/10.1016/S0070-2153(10)91002-8
- Kaiser E., Ouzounis T., Giday H., Schipper R., Heuvelink E., Marcelis L.F. Adding blue to red supplemental light increases biomass and yield of greenhouse-grown tomatoes, but only to an optimum. Frontiers in Plant Science. 2019;(9):2002-2012. https://doi.org/10.3389/fpls.2018.02002
- Cary A. Mitchell, Fatemeh Sheibani LED advancements for plant-factory artificial lighting. Plant Factory (Second Edition). An Indoor Vertical Farming System for Efficient Quality Food Production Editors Toyoki Kozai Genhua Niu Michiko Takagaki Acad. Press. 2020. P.167-184. https://doi.org/10.1016/B978-0-12-816691-8.00010-8
- Yuanchun M., An Xu., Zong-Ming (Max). Cheng Effects of light emitting diode lights on plant growth, development and traits a metaanalysis.Horticultural Plant Journal. 2021;7(6):552-564, https://doi.org/10.1016/j.hpj.2020.05.007
- Фадеев П.Д. Экспериментальные исследования влияния ультрафиолета на развитие растений. В сборнике: Химия, физика, биология, математика: теоретические и прикладные исследования. Сборник статей по материалам LXVIII международной научно-практической конференции. Москва, 2023. С. 27-31.
- Иванов A.A., Креславский В.Д., Кособрюхов А.А. Повышение устойчивости листьев рябины к УФ-В лучам посредством предоблучения красным светом. Материалы симпозиума. “Новые и нетрадиционные растения и перспективы их использования” 9-14 июня, 2003. М.: Пущино, 2003. C. 71-73.
- Kryvokhyzha M., Libantova Y., Rashydov N. Influence of short - wavelenth ultraviolet light on genes expression in Arabidopsis Thaliana plants. Biotechnologia Acta. 2019;12(3):57-66.
- Mantha S.V., Johnson G.A., Day T.A. Evidence from action and fluorescence spectra that UV-induced violet-blue-green fluorescence enhances leaf photosynthesis. Photochemistry and Photobiology. 2001;73(3):249-256, https://doi.org/10.1562/0031-8655(2001)0730249efaafs2.0.co2
- Вай Х., Хи К. и др. Ультраструктура клеточной стенки и изменение цвета стебля Phylostachys pubescens после обработки ультрафиолетом. Науч. Лесн. конф. M., 2003. C. 137-139.
- Hada Hirosohi, Hidema Jun. Effects supplementary UFB on the relationship between accumulation of anthocyanins and UV-absorbing compounds and levels of CPD with leaf age in purple rice // Tes. Annual Muting and Symposia of the 2003 Annual 112 Meeting (Nara) of the Japanese Society of Plant Physiologists (ISPP), Osaca Norch. 2003. p.54.
- Diene X.A., Tainá T.R., de Carvalho A.A., Bertolucci S.K.V., Medeiros A.P.R., Ribeiro F.N.S., Barbosa S.M., Brasil Pereira Pinto J.E. Photon flux density and wavelength influence on growth, photosynthetic pigments and volatile organic compound accumulation in Aeollanthus suaveolens (Catingade-mulata) under in vitro conditions. Industrial Crops and Products. 2021;168(15):113597. https://doi.org/10.1016/j.indcrop.2021.113597
- Verdaguer D., Jansen M.A., Llorens L., Morales L.O., Neugart S. UV-A radiation effects on higher plants: Exploring the known unknown. Plant Science. 2017;(255),72-81, https://doi.org/10.1016/j.plantsci.2016.11.014
- Neugart S., Schreiner M. UVB and UVA as eustressors in horticultural and agricultural crops Scientia Horticulturae. 2018;(234):370-381. https://doi.org/10.1016/j.scienta.2018.02.021
- Chen Y., Li T., Yang Q., Zhang Y., Zou J., Bian Z., Wen X. UVA radiation is beneficial for yield and quality of indoor cultivated lettuce. Frontiers in Plant Science. 2019;(10):1563-1572. https://doi.org/10.3389/fpls.2019.01563
- Гинс М.С., Гамбурова Н.Т. Активность антиоксидантной системы красноокрашенного амаранта при кратковременном действии УФ-А радиации. Овощи России. 2009;(1):33-35. https://doi.org/10.18619/2072-9146-2009-1-33-35. EDN OYCLGH.
- Ittetsu Yamaga, Shigekazu Nakamura. Penicillium growth inhibition, fruit decay reduction, and polymethoxyflavones and scoparone induction in satsuma mandarin irradiated with ultraviolet-A light-emitting diodes. Scientia Horticulturae. 2022;303(20):111197. https://doi.org/10.1016/j.scienta.2022.111197
- Русакович А.А., Шашко А.Ю., Ветошкин А.А., Солдатенко А.А., Болвонович В.В., Смолич И.И., Соколик А.И., Шашко Ю.К., Демидчик В.В. Влияние диодного ультрафиолетового излучения на скорость роста колоний мицелиальных грибов рода Alternaria. Журнал Белорусского государственного университета. Биология. 2021;(2):19-28. https://doi.org/10.33581/2521-1722-2021-2-19-28. EDN OQPSXK.
- Rui He, Yiting Zhang, Shiwei Song, WeiSu, Yanwei Hao, Houcheng Liu UV-A and FR irradiation improves growth and nutritional properties of lettuce grown in an artificial light plant factory. Food Chemistry. 2021;345(30):128727. https://doi.org/10.1016/j.foodchem.2020.128727
- Marco Landi, Marek Zivcak, Oksana Sytar , Marian Brestic, Suleyman I. Allakhverdiev Plasticity of photosynthetic processes and the accumulation of secondary metabolites in plants in response to monochromatic light environments: A review. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 2020;1861(2):148131. https://doi.org/10.1016/j.bbabio.2019.148131
- Канаш Е.В., Савин В.Н. Изучение чувствительности различных сельскохозяйственных растений к непродолжительному УФ - стрессу. Космическая биология и авиакосмическая медицина. 2003;(4):18-20.
- Auрra Brazaitytл, Akvilл Virрilл. Light quality: Growth and nutritional value of microgreens under indoor and greenhouse conditions. Presentation in Acta horticulturae. May 2016 https://doi.org/10.17660/ActaHortic.2016.1134.37
- Гулин А.В., Донская В.И Сравнительная оценка характера воздействия ультрафиолетового излучения на семена арбуза во временном режиме. Овощи России. 2019;(6):155-158. https://doi.org/10.18619/2072-9146-2019-6-155-158. EDN KZDVCM.
- Claypool N.B., Lieth J.H. Physiological responses of pepper seedlings to various ratios of blue, green, and red light using LED lamps. Scientia Horticulturae. 2020;268(27):109371. https://doi.org/10.1016/j.scienta.2020.109371
- Zelenkov V.N., Vernik P.A., Latushkin V.V. Creating closed technobioecosystems (synergotron class) as a modern direction of using digital technologies for the development of Agrarian Science and solving tasks of the agrarian-industrial complex of Russia. IOP Conf. Series: Earth and Environmental Science. 2019;(274):012101. https://doi.org/10.1088/1755-1315/274/1/
- Латушкин В.В., Зеленков В.Н., Лапин А.А., Верник П.А., Гаврилов С.В., Новиков В.Б. Экспериментальное моделирование условий онтогенеза растений и биотехнологических методов их выращивания в закрытой экосистеме - синерготроне. Вестник РАЕН. 2021;21(1):46-53. https://doi.org/10.52531/1682-1696-2021-21-1-46-53. EDN UWOIYU.
- Тихомиров А.А., Шарупич В.П., Лисовский Г.М. Светокультура растений. Биофизические и биотехнологические основы. Новосибирск: Изд-во СО РАН, 2000. 213 с.
- Зяблицкая Е.Я., Козьмин Г.В., Симоненкова Е.Д. и др. Влияние хронического УФ -облучения зоны В на рост, развитие и продуктивность кормовой свеклы. Космическая биология и авиакосмическая медицина. М: Наука, 1991;(4):23-26.
- Зеленков В.Н., Лапин А.А., Латушкин В.В., Карпачев В.В. Влияние ультрафиолетового облучения на биохимические свойства растений. Бутлеровские сообщения. 2020;63(8):134-140. https://doi.org/10.37952/ROI:jbc-01/20-63-8-134. EDN EGLQEH.
- Худжаназарова Г.С. Действие УФ радиации на ростовые процессы и анатомическое строение листьев растений. Душанбе:, 2003. 22 с.
- Соколов А.В. Анализ эффективности облучения растений ультрафиолетовой радиацией в условиях защищенного грунта. Электротехнологии и электрооборудование в АПК. 2020;67,2(39):37- 43.
- Шаронова Т.В., Белов Е.Л., Ефимова И.О. Применение ультрафиолетовых светодиодных светильников. В сборнике: Перспективы развития механизации, электрификации и автоматизации сельскохозяйственного производства. Материалы II Национальной (Всероссийской) научно-практической конференции. Чебоксары, 2020. С. 75-79.


