Влияние газотрансперсмиттеров на проницаемость мембран и активность тонопластной H + -АТФазы при окислительном стрессе
Автор: Спиридонова Е.В., Озолина Н.В., Нестеркина И.С., Нурминский В.Н.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 2 т.12, 2016 года.
Бесплатный доступ
Проведено исследование влияния газотрансперсмиттеров - нового класса сигнальных молекул - на корневые ткани красной свеклы (Beta vulgaris L.). Было обнаружено, что сероводород (H2S) оказывает некоторое стабилизирующее действие на клеточные мембраны, уменьшая их проницаемость, обнаруженную с помощью кондуктометрического метода. Надежное влияние окиси углерода (СО) и оксида азота (NO) в наших экспериментах не наблюдалось. Наблюдалось значительное увеличение оттока электролитов из свекольной ткани при окислительном стрессе. Добавление газоотрансмиттеров не позволило надежно снизить его. В нормальных условиях не было обнаружено заметного влияния газоперемешивающих устройств на транспортную активность тонопластов H + -АТФазы. При окислительном стрессе NO и H2S увеличивали активность H + -АТФазы, значительно снижаясь при воздействии перекиси водорода, но полностью не восстанавливали ее. CO усилило отрицательное воздействие окислительного стресса и уменьшило транспортную активность H + -ATPase. Полученные результаты позволяют сделать вывод о том, что газовые сигнальные молекулы участвуют в регуляции транспортных процессов в клетке растения посредством контроля активности H + -АТФазы при окислительном стрессе.
Короткий адрес: https://sciup.org/14323992
IDR: 14323992
Текст научной статьи Влияние газотрансперсмиттеров на проницаемость мембран и активность тонопластной H + -АТФазы при окислительном стрессе
К сигнальным молекулам газообразных веществ (газотрансмиттерам) в настоящее время относят оксид азота (NO), сульфид водорода (H2S) и монооксид углерода (СО). Существует ряд критериев, которым соответствуют газотрансмиттеры: их молекулы должны существовать в виде газа и свободно проникать сквозь биологические мембраны (обладать липофильными свойствами), вырабатываться эндогенно (их синтез должен регулироваться ферментами), осуществлять определённые функции в физиологических концентрациях, иметь специфические клеточные и молекулярные мишени (Wang, 2002). Газотрансмиттеры являются высокотоксичными веществами, однако, несмотря на это свойство, они продуцируются практически всеми клетками любого организма, что указывает на высокую значимость данных молекул в регуляции жизнедеятельности клеток, тканей и организма в целом (Kaczorowski, Zuckerbraun, 2007). Участвуя в передаче сигнала, газотрансмиттеры вызывают физиологические и биохимические изменения в клетке (Jin et al., 2011). В настоящее время активно изучается их роль в поддержании сосудистого тонуса, ингибировании противовоспалительных сигнальных путей, апоптозе и др. процессах (Новицкий и др., 2011). Роль этих сигнальных молекул в метаболизме растений изучена меньше. Не вызывает сомнения, что она не менее существенна, чем у животных, и в настоящее время появилось значительное количество исследований, посвящённых этой теме. Наиболее изученной является роль NO в регуляции метаболизма и защите растительной клетки от стрессового воздействия (Besson-Bard et al., 2008). В последние годы начато изучение влияния других газотрансмиттеров на метаболизм растительной клетки. Так, уже показано, что H2S участвует в регуляции прорастания семян, морфогенезе корней, фотосинтезе и старении цветов, а также является важным участником в системах защиты растений против стрессового воздействия (Jin, Pei, 2015). CO также вовлекается в различные физиологические процессы, такие как прорастание и покой семян, закрытие устьиц, регуляция абиотических стрессов (He, He, 2014). Однако механизмы этих процессов ещё мало изучены. Известно, что в процессах жизнедеятельности клетки и организма в целом, активное участие принимают биологические мембраны. В связи с чем, целью нашей работы было исследование влияния газотрансмиттеров на проницаемость мембран растительной клетки, а также возможности влияния этих соединений на механизмы мембранного транспорта, в частности на активность протонной помпы вакуолярной мембраны (Н+-АТФазы) в норме и в условиях окислительного стресса.
MATERIALS AND METHODS
В качестве объекта исследования служили корнеплоды столовой свёклы (Beta vulgaris L.), которые находились на стадии покоя и хранились при +4ºС. Для настоящего исследования использовали как ткань корнеплодов, так и фракции вакуолей и везикул вакуолярных мембран. Изолирование вакуолей и последующее получение везикул вакуолярных мембран осуществляли с помощью метода (Саляев и др., 1981). Окислительный стресс создавали внесением в раствор пероксида водорода (Н2О2). Для этого к участкам ткани, нарезанным в форме дисков, в суспензию изолированных вакуолей или к осадку мембранных везикул добавляли 50 мМ Н2О2, после чего инкубировали 30 мин при комнатной температуре. Концентрация пероксида водорода, использованная в экспериментах, была предварительно подобрана (Озолина и др., 2014). В контрольном варианте инкубацию проводили в дистиллированной воде.
Для оценки устойчивости мембран к окислительному стрессу использовали кондуктометрический метод (Грищенкова, Лукаткин, 2005). Уровень повреждения клеточных мембран оценивали по выходу электролитов из тканевых дисков в дистиллированную воду с использованием кондуктометра (ОК-104, Radelkis) с платиновым электродом. В ходе эксперимента из ткани корнеплодов нарезали диски одинакового диаметра и толщины, которые в дальнейшем помещали в дистиллированную воду (контроль) или в 50 мМ раствор Н 2 О 2 (окислительный стресс). В течение 30 мин проводили инкубацию при комнатной температуре, после чего раствор сливали, а диски промывали и помещали в равный объём дистиллированной воды. Через сутки измеряли уровень выхода электролитов по электропроводности раствора в мкСм. Сразу после этого раствор с растительным материалом доводили до кипения, кипятили в течение 5 мин (для разрушения мембран) и давали ему остыть до комнатной температуры, затем объём доводили до исходной величины и вновь измеряли электропроводность раствора. Выход электролитов из тканей корнеплода столовой свёклы (V, % от полного выхода) рассчитывали по формуле: V
= 100 (L 1 /L 2 ), где L 1 – электропроводность образца после инкубации, L 2 – электропроводность того же образца после кипячения. Для изучения влияния газотрансмиттеров на выход электролитов из тканей корнеплодов в условиях нормы или окислительного стресса при 30 мин инкубации в воду (контроль) или 50 мМ раствор Н 2 О 2 (окислительный стресс) вносили источники газовых молекул: SNP (NO), NaHS (H 2 S) и CORM-3 (СО) в концентрации 100 мкМ. Концентрация газотрансмиттеров была выбрана после серии экспериментов, в которых были использованы и другие концентрации, но существенной разницы выявлено не было, поэтому в статье приведены данные с концентрацией 100 мкМ. Кроме того, эта концентрация обычно используется другими исследователями (Christou et al. , 2013).
Влияние окислительного стресса на барьерные свойства мембран (стабильность мембран) изучали с использованием экспериментальной установки собственного изготовления, позволяющей получать серии компьютерных изображений (цейтраферная видеосъемка, частота кадров 0.1 мин-1 (1 кадр за 10 мин)), отражающих динамику процесса разрушения вакуолей (Нурминский и др., 2004). С помощью компьютерной обработки данных строили график зависимости количества сохранившихся вакуолей (%) от времени и рассчитывали значения периода полураспада изолированных вакуолей, в течение которого разрушаются 50% вакуолей (Т 1/2 ).
Уровень транспортной активности вакуолярной Н+-АТФазы оценивали по изменению рН везикул тонопласта при помощи флуоресцентного зонда акридинового оранжевого при длине волны возбуждающего и испускаемого света 493 и 540 нм, соответственно. Эксперименты проводили на спектрофлуориметре (RF-5301PC, Shimadzu). В кювету поэтапно вносили 2.5 мл инкубационного раствора и 0.05 мл осадка везикул тонопласта. Инкубационный раствор содержал: 20 мМ Трис/МЭС, 50 мМ KCl, 280 мМ маннит, 5 мкМ акридиновый оранжевый, 3 мМ MgCl2, рН 7.3. Содержание белка определяли по методу Бредфорд (Brеdford, 1976). В среднем на 0.05 мл образца приходилось 30–50 мкг белка. В среду инкубации вносили 3 мМ АТФ (Трис), а также источники газовых молекул: SNP (NO), NaHS (H2S) и CORM-3 (СО) также в концентрации 100 мкМ. Для доказательства специфичности проводимых исследований во всех экспериментах использовали общепринятый ингибитор Н+-АТФазы – бафиломицин (2 нМ), который подавлял активность этого фермента, а также протонофор 10 мкМ карбонилцианид 3-хлорофенилгидразон (CCCP), который полностью предотвращал тушение флуоресценции, возникающее при функционировании фермента. Транспортная активность измерялась в общепринятых единицах (%*Р/мг белка/мин), где ^F-тушение флуоресценции акридинового оранжевого (Braun et al., 1986). Средняя величина, полученная в контрольных экспериментах и принятая за 100%, при измерении транспортной активности Н+-АТФазы тонопласта равна 13,6 ±4,5 *Р/мг белка /мин.
В работе применяли следующие реактивы фирмы “Sigma”: 2-N-морфолино-этансульфоновую кислоту (МЭС), аденозинтрифосфат (АТФ, натриевая соль), Трис, 2-меркаптоэтанол, карбонилцианид 3-хлорофенилгидразон (СССР), гидросульфид натрия
(NaHS), CORM-3, бафиломицин А 1 , акридиновый оранжевый; фирмы “Fluka”: нитропруссид натрия (SNP), этиленгликоль-бис-(2-аминоэтил)-N,N,N,N-тетрауксусная кислота (ЭГТА). Остальные реактивы были отечественного производства квалификации ХЧ.
На графиках представлены средние арифметические значения величин и их стандартные отклонения, которые были получены в пяти-семи независимых экспериментах, рассчитанные с помощью программы Microsoft Excel.
RESULTS AND DISCUSSION
На первом этапе исследований проводилось изучение влияния газотрансмиттеров на выход электролитов из тканей корнеплодов в условиях нормы (рис. 1). Этот параметр позволяет оценить проницаемость клеточных мембран и их устойчивость к стрессу. При действии неблагоприятных факторов повышается утечка электролитов из тканей, что свидетельствует о нарушении избирательной проницаемости мембран растительной клетки (Приходько 1977). Это может быть связано с изменениями в структуре мембран, возникновением дефектов и стрессовых пор (Bertin et al., 1996). Результаты проведённых экспериментов показали, что только H2S оказывал небольшое влияние по снижению выхода электролитов из тканей корнеплода столовой свёклы, что позволяет предположить возможность стабилизирующего влияния этого газотрансмиттера на мембраны. Достоверного снижения выхода электролитов при влиянии других газотрансмиттеров обнаружено не было. Влияние газотрансмиттеров на проницаемость мембран может быть связано с тем, что они растворимы в липидах и могут оказывать влияние непосредственно на липидный бислой. Кроме того, было показано, что газотрансмиттеры принимают участие в регуляции ионных каналов (Scragg et al., 2008), что также может быть связано с их возможным влиянием на проницаемость мембран.
Для изучения влияния газотрансмиттеров на метаболические процессы растительной клетки было исследовано изменение транспортной активности Н+-АТФазы под воздействием этих соединений. Эта протонная помпа представляет собой один из наиболее важных ферментов, участвующих в процессах активного транспорта через вакуолярную мембрану. На долю Н+-АТФазы приходится до 15% всех белков тонопласта (Maeshima 2001), за счет чего обеспечивается поступление в вакуоль большого числа метаболитов (Martinoia, 2007).
Результаты этих экспериментов представлены на рис. 2. Они показывают, что достоверных отличий в изменении транспортной активности этого фермента ни один газотрансмиттер не вызвал, хотя небольшое снижение транспортной активности под влиянием NO и H 2 S все же было отмечено.
Известно, что газотрансмиттеры участвуют в механизмах защиты тканей и клеток от стрессового воздействия (He, He, 2014; Christou et al. , 2013). Для выяснения молекулярных механизмов участия газотрансмиттеров в защите растительной клетки от стрессового воздействия были проведены эксперименты по изучению влияния этих молекул на проницаемость клеточных мембран и на активность мембранных транспортных процессов в условиях окислительного стресса.
Чтобы оценить эффективность созданного стрессового воздействия, которое оказывал пероксид водорода на ткани корнеплодов столовой свёклы, было изучено его влияние на стабильность мембран с использованием метода цейтраферной видеосъёмки. В результате по полученным данным установили, что в условиях искусственно созданного окислительного стресса, период полураспада вакуолей уменьшался более чем в 2 раза (рис. 3), то есть темпы их разрушения были очень высокими и стресс действительно оказывал негативное воздействие на мембраны клеток корнеплодов. Кроме того, результаты, полученные кондуктометрическим методом, показали заметное увеличение выхода электролитов из тканей корнеплода (рис. 4), что говорит о значительных нарушениях структуры мембран, которые произошли в ответ на это стрессовое воздействие.
На следующем этапе наших исследований проводилось изучение влияния газотрансмиттеров на проницаемость мембран при окислительном стрессе. Так, кондуктометрическим методом, было установлено, что в условиях стресса газовые молекулы не способствовали снижению выхода электролитов, и, следовательно, защитной роли с их стороны выявлено не было (рис. 4).
Таким образом, полученные результаты показывают, что в зависимости от условий, исследуемые газотрансмиттеры оказывают различное действие на проницаемость клеточных мембран. Так, NO и СО не оказывали достоверного влияния ни в норме, ни в условиях стрессового воздействия. Тогда как молекулы H2S стабилизировали мембраны, уменьшая их проницаемость в условиях нормы, но в
Добавление газотрансмиттеров на фоне условиях окислительного стресса достоверного окислительного стресса оказывало заметное влияние влияния не оказывали (рис. 1 и 4).
на транспортную активность Н+-AТФазы (рис. 5). Так
Для оценки влияния окислительного стресса на молекулярном уровне было проведено изучение изменений, происходящих с транспортной активностью протонной помпы вакуолярной мембраны – Н+-АТФазой. Транспортная активность Н+-АТФазы в условиях окислительного стресса падает более чем на 40%, что говорит о существенном влиянии этого стрессового воздействия на механизмы мембранного транспорта (рис. 5). Было высказано предположение, что пероксид водорода вызывает окисление сульфгидрильных групп гидрофильного комплекса фермента, вследствие чего и происходит частичное инактивирование Н+-AТФазы (Seidel, 2012). Кроме, того на уровень активности протонной помпы могло оказать влияние изменение липидного окружения (Лось, 2013) при окислительном стрессе, что могло приводить к перестройке конформации фермента и добавление NO и H2S приводило к увеличению транспортной активности Н+-АТФазы, существенно сниженной воздействием пероксида водорода, однако не восстанавливали её полностью, тогда как СО усиливал негативное влияние стрессового воздействия в результате чего, транспортная активность Н+-АТФазы ещё больше снижалась. Поскольку газотрансмиттеры не оказывали влияния на транспортную активность Н+-AТФазы в норме (рис. 2), а оказывали влияние на активность этого фермента только в условиях окислительного стресса, можно предположить, что влияние газотрансмиттеров связано с такими изменениями в молекуле фермента или в её липидном окружении, которые вызывает окислительный стресс. С уменьшением негативного влияния окислительного стресса может быть в определённой степени связана защитная роль тем самым изменять его транспортную активность газотрансмиттеров, неоднократно показанная другими
(Палладина, Симчук, 1990). исследователями (Jin et al. , 2011; Zhang et al. , 2012).
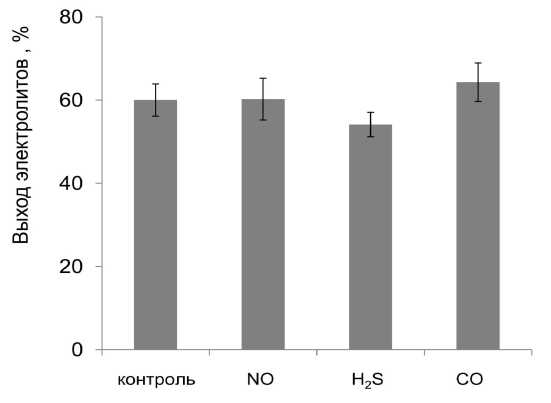
Figure 1. Влияние газотрансмиттеров на выход электролитов из тканей корнеплода столовой свёклы (в % от полного выхода).
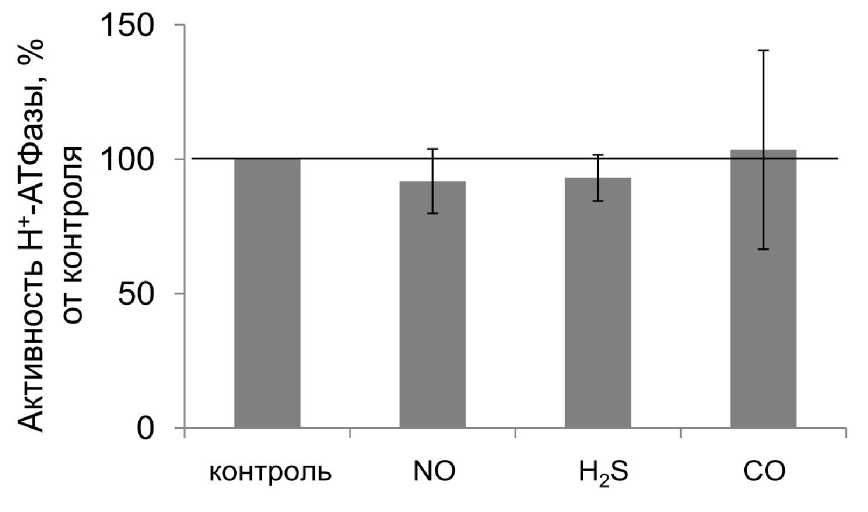
Figure 2. Влияние газотрансмиттеров на транспортную активность Н+-АТФазы.
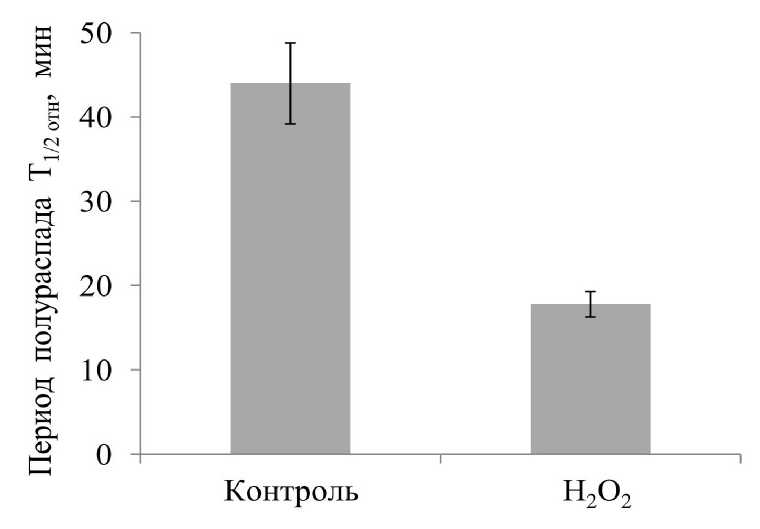
Figure 3 . Влияние окислительного стресса на период полураспада изолированных вакуолей (Т 1/2 ).
Результаты получены методом цейтраферной видеосъемки.
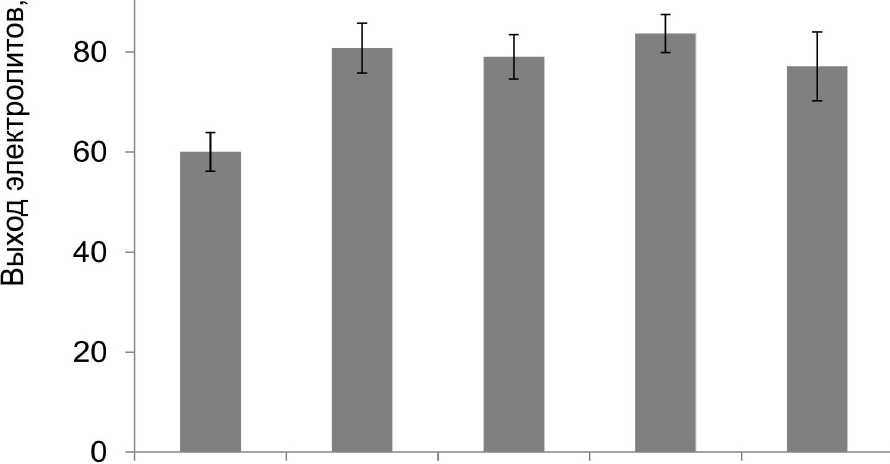
контроль Н2О2 NO+H2O2 H2S+H2O2 СО+Н2О2
Figure 4 . Влияние газотрансмиттеров на выход электролитов из тканей корнеплода столовой свёклы в условиях окислительного стресса (в % от полного выхода).
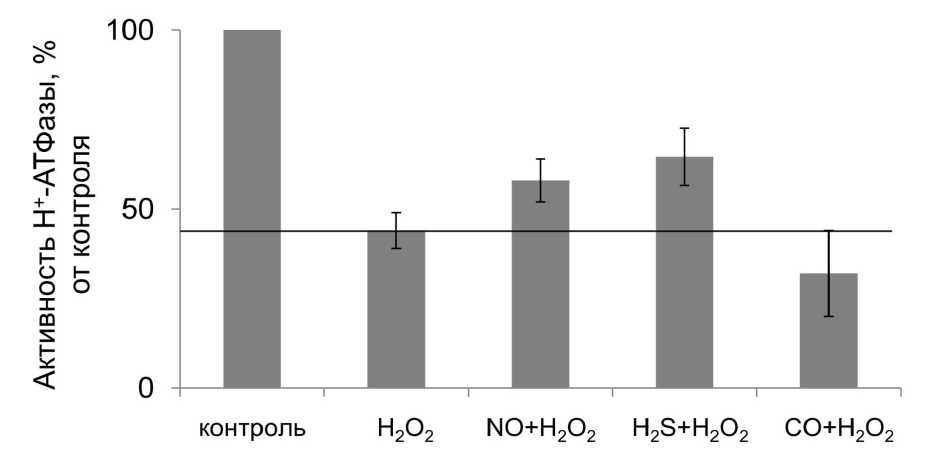
Figure 5 . Влияние газотрансмиттеров на транспортную активность Н+-АТФазы в условиях
окислительного стресса.
CONCLUSION
Полученные результаты позволяют сделать вывод о возможности участия газообразных сигнальных молекул в регуляции транспортных процессов и в защитных механизмах растительной клетки при окислительном стрессе через влияние на активность Н+-AТФазы.
ACKNOWLEDGMENT
Исследование выполнено при финансовой поддержке РФФИ в рамках научных проекта № 14-0431080 мол_а. В работе использовалось оборудование Байкальского аналитического центра (ЦКП) ИНЦ СО РАН.
Список литературы Влияние газотрансперсмиттеров на проницаемость мембран и активность тонопластной H + -АТФазы при окислительном стрессе
- Bertin P., Bouharmont J., Kinet J. (1996) Somaclonal variation and improvement in chilling tolerance in rice. Changes in chilling-induced electrolyte leakage. Plant Breeding, 115, 268-272
- Besson-Bard A., Pigun A., Wendehenne D. (2008) New insights into nitric oxide signaling in plants Annu. Rev. Plant Biol., 59, 21-39
- Braun Y., Hassidim M., Lerner H., Reinhold L. (1986) Studies on H+-translocating ATPases in plants of varying resistance to salinity. Plant Physiol., 81, 1050-1056
- Brеdford M.A. (1976) A rapid and sensitive method for the quantitation of protein utilising the principl of protein-dye binding. Anal. Biochem., 72, 248-254
- Christou A., Manganaris G., Papadopoulos I., Fotopoulos V. (2013) Hydrogen sulfide induces system tolerance to salinity and non-ionic osmotic stress in strawberry plants through modification of reactive species biosynthesis and transcriptional regulation of multiple defence pathways. J. Exp. Bot., 64, 1953-1966
- Grishhenkova N.N., Lukatkin A.S. (2005) Opredelenie ustojchivosti rastitel'nyh tkanej k abiotichesktm stressam s ispol'zovaniem konduktometricheskogo metoda. Povolzhskij jekologicheskij zhurnal, 1, 3-11
- He H., He L. (2014) The role of carbon monoxide signaling in the responses of plants to abiotic stress. Nitric oxide, 42, 40-43
- Jin Z., Shen J., Qiao Z., Yang G., Wang R., Pei Y. (2011) Hydrogen sulfide improves drought resistance in Arabidopsis thaliana. Biochem. Biophys. Res. Commun., 414, 481-486
- Jin Z., Pei Y. (2015) Physiological implications of hydrogen sulfide in plant: pleasant exploration behind its unpleasant odour. Oxid. Med. Cell. Longev., Article ID 397502, 6 p DOI: 10.1155/2015/397502/
- Kaczorowski D.J., Zuckerbraun B.S. (2007) Carbon monoxide: medicinal chemistry and biological effect. Curr. Med. Chem., 14, 2720-2725
- Los D.A., Mironov K.S., Allakhverdiev S.I. (2013) Regulatory role of membrane fluidity in gene expression and physiological functions. Photosynth. Res., 343, 489-509
- Maeshima M. (2001) Tonoplast transporters: organization and function. Annu Rev. Plant Physiol. Plant Mol. Biol., 52, 469-497
- Novitskii V.V., Ryazantseva N.V., Starikova E.G., Tashireva L.A. (2011) Regulyatsiya apoptoza kletok s ispol'zovaniem gazovykh transmitterov (oksida azota, monooksida ugleroda i sul'fida vodoroda). Vestnik nauki Sibiri, 1, 635-640
- Nurminsky V.N., Korzun A.M., Rozinov S.V., Salyaev R.K. (2004) Komp'yuternaya tseitrafernaya videos"emka fraktsii izolirovannykh vakuolei. Biomeditsinskaya khimiya, 50, 180-187
- Ozolina N.V., Nurminsky V.N., Rakevich A.L., Kolesnikova E.V., Nesterkina I.S., Donskaya L.I., Salyaev R.K. (2014) Vliyanie okislitel'nogo stressa na vakuolyarnuyu membranu. Biologicheskie membrany, 31, 263-269
- Palladina T.A., Simchuk E.E. (1990) Vliyanie sterinov na aktivnost' H+-ATFazy plazmaticheskikh membran kletok kornei kukuruzy. Dokl. AN SSSR, 314, 1018-1020
- Prikhod'ko N.V. (1977) Izmenenie pronitsaemosti kletochnykh membran kak obshchee zveno mekhanizmov nespetsificheskoi reaktsii rastenii na vneshnie vozdeistviya. Fiziologiya i biokhimiya kul'turnykh rastenii, 9, 301-309
- Salyaev R.K., Kuzevanov V.Ia., Khaptagaev S.B., Kopytchuk V.N. (1981) Vydelenie i ochistka vakuolei i vakuolyarnykh membran iz kletok rastenii. Fiziologiya Rastenii, 28, 1295-1305
- Scragg J., Dallas M., Wilkinson J., Varadi G., Peers C. (2008) Carbon monoxide inhibits L-type Ca2+ channels via redox modulation of key cysteine residues by mitochondrial reactive oxygen species. J. Biol. Chem., 283, 24412-24419
- Seidel T., Scholl S., Krebs M., Rienmuller F., Marten I., Hedrich R., Hanitzsch M., Janetzki P., Dietz K.-J., Schumacher K. (2012) Regulation of the V-type ATPase by redox modulation. Biochem. J., 448, 243-251
- Wang K. (2002) Two's company, three's a crowd: can H2S be third endogenous gaseous transmitter? FASEB J., 16, 1792-1798
- Zhang C., Li Y., Yuan F., Hu S., He P. (2012) Effects of hematin and carbon monoxide on the salinity stress responses of Cassia obtusifolia L. seeds and seedlings. Plant Soil, 105, 359-385


