Влияние гербицида раундап на активность гликозидаз в кишечнике молоди рыб при различных значениях pH и температуры
Автор: Аминов Александр Иванович
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Экология
Статья в выпуске: 3-4, 2013 года.
Бесплатный доступ
Исследована амилолитическая активность в кишечнике молоди некоторых видов рыб при действии in vitro гербицида Раундап при различных значениях температуры и pH.
Гербицид, раундап, рыба, гликозидазы, температура
Короткий адрес: https://sciup.org/14720040
IDR: 14720040 | УДК: 661.162.2:597:591.434
Текст научной статьи Влияние гербицида раундап на активность гликозидаз в кишечнике молоди рыб при различных значениях pH и температуры
Общеизвестно, что продуктивность водоемов в значительной мере зависит от эффективности питания рыб, которая определяется не только количеством, но и качеством корма. Углеводы, несмотря на их относительно низкое содержание в естественной пище большинства видов рыб, играют важную роль в энергетическом и пластическом обмене организма. Об эффективности гидролиза углеводов можно судить по активности гликозидаз – ферментов, осуществляющих гидролиз ди- и полисахаридов.
Температура является одним из основных абиотических факторов среды, определяющих основные параметры жизнедеятельности эктотермных животных. Изменение температуры среды приводит к значительным изменениям скорости основных метаболических процессов, темпа роста, интенсивности питания, скорости переваривания пищи и активности различных ферментов рыб [1; 9].
Как правило, характеристики ферментных систем рыб хорошо адаптированы к температурным условиям среды обитания. При этом ферменты пойкилотермных животных способны функционировать при температуре, близкой к 0 °С, тогда как ферменты теплокровных утрачивают активность [9]. С увеличением температуры активность большинства ферментов возрастает, при этом происходит изменение ряда температурных
и кинетических характеристик (topt, Q10, Еact, Vmах и Km) пищеварительных гидролаз рыб. Наибольшей адаптационной пластичностью обладают гидролазы, находящиеся в начале ферментативной цепи. Существует зависимость относительной активности ферментов в зоне низких температур от биологии вида. Так, активность а-амилазы у рыб, не питающихся в зимний период, при t 0° С составляет 10–15 % от максимальной активности, у питающихся – 50–70 % от максимальной активности [Там же].
Значения рН воды, в которой живут рыбы, варьируют в пределах 3,5–10,0. Большинство видов рыб живет в воде с рН от 6,0 до 8,0, отдельные виды (щука, окунь) могут жить при рН воды меньше 5,0 [6]. Значения рН в пищеварительном тракте рыб колеблются от 1,6 до 10,5 [8]. Для ферментов цепи гликозидаз у большинства видов рыб оптимальные значения рН отмечены в диапазоне 6,0–8,0. Оптимум рН амилолитической активности, активности мальтазы и a-амилазы у пресноводных рыб находится в зоне 7,0–8,0, сахаразы у бентофагов – 7,0–8,0, у щуки – 6,0 [9].
Изменение температуры может влиять на рН-функцию ферментов. Так, в зоне оптимальных значений рН – 7,4 для «мирных» и рН – 8,0 для хищных рыб, максимальный уровень активности кишечных гликозидаз отмечен при t 20 °С, а низкие значения температуры снижают тормозящее действие кислых рН на активность a-амилазы, мальтазы и сахаразы в слизистой оболочке кишечника плотвы, щуки и леща [Там же].
Среди антропогенных факторов, влияющих на функционирование водных экосистем, важная роль принадлежит ксенобиотикам, количество которых увеличивается с ростом уровня антропогенного загрязнения. Одним из них является высокотехнологичный системный гербицид глифосат (N-(phosphonomethyl) glycine), широко используемый в мире с середины 70-х гг. ХХ в. На основе его действующего вещества изопропиламиновой соли глифосата создано много гербицидов, самый известный из которых Раундап. Это неспецифический гербицид широкого спектра действия, предназначенный для борьбы с однолетними и многолетними сорняками. Механизм действия Раун- дапа заключается в ингибировании ферментного пути с участием шихимовой кислоты, что препятствует синтезу 3 аминокислот: фенилаланина, тирозина и триптофана [11; 14]. Попадая в организм гидробионтов, гербицид включается в метаболизм и может вызвать нарушение различных функций. За последние годы накопилось много сведений о токсичности Раундапа [3; 5; 7; 11–16], а Европейский Союз признал глифосат опасным для окружающей среды и токсичным для водных организмов. Тем не менее он широко используется в Южной Америке, странах Восточной Европы для борьбы с зарастанием водохранилищ, прудов и каналов, а также в коллекторно-дренажных системах оросительного земледелия. Ранее при исследовании in vitro активности ферментов (амилолитическая активность и активность сахаразы), гидролизующих углеводы в кишечнике и в целом организме молоди рыб, при действии Раундапа в широком диапазоне концентраций 0,1–50,0 мкг/л установлен тормозящий эффект гербицида при t 20 °С и рН 7,4 [4]. Выявлено, что Раундап оказывает больший эффект на активность гликозидаз в тканях реальной жертвы (извлеченной из желудка хищника) по сравнению с потенциальной. Эти результаты позволили предположить зависимость эффектов гербицида от рН среды.
В процессе изучения влияния Раунда-па на амилолитическую активность в слизистой оболочке кишечника рыб при различных значениях pH и температуры использовалась молодь трех видов пресноводных рыб: тюлька Сlupeonella cultriventris (Nord.) (масса тела 0,55±0,03 г), речной окунь Perca fluviatilis L. (0,63±0,05 г) и карп Cyprinus carpio (L.) (1,33±0,15 г). Окунь и тюлька были выловлены в летний сезон в Рыбинском водохранилище, карп выращен в пруду. В суммарных гомогенатах слизистой оболочки кишечника рыб определяли амилолитическую активность (отражающую суммарную активность ферментов, гидролизующих крахмал – a-амилазы КФ 3.2.1.1, глюкоамилазы КФ 3.2.1.3 и мальтазы КФ 3.2.1.20) модифицированным методом Нельсона [10]. Инкубацию гомогенатов и субстрата (растворимый крахмал в концентрации 18 г/л) проводили в течение
30 мин в 18 вариантах экспериментальных условий с использованием двух концентраций Раундапа (0 и 25 мкг/л), трех значений температуры (0, 10 и 20 °С) и трех значений рН (5,0; 7,4; 8,3). Концентрация Раундапа 25 мкг/л выбрана как действующая на активность гликозидаз, исходя из результатов экспериментов, проведенных ранее [4]. За контроль была принята ферментативная активность при t 20 °С, рН 7,4 в отсутствие Раундапа (концентрация 0 мкг/л). Выбор диапазона температуры и рН для исследования обусловливался тем, что средние сезонные значения температуры для водоемов умеренных широт России составляют 0–3 °С зимой, 10 °С весной и осенью, 20 °С летом, а значения рН в пищеварительном тракте рыб в зависимости от стадии пищеварения варьируют от кислых до слабо щелочных значений [8].
При t 20 º С и рН 7,4 тормозящий эффект Раундапа на амилолитическую активность у карпа составил 20 % (рис. 1), у тюльки – 37 % (рис. 2) от контроля. У окуня достоверного тормозящего эффекта Раундапа отмечено не было (рис. 3).
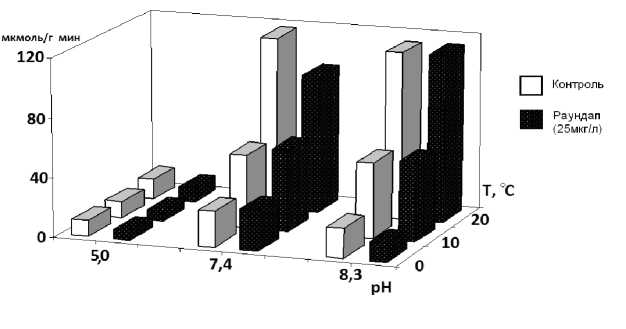
Рис. 1 . Влияние Раундапа на уровень амилолитической активности в кишечнике карпа
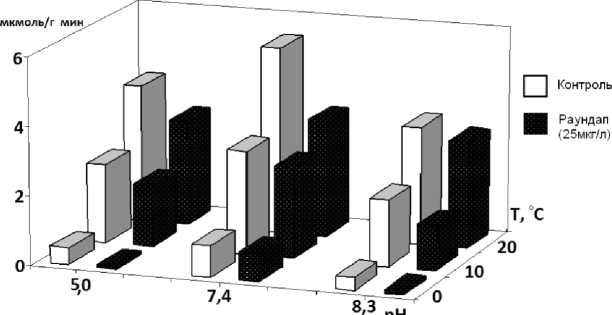
Рис. 2 . Влияние Раундапа на уровень амилолитической активности в кишечнике тюльки
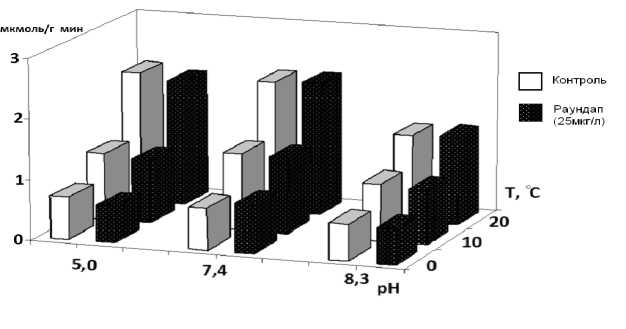
Рис. 3. Влияние Раундапа на уровень амилолитической активности в кишечнике окуня
У карпа тормозящий эффект увеличивался в зоне кислых значений pH в 1,5–2,0 раза, особенно при низкой температуре. У окуня снижение pH не влияло на эффект Раундапа, у тюльки эффект уменьшался при t 20 °С и увеличивался при более низкой температуре. Снижение температуры при pH 7,4 нивелировало тормозящий эффект Раундапа у всех исследованных видов.
В ходе исследования максимальное снижение амилолитической активности отмечено при комплексном действии t 0 °С, pH 5,0 и в присутствии Раундапа: у окуня – на 72 % от контроля, у карпа и тюльки – на 95 и 98 % соответственно. При этом, если у окуня эффект обусловлен в основном совместным действием температуры и pH, то у тюльки и карпа статистически достоверное усиление эффекта отмечено при действии трех факторов.
Сравнительный анализ полученных данных и результатов экспериментов, проведенных на беспозвоночных [2], показал, что при комплексном действии низкой температуры, кислых pH и Раундапа амилолитическая активность снижалась в большей степени в слизистой оболочке кишечника рыб (на 72–98 %), чем в целом организме беспозвоночных (на 29–88 %). Близкие результаты были получены и при щелочных значениях pH. Меньшая чувствительность гликозидаз беспозвоночных животных к действию негативных факторов среды может быть обусловлена большей лабильностью адаптивных механизмов у более простых в эволюционном плане организмов.
Таким образом, изучение амилолитической активности в слизистой оболочке кишечника молоди рыб выявило разные эффекты Раундапа в диапазоне значений температуры от 0 до 20 °С и pH от 5,0 до 8,3. Наибольшее торможение ферментативной активности в присутствии Раундапа показано при кислых значениях рН в кишечнике тюльки и карпа. Снижение температуры при кислых рН усиливает тормозящий эффект Раундапа у молоди всех исследованных видов, при щелочных рН – лишь у тюльки и карпа. Максимальное снижение амилолитической активности отмечено при комплексном действии низкой температуры 0 º С, кислых pH и в присутствии Раундапа: у окуня – на 72 % от контроля, у карпа и тюльки – на 95 и 98 % соответственно. При этом вклад Раундапа в совместный эффект статистически значим.
Список литературы Влияние гербицида раундап на активность гликозидаз в кишечнике молоди рыб при различных значениях pH и температуры
- Алабастер Д. Критерии качества воды для пресноводных рыб/Д. Алабастер, Р. Ллойд. М.: Легкая и пищевая пром-ть, 1984. -344 с.
- Аминов А. И. Влияние гербицида Раундап на амилолитическую активность у рыб и беспозвоночных при различных значениях рН и температуры/А. И. Аминов, И. Л. Голованова//Экология, эволюция и систематика животных: материалы Междунар. науч.-практ. конф. -Рязань: НП «Голос губернии», 2012. -С. 177-178.
- Голованова И. Л. Влияние гербицида Раундап на активность карбогидраз рачкового зоопланктона и молоди плотвы/И. Л. Голованова, Г. А. Папченкова//Токсикол. вестн. -2009. -№ 4. -С. 32-35.
- Голованова И. Л. Влияние гербицида Раундап in vitro на активность карбогидраз молоди рыб/И. Л. Голованова, А. А. Филиппов, А. И. Аминов//Токсикол. вестн. -2011. -№ 5. -С. 31-35.
- Жиденко А. А. Изменения биохимических показателей в печени карпа в условиях действия Раундапа/А. А. Жиденко, Е. В. Бибчук//Современные проблемы теоретической и практической ихтиологии: тез. II Междунар. науч.-практ. конф. -Севастополь, 2009. -С. 50-52.
- Комов В. Т. Природное и антропогенное закисление малых озер северо-запада России: причины, последствия, прогноз: автореф. дис.. д-ра. биол. наук/В. Т. Комов. -СПб.: Ин-т озероведения РАН, 1999. -45 с.
- Папченкова Г. А. Репродуктивные показатели, размеры и активность гидролаз у Daphnia magna в ряду поколений при действии гербицида «Раундап»/Г. А. Папченкова, И. Л. Голованова, Н. В. Ушакова//Биология внутр. вод. -2009. -№ 3. -С. 105-110.
- Сорвачев К. Ф. Основы биохимии питания рыб: эколого-биохимические аспекты/К. Ф. Сорвачев, В. В. Кузьмина. -М.: Легкая и пищевая пром-ть, 1982. -247 с.
- Уголев А. М. Пищеварительные процессы и адаптации у рыб/А. М. Уголев, В. В. Кузьмина. -СПб.: Гидрометеоиздат, 1993. -283 с.
- Уголев А. М. Определение активности инвертазы и других дисахаридаз/А. М. Уголев, Н. Н. Иезуитова//Исследование пищеварительного аппарата у человека. -Л.: Наука, 1969. -С. 192-196.
- Toxicological responses of cyprinus carpio exposed to a commercial formulation containing glyphosate/R. Cattaneo [at al.]//Bull. Environ. Contain. Toxicol. -2011. -Vol. 87, № 6. -P. 597-602.
- Cox С. Glyphosate/С. Cox//Journal of pesticide reform. -2004. -Vol. 24, № 4. -P. 10-15.
- Folmar L. Toxicity of the herbicide glyphosate and several of its formulations to fish and aquatic invertebrates/L. C. Folmar, H. O. Sanders, A. M. Julin//Arch. Environ. Contain. Toxicol. -1979. -Vol. 8, № 3. -P. 269-278.
- Low toxic herbicide Roundup induces mild oxidative stress in goldfish tissues/O. V. Lushchak [at al.]//Chemosphere. -2009. -Vol. 52, № 7. -P. 932-937.
- Sublethal effects of waterborne herbicides in tropical freshwater fish/S. C. Rossi [at al.]//Bull. Environ. Contam. Toxicol. -2011. -Vol. 87, № 6. -P. 603-607.
- Tsui M. T. K. Aquatic toxicity of glyphosate-based formulations: comparison between different organisms and the effects of environmental factors/M. T. K. Tsui, L. M. Chu//Chemosphere, 2003. -Vol. 52, № 7. -P. 1189-1197.


