Влияние гербицида топик на антиоксидантные ферменты (каталазу, супероксиддисмутазу, аскорбат-пероксидазу) в молодых листьях пшеницы
Автор: Бочкарева А.С., Самаркина Е.Н., Аросланкина Ю.Н., Гарькова А.Н., Лукаткин А.С.
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Ботаника и физиология растений
Статья в выпуске: 1, 2010 года.
Бесплатный доступ
Инкубация молодых листьев пшеницы в различных концентрациях гербицида Топик (0,1-10 мкл/л) приводила к изменениям параметров антиоксидантной системы. В большинстве вариантов опыта наблюдалась активация ферментов супероксиддисмутазы (СОД), аскорбат-пероксидазы (АПО) и каталазы в высечках листьев.
Короткий адрес: https://sciup.org/14719497
IDR: 14719497
Текст научной статьи Влияние гербицида топик на антиоксидантные ферменты (каталазу, супероксиддисмутазу, аскорбат-пероксидазу) в молодых листьях пшеницы
Инкубация молодых листьев пшеницы в различных концентрациях гербицида Топик (0,1 —10 мкл/л) приводила к изменениям параметров антиоксидантной системы. В большинстве вариантов опыта наблюдалась активация ферментов супероксиддис-мутазы (СОД), аскорбат-пероксидазы (АПО) и каталазы в высечках листьев.
В современных системах земледелия производство продукции растениеводства должно быть экономически эффективным и экологически безопасным. В то же время многочисленные вредные объекты, такие как болезни, вредители и сорняки, значительно повышают затраты на производство сельскохозяйственной продукции. Сорные растения в процессе совместного произрастания с полевыми культурами приспособились к существованию в агроценозах. Применяемые сегодня различные меры борьбы с сорным компонентом позволяют снизить засоренность посевов, но полностью избавиться от сорняков не удается [5]. Поскольку подавление сорняков одними агротехническими и фитоценотическими способами не всегда дает желаемые результаты, для их уничтожения используют гербициды (Ю].
Химический метод борьбы с сорняками в посевах зерновых культур, несомненно, является одним из наиболее эффективных и рентабельных. Однако это неизбежно приводит к попаданию больших количеств химических препаратов в окружающую среду, где гербициды могут воздействовать на не целевые растения [1]. Широкое использование гербицидов в сельском хозяйстве требует разработки высокочувствительных методов оценки влияния токсичных веществ на живые организмы, а также изучения механизмов их гербицидного действия на различные виды культурных и сорных растений [4]. Это особенно актуально в настоящее время, так как появляется все больше сведений о том, что при длительном использовании гербицидов происходят изменения в видовом составе растений, образуются биотипы сорняков, обладающих повышенной устойчивостью к химическим препаратам [9; 11].
В литературе есть много сведений о негативном влиянии гербицидов на физиологические процессы в растениях: угнетении фотосинтеза, дыхания, синтеза необходимых веществ. Проявление токсического действия гербицидов может выражаться в ингибировании антиоксидантных ферментов [12]. Данные вещества защищают растение от активированных форм кислорода (АФК). При действии гербицидов наблюдается такое явление, как «окислительный стресс», характеризующийся повышением содержа- ния АФК с одновременным снижением активности антиоксидантных ферментов [14]. Это может привести к повреждению нуклеиновых кислот, белков, ингибированию фотосинтеза, торможение клеточного цикла [14].
Под влиянием стрессовых условий окружающей среды в клетках растений активизируются процессы свободнорадикального окисления, в результате чего нарушаются структура биологических мембран и физиолого-биохимические процессы. Важную роль в защите от негативного воздействия свободных радикалов играют ферменты антиоксидантной защиты [3].
Целью данной работы было изучение кратковременного (до 3 ч) влияния гербицида Топик на активность антиоксидантных ферментов, в частности аскорбат-пероксида-зы, каталазы и супероксиддисмутаэы в листьях пшеницы.
Объектами исследования служили листья молодых (7 — 1 t-дневных) растений пшеницы Triticum aestivum L. «мироновская 808». Растения выращивали в лабораторных условиях в сосудах с почвой при температуре 22 — 25 ’С, освещении люминесцентными лампами интенсивностью 5 000 лк и продолжительности светового дня, равной 12 ч. Высечки листьев пшеницы замачивали в разных концентрациях гербицида Топик (10 мкл/л, 1 мкл/л и 0,1 мкл/л) в течение 1-3 ч с последующим определением активности СОД, АПО и каталазы. В качестве контроля использовали дистиллированную воду.
Топик — послевсходовый гербицид для борьбы с овсюгом и другими однолетними злаковыми сорняками в посевах яровой и озимой пшеницы. Действующее вещество -клодинафоп-пропаргил (химический класс арилоксифеноксипропилаты) + антидот клоквинтосет-мексил (80 г/л + 20 г/л). Топик обладает системным действием, проникает в растение через листья и стебли и распространяется по нему, накапливаясь в точках активного роста. Действующее вещество гербицида быстро гидролизуется с образованием свободных кислот, которые подавляют ферменты, катализирующие биосинтез жирных кислот в меристематических тканях. В результате прекращается образование клеточных мембран в точках роста [10]. Визуальные симптомы повреждения — ранняя остановка роста, некроз на кончиках и краях листьев, отмирание мери-стемной ткани; полная гибель сорняков наступает через 1—3 недели [8; 9]. Антидот способствует тому, что в тканях пшеницы действующее вещество Топика быстро преобразуется в нейтральные метаболиты, которые не оказывают отрицательного влияния на культуру.
Активность СОД определяли методом, основанным на восстановлении нитросинего тетразолия (ИСТ) супероксидным радикалом с образованием голубых формазанов НСТ [6]. К 2,6 мл ферментной фракции, содержащей СОД, в определенном порядке добавляли компоненты реакционной среды: 0,1 мл 13 мМ L-метионина; 0,05 мл 75 мкМ НСТ; 0,1 мл 0,1 мМ ЭДТА и 0,1 мл 2 мМ рибофлавина. Реакцию запускали добавлением рибофлавина с последующей 20-минутной инкубацией на белом свету (освещенность 4 000 лк). Измерения проводили против контрольного варианта, выдержанного в темноте. Оптическую плотность измеряли на спектрофотометре СФ-46 (ЛОМО, Россия) при длине волны 560 нм. За единицу активности СОД принимали 50 %-е ингибирование образования формаза-на [6].
Активность аскорбат-пероксидазы определяли по методике [6] с некоторыми модификациями. Высечки листьев массой 1 г гомогенизировали в 10 мл 50 мМ фосфатного буфера (pH = 7,6) с добавлением 0,3 г по-ливинилпирролидона. Полученную смесь фильтровали и центрифугировали 10 мин при 8 000 g. Реакционная смесь состояла из 50 мкл 0,1 мМ этилендиаминтетраацетата (ЭДТА), 300 мкл 0,05 мМ аскорбиновой кислоты, 50 мкл мМ перекиси водорода, 2,55 мл фосфатного буфера (pH = 7,6) и 50 мкл полученного при центрифугировании экстракта. Оптическую плотность регистрировали на спектрофотометре СФ-46 при длине волны 290 нм. Контролем служила смесь, состоящая из 2,75 мл фосфатного буфера (pH = 7,6), 50 мкл ЭДТА, 50 мкл перекиси водорода, 150 мкл аскорбиновой кислоты (без ферментного экстракта) [6]. При расчете активности аскорбатпероксидазы использовали понижение оптической плотности раствора за первые 30 с реакции, с последующим расчетом активности по коэффициенту молярной ЭКСТИНКЦИИ Е = = 2,8 мМ-1 см"1.
Для определения активности каталазы 1 г листовой ткани растирали с 10 мл 50 мМ фосфатного буфера (pH = 7,0). Гомогенат фильтровали и центрифугировали 10 мин при 8 000 g. К 2,9 мл фосфатного буфера приливали 25 мкл полученного ферментного экстракта и непосредственно перед измерением добавляли 90 мкл 3 % перекиси водорода. На СФ 46 при длине волны 240 нм измеряли падение оптической плотности за 1 мин и активность рассчитывали в ммоль/г навески х мин с использованием коэффициента молярной экстинкции £ = 39,4 мМч см~* [6].
Статистическую обработку полученных результатов проводили с помощью программы Fri-matrix. Каждый опыт повторялся в трех повторностях. На графиках представлены средние значения из всех опытов с их стандартными ошибками.
Из полученных результатов видно, что активность антиоксидантных ферментов изменялась в динамике действия гербицида и зависела от его концентрации. Так, активность каталазы была самой высокой при концентрации гербицида 10 мкл/л (спустя 3 ч инкубации) (рис. 1) Наименьшую активность наблюдали при концентрации гербицида 0,1 мкл/л. В ходе выдерживания высечек листьев в гербициде Топик наблюдали изменения активности каталазы: если в первые 1 —2 ч она была минимальной и не зависящей от концентрации препарата, то спустя 3 ч заметно возрастала прямо пропорционально увеличению концентрации гербицида (см. рис. 1). Очевидно, это свидетельствует о возникновении окислительного стресса в высечках листьев, так как каталаза — инцубельный фермент, синтез которого резко усиливается при повышении Н2О2 в клетках растений.
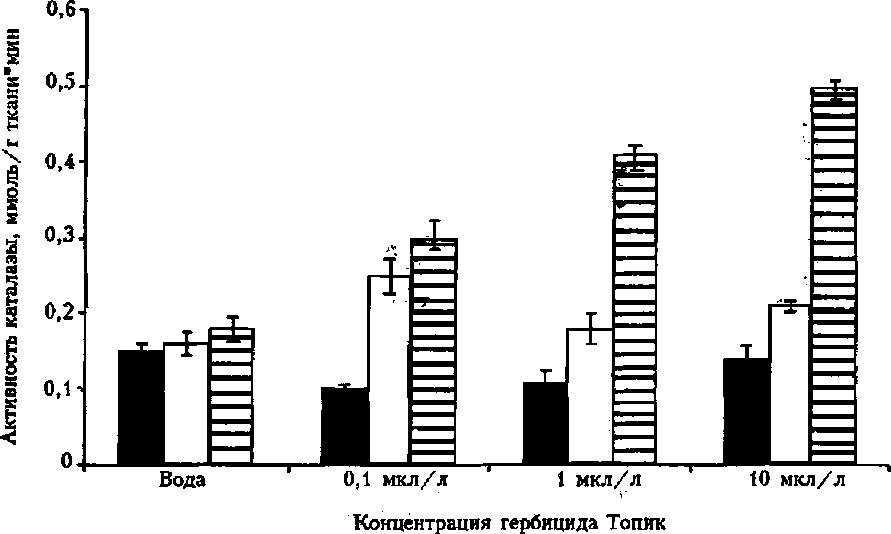
■ 1ч □ 2 ч 83 ч
Рисунок /
Активность каталазы в листьях пшеницы, инкубируемых в гербициде Топик различной концентрации в течение 1, 2, 3 ч
Различия, выявленные в активности каталазы в листьях пшеницы при выдерживании, связаны с функционированием АО-систем в ее клетках. Степень изменения активности каталазы связана с развитием окислительного стресса при действии гербицида [9].
В листьях пшеницы при выдерживании в течение 1 ч наблюдали снижение активности каталазы, а спустя 2 и 3 ч — заметное увеличение активности, достигающее 127 % к контролю через 3 ч инкубации.
Активность СОД в листьях пшеницы нелинейно изменялась в динамике выдер живания в гербициде (рис. 2). Выдерживание листьев в течение 1 ч привело к незначительному увеличению активности СОД при концентрациях гербицида 1 и 10 мкл/л и к уменьшению активности — при концентрации 0,1 мкл/л. Таким образом, по мере уменьшения концентрации гербицида наблюдали снижение активности СОД; это согласуется с данными, приведенными в [2]. После 2 ч выдерживания во всех концентрациях гербицида активность СОД в листьях пшеницы возросла, увеличение достигало двукратного при концентрации 10 мкл/л;
по мере снижения концентрации гербицида Топик видно незначительное уменьшение активности СОД.
При выдерживании в течение 3 ч наблюдали заметное снижение активности фермента по сравнению с контролем (см. рис. 2). Сравнение активности СОД при выдерживание листьев пшеницы в течение 1, 2 и 3 ч показало, что наибольшая актив ность наблюдалась после двухчасовой инкубации в гербициде концентрации 10 мкл/л. Можно заключить, что в нашем эксперименте показано негативное влияние гербицида Топик на антиоксидантную систему. Это выражалось в небольшой инактивации СОД, прогрессирующей с повышением концентрации и удлинением экспозиции высечек листьев в растворах гербицида.
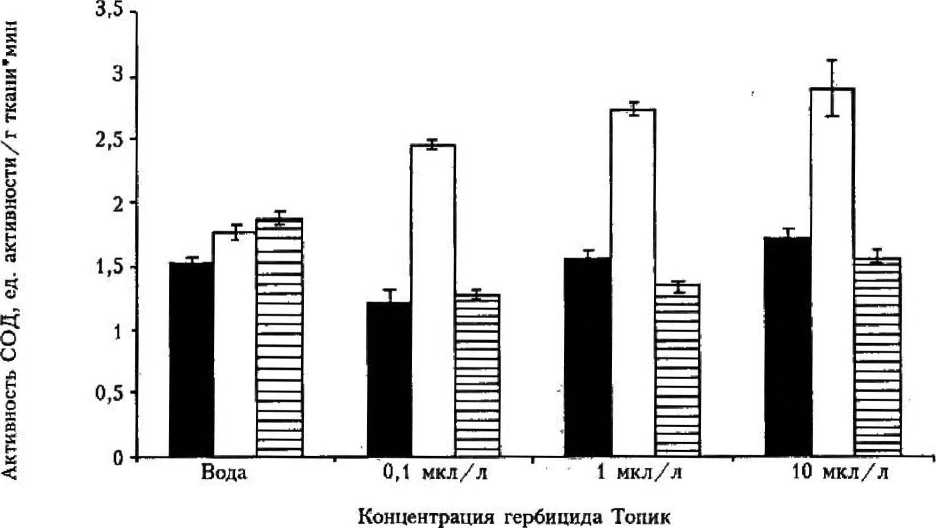
■ 1ч □ 2 ч В 3 ч
Рисунок 2
Активность СОД в листьях пшеницы, инкубируемых в гербициде Топик различной концентрации в течение 1, 2, 3 ч
В активности АПО наблюдали заметные концентрационные различия при одночасовом выдерживании в гербициде (рис. 3). При этом максимальная активность (на 35 % выше контроля) была при концентрации 10 мкл/л, тогда как в концентрациях 1 и 0,1 мкл/л наблюдалось снижение активности по сравнению с контролем (аналогично показанному в [13]). При удлинении инкубации происходило почти линейное повышение активности АПО. Чем выше концентрация гербицида, тем более выраженной была активация фермента.
На основании проведенных опытов можно сделать заключение: 1) гербицид Топик ингибировал активность ферментов (примерно на 3 %) по сравнению с контро лем (вода); 2) увеличение длительности инкубации высечек листьев в растворе гербицида приводило к дальнейшему падению активности; 3) с увеличением концентрации гербицида активность окислительных ферментов снижается более значительно. Таким образом, можно сделать вывод, что применение гербицидов в сельском хозяйстве в неумеренных дозах может привести не только к накоплению гербицидов, но и к гибели растений. Учитывая большую работу, проводимую в области создания новых пестицидов и подбора ассортимента, можно надеяться, что будет уменьшаться вредное воздействие и увеличиваться избирательность действия гербицидов на различные живые организмы.
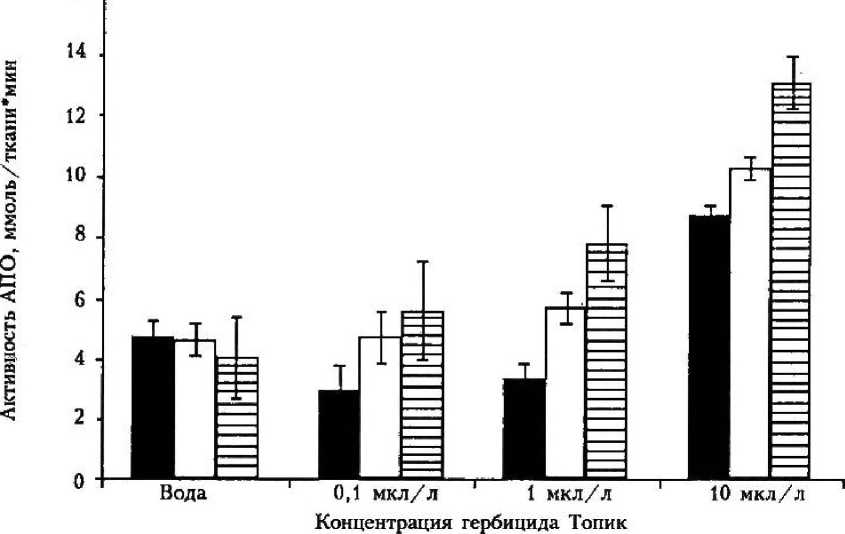
■ 1ч □ 2 ч §3 ч
Рисунок 3
Активность АПО в листьях пшеницы, инкубируемых в гербициде Топик различной концентрации в течение 1, 2, 3 ч
Список литературы Влияние гербицида топик на антиоксидантные ферменты (каталазу, супероксиддисмутазу, аскорбат-пероксидазу) в молодых листьях пшеницы
- Баздырев Г. И. Земледелие/Г. И. Баздырев. -М.: Космос, 2008. -45 с.
- Бараненко В. В. Супероксиддисмутаза в клетках растений/В. В. Бараненко//Цитология. -2006. -Т. 48, № 6. -С. 465-473.
- Владимиров Ю. А. Свободные радикалы в первичных фотобиологических процессах/Ю. А. Владимиров//Биол. мембраны. -1998. -Т. 15, вып. 5. -С. 517-529.
- Захаренко В. А. Гербициды/В. А. Захаренко. -М.: Агропромиздат, 1990. -48 с.
- Зинченко В. А. Химическая защита растений. Средства технологии и экологическая безопасность/В. А. Зинченко. -М.: Космос, 2005. -35 с.
- Лукаткин А. С. Холодовое повреждение теплолюбивых растений и окислительный стресс/А. С. Лукаткин. -Саранск: Изд-во Мордов. ун-та, 2002. -208 с.
- Мартыненко В. И. Пестициды: справочник/В. И. Мартыненко. -М.: Агропромиздат, 1992. -268 с.
- Мельников Н. Н. Пестициды: химия, технология и применение/Н. Н. Мельников. -М.: Химия, 1987. -710 с.
- Спиридонов Ю. Я. Методическое руководство по изучению гербицидов, применяемых в растениеводстве/Ю. Я. Спиридонов, Г. Е. Ларина, В. Г. Шестаков. -М.: Печат. город, 2009. -252 с.
- Справочник пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации. -М.: Агрорус, 2003. -660 с.
- Структурно-функциональные характеристики различных типов пестицидов/С. А. Кириан, Л. Ш. Семеньтева, Е. А. Контор, Л. А. Тюрина//Агрохимия. -2008. -№ 2. -С. 22-25.
- Федтке К. Биохимия и физиология действия гербицидов/К. Федке. -М.: Агропромиздат, 1985. -223 с.
- Duke S. O. Natu ral products as sou rces for new mechanisms of herbicidal action/S. O. Duke, J. G. Romagni, F. E. Dayan//Crop Protection. -2000. -V. 19, № 8-10. -Р. 583-589.
- Hassan N. M. Oxidative stress in herbicide-treated broad bean and maize plants/N. M. Hassan, M. M. Nemat Alla//Acta Physiologiae Plantarum. -2005. -V. 27, № 4A. -P. 429-438.


