Влияние гербицидов на образование перекиси водорода в изолированных вакуолях красного корня свеклы (Beta vulgaris L.)
Автор: Прадедова Е.В., Нимаева О.Д., Карпова А.Б., Саляев Р.К.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.11, 2015 года.
Бесплатный доступ
Исследовано влияние гербицидов на образование перекиси водорода в вакуолярных экстрактах красной свеклы (Beta vulgaris L.). Использовались различные химические классы гербицидных соединений. Гербициды отличаются друг от друга механизмом воздействия на растения. Клопиралид (гербицид ароматических кислот, производное пиколиновой кислоты) и 2,4-D (феноксиуксусный гербицид), характеризующийся гормоноподобными эффектами, способствовали образованию H 2 O 2 в вакуолярных экстрактах. Фтордифен (гербицид нитрофенилового эфира) и диурон (карбамид-гербицид) также имеют повышенное содержание H 2 O 2. Эти соединения ингибируют перенос электронов, фотосинтез и фотодыхание на чувствительных растениях. Гербицидный эффект глифосата (фосфорорганического гербицида) обусловлен ингибированием синтеза аминокислот в растительных клетках. Глифосат не влиял на содержание H 2 O 2 в вакуолярных экстрактах. Гербицидное зависимое образование H 2O 2 не происходило с ингибиторами оксидоредуктазы, цианидом калия и азидом натрия. Результаты показывают, что образование ROS в вакуолях связано с активностью оксидоредуктаз, которые могут взаимодействовать с гербицидами.
Короткий адрес: https://sciup.org/14323970
IDR: 14323970
Текст научной статьи Влияние гербицидов на образование перекиси водорода в изолированных вакуолях красного корня свеклы (Beta vulgaris L.)
Интенсивное образование активных форм кислорода (АФК), называемое окислительным взрывом, у растений происходит при действии многих факторов окружающей среды. В растительных клетках АФК образуются в клеточных структурах, т.е. локально. В нормальных условиях этот процесс является регулируемым, он протекает, как правило, при одновременной активации систем, синтезирующих АФК, и антиоксидантных систем (Lamb, Dixon, 1997). Благодаря тесной взаимосвязи между АФК-генерирующими и -утилизирующими процессами, осуществляется контроль над интенсивностью окислительных реакций в клеточных компартментах.
Локальные АФК-генерирующие редокс-системы растительных клеток достаточно активно исследуются у таких клеточных структур, как хлоропласты, митохондрии, пероксисомы, клеточные стенки и ядра (Poleskaja, 2007). В то же время у центральной вакуоли эти системы остаются малоизученными, хотя этот компартмент растительной клетки содержит редокс-ферменты и редокс-активные низкомолекулярные соединения, которые могут быть потенциальными источниками АФК (Ferreres et al., 2011). На сегодня в вакуолярном содержимом растений выявлены такие редокс-ферменты, как: фенольная пероксидаза (POX, EC 1.11.1.7) и Cu,Zn-супероксиддисмутаза (Cu,Zn-SOD, EC 1.15.1.1) (Deepesh, 2000; Baranenko, 2006). Известно, что POX, в зависимости от условий, определяющих редкс-состояние кофермента (гемина), не только восстанавливает H2O2 до H2O, но и генерирует O2•– (Lamb and Dixon,1997; Bolwell et al., 1999). Дисмутацию 2O2•–, в результате которой образуется H2O2 значительно ускоряет SOD (Baranenko, 2006). Таким образом, оба фермента, относимые к антиоксидантам, в действительности могут быть активными генераторами АФК.
В вакуолярном компартменте, также как и в любом другом компартменте клетки, где существует тандем POX и SOD, образуется H2O2. Однако до сих пор не установлено, какие условия или факторы среды являются триггером для АФК-генерации в вакуолях. Имеются единичные работы, в которых показано образование АФК в вакуолярном содержимом. Например, у растений гороха (Pisum sativum L.), обработанных кадмием, отмечали многократное повышение H2O2 и O2•– возле вакуолярной мембраны в клетках обкладки сосудистых пучков. Если H2O2 накапливалась главным образом с цитоплазматической стороны тонопласта, то O2•– был сосредоточен в вакуолярном содержимом (Romero-Puertas et al., 2004). Следовательно условием для АФК-генерации в вакуолях мог служить токсический эффект тяжелых металлов. Возможно, токсическое действие гербицидов тоже будет одним из таких условий. Следует отметить, что гербициды определенных классов являются субстратами для оксидаз (фенолоксидаз, POX и др.). Например, POX кукурузы инактивировала некоторые триазины, которые при окислении или гидроксилировании теряли гербицидную активность (Gruzdev, 1987). А POX из хрена взаимодействовала с гербицидом 2.4-Д (Rogozhin, 2004). Лакказы грибов и бактерий участвовали в биохимической трансформации гербицида диурона (Vieira et al., 2015). Известно, что после окислительного преобразования оксидазами некоторые соединения, вступая в реакцию с молекулярным кислородом, способствуют образованию АФК, т.е. играют роль вторичных генераторов. Например, гербициды дипиридилы, в результате вторичного окисления кислородом, служили источником гидроперекисных радикалов (Gruzdev, 1987). Очевидно, что сами гербициды или продукты их химического преобразования могут быть первичными или вторичными генераторами АФК. Ранее установили, что некоторые из них действительно вызывали у растений окислительный взрыв (Romero-Puertas et al., 2004). Например, интенсивная генерация АФК в хлоропластах происходила при обработке растений гербицидом паракватом (N,N-диметил-4,4-дипиридилия дихлорид) (Fuerst et al., 1985). Источником АФК служил радикал гербицида, который являлся продуктом реакции восстановления параквата дегидрогеназами (Gruzdev, 1987). Активное образование H2O2 и O2•– наблюдали у растений гороха, после обработки гербицидом 2.4-Д (Romero-Puertas et al., 2004). Эти исследования и ряд других позволили прийти к заключению, что в основе механизма, с помощью которого упомянутые гербициды проявляют свою активность, лежит АФК-генерация, приводящая к развитию окислительного стресса. Несмотря на активное исследование физиолого-биохимических свойств гербицидов разных классов, многие аспекты их токсикологического действия до сих пор остаются неизученными. Возможно, чрезмерное образование АФК в субклеточных структурах, вызываемое определенными гербицидами, является одним из факторов, ослабляющим защитные системы клеток у чувствительных растений. В связи с этим выявление эффекта гербицидов на генерацию H2O2 в вакуолях клеток растений явилось основной задачей настоящего исследования.
MATERIALS AND METHODS
Объектом исследования служили вакуоли, изолированные из клеток корнеплодов столовой свеклы ( Beta vulgaris L.) сорта Бордо. Использовали модифицированный макрообъемный метод выделения вакуолей (Salyaev et al ., 1981).
Изолированные вакуоли разрушали и получали вакуолярные экстракты. Для этого органеллы подвергали осмотическому шоку в гипотоническом растворе (50 мМ трис/HCl, рН 6.5). Полученный лизат центрифугировали при 13500 g 10 мин.
В вакуолярных экстрактах определяли Н2О2 при помощи FOX-метода, основанного на изменении окраски ксиленолового оранжевого (o-cresolsulfonephthalein-3´-3´-bis-[methyliminodiacetic acid sodium salt]) (Galletti et al., 2008). Общие детали эксперимента состояли в следующем. Аликвоту вакуолярного экстракта инкубировали в среде инкубации (25 мМ трис-пропан/HCl, рН 5.5 или pH 8.0) в течение 15 мин. В среду инкубации с вакуолярным экстрактом вносили испытуемые соединения. В том случае, когда выявляли АФК-генерирующую активность вакуолей, использовали среды инкубации с pH 8.0 (Bolwell et al., 2001). В каждый опытный вариант добавляли одно или несколько ниже указанных соединений (их сочетание в пробе можно увидеть в описании результатов). Конечная концентрация в среде инкубации каждого исследуемого соединения составила: 10 мкМ NADH; 5 у.е. SOD быка; 1 мкг/мл каталазы из бычьей сыворотки; 50 мкМ салициловой кислоты. Если исследовали влияние гербицидов на АФК-генерацию, то использовали среды с pH 5.5, т.к. слабо кислые условия близки к физиологическим условиям вакуолярной среды. В среды инкубации каждого опытного варианта добавляли одно из перечисленных соединений в конечной концентрации: 10 мкМ 2.4-Д (2.4-дихлорфеноксиуксусной); 10 мкМ глифосата (N-(фосфонометил)-глицин); 10 мкМ диурона (3-[3,4-дихлорофенил]-1,1-диметилмочевина); 10 мкМ фтородифена (4-нитрофенил-2′-нитро-α,α,α-трифтор-n-толиловый эфир); 10 мкМ клопиралида (3,6-дихлорпиридин-2-карбоновая кислота). В том случае, когда определяли эффект ингибиторов оксидоредуктаз, готовили отдельные варианты с выше перечисленными гербицидами, в которые вносили KCN (10 мкМ) и NaN3 (50 мкМ). Известно, что цианид, азид и глифосат взаимодействуют с ионами железа. Для вариантов с этими соединениями, а также для вариантов с другими испытуемыми соединениями, готовили контрольный вариант, который отличался тем, что не содержал вакуолярный экстракт. Это давало возможность учитывать влияние соединений на реагент ксиленолового оранжевого.
После 15-мин инкубации при 25°С в реакционную среду вносили охлажденный ацетон (1 : 2, среда : ацетон), выдерживали на холоде 10 мин, затем центрифугировали в течение 15 мин при 13500 g. Таким образом удаляли белок. Образцы переносили в чистые пробирки и добавляли реагент (в соотношении 1 : 1), содержащий: 0,5 мМ сульфата аммония железа (FeH 8 N 2 O 8 S 2 ∙ 6H 2 O); 50 мM H 2 SO 4 ; 100 мM сорбита; 250 мкМ ксиленолового оранжевого. После 45-мин инкубации прореагировавшую смесь центрифугировали 5 мин при 13500 g. Затем смесь вносили в лунки планшета и проводили измерение оптической плотности на микропланшетном фотометре (ImmunoChem–2100, USA) при длине волны 595 нм (Jiang et al ., 1990; Garcia et al ., 2000).
Количество пероксида водорода рассчитывали по калибровочной кривой, построенной для H 2 O 2 . Содержание выражали в мкмолях Н 2 О 2 на мг белка, последний определяли в экстрактах по методу Bradford (1976).
При сравнении результатов сопоставляли процентное соотношение концентраций Н 2 О 2 опытных образцов. За 100% брали содержание Н 2 О 2 в варианте с вакуолярным экстрактом, не содержащим каких-либо испытуемых соединений.
Проводили модельный эксперимент с пероксидазой хрена , с целью установить вклад пероксидаз в генерацию H 2 O 2 . Для этого готовили раствор пероксидазы из корней хрена (1 мг/10 мл)
в среде, содержащей 25 мМ трис/HCl (рН 6.5). Ход анализа и варианты опыта соответствовали опыту с вакуолярным экстрактом.
Эксперименты были выполнены в 4-5 биологических повторностях. На гистограммах представлены средние арифметические значения и средние квадратичные отклонения величин, отражающих процентное содержание Н 2 О 2 .
В работе использовали реактивы производства Sigma (США).
RESULTS
На первом этапе исследования необходимо было установить, может ли H 2 O 2 образовываться в вакуолярном содержимом клеток корнеплодов столовой свеклы. Ранее интенсивная генерация H 2 O 2 при наличии NADH была показана на экстрактах апопласта клеток фасоли ( Phaseolus vulgaris L.). Обязательным условием для АФК-генерирующих реакций были относительно высокие значения pH среды, несмотря на то, что pH апопласта в среднем близок к 5.5. Высказывалось предположение о ведущей роли POX апопласта в продукции АФК (Bolwell et al ., 1999, 2002). Образование H 2 O 2 в апопласте у ряда растений наблюдали и при взаимодействии POX с салициловой кислотой (SA). Согласно полученным результатам, основными продуктами такого взаимодействия являлись O 2•– и радикал SA (Kawano, Muto 2000).
Если к вакуолярному экстракту добавляли NADH и SA, то происходило слабое увеличение содержания H2O2, в среднем на 20% (Рис. 1). В среды инкубации кроме этих соединений в отдельные варианты вносили SOD – фермент, катализирующий реакцию дисмутации 2O2•–, в результате которой образуется H2O2. А также добавляли каталазу – фермент, который разлагает H2O2 до H2O. В вариантах с SOD и NADH концентрация H2O2 повышалась на 40%, а в вариантах с SOD и SA – на 50%, от значений контрольного варианта. При наличии каталазы в среде с NADH содержание H2O2 снижалась на 60% от значений опытного варианта или на 10-20% от значений контрольного варианта. А в варианте с салициловой кислотой каталаза оказалась не эффективной, видимо из-за того, что SA является ингибитором фермента. Этот эксперимент позволил оценить чувствительность используемого метода и его эффективность для нашего объекта исследования, который представлял вакуолярное содержимое в буферном растворе на основе триса.
Следует отметить, что особенность используемого нами метода заключалась в окислении Fe 2+ до Fe 3+ пероксидом водорода в присутствии сорбита. Окисленный ион Fe 3+ формировал комплекс с ксиленоловым оранжевым, изменяя цвет и спектр поглощения реагента. Полагают, что в целом этот метод достаточно специфичный, однако хелатирующие белки и агенты, восстанавливающие или окисляющие ионы железа, могут влиять на развитие реакции. По этой причине некоторые исследователи для определения специфичности реакции в своих экспериментах применяли каталазу (Jiang et al .,
1990; Garcia et al ., 2000). Проверка специфичности окраски в наших образцах показала, что с каталазой снижение концентрации Н 2 О 2 в контроле было не столь значительным, как можно было бы ожидать. Оно составило 20-25% от значений контрольного варианта (варианта, содержащего только вакуолярный экстракт) (Рис. 1). Возможно, каталаза, обладающая низким сродством к Н 2 О 2 и активно функционирующая при его высоких концентрациях, была малоэффективной в условиях нашего эксперимента. Хотя повышение концентрации Н 2 О 2 с NADH и SOD, и резкое ее снижение на фоне каталазы, свидетельствовало в пользу специфичности наблюдаемых реакций и эффективности каталазы. Поскольку в наших образцах, как и в любых других образцах растительного происхождения, присутствовали низкомолекулярные соединения, которые могли взаимодействовать с агентами реакционной среды, можно было допустить наличие неспецифичных взаимодействий, которые следовало учитывать при интерпретации результатов последующих экспериментов. В целом, полученные данные позволили заключить, что в вакуолях может образовываться Н 2 О 2 , т.е. органеллы содержат системы, способные синтезировать это соединение при определенных условиях.
В дальнейших экспериментах, когда к вакуолярному содержимому добавляли различные гербициды, в отдельных случаях наблюдали заметное повышение концентрации H 2 O 2 (Рис. 2). Увеличение концентрации H 2 O 2 , в среднем на 30-
40% от контрольных значений, вызывали такие гербициды, как диурон, фтородифен и клопиралид. В том случае, когда в среды инкубации наряду с гербицидом вносили каталазу, содержание H 2 O 2 снижалось. Никакого повышения H 2 O 2 не происходило и при наличии одного из ингибиторов KCN или NaN 3 . Известно, что оба соединения угнетают активность оксидоредуктаз, содержащих в активном центре железо и медь, в том числе POX, фенолоксидаз, Cu,Zn-SOD и др.
Обращало на себя внимание то, что не все из исследуемых гербицидов оказывали выраженный стимулирующий эффект на образование H 2 O 2 . Например, на фоне 2.4-Д концентрация H 2 O 2 повышалась в среднем на 20%, а при наличии глифосата достоверного повышения H 2 O 2 не происходило (Рис. 2).
Подавление синтеза пероксида водорода KCN и NaN3 указывало на участие в этом процессе каталитических белков – по всей видимости, гем-содержащих оксидоредуктаз. На сегодня в вакуолярном содержимом клеток растений из гемсодержащих ферментов, потенциальных претендентов на участие в АФК-генерации, выявлена POX. Вакуолярная POX представлена многочисленными изоформами, субстратная специфичность которых до сих пор мало изучена (Ferreres et al., 2011). Учитывая широкую субстратную специфичность изопероксидаз, можно предположить, что гербициды служили субстратами для POX вакуолей. На данном этапе работы проверить это предположение можно было с помощью модельного эксперимента с POX из корней хрена. Однако известно, что POX разного происхождения могут сильно отличаться по субстратной специфичности. Тем ни менее эффект некоторых гербицидов можно было наблюдать и в эксперименте с POX хрена (Рис. 3). При наличии в среде инкубации фтородифена концентрация H2O2 возрастала на 60-80% по сравнению с контролем, не содержащим гербицид. А в опытных вариантах с 2.4-Д, как и в эксперименте с вакуолярным экстрактом, повышение концентрации H2O2 было не таким выраженным и соответствовало 20-30%. В то же время, глифосат, диурон и клопиралид в случае с POX хрена оказались неэффективными, хотя два последних гербицида в вакуолярных экстрактах стимулировали образование H2O2 (Рис. 2, 3).
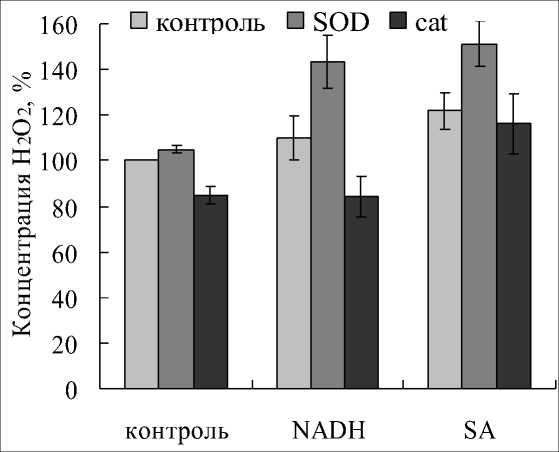
Figure 1. Содержание пероксида водорода в вакуолярных экстрактах при наличии соединений: NADH;
салициловая кислота (SA); супероксиддисмутаза (SOD); каталаза (cat).
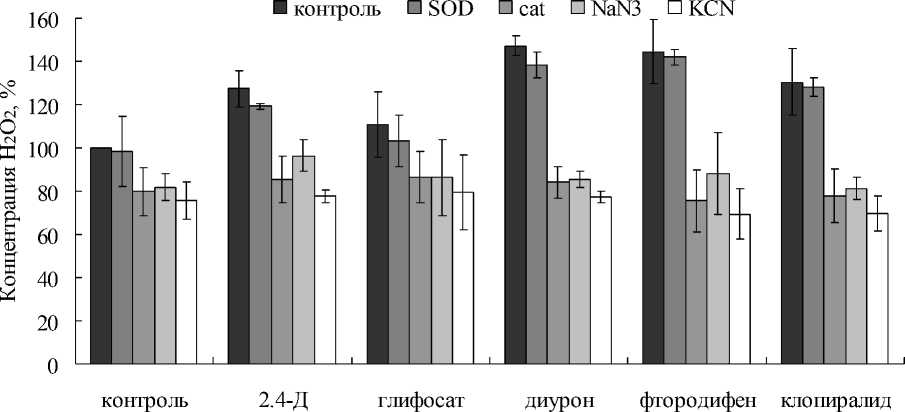
Figure 2. Содержание H 2 O 2 в вакуолярных экстрактах при наличии в реакционной среде гербицидов (2.4-Д, глифосат, диурон, фтородифен и клопиралид), каталазы (cat), SOD и ингибиторов оксидоредуктаз (KCN и NaN 3 ).
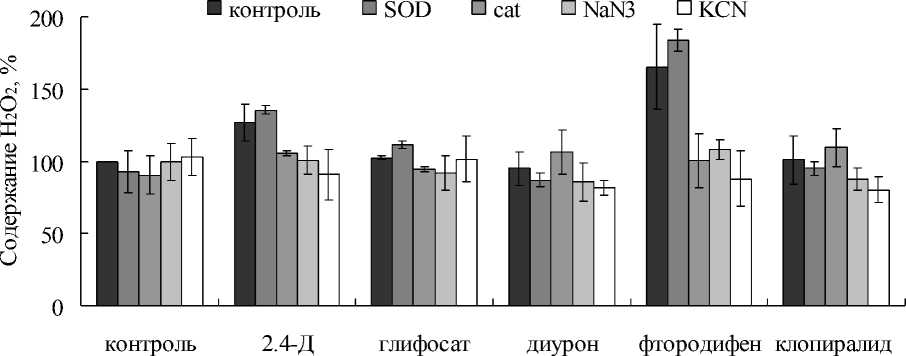
Figure 3. Образование H 2 O 2 в среде, содержащей POX из корней хрена, а также гербициды (2.4Д, глифосат, диурон, фтородифен и клопиралид), каталазу (cat), SOD и ингибиторы оксидоредуктаз (KCN и NaN 3 ).
DISCUSSION
Основным объектом исследования служил вакуолярный экстракт, который получали в результате разрушения вакуолей в гипотоническом буферном растворе. Мы не использовали интактные изолированные вакуоли по причине неодинаковой проницаемости гербицидов через клеточные мембраны. Известно, что проникновение ксенобиотиков в клетки регулируется в основном их липофильностью. Чем выше липофильность гербицидов, тем быстрее они преодолевают мембранный барьер. Однако для соединений, подобных клопиралиду, т.е. являющихся слабыми кислотами, поглощение и удержание в клетке требует целостности мембран и высокого мембранного градиента H+, который формируют АТФ-зависимые насосы (Devine et al.,1987). Тогда как для гербицидов 2.4-Д и глифосата характерно опосредованное поглощение посредством переносчиков (Devine et al.,1987). Учитывая эти обстоятельства для того, чтобы создать равные реакционные условия, одним из которых являлось определенное время инкубации, гербициды добавляли сразу к вакуолярному содержимому.
В работе использовали гербициды различной химической природы и разного механизма действия на растения. Несмотря на то, что токсическое действие гербицидов определяется их химической природой, соединения разных классов гербицидов, различающихся по структуре, иногда могут оказывать одинаковый эффект. Например, клопиралид и 2.4-Д. Клопиралид является пиридиновым соединением, синтезированным на основе пиколиновой кислоты, а 2.4-Д – представитель класса арилоксиалканкарбоновых кислот. Клопиралид и 2.4-Д по механизму действия относят к гербицидам ауксинового типа. Оба соединения воздействуют на удлинение клеток, подобно ауксину стимулируют синтез этилена, который в чрезмерных количествах приводит к торможению роста у активно растущих растений (Hall et al., 1985). Следует отметить, что растения свеклы обладают устойчивостью к клопиралиду, но чувствительны к 2.4-Д, при этом эффект последнего зависит от дозы и фазы развития растения (Zaharichev, 2007). Благодаря дозозависимому эффекту, а также сходству с ауксинами, 2.4-Д находит широкое применение в лабораторных исследованиях (Romero-Puertas et al., 2004). В отличие от других гербицидов, для которых установлены определенные «биохимические мишени» в клетках, специфичность действия 2.4-Д до сих пор мало изучена, несмотря на то, что в течение последних десятилетий был выявлен целый ряд эффектов гербицида на клетки растений. Например таких, как: снижение содержания углеводов; стимуляция фотодыхания; ингибирование активности фотосистемы II; ингибирование фиксации СО2; активация синтеза этилена; стимулирование активности ферментов (фосфолипазы А2, цитохрома Р-450, НАДН-оксидазы, гидроксилаз) и др. При этом неоднократно отмечали, что применение ауксинподобных гербицидов приводило к гибели клеток из-за развития окислительного стресса, вызванного интенсивным образованием АФК. Например, на растениях гороха показано резкое увеличение концентрации H2O2 после обработки 2.4-Д, однако источник АФК не был установлен (Romero-Puertas et al., 2004). В наших исследованиях гербициды ауксинового ряда, 2.4-Д и клопиралид, способствовали образованию АФК в вакуолярном содержимом. Повышение концентрации H2O2 при добавлении клопиралида и ее снижение на фоне ингибиторов, указывало на активное взаимодействие гербицида с оксидоредуктазами вакуолей. Ранее высказывали предположение, что дипиридилы, к которым относится клопиралид, могут окисляться молекулярным кислородом и служить вторичными генераторами АФК (Gruzdev, 1987). По всей видимости, клопиралид «распознается» как субстрат ферментативными системами вакуолей клеток корнеплодов свеклы. 2.4-Д тоже мог служить субстратом для оксидоредуктаз вакуолей. На сегодняшний день установлены разные пути детоксикации 2.4-Д в растениях. Наряду с декарбоксилированием и этерификацией, осуществляется его окисление и гидроксилирование с последующей конъюгацией с глутатионом, аминокислотами, углеводами и т.д. (Karuppanapandian et al., 2011). Окисление и гидроксилирование предполагает взаимодействие гербицида с оксидоредуктазами. Полученные нами результаты могут служить косвенным тому подтверждением.
Следует отметить, что свекла не обладает устойчивостью к глифосату. Возможно поэтому не выявлен стимулирующий эффект этого гербицида на образование H2O2 в вакуолях клеток корнеплодов свеклы. Не исключено, что соединение не взаимодействует с окидоредуктазами вакуолей в тех условиях, при которых проводился эксперимент. Среди фосфорорганических соединений глифосат является наиболее важным системным гербицидом сплошного действия, применяемым для борьбы с глубокоукореняющимися и многолетними сорняками в период вегетации. У чувствительных растений глифосат подавляет синтез некоторых жизненно важных аминокислот. Он действует только как контактный гербицид, его эффективность в почве резко снижается из-за образования устойчивых хелатов с ионами тяжелых металлов, особенно с железом (Gruzdev, 1987; Zaharichev, 2007). Мы учли эту особенность глифосата при определении пероксида водорода FOX-методом, в котором главными реагентами являлись ионы железа. Несмотря на то, что молярная концентрация гербицида в конечных растворах ацетона была в несколько раз меньше молярной концентрации соли железа в реагенте, введение дополнительного контрольного варианта, содержащего только реакционный раствор и гербицид, было необходимым условием. Дополнительный контроль позволял учитывать неспецифическое взаимодействие гербицида.
Особый интерес вызывал гербицид фтородифен. Ранее, исследуя глутатионтрансферазную активность вакуолей и тканевого экстракта мы установили, что это соединение может служить субстратом для глутатион-S-трансфераз (GST) корнеплодов столовой свеклы (данные не приводятся). По всей видимости, с гербицидом как с субстратом могут взаимодействовать не только GST, но и оксидоредуктазы вакуолей. Более того, для пероксидазы корней хрена фтородифен тоже служил субстратом. В опытных вариантах, которые содержали фтородифен, увеличение концентрации H2O2 было одно из самых высоких. В то же время, другой гербицид, диурон, стимулирующий образование АФК в вакуолярном экстракте, оказался неэффективным в опыте с пероксидазой хрена. Следует отметить, что оба соединения, диурон и фтородифен, обладают схожим токсическим действием, они подавляют электронный транспорт, ингибируют фотосинтез и фотодыхание. Несмотря на то, что эти соединения, как и большинство гербицидов, являются галjгенсодержащими, по химической структуре они заметно различаются. Диурон является производным мочевины и относится к классу фениламидов и подклассу производных фенилмочевины (Vieira et al., 2015). Соединения этого класса применяются как системные гербициды широкого спектра действия. Они обладают высокой биологической активностью, избирательностью и стойкостью в биологических средах, что обуславливает их широкое применение в сельском хозяйстве. Однако некоторые из них, в том числе диурон, на сегодня используются в основном в научных исследованиях как модельные соединения. Например, с помощью диурона исследуются процессы переноса электронов у фотосинтезирующих организмов. Он подавляет фотосинтез, предотвращает производство кислорода, блокируя перенос электронов на уровне Фотосистемы II (Vieira et al., 2015). Полагают, что основными модификаторами диурона в растении и окружающей среде могут быть лакказы (фенолоксидазы). На сегодняшний день в нашей стране диурон практически не используется в качестве гербицида, зато его аналоги из группы гербицидов производных сулфонилмочивины находят широкое применение. Следует отметить, что к некоторым из них свекла устойчива даже на стадии ранних всходов (Gruzdev, 1987). Что же касается фтородифена, то это соединение является производным нитродифенила и относится к классу гербицидов дифениловых эфиров (De Buono et al., 2011). Действие диариловых эфиров на растения связано с нарушением транспорта электронов и реакции фосфорилирования. Однако не все растения одинаково чувствительны к гербицидам этого класса. Фтородифен, например, в зависимости от дозы, может угнетать процессы жизнедеятельности у свеклы и ряда других культурных растений, но не приводить к их гибели (Maksoud et al., 1981). Как показали прежние исследования, при фотохимическом разложении диариловых эфиров в водных растворах может происходить отщепление заместителей в ароматическом ядре, а также замена галогенов на гидроксильную группу (Zacharenko, 1990). Возможно, в нашем исследовании оксидоредуктазы вакуолей и пероксидаза хрена взаимодействовали с гидроксилированной в водном растворе формой фтородифена. Чтобы подтвердить это, требуются дополнительные исследования.
В целом полученные нами результаты позволяют сделать вывод о том, что в вакуолях могут протекать активные окислительные процессы, сопровождающиеся генерацией АФК. Вакуоли клеток корнеплодов столовой свеклы содержат ферментативные системы, способные взаимодействовать с токсичными ксенобиотиками такими, как гербициды. Возможно, вакуолярный компартмент вносит весомый вклад в детоксикацию ксенобиотических соединений в клетках растений.
ACKNOWLEDGMENT
Работа выполнена при поддержке Российского фонда фундаментальных исследований и Правительства Иркутской области, проект № 14-4404059 р_сибирь_а.
Список литературы Влияние гербицидов на образование перекиси водорода в изолированных вакуолях красного корня свеклы (Beta vulgaris L.)
- Baranenko V.V. (2006) Superoxide dismutase in plant cell. Tsitologiia, 48, 465-474
- Bradford M. (1976) A rapid and sensitive method for the quantitation of protein utilising the principal of protein-dye binding. Anal. Biochem., 72, 248-254
- Bolwell G.P., Blee K.A., Butt V.S., Davies D.R., Gardiner S.L., Gerrish C., Minibaeva F., Rowntree E.G. and Wojtaszek P. (1999) Recent advances in understanding the origin of the apoplastic oxidative burst in plant cells. Free Rad. Res., 31, 137-145
- Bolwell G.P., Bindschedler L.V., Blee K.A., Butt V.S., Davies D.R., Gardiner S.L., Gerrish C. and Minibaeva F. (2001) The apoplastic oxidative burst in response to biotic stress in plants: a three component system. J. Exp. Botany., 53, 1367-1376
- Deepesh N.De. (2000) Plant Cell Vacuoles: An Introduction. Csiro Publishing, 288 p
- Del Buono D., Ioli G., Nasini L. and Proietti P. (2011) A comparative study on the interference of two herbicides in wheat and italian ryegrass and on their antioxidant activities and detoxification rates. J Agric Food Chem., 59, 12109-12115
- Devine M.D., Bestman H.D. and Vanden Born W.H. (1987) Uptake and accumulation of the herbicides chlorsulfuron and clopyralid in excised pea root Tissue. Plant Physiol., 85, 82-86
- Ferreres F., Figueiredo R., Bettencourt S., Carqueijeiro I., Oliveira J., Gil-Izquierdo A., Pereira D.M., Valentao P., Andrade P.B., Duarte P., Barcelo A.R. and Sottomayor M. (2011) Identification of phenolic compounds in isolated vacuoles of the medicinal plant Catharanthus roseus and their interaction with vacuolar class III peroxidase: an H2O2 affair? J. Exp. Botany., 62, 2841-2854
- Fuerst P.E., Nakatani H.Y., Dodge A.D., Penner D. and Arntzen C.J. (1985) Paraquat resistance in Conyza. Plant Physiol., 77, 984-989
- Galletti R., Denoux C., Gambetta S., Dewdney J., Ausubel F.M., De Lorenzo G. and Ferrari S. (2008) The AtrbohD-mediated oxidative burst elicited by oligogalacturonides in Arabidopsis is dispensable for the activation of defense responses effective against Botrytis cinerea. Plant Physiol., 148, 1695-1706
- Garcia R., Kaid N., Vignaud C. and Nicolas J. (2000) Purification and some properties of catalase from wheat germ (Triticum aestivum L.). J. Agric. Food Chem., 48, 1050-1057
- Gruzdev G.S. (1987) Chemical protection of plants. In Gruzdev,G.S. (ed). M.: Agropromizdat, 415 p
- Hall J.C., Bassi P.K., Spencer M.S. and Vanden Born W.H. (1985) An evaluation of the role of ethylene in herbicidal injury induced by picloram or clopyralid in rapeseed and sunflower plants. Plant Physiol., 79, 18-23
- Jiang Z.-Y., Woollard A.C.S. and Wolff S.P. (1990) Hydrogen peroxide production during experimental protein glycation. FEBS, 268, 69-71
- Kawano T. and Muto S. (2000) Mechanism of peroxidase actions for salicylic acid-induced generation of active oxygen species and an increase in cytosolic calcium in tobacco cell suspension culture. J. Exp. Botany., 51, 685-693
- Karuppanapandian T., Wang H.W., Prabakaran N., Jeyalakshmi K., Kwone M., Manoharan K. and Kim W. (2011) 2,4-dichlorophenoxyacetic acid-induced leaf senescence in mung bean (Vigna radiata L. Wilczek) and senescence inhibition by co-treatment with silver nanoparticles. Plant Physiol. Biochem., 49, 168-177
- Lamb C. and Dixon R.A. (1997). The oxidative burst in plant disease resistance. Annu. Rev. Plant Physiol. Plant Mol. Biol., 48, 251-275
- Maksoud M.A., Rizk T.Y., El-Oksh I., Fayed T. and Ibrahim H. (1981) Chemical and mechanical weed control in transplanted tomatoes. J. Annals of Agricultural Science, 26. 307-321
- Rogozhin V.V., Verkhoturov V.V. and Rogozhina T.V. (2004) Peroksidaza: stroenie i mekhanizm deistviya (Peroxidase: structure and mechanism of action). Irkutsk: Irkutsk. Gos. Tech. Univ., 200 p
- Romero-Puertas M.C., Rodriguez-Serrano M., Corpas F.J., Gomez M., Del Rio L.A. and Sandalio L.M. (2004) Cadmium-induced subcellular accumulation of O2·-and H2O2 in pea leaves. Plant, Cell and Environment, 27, 1122-1134
- Salyaev R.K., Kuzevanov V.Y., Khaptogaev S.B. and Kopytchuk V.N. (1981) Isolation and purification of vacuoles and vacuolar membranes from plant cells. Russ. J. Plant Physiol., 25, 1295-1305
- Vieira A.C., Marschalk C., Biavatti D.C., Lorscheider C.A., Peralta R.M. and Seixas V.F. (2015) Modeling based structural insights into biodegradation of the herbicide diuron by laccase-1 from Ceriporiopsis subvermispora. Bioinformation, 11, 224-228
- Zaharenko V.A. (1990) Gerbicidi. M.: Agropromizdat, 240 p
- Zaharichev V.V. (2007) Gerbicidi i regulatori rosta rastenii. Osnovi biohimii i primeneniya. M.: RHTU. im. D.I. Mendeleeva. 204 p


