Влияние гидрогелей полиакриламида на микрофлору почвы
Автор: Максимова Ю.Г., Максимов А.Ю., Демаков В.А., Будников В.И.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Экология
Статья в выпуске: 1, 2010 года.
Бесплатный доступ
Изучено влияние синтезированных гидрогелей полиакриламида (ПААГ) с различными наполнителями на бактериальную флору почвы и жизнеспособность модельных почвенных средообразующих бактерий. Показано, что ПААГ не оказывают отрицательного воздействия на почвенные бактерии, в то время как мономеры в высоких концентрациях подавляют их рост. Общее количество гетеротрофных бактерий в почвах после внесения ПААГ достоверно не изменялось, за исключением ПААГ с древесной мукой, при внесении которого наблюдали небольшое снижение общего количества бактерий.
Гидрогели полиакриламида, пааг, микрофлора почвы, ингибирование роста, акриламид, акрилат аммония
Короткий адрес: https://sciup.org/147204878
IDR: 147204878 | УДК: 579.64:
Текст научной статьи Влияние гидрогелей полиакриламида на микрофлору почвы
Гидрофильные акриловые полимеры находят широкое применение в различных областях народного хозяйства как суперабсорбенты. Перспективной сферой их использования является производство влагоудерживающих препаратов для сельского хозяйства, декоративного и приусадебного растениеводства.
Внесение препаратов на основе полиакриламида (ПАА) в почву аридных областей имеет выраженное положительное влияние на рост и выживание растений (Hayat, Ali, 2004; El-Rehim, 2005). Широкое применение акриловых полимеров ограничивается в основном высокой стоимостью таких препаратов. Синтез полимеров с органоминеральными наполнителями (древесным опилом и твердыми отходами биотехнологического производства акриловых мономеров) позволит снизить их себестоимость, а биоразложение этих отходов может служить дополнительным источником питания растений. Кроме того, полиакриламидный гель может рассматриваться как потенциальный носитель для инсектицидов, фунгицидов, гербицидов и удобрений (Jhurry, 1997).
Гидрофильные полимеры могут изменять свойства почвы благодаря способности адсорбировать большое количество воды, в 400 и более раз превышающее собственную массу, что в свою очередь влияет на скорость инфильтрации и испарения, плотность и структуру почвы (Hayat, Ali, 2004). Полиакриламид стабилизирует почвенные агрега- ты, а в дождливых областях и на орошаемых землях уменьшает поверхностное уплотнение и корко-образование, а также эрозию (Green, Stott, 2001).
До сих пор остается не вполне ясным вопрос о влиянии гидрофильных акриловых полимеров на микробиоценоз почвы. В лабораторных экспериментах ПААГ в небольшой степени стимулировал рост бактерий рода Pseudomonas , причем стимуляцию роста авторы связывали с дополнительным поступлением аммонийного азота в среду при гидролизе амидных групп углеродной цепи ПАА (Gru-la, Huang, 1981; Grula et al., 1994). Позднее было продемонстрировано, что почвенные микроорганизмы, обладающие амидазной активностью, могут утилизировать ПАА как единственный источник азота, но не как единственный источник углерода. По мнению авторов, данный факт может быть связан с тем, что ПАА конвертируется в длинноцепочечный полиакрилат, который в дальнейшем может деградироваться физическими или биологическими механизмами или включаться в органическую материю (Kay-Shoemake et al., 1998a, 1998b, 2000). Длительное воздействие ПАА на почвенные микробные сообщества приводит к появлению и долговременному сохранению ПАА-специфической амидазной активности. Тем не менее, общий эффект применения ПАА, по-видимому, невелик, особенно когда он рассматривается в ряду химических веществ, вносимых в такие почвы (Kay-Shoemake et al., 1998b).
Также было проанализировано влияние обработки ПАА на общее количество бактерий в почвах. Было обнаружено, что количество культивируемых гетеротрофных бактерий значительно увеличивалось в почвах, обработанных ПАА и засеянных картофелем ( Solanum tuberosum ), тогда как этот эффект не наблюдался, если обработанные почвы засевались фасолью ( Phaseolus vulgaris ). Эти данные коррелировали с тем, что почвы, обработанные ПАА и засеянные картофелем, содержали значительно более высокие концентрации NO 3 – и NH 3 , чем необработанные почвы, тогда как в почвах, засеянных фасолью, такой разницы не было (Kay-Shoemake et al., 1998a). Таким образом, влияние ПАА на количество бактерий в почве было труднопредсказуемым.
Данная работа посвящена изучению влияния синтезированных ПААГ различного наполнения, предназначенных для использования в качестве влагоудерживающих препаратов в сельском хозяйстве и декоративном растениеводстве, на модельные почвенные средообразующие бактерии и микрофлору почв.
Материалы и методы исследований
В качестве модельных культур использовали штаммы Pseudomonas fluorescens C2 и Bacilus subtilis ATCC 6633.
В качестве полимерной основы использовали смесь акриламида и акрилата аммония при их соотношении 50 : 50 мольн. %, содержание сшивающего агента (метиленбисакриламид) – 0.2 мольн.% от суммы мономеров, в качестве инициирующей системы использовали окислительновосстановительную систему – персульфат аммония + сульфит натрия. Получение наполненных композиций осуществляли смешением акриловых мономеров и наполнителей при температуре 18-22 ° С в течение 8–10 мин, после чего вводили компоненты инициирующей системы; режим полимеризации – 80 ° С, 6 час. Наполнитель - отработанный биокатализатор биокаталитического производства акриламида добавляли в количестве 30 масс.%. Обозначения образцов ПААГ: 36/0 – ненаполненный ПААГ, 36/Б – наполненный шламом биокатализатора производства акриловых мономеров, 36/Д – наполненный измельченной древесиной.
Для выращивания бактерий использовали синтетическую среду N (солевую основу), следующего состава (г/л): KH 2 PO 4 – 1.0; K 2 HPO 4 ×3H 2 O – 1.6; NaCl – 0.5; MgSO 4 ×7H 2 O – 0.5; CaCl 2 – 0.005; CoCl 2 ×6H 2 O – 0.01; FeSO 4 ×7H 2 O – 0.005; pH 7.2 ± 0.2. Источником углерода служила глюкоза в конечной концентрации 0.2%. В качестве источника азота использовали NH 4 Cl в концентрации 10 мМ.
Количество колониеобразующих единиц (КОЕ) определяли методом серийных разведений с по- следующим высевом на агаризованную среду Лу-риа-Бертани и подсчетом колоний на чашках Петри.
Рост бактерий оценивали по изменению оптической плотности культуры, измеренной при длине волны 540 нм (ОП 540 ) на фотоэлектроколориметре КФК-3.
Влияние гидрогелей различного состава на модельные культуры бактерий в почвенной и водной среде оценивали по КОЕ. В водной среде для этого ПААГ без наполнителя (36/0) и с наполнителями (древесиной (36/Д); шламом отработанного биокатализатора производства акриламида (36/Б)) добавляли в количестве 500 мг к 20–30 мл ростовой среды, которую инокулировали штаммами бактерий P. fluorescens C2 и B. subtilis ATCC 6633. Высев культур для оценки жизнеспособности проводили через 4 дня.
Для определения влияния гидрогелей на модельные культуры бактерий в почвенной среде 5 г почвы стерилизовали автоклавированием при 121°С, увлажняли стерильным 10 мМ калий-фосфатным буфером, вносили 500 мг ПААГ и инокулировали 0.1 мл суспензии спор B. subtilis АТСС 6633 и 0.5 мл суспензии клеток P. fluorescens С2 (ОП 540 =0.5). Высев культур для оценки жизнеспособности проводили через 14 и 70 дней.
Д ля определения влияния ПААГ на общее количество гетеротрофных бактерий в почве использовали почвогрунт универсальный на основе биогумуса «Terra vita живая земля», производства ЗАО «МНПП «Фарт», Россия. КОЕ определяли путем высева на среду Луриа-Бертани из почв, в которые добавляли ПААГ различного наполнения (0.4% от веса почвы), через 21 день выращивания фасоли ( Phaseolus vulgaris L.). Количество бактерий, гидролизующих амид, определяли при высеве на агаризованную среду N с ацетамидом в качестве единственного источника углерода и азота.
Влияние мономеров ПАА на рост и жизнеспособность модельных почвенных культур B. subtilis АТСС 6633 и P. fluorescens С2 определяли в водной среде N с глюкозой и аммонием. В среду добавляли растворы акриламида (АА) и акрилата аммония (ААм) до концентрации 5, 10, 20% и раствор акриловой кислоты (АК) до концентрации 10%. Рост бактерий оценивали по изменению ОП 540 среды культивирования, жизнеспособность – по КОЕ.
Результаты и обсуждение
Изучено влияние высоких концентраций мономеров ПАА на рост и жизнеспособность почвенных средообразующих бактерий B. subtilis и P. fluorescens С2. Выявлено, что мономеры ПАА (5–20% раствор АА, 5–20% раствор ААм и 10% раствор АК) оказывают выраженное подавляющее действие на рост модельных культур, причем единичные жизнеспособные клетки B. subtilis сохранялись только в растворе акриламида – 100–200 КОЕ/мл и акрилата аммония – 60 КОЕ/мл (кон- троль – 4.4×106 КОЕ/мл). Культура P. fluorescens после инкубации с мономерами ПААГ не содержала жизнеспособных клеток (табл. 1).
Таблица 1
Влияние мономеров ПАА на жизнеспособность почвенных средообразующих бактерий
|
Концентрация мономеров |
КОЕ/мл |
|
|
B. subtilis АТСС 6633 |
P. fluorescens С2 |
|
|
Контроль |
4.4×106 |
2.9×109 |
|
Раствор АА |
||
|
5% |
2.4×102 |
0 |
|
10% |
1.0×102 |
0 |
|
20% |
1.2×102 |
0 |
|
Раствор ААм |
||
|
5% |
0 |
0 |
|
10% |
60 |
0 |
|
20% |
0 |
0 |
|
Раствор АК |
||
|
10% |
0 |
0 |
Таким образом, мономеры ПАА в высоких концентрациях токсичны для почвенных бактерий, причем более устойчивыми являются B. subtilis , вероятно, за счет спорообразования.
Изучено влияние гидрогелей различного состава на модельные культуры почвенных бактерий в водной и почвенной среде. Показано незначительное стимулирующее действие гидрогелей на бакте- рии в водной среде (вне зависимости от наполнителя) по сравнению с контролем (табл. 2).
Влияние ПААГ на модельные микроорганизмы в почвенной среде, достоверно отличающееся от контроля, выявлено не было (табл. 3). Исключение составил ПААГ с наполнителем древесиной: количество бактерий при длительном культивировании (70 дней) снижалось на порядок.
Таблица 2
Влияние ПААГ различного состава на модельные культуры почвенных бактерий в водной среде
|
Наполнитель |
КОЕ/мл |
|
|
B. subtilis АТСС 6633 |
P. fluorescens С2 |
|
|
Контроль |
2.5×106 |
6.2×108 |
|
36/0 |
2.3×107 |
2.9×109 |
|
36/Б |
8.0×106 |
5.3×109 |
|
36/Д |
2.4×107 |
1.3×109 |
Таблица 3
Влияние ПААГ различного состава на модельные культуры бактерий в почвенной среде
|
Наполнитель |
КОЕ/мл |
|||
|
B. subtilis АТСС 6633 |
P. fluorescens С2 |
|||
|
14 дн. |
70 дн. |
14 дн. |
70 дн. |
|
|
К* |
8.6×107 |
1.6×108 |
1.8×109 |
6.9×108 |
|
36/0 |
3.6×107 |
1.7×108 |
5.2×106 |
5.1×108 |
|
36/Б |
6.0×106 |
1.4×108 |
1.4×109 |
5.4×108 |
|
36/Д |
2.2×107 |
1.6×107 |
2.0×108 |
3.7×107 |
* Контрольный опыт без добавок ПААГ.
По-видимому, воздействие ПААГ на изучаемые бактерии может быть более заметным при внесении его в водную среду со строго определенным химическим составом, т.к. наличие различных органических и минеральных веществ в естественной почве не позволяет заметить эффект внесенного вещества. Тем не менее, было показано, что ПААГ не оказывает отрицательного воздействия на мо- дельные почвенные бактерии. В качестве рекомендации может быть замечено, что при производстве влагоудерживающих препаратов на основе ПААГ следует сводить к минимуму содержание токсичных мономеров в препарате.
Изучено влияние ПААГ с различными добавками (шлам биокатализатора производства акриловых мономеров – Rhodococcus rhodochrous, Al- caligenes denitrificans; древесная мука) на содержание в почве гетеротрофных и амидгидролизую-щих бактерий (рисунок).
Было показано, что внесение в почву ПААГ различного состава не оказывает на почвенную бактериальную флору влияния, достоверно отличающегося от контроля. Исключение составил ПААГ с добавлением древесной муки, при внесении которого наблюдалось небольшое снижение общего количества гетеротрофных бактерий. Определено, что количество бактерий, использующих амид в качестве единственного источника углерода и азота, составило от 6 до 16% от общего количества гетеротрофов. В образце почвы после внесения ПААГ с древесной мукой количество амид-гидролизующих бактерий составило половину от общего числа гетеротрофов. Кроме того, в этой почве увеличивалась доля грибной микрофлоры.
КОЕ/г 1.00E+10
1.00E+09
1.00E+08
1.00E+07
1.00E+06
1.00E+05
1.00E+04
1.00E+03
1.00E+02
1.00E+01
1.00E+00
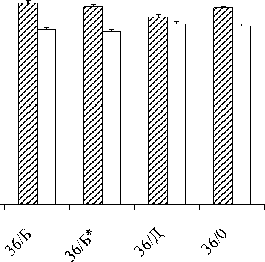
Количество гетеротрофных бактерий в почве с добавлением ПААГ после 21 дня выращивания фасоли:
36/Б – ПААГ с добавлением шлама биокатализатора R. rhodochrous , 36/Б* – ПААГ с добавлением шлама биокатализатора A. denitrificans , 36/Д – ПААГ с добавлением древесной муки,
36/0 – ПААГ без добавок; 1 – на среде LB, 2 – на минимальной среде с ацетамидом
Таким образом, ПААГ, являясь нетоксичным и биодеградабельным соединением, не нарушает бактериальную флору почвы и может служить дополнительным источником питания для почвенных бактерий. В качестве наполнителя можно порекомендовать шлам биокатализатора производства акриловых мономеров, что позволит одновременно достичь удешевления влагоудерживающего препа- рата и утилизировать отходы биотехнологического производства.
Работа выполнена при поддержке гранта Российского фонда фундаментальных исследований и Министерства промышленности, инноваций и науки Пермского края № 09-03-99026 р-офи.
Список литературы Влияние гидрогелей полиакриламида на микрофлору почвы
- Abd El-Rehim, H.A. Characterization and possible agricultural application of polyacrylamide/sodium alginate crosslinked hydrogels prepared by ionizing radiation//J. Appl. Polymer Sci. 2006. Vol. 101. P. 3572-3580.
- Green, V.S. Polyacrylamide: a review of the use, effectiveness, and cost of a soil erosion control amendment/V.S. Green, D.E. Stott//D.E. Stott, R.H. Mohtar, G.C. Steinhardt (eds). Sustaining the Global Farm. 2001. P. 384-389.
- Grula, M. Interactions of polyacrilamides with certain soil pseudomonas/M. Grula, M. Huang//Dev. Ind. Microbiol. 1981. Vol. 22. P. 451-457.
- Grula, M. Interaction of certain polyacrilamides with soil bacteria/M. Grula, M. Huang, G. Sewell//Soil Sci. 1994. Vol. 158, № 4. P. 291-300.
- Hayat, R. Water absorption by synthetic polymer (Aquasorb) and its effect on soil properties and tomato yield/R. Hayat, S. Ali//Int. J. Agri. Biol. 2004. Vol. 6, № 6. P. 998-1002.
- Jhurry, D. Agricultural polymers//Conf. Proc. AMAS. 1997. P. 109-113.
- Kay-Shoemake, J.L. Polyacrylamide as an organic nitrogen source for soil microorganisms with potential effects on inorganic soil nitrogen in agricultural soil/J.L. Kay-Shoemake, M.E. Watwood, R.D. Lentz, R.E. Sojka//Soil Biol. Biochem. 1998a. Vol. 30, № 8/9. P. 1045-1052.
- Kay-Shoemake, J.L. Polyacrylamide as a substrate for microbial amidase in culture and soil/J.L. Kay-Shoemake, M.E. Watwood, R.E. Sojka, R.D. Lentz//Soil Biol. Biochem. 1998b. Vol. 30, № 13. P. 1647-1654.
- Kay-Shoemake, J.L. Soil amidase activity in polyacrilamide-treated soils and potential activity toward common amide-containing pesticides/J.L. Kay-Shoemake, M.E. Watwood, R.E. Sojka, R.D. Lentz//Biol. Fertil. Soils. 2000. V. 31. P. 183-186.


