Влияние гидрокортизона на течение лепрозной инфекции в эксперименте
Автор: Геннатулина Г. Н., Сароянц Л. В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 3 т.39, 2024 года.
Бесплатный доступ
Лепра является хроническим инфекционным заболеванием, вызываемым Mycobacterium leprae (M. leprae), сопровождающимся нарушением различных звеньев иммунитета. В связи с этим разработка экспериментальной модели лепры может основываться на создании искусственного дефекта макрофагального звена, в частности, с использованием глюкокортикоидов.Цель исследования: разработка и характеристика модели генерализованной лепрозной инфекции у мышей на фоне длительного введения гидрокортизона (ГК).Материал и методы. Для проведения исследования были сформированы контрольная группа, состоящая из 50 мышей, зараженных по методу Шепарда, и опытная группа, включавшая 50 мышей, аналогично зараженных на фоне введения ГК. ГК вводили внутримышечно в разовой суточной дозе 25 мг/кг в первый день за 2 ч до заражения взвесью М. leprae, затем в виде 4 курсов по 2 нед. с двухнедельными интервалами.Результаты. Введение ГК приводило к ускорению размножения микобактерий в подушечке лапы по сравнению с контролем (без ГК). Генерализация лепрозной инфекции подтверждается наличием лепроматозных структур в виде гранулем из макрофагов с высоким содержанием M. leprae в ткани печени, селезенки, легких и почках.Заключение. Данная модель позволяет изучать свойства возбудителя и механизмы патогенеза заболевания, а в перспективе осуществлять скрининг фармакологических препаратов с потенциальной противолепрозной активностью.
Mycobacterium leprae, лепрозный процесс, экспериментальная модель, мыши, гидрокортизон, макрофаги
Короткий адрес: https://sciup.org/149146290
IDR: 149146290 | УДК: 616.5-002.73 | DOI: 10.29001/2073-8552-2024-39-3-144-149
Текст научной статьи Влияние гидрокортизона на течение лепрозной инфекции в эксперименте
Mycobacterium leprae является патогенным возбудителем такого тяжелого хронического инфекционного заболевания, как лепра, характеризующегося относительно низкой контагиозностью, разнообразными клиническими проявлениями, склонностью к периодическим обострениям, поражающее преимущественно кожу и периферические нервы, что в конечном итоге приводит к инвалидности [1]. Сложность изучения биологии M. leprae заключается в невозможности на сегодняшний день ее культивирования на искусственных питательных средах и ограниченности моделей на экспериментальных животных.
Поиск экспериментальной модели лепры имеет длительную историю и ведется с начала 1960-х гг., когда C. Shepard предложил первый успешный метод интра-плантарного заражения мышей в подушечку лапы дозированным количеством M. leprae [2]. Характерными чертами этой модели являются локальная инфекция и низкая скорость размножения. Только через 8–12 мес. после заражения количество микобактерий в месте инокуляции возрастает с 104 до 106 микробных тел.
Для развития генерализации лепрозного процесса с целью изучения патогенетических механизмов лепры были предложены модели на различных экзотических животных: мартышках мангобеи, африканских зеленых мартышках, резус-макаках, броненосцах, единственных животных, у которых наблюдается естественная восприимчивость к M. leprae [3, 4]. Однако использование данных моделей весьма ограничено, так как экзотические животные редко размножаются в неволе, и их содержание связано со значительными материальными затратами.
В связи с этим возникает необходимость дальнейших исследований по созданию и совершенствованию вос- производимых экспериментальных моделей лепры, которые позволят изучать не только биологию возбудителя заболевания, но и важные аспекты патогенеза лепры, а также осуществлять скрининг препаратов с потенциальной противолепрозной активностью.
Известно, что лепра является инфекционным заболеванием, характеризующимся иммунодефицитным состоянием с нарушением различных звеньев иммунного ответа [5]. Первичными клетками-мишенями для M. leprae являются макрофаги и шванновские клетки, последние способствуют построению миелиновой оболочки, покрывающей нервные волокна. Макрофаги, являясь микобактериальной мишенью, обладают высокой пластичностью и гетерогенностью, что обеспечивает успешность выживания и репликации внутри них M. leprae, тем самым определяя исход заболевания [6].
Таким образом, разработка экспериментальной модели лепры может основываться на создании искусственного дефекта макрофагального звена, в частности, с использованием гидрокортизона (ГК). Применение ГК обусловлено его свойством снижать количество и функциональную активность иммунокомпетентных клеток, в том числе макрофагов и клеток соединительной ткани, вызывать ингибицию ангиогенеза за счет подавления синтеза ростовых факторов и провоспалительных цитокинов, угнетение высвобождения эозинофилами медиаторов воспаления, нарушение метаболизма арахидоновой кислоты и синтеза простагландинов [7, 8].
Результаты исследований влияния ацетатов кортизона и ГК на течение инфекций, вызванных микобактериями, неоднородны и противоречивы. Известно, что длительное введение ГК ацетата приводит к снижению роста Mycobacterium lepraemurium у крыс [9]. В эксперименте на мышах было обнаружено, что при введении кортизона во время логарифмической фазы размножение M. leprae происходило несколько медленнее [10].
Цель исследования: разработка модели генерализованной лепрозной инфекции у мышей на фоне длительного введения ГК.
Материал и методы
Все исследования по моделированию лепрозной инфекции с искусственно созданным дефектом иммунной системы проводили на 100 мышах обоего пола линии Balb/c с первоначальной массой тела 20 г, полученных из вивария Научно-исследовательского центра ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России. Содержание лабораторных животных соответствовало требованиям Директивы Европейского Парламента и Совета Европейского Союза по охране животных, используемых в научных целях (2010/63/EU); «Международной конвенции по защите позвоночных животных, используемых для экспериментальных и научных целей» (Страсбург, 1986).
Для проведения исследования были сформированы экспериментальные группы. Контрольная группа включала 50 мышей, интраплантарно зараженных взвесью M. leprae (первоначально выделенные от больного Ш. лепроматозным типом лепры) в дозе 104 микробных тел на мышь по методу C. Shepard [2]. В опытную группу вошли 50 мышей, аналогично зараженных той же взвесью M. leprae на фоне введения ГК (Гедеон Рихтер, Венгрия) внутримышечно в разовой суточной дозе 25 мг на 1 кг массы животного в первый день за 2 ч до заражения, затем двухнедельными курсами каждый месяц на протяжении 4 мес.
Из эксперимента животных выводили группами по 10 мышей опыт-контроль в сроки 4, 5, 6, 7 и 8 мес. после заражения. Для подсчета кислотоустойчивых микобактерий (КУМ) из подушечки лапы мыши готовили суспензию, которую наносили на специальные предметные стекла, высушивали, окрашивали по методу Циля – Нильсена. Количество микобактерий подсчитывали по методу C.C. Shepard McRae D.H. [11]. Для определения генерализации лепрозного процесса проводили гистологическое исследование ткани органов (печени, селезенки, легких и почек) после фиксирования их в 10% нейтраль- ном формалине с последующей проводкой в спиртах, заливкой в парафин и окраской срезов гематоксилином и эозином по общепринятым методикам [12]. Для обнаружения КУМ срезы окрашивали карболовым фуксином по Цилю – Нильсену. Генетическую принадлежность КУМ к M. leprae определяли с использованием разработанной тест-системы на основе ПЦР к 16S рРНК M. leprae [13].
Каждое животное взвешивали до начала эксперимента и в дни выведения из опыта. Для исследования влияния ГК на иммунную систему у животных брали периферическую кровь, селезенку и тимус. Кровь собирали в пробирки с добавлением гепарина (50 ед./мл). В крови определяли уровень гемоглобина, количество эритроцитов, лейкоцитов и лейкоцитарную формулу, а также активность миелопероксидазы (МП) нейтрофильных гранулоцитов по среднему цитохимическому коэффициенту.
Селезенки и тимусы взвешивали на лабораторных весах Explorer EX124 (OHAUS, США), механически гомогенизировали и фильтровали через два слоя марли. Эритроциты лизировали 0,83% раствором хлористого аммония, клеточную взвесь отмывали и подсчитывали количество лейкоцитов в камере Горяева.
Для статистической обработки данных использовали программу StatTech (Россия). Нормальность распределения количественных показателей в группах проверяли по критерию Шапиро – Уилка. Количественные показатели в сравниваемых группах представлены средним значением и его стандартной ошибкой, М ± SE . Для сравнения количественных показателей в опытной и контрольной группах использовали непараметрический критерий Манна – Уитни. Различия считали статистически значимыми при p ˂ 0,05.
Результаты
У мышей линии Balb/c, интраплантарно зараженных инокулируемой взвесью M. leprae , введение ГК в дозировке 25 мг на 1 кг массы животного приводило к статистически значимому увеличению числа микобактерий в месте инокуляции на каждом этапе наблюдения (рис. 1) и в органах (табл. 1) по сравнению с контролем.
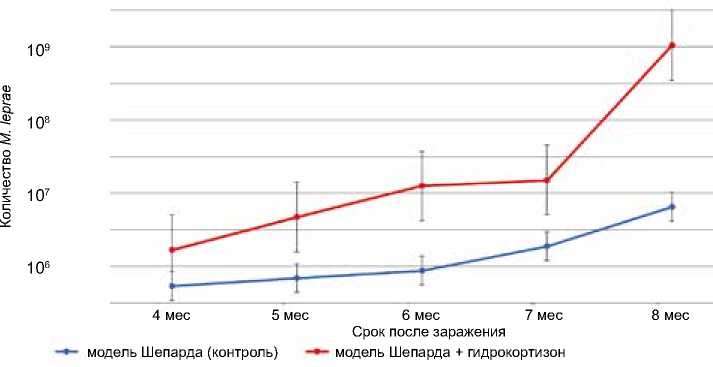
Рис. 1. Количество M. leprae в лапе мышей, зараженных по методу Шепарда: ^^^^ контроль, ^^ш на фоне введения гидрокортизона
Fig.1. The number of M. leprae in the paw of mice infected using the Shepard method: ^^^м control, ^^^м against the background of hydrocortisone administration
Таблица 1. Число M. leprae в органах мышей, зараженных по методу Шепарда
Table 1. The number of M. leprae in the organs of mice infected using the Shepard method
|
Срок после заражения |
Группы |
Количество M. leprae (в 10 п/з) |
|||
|
селезенка |
печень |
легкое |
почки |
||
|
4 мес., n = 10 |
контрольная |
0 |
0 |
0 |
0 |
|
опытная |
1,4 ± 0,9* |
0 |
0 |
0 |
|
|
5 мес., n = 10 |
контрольная |
0 |
0 |
0 |
0 |
|
опытная |
20,4 ± 1,7** |
10,8 ± 0,4** |
0,5 ± 0,3* |
0 |
|
|
6 мес., n = 10 |
контрольная |
0 |
0 |
0 |
0 |
|
опытная |
40,5 ± 1,4** |
23,6 ± 1,1** |
14,3 ± 1,2** |
0,9 ± 0,9* |
|
|
7 мес., n = 10 |
контрольная |
0 |
0 |
0 |
0 |
|
опытная |
49,2 ± 2,2** |
26,3 ± 2,9** |
16,3 ± 1,1** |
3,4 ± 1,4** |
|
|
8 мес., n = 10 |
контрольная |
4,3 ± 0,7 |
0 |
0 |
0 |
|
опытная |
55,4 ± 2,4** |
32,2 ± 4,3** |
19,7 ± 2,4** |
5,2 ± 0,4** |
|
Примечание: * – p < 0,05; **– p < 0,01 – относительно контроля; контрольная группа мыши без ГК, опытная группа – мыши на фоне введения ГК.
Через 4 мес. и далее после заражения при введении ГК отмечалось поражение внутренних органов в виде специфических для лепроматозного типа лепры изменений: наличие гранулем из макрофагов с высоким содержанием микобактерий в печени, селезенке, что свидетельствовало о генерализации лепрозной инфекции. Снижение поглотительной способности макрофагов и фагоцитоза зависит от индуцирования окислительного стресса [6], различных рецепторов, которые нарушают функцию эндоцитоза и регулируют поляризацию макрофагов [14]. Эти нарушения фагоцитарной функции подавляют общие воспалительные реакции, наблюдаемые нами в эксперименте у мышей с длительным введением ГК. В ткани внутренних органов группы контрольных мышей только через 8 мес. после заражения в отдельных случаях отмечались единичные КУМ.
Введение ГК привело к изменению различных показателей иммунитета у мышей (табл. 2).
Таблица 2. Влияние гидрокортизона на экспериментальных животных (4 мес. наблюдения)
Table 2. Effect of hydrocortisone on experimental animals
|
Показатели |
Контрольная группа |
Опытная группа (ГК (25 мг/кг)) |
|
Общее количество лейкоцитов, 109/л |
19,1 ± 1,7 |
6,4 ± 4,6* |
|
Эозинофилы, % |
2,3 ± 0,07 |
1,5 ± 0,01 |
|
Палочкоядерные нейтрофилы, % |
3,9 ± 3,1 |
7,5 ± 5,2* |
|
Сегментоядерные нейтрофилы, % |
29,1 ± 3,9 |
8,3 ± 4,4* |
|
Лимфоциты, % |
68,3 ± 4,6 |
56,4 ± 3,6 |
|
Моноциты, % |
0,4 ± 0,4 |
0,1 ± 3,5* |
|
Эритроциты, 1012/л |
3,61 ± 2,7 |
4,38 ± 0,47* |
|
Гемоглобин, г/л |
115,3 ± 4,22 |
93,4 ± 1,98* |
|
Печень, г |
2,78 ± 0,49 |
4,01 ± 0,41* |
|
Селезенка, г |
0,229 ± 0,03 |
0,318 ± 0,02 |
|
Кол-во спленоцитов в 1 мг органа, × 105 |
473,2 ± 1,3 |
259,3 ± 2,1* |
|
Тимус, г |
0,105 ± 0,03 |
0,099 ± 0,05 |
|
Кол-во тимоцитов в 1 мг органа, × 105 |
148,5 ± 39,4 |
129,1 ± 4,5 |
|
Уровень МП, усл. ед. |
1,81 ± 0,06 |
0,88 ± 0,01* |
Примечание: * – p < 0,05 – относительно контрольной группы.
Как видно из таблицы 2, при введении ГК у мышей в крови возникает дефицит гемоглобина, компенсаторно происходит увеличение эритропоэза по сравнению с контрольной группой ( p < 0,05), что, вероятно, может объясняться выходом в кровоток молодых эритроцитов и ретикулоцитов. Уровень этих клеток в периферической крови при окислительном стрессе отражает степень гипоксии тканей [15]. В данном исследовании в лейкоцитарной формуле крови мышей на фоне лепрозной инфекции и иммуносупрессии ГК наблюдалось повышение общего количества лейкоцитов. Отмечалось увеличение индекса сдвига лейкоцитов, связанного с достоверным снижением абсолютного количества эозинофилов и статистически значимым повышением абсолютного количества моноцитов и лимфоцитов относительно контроля.
Данное изменение может свидетельствовать о нарушении иммунологической реактивности в условиях активного воспалительного процесса под влиянием глюкокортикоидов, в результате чего снижается антимикробная активность макрофагов в очаге воспаления [7]. Возможно, наблюдаемое перераспределение отдельных популяций лейкоцитов, характеризующееся компенсацией сегментоядерных нейтрофильных гранулоцитов более молодыми палочкоядерными формами нейтрофилов на фоне введения ГК, может быть обусловлено сменой фаз воспалительной реакции и заменой процессов альтерации на пролиферативные. Это можно рассматривать как показатель активного ответа лейкоцитов на воспалительный ответ [16]. При этом в нейтрофилах у животных в условиях введения ГК отмечалась низкая активность МП. Недостаточная активность фагоцитарной МП после дегранулирования нейтрофильных клеток в формирующихся фагосомах способствует созданию условий для незавершенного фагоцитоза [17], что коррелирует со значительной персистенцией микобактерий в месте инокуляции по сравнению с контролем (см. табл. 1).
Под влиянием ГК произошло снижение веса животных, уменьшение относительного коэффициента массы печени по сравнению с контрольной группой (p < 0,05), а также отмечалась тенденция к снижению массы селезенки и тимуса. Количество спленоцитов сократилось практически вдвое (p < 0,05), снизилось количество тимоцитов в организме. Спленоциты и тимоциты являются важной составляющей иммунной системы, они играют ключевую роль в развитии и регуляции иммунных реакций. Низкий уровень их в организме может означать угнетение иммунного ответа под влиянием ГК.
Таким образом, введение ГК в условиях экспериментальной лепрозной инфекции приводит к подавлению иммунного ответа организма мышей, что, в частности, проявляется снижением антимикробной активности макрофагов, способствуя персистенции микобактерий в месте инокуляции и генерализации процесса в организме экспериментальных животных.
Заключение
Моделирование лепрозной инфекции в эксперименте является одной из актуальных задач современной ле-прологии. Разработанная нами модель генерализован- ной лепрозной инфекции у мышей на фоне длительного введения ГК учитывает патогенетические механизмы развития лепрозного процесса. Направленное воздействие ГК на функциональную активность иммунокомпетентных клеток, приводящее к системному истощению звеньев иммунной системы мышей, зараженных интраплантар-но взвесью M. leprae, позволило значительно сократить сроки их статистически значимого увеличения в месте инокуляции, а также получить генерализацию лепрозного процесса.
Применение данной модели даст возможность не только изучать биологию M. leprae и патогенетические особенности данного заболевания, но и разрабатывать методы диагностики лепры, а также проводить скрининг новых противолепрозных соединений.
Список литературы Влияние гидрокортизона на течение лепрозной инфекции в эксперименте
- Holland S.M., Rosenzweig S.D., Schumacher R.F. Notarangelo L.D. Immunodeficiencies. Section 4. Infections in the immunocompromised host. In: Cohen J., Powderly W.G., Opal S.M. (eds.). Infectious Diseases; 4th edition. Elsevier; 2017;1:705–722.e2. URL: https://www.google.ru/books/edition/Infectious_Diseases_E_Book/Dhq3DAAAQBAJ?hl=ru&gbpv=1&dq=Infectious+Diseases+(Fourth+Edition).+Edited+by:+Cohen+J.,+Powderly+W.G.+and+Opal+S.M.+2017%3B+(1):705-722.e2.&printsec=frontcover (10.04.2024).
- Shepard C.C. The experimental disease that follows the injection of human leprosy bacilli into foot-pads of mice. J. Exp. Med. 1960;112(3):445–454. DOI: 10.1084/jem.112.3.445.
- Adams L.B., Pena M., Sharma R., Hagge D.A., Schurr E., Truman R. Insights from animal models on the immunogenetics of leprosy – A review. Memórias do Instituto Oswaldo Cruz. 2012;107(1):197–208. DOI: 10.1590/S0074-02762012000900028.
- Honap T., Pfister L., Housman G., Mills S., Tarara R., Suzuki K. et al. Mycobacterium leprae genomes from naturally infected nonhuman primates. PLOS Negl. Trop. Dis. 2018;12(1):e0006190. DOI: 10.1371/journal.pntd.0006190.
- Pinheiro R.O., Schmitz V., Silva B., Dias A., de Souza B., de Mattos Barbosa M. et al. Innate immune responses in leprosy. Front. Immunol. 2018;9:518. DOI: 10.3389/fimmu.2018.00518.
- Prata R.B.da S., Bar-bosa M.G.de M., Silva B.J.de A., De Oliveira J.A.da P., Bittencourt T.L., Pinheiro R.O. Macrophages in the Pathogenesis of Leprosy. In: Bhat K.H. (ed.). Macrophage Activation – Biology and Disease [Internet]. IntechOpen; 2020. DOI: 5772/intechopen.79065.
- Варюшина Е.А., Анциферова М.А., Александров Г.В., Минаева Е.Н., Пигарева Н.В., Петров А.В. и др. Модель осложненного течения раневого процесса у мышей на фоне иммуносупрессии, вызванной введением гидрокортизона. Цитокины и воспаление. 2004;3(4):14–20. Variouchina E.A., Antsiferova M.A., Aleksandrov G.V., Minaeva E.N., Pigareva N.V., Petrov A.V. et al. A model of delayed wound healing in glucocorticoid-treated immunocompromised mice. Citokiny i vospalenie. 2004;3(4):14–20. (In Russ). URL: https://www.elibrary.ru/item.asp?id=9124421 (09.04.2024).
- Nicolaides N.C. The Human glucocorticoid receptor beta: From molecular mechanisms to clinical implications. Endocrinology. 2022;163(11):bqac150. DOI: 10.1210/endocr/bqac150.
- Buttle G.A., D’arcy P.F., Howard E.M. The influence of cortisone and hydrocortisone acetates on the course of Mycobacterium lepraemurium infection in rats. Pharmacol. Chemother. 1958;13(1):95–97. DOI: 10.1111/j.1476-5381.1958.tb00198.x.
- Shepard C.C., Mcrae D.H. Mycobacterium leprae in mice: minimal infectious dose, relationship between staining quality and infectivity, and effect of cortisone. International journal of systematic bacteriology. 1965;89(2):365–372. DOI: 10.1128/jb.89.2.365-372.1965.
- Shepard C.C. McRae D.H. A method of counting acid-fast bacteria. International journal of leprosy and other mycobacterial diseases. 1968;36(1):78–82.
- Иванова В.В., Мильто И.В., Дзюман А.Н., Серебрякова О.Н., Порохова Е.Д., Суходоло И.В. Гистологический практикум: учебное пособие. Томск: СибГМУ; 2023:81. Ivanova V.V., Milto I.V., Dzyuman A.N., Serebryakova O.N., Porohova E.D., Suhodolo I.V. Gistologicheskij praktikum: uchebnoe posobie. Tomsk: SibSMU, 2023:81. (In Russ). URL: http://elar.ssmu.ru/bitstream/20.500.12701/3486/1/tut_ssmu-2023-12.pdf (09.04.2024).
- Сароянц Л.В., Арнаудова К.Ш., Абрамов Д.Д., Трофимов Д.Ю. Разработка лабораторной диагностики лепры с помощью полимеразной цепной реакции. Клиническая лабораторная диагностика. 2018;63(1):55–59. Saroyanc L.V., Arnaudova K.Sh., Abramov D.D., Trofimov D.Yu. The development of laboratory diagnostic of leprosy using polymerase chain. Klinicheskaya laboratornaya diagnostika. Russian Clinical Laboratory Diagnostics. 2018;63(1):55–59. (In Russ). DOI: 10.18821/0869-2084-2018-63-1-55-59.
- Jha A.K., Huang S.C.-C., Sergushichev A., Lampropoulou V., Ivanova Y., Loginicheva E. et al. Network integration of parallel metabolic and transcriptional data reveals metabolic modules that regulate macrophage polarization. Immunity. 2015;42(3):419–430. DOI: 10.1016/j.immuni.2015.02.005.
- Alghareeb S., Alsughayyir J., Alfhili M. Eriocitrin disrupts erythrocyte membrane asymmetry through oxidative stress and calcium signaling and the activation of casein kinase 1α and Rac1 GTPase. Pharmaceuticals. 2023;16(12):1681. DOI: 10.3390/ph16121681.
- Мордык А.В., Батищева Т.Л., Пузырева Л.В. Прогностическая роль лейкоцитарных индексов в эффективности курса лечения инфильтративного туберкулеза легких у впервые выявленных социально сохранных пациентов. Вестник современной клинической медицины. 2014;7(S1):126–127.Mordyk A.V., Batisheva T.L., Puzyreva L.V. Prognosticheskaya rol lejkocitarnyh indeksov v effektivnosti kursa lecheniya infiltrativnogo tuberkuleza legkih u vpervye vyyavlennyh socialno sohrannyh pacientov. Vestnik sovremennoj klinicheskoj mediciny. 2014;7(S1):126–127. (In Russ). DOI: 10.15789/2220-7619-2015-3-219-224.
- Пименов Н.В., Лаптев С.В., Пермякова К.Ю., Марзанова С.Н., Иванникова Р.Ф. Роль нейтрофильных гранулоцитов и катионных белков в качестве биомаркеров тяжести течения инфекционных и неинфекционных заболеваний животных. Международный вестник ветеринарии. 2023;(4):37–48.Pimenov N.V., Laptev S.V., Permyakova K.YU., Marzanova S.N., Ivannikova R.F. Rol’ nejtrofil’nyh granulotsitov i kationnyh belkov v kachestve biomarkerov tyazhesti techeniya infektsionnyh i neinfektsionnyh zabolevanij zhivotnyh. Mezhdunarodnyj vestnik veterinarii. 2023;(4):37–48. (In Russ). DOI: 10.52419/issn2072-2419.2023.4.37.


