Влияние гипертермии и заражения на активность общей пероксидазы картофеля двух сортов, контрастных по устойчивости к Clavibacter michiganensis ssp. sepedonicus
Автор: Перфильева А.И., Рымарева Е.В., Живетьев М.А., Папкина А.В.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 1 т.8, 2012 года.
Бесплатный доступ
Изучали изменение активности общей пероксидазы в растениях in vitro, в вегетирующих растениях устойчивого и восприимчивого сортов картофеля под влиянием абиотического (гипертермии) и биотического (заражение патогеном) стрессов. Показано, что активность пероксидазы в растениях восприимчивого сорта изменялась интенсивнее, чем в растениях устойчивого, вне зависимости от объекта исследования (растения in vitro, листья вегетирующих растений).
Картофель in vitro, вегетирующие растения, пероксидаза, гипертермия
Короткий адрес: https://sciup.org/14323595
IDR: 14323595
Текст научной статьи Влияние гипертермии и заражения на активность общей пероксидазы картофеля двух сортов, контрастных по устойчивости к Clavibacter michiganensis ssp. sepedonicus
Изучали изменение активности общей пероксидазы в растениях in vitro , в вегетирующих растениях устойчивого и восприимчивого сортов картофеля под влиянием абиотического (гипертермии) и биотического (заражение патогеном) стрессов. Показано, что активность пероксидазы в растениях восприимчивого сорта изменялась интенсивнее, чем в растениях устойчивого, вне зависимости от объекта исследования (растения in vitro , листья вегетирующих растений).
Одним из наиболее важных антиоксидантных ферментов, являющихся показателем неспецифического иммунитета является пероксидаза, активность и спектр изоформ которой меняются под действием биологических и небиологических агентов (Рогожин и др., 2004). Стрессоры различной природы приводят к повышению активности пероксидазы. Например, в ответ на воздействие солями отмечены как активация фермента, так и качественные изменения в его спектре (Аникеева, Егоров, 2001), а также показано, что при недостатке кислорода увеличивается интенсивность работы фермента и существенно меняется состав катионных форм (Ласточкин, 2005). Обезвоживание сопровождается не только повышением активности пероксидазы цитоплазмы и хлоропластов, но и изменением их изоферментного состава (Гайдаш, 2005). Под влиянием низких температур в листьях озимой ржи также возрастала активность фермента (Андреева, 1988). Повышение активности фермента ранее было отмечено и при механических повреждениях (Павловская и др.,
2010). На этиолированных проростках пшеницы показано, что их обработка в течение часа при 42°С увеличивала активность пероксидазы в корнях проростков и уменьшала ее в листьях (Орлова и др., 2007). Известно, что гипертермия изменяет активность антиоксидантных ферментов. Например, показано, что у ржи гипертермия необратимо изменяла активность каталазы, снижала активность каталазы огурца, сопровождаясь обесцвечиванием хлорофилла, что свидетельствует о существенном окислительном повреждении (Кошкин, 2010).
В настоящее время широкое распространение получило заболевание картофеля – кольцевая гниль картофеля, вызываемая бактерией Clavibacter michiganensis ssp. sepedonicus ( Cms ) (Иванюк и др., 2005). Показано, повышение активности пероксидазы в растениях картофеля, зараженных данным патогеном (Граскова, 2011). Для выявления обеззараживающего эффекта гипертермии в зараженных Cms растениях картофеля в данной работе определяли изменение активности общей пероксидазы, как одного из важнейших маркеров иммунного статуса растительного организма. Причем изменения активности данного фермента исследовали в растениях картофеля различной структурной организации: картофель in vitro , вегетирующие растения (в вегетационных сосудах, в полевых условиях).
МАТЕРИАЛЫ И МЕТОДЫ
В работе были использованы растения картофеля (Solanum tuberosum L). Сорт Луговской – устойчивый к бактериальному фитопатогену Cms и сорт Лукьяновский – восприимчивый к Cms. Растения in vitro выращивали на питательной среде Мурасиге-Скуга (МС) 42.2 г/л (Sigma, США) с добавлением сахарозы 20 г/л, пиридоксина 1 мл/л, тиамина 1 мл/л и феруловой кислоты 1 мл/л, рН 5.8-6.0. Черенки культивировали при температуре 24-25оС днем и 19-20оС ночью, освещенности 5-6 кLx и продолжительности фотопериода 16 часов. Растения in vitro заражали суспензией Cms (штамм Ac 14 05), OD заражения = 1,3. Ранее было установлено, что Cms полностью колонизирует растения картофеля на 2-е сутки после заражения (Перфильева, Рымарева, 2011). Поэтому, зараженные растения спустя 2 суток после заражения подвергали термообработке (37; 39; 45°С) в течение 2 ч в термостате, затем выдерживали при комнатной температуре 2 ч, после чего определяли активность общей пероксидазы в тканях картофеля.
Для исследования активности фермента в листьях вегетирующих зараженных растений картофеля, проводили предпосадочную обработку клубней картофеля. Клубни подвергали инъекции бактериальной суспензией Cms (OD = 1,0), затем клубни прогревали в термостате при 45°С, 1 ч. В силу того, что зараженные клубни нельзя высаживать в поле, во избежание заражения почвы патогеном, их высаживали в вегетационные сосуды с почвой.
Исследовали также влияние гипертермии на активность пероксидазы вегетирующих растений картофеля, произрастающих в естественной среде обитания. Клубни картофеля обрабатывали в термостате при 45°С, 1 ч, после чего, клубни высаживали на экспериментальном участке СИФИБРа.
Эксперименты на вегетирующих растениях проводили в 2009-2010 гг.
Для измерения активности общей пероксидазы брали листья среднего яруса вегетирующего картофеля / целое растение
Активность фермента рассчитывали по картофеля in vitro, определяли вес и растирали в методу Бояркина (Бояркин, 1951) по формуле:
двойном объеме 0.1 М цитратно-фосфатного буфера pH 5,5. Полученный гомогенат центрифугировали при 3000g в течение 10 мин и супернатант использовали для определения активности фермента при длине волны 580 нм в 2 мл реакционной смеси следующего состава: 0.5 мл 0.1 М цитратно-фосфатный буфер (pH 6.2
или 4.4), 0.5 мл 0.3% Н 2 О 2 («Реахим», Россия), 0,5 мл 0,05% гваякол (Sigma, США).
А = Σ ( α ∙ β ∙ γ) / d ∙ t , где
А – активность фермента, у.е./мг;
Σ – коэффициент экстинкции, равный 0,125;
α – отношение количества буфера, взятого для приготовления вытяжки в мл к весу сырой ткани;
β – степень дополнительного разведения вытяжки в реакционной смеси;
γ – степень постоянного разведения вытяжки в реакционной смеси;
d – толщина поглощающего слоя;
Вариант
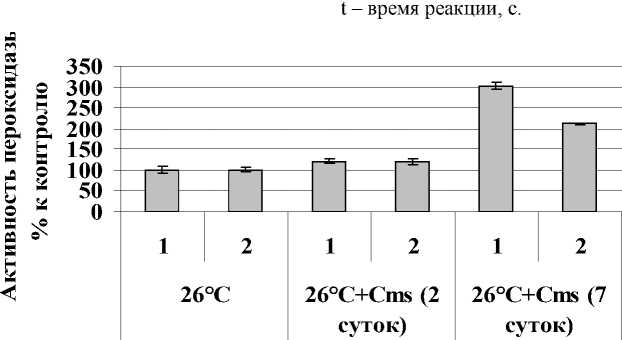
Рисунок 1. Влияние Cms на активность общей пероксидазы растений картофеля in vitro. 1 – Лукьяновский; 2 – Луговской. n = 3. M ± S.D.
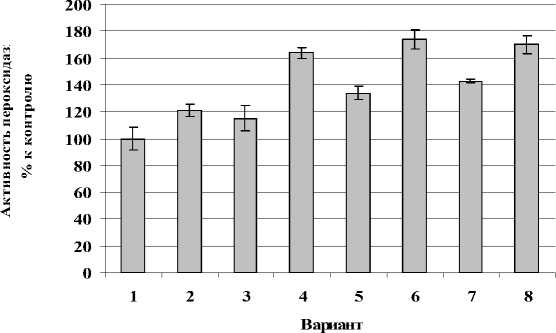
Рисунок 2. Влияние термообработки и заражения на активность общей пероксидазы растений картофеля in vitro сорта Лукьяновский. 1 - 26˚С (контроль); 2 - 26˚С + Cms ; 3 -37˚С; 4 - 37˚С + Cms ; 5 - 39˚С; 6 - 39˚С + Cms ; 7 - 45˚С; 8 - 45˚С + Cms . n = 3. M ± S.D.
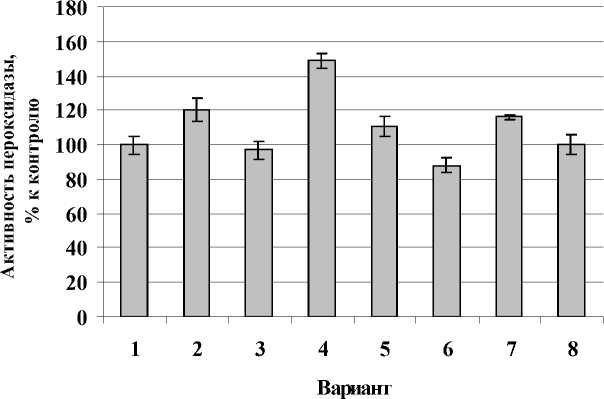
Рисунок 3. Влияние термообработки и заражения на активность общей пероксидазы картофеля сорта Луговской in vitro. 1 - 26˚С (контроль); 2 - 26˚С + Cms ; 3 - 37˚С; 4 - 37˚С + Cms ; 5 - 39˚С; 6 - 39˚С + Cms ; 7 - 45˚С; 8 - 45˚С + Cms . n = 3. M ± S.D.
Вариант
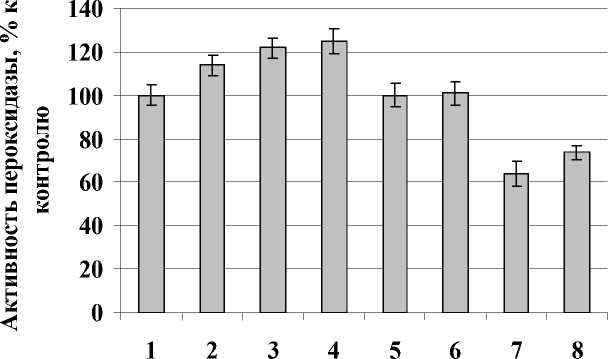
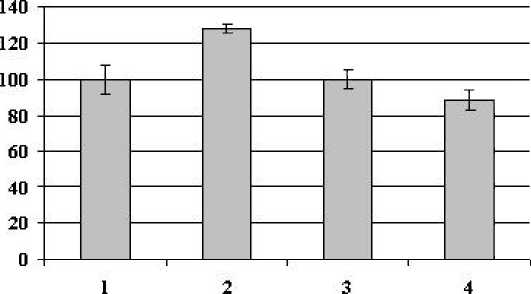
Рисунок 4. Активность общей пероксидазы в листьях картофеля сортов Лукъяновский и Луговской, выращенных из клубней, зараженных Cms и обработанных повышенными температурами. (1 – Лукьяновский, 26 °С (контроль); 2 – Лукьяновский, Cms + 26 °С; 3 – Лукьяновский, 45 °С; 4 – Лукьяновский Cms + 45 °С; 5 - Луговской, 26 °С; 6 – Луговской, Cms + 26 °С; 7 – Луговской, 45 °С; 8 – Луговской, Cms + 45°С ). Фаза бутонизации. n = 3-7. M ± S.D.

Рисунок 5. Активность общей пероксидазы в листьях картофеля сортов Луговской и Лукъяновский, выращенных из клубней, предварительно подвергнутых влиянию повышенной температуры (1 – Лукьяновский, 26°С; 2 – Лукьяновский, 45°С; 3 – Луговской, 26°С (контроль); 4 – Луговской, 45°С) n = 5. M ± S.D.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние термообработки и заражения на активность общей пероксидазы растений картофеля in vitro.
При сравнении активности исследуемого фермента у картофеля двух сортов, сразу после заражения и спустя 2 суток, активность пероксидазы растений Луговского сорта была чуть выше, чем активность пероксидазы из растений восприимчивого сорта Лукьяновский (рис.1). На 7-е сутки активность фермента у растений обоих сортов увеличивалась, причем интенсивнее у растений восприимчивого.
Представленные данные согласуются с данными, ранее полученными Грасковой (2008). Показано, что у растений восприимчивого сорта при заражении патогеном происходит синтез пероксидазы de novo , что требует времени и что не позволяет растению своевременно сформировать необходимую устойчивость (Граскова, 2008).
Оценивая влияние термообработки на активность исследуемого фермента в растениях каждого сорта, следует отметить, что у растений восприимчивого сорта (Лукьяновский) заражение при любой термообработке повышало активность пероксидазы (рис.2).
У устойчивого же сорта (Луговской) активность общей пероксидазы при заражении повышалась лишь при обычной и закаливающей температуре (37˚С), а при более высоких температурах (39 и 45˚С) снижалась (рис.3).
Таким образом, под действием термообработки активность общей пероксидазы в различной степени повышалась у здоровых растений обоих сортов (рис. 2, рис. 3). У растений восприимчивого сорта она несущественно превышала таковую устойчивого сорта. Это свидетельствует о том, что защитная реакция на абиотический стресс носит неспецифический характер. Однако, совместное воздействие двух неблагоприятных факторов существенно изменяло активность общей пероксидазы. В тканях растений восприимчивого сорта наблюдали более высокую активность этого фермента при температуре 45°С по сравнению с устойчивым сортом в аналогичных условиях. Это косвенно подтверждает специфичность устойчивости сортов растения-хозяина к патогену. Причем, в данном случае активность общей пероксидазы зависит от интенсивности гипертермии.
Влияние термообработки и заражения на активность общей пероксидазы в листьях вегетирующих растений картофеля, выращенных в вегетационных сосудах.
Исследования показали, что активность общей пероксидазы в тканях листьев здоровых растений восприимчивого сорта после термообработки клубней (45°С) понижалась, а у растений устойчивого сорта увеличивалась. В листьях зараженных растений восприимчивого сорта картофеля, как в контроле (26°С), так и обработанных при 45°С, наблюдалась тенденция к повышению активности общей пероксидазы (рис. 4). Наибольшее увеличение активности вызывала гипертермия по сравнению с контролем. Гипертермия на фоне заражения не вызывала дополнительного повышения активности фермента.
Активность общей пероксидазы в тканях листьев картофеля устойчивого сорта, выращенных из предварительно зараженных клубней, либо не изменялась после обработки при 26°С, либо уменьшалась при 45°С по сравнению с контролем.
Таким образом, на активность общей пероксидазы вегетирующих растений обоих сортов наибольшее влияние оказывала термообработка, что свидетельствует о неспецифичности ответных реакций растений. С другой стороны, специфичность ответа растений зависила от устойчивости к патогену. Так, у восприимчивого сорта активность общей пероксидазы повышалась, а у устойчивого – снижалась, не зависимо от способа воздействия. Следует учитывать, что обработке подвергали клубни, а долговременную реакцию наблюдали через 45 дней. Это свидетельствует о запуске пролонгированных механизмов, обеспечивающих долговременную ответную реакцию растений.
Влияние термообработки на активность общей пероксидазы в листьях вегетирующих растений картофеля, выращенных в полевых условиях.
Для исследования активности общей пероксидазы использовали листья среднего яруса кустов картофеля, выращенных в полевых условиях. Результаты активности фермента представлены на рис. 5.
Активность общей пероксидазы в тканях листа растений, выращенных из шокированных клубней (45°С) восприимчивого сорта была чуть выше, а у устойчивого сорта практически не изменялась (рис. 5). Из этого следует, что в условиях естественной среды, предпосадочная термообработка клубней изменяла активность общей пероксидазы листьев в зависимости от сорта картофеля.
Таким образом, на изменение активности пероксидазы под влиянием абиотического и биотического стрессоров не оказывают влияния условия культивирования картофеля. В трех условиях культивации (in vitro, вегетационные сосуды, полевые условия) у сортов наблюдалась одинаковая тенденция в изменении активности общей пероксидазы. Причем, интенсивность изменения фермента была различной, что объясняется разнообразными условиями выращивания. В данной работе не наблюдалось специфичности изменения активности пероксидазы в зависимости от условий выращивания, данный показатель зависел только от сорта. У восприимчивого сорта активность пероксидазы возрастала как при гипертермии, так и при заражении. Пероксидазная активность тканей устойчивого сорта незначительно изменялась при влиянии стрессоров. Таким образом, показатель изменения активности пероксидазы может выступать маркером стрессового состояния организма в большей степени для растений восприимчивого сорта.
ВЫВОДЫ
Наибольшие изменения, как при абиотическом, так и при биотическом стрессах наблюдались в растениях восприимчивого сорта (Лукьяновский). Активность общей пероксидазы увеличивалась при гипертермии, заражении и совместном действии гипертермии и заражения как на растения in vitro , так и на растения, выращенные в вегетационных сосудах и в полевых условиях.
У устойчивого сорта активность фермента при всех видах обработки существенно не изменялась, либо незначительно снижалась в растениях in vitro , в тканях листа вегетирующих растений, выращенных в вегетационных сосудах и в полевых условиях.
Список литературы Влияние гипертермии и заражения на активность общей пероксидазы картофеля двух сортов, контрастных по устойчивости к Clavibacter michiganensis ssp. sepedonicus
- Андреева В.А. (1988) Фермент пероксидаза. М.: Наука, 128 с.
- Аникеева Т.А., Егоров В.В. (2001) Влияние липидов и солей жирных кислот на активность пероксидазы в растворе. Вестник Московского университета. Серия химия, 42, 138-141.
- Бояркин А.Н. (1951) Быстрый метод определения активности пероксидазы. Биохимия, 16, 352.
- Гайдаш М.В. (2005) Процесс перекисного окисления липидов и активность пероксидазы в прорастающих семенах ярового ячменя в условиях оптимального увлажнения и засухи. Канд. Дис., 130с.
- Граскова И.А. (2008) Роль слабосвязанной с клеточной стенкой пероксидаз в устойчивости растений к биотическому стрессу. Автореф. дисс. доктора биол. наук, Иркутск, 46 с.
- Граскова И.А. (2011) Роль пероксидаз в устойчивости растений к биотическому стрессу. -Berlin: LAP LAMBER Academic Publishing, 356 с.
- Иванюк В.Г., Банадысев С.А., Журомский Г.К. (2005) Защита картофеля от болезней, вредителей и сорняков. -Мн.: Бенлпринт, 696 с.
- Кошкин Е.И. (2010) Физиология устойчивости сельскохозяйственных культур: учебник. -М.: Дрофа, 638 с.
- Ласточкин В.В. (2005) Роль антиоксидантной энзиматической системы в адаптации растений к условиям аноксии и постаноксической аэрации. Канд. Дис., 128с.
- Орлова А.Г., Олюшина Л.Н., Французова В.П., Веселов А.П. (2007) Влияние гипертермии на активность пероксидазы и ИУК-оксидазы проростков пшеницы. Вестник Нижегородского университета им. Н.И. Лобачевского, 3, 116-118.
- Павловская Н.E., Гагарина И.Н., Горькова И.В., Козявина К.Н., Муштакова В.М., Фомина В.Н., Роговин В.В. (2010) Пероксидазозависимый иммунитет гороха к фузариозу. Вестник ОрелГАУ, 5, 72-74.
- Перфильева А.И., Рымарева Е.В. (2011) Влияние гипертермии на распространение возбудителя кольцевой гнили картофеля по растениям картофеля in vitro. Вестник ИрГСХА, 46, 30-36.
- Рогожин В.В., Верхотуров В.В., Рогожина Т.В. (2004) Пероксидаза: строение и механизм действия. Иркутск: Изд-во ИрГТУ, 200 с.


