Влияние гипобарической барокамерной гипоксии на состояние гепатоцитов крыс с неалкогольной жировой дистрофией печени
Автор: Токтогулова Нургуль Асылбековна, Тухватшин Рустам Романович, Шувалова Мария Сергеевна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 3 т.8, 2022 года.
Бесплатный доступ
Проблема неалкогольной жировой дистрофии печени (НЖДП) приобрела особую актуальность в связи с широким распространением среди населения во всем мире. Механизмы накопления жиров в гепатоцитах до конца не раскрыты. Определенная роль в этом процессе отводится инсулинорезистентности, которая влечет за собой гиперпродукцию триглицеридов в печени. Влияние гипоксии на гепатоциты имеет многоконтурный характер. Актуальность работы продиктована отсутствием знаний об особенностях течения жировой дистрофии печени в условиях гипобарической гипоксии. В статье отражены результаты влияния гипобарической гипоксии на структурную организацию печени крыс, страдающих НЖДП. Цель. Изучить особенности влияния гипобарической гипоксии на структурную организацию печени крыс, страдающих НЖДП. Материалы и методы. Работа выполнена на 180 беспородных крысах-самцах массой 150-250 г. Перед началом эксперимента животных разделили на 2 серии: контрольную, где животные содержались на модифицированной диете по Ackerman и основную, в которой животные находящиеся на идентичной диете, одновременно подвергались действию барокамерной гипоксии (6000 м над ур. м., время экспозиции 6 часов, продолжительность эксперимента 35 и 70 суток). По истечении срока опытов животных декапитировали, проводили патологоанатомическое исследование и забор материала. Готовые гистологические препараты изучались под микроскопом с проведением морфометрии. Анализ полученных результатов проводили с помощью статистического пакета прикладных программ SPSS 16.0 для Windows. Значение p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Неалкогольная жировая дистрофия печени, гипобарическая гипоксия
Короткий адрес: https://sciup.org/14123625
IDR: 14123625 | УДК: 612.357.6-092.9(23.01+23.03)
Текст научной статьи Влияние гипобарической барокамерной гипоксии на состояние гепатоцитов крыс с неалкогольной жировой дистрофией печени
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 612.357.6-092.9(23.01+23.03)
Проблема неалкогольной жировой дистрофии печени (НЖДП) приобрела особую актуальность в связи с широким распространением среди населения во всем мире. Это дало основание трактовать НЖДП как не инфекционную эпидемию [1, 2]. Так установлено, что у 34% взрослого населения США и 29% Японии отмечается избыточное отложение жира в печени, не связанное со злоупотреблением алкоголя [3, 4]. В Российской Федерации масштабное эпидемиологическое исследование выявило неалкогольную жировую болезнь печени (НАЖБП) у 37,3 [5, 6]. Механизмы накопления жиров в гепатоцитах до конца не раскрыты. Определенная роль в этом процессе отводится инсулинорезистентности, которая влечет за собой гиперпродукцию триглицеридов в печени [7]. От функционального состояния печени в значительной степени зависит динамическое постоянство гомеоморфоза и гомеокинеза других органов и гомеостаза организма в целом. Главным условием, поддерживающим метаболические процессы на адекватном уровне в организме, в том числе в печени, является бесперебойное обеспечение кислородом [8]. Влияние гипоксии на гепатоциты имеет многоконтурный характер. Согласно одним данным [9], гипоксия усиливает экспрессию HIF-1α и NF-kappaB, тем самым стимулирует активацию звездчатых клеток печени, увеличивает ангиогенез, эпителиально-мезенхимальный переход, опосредует хроническое воспаление и генетическую модификацию; в итоге возникает и развивается фиброз печени. По другим данным [10, 11] чрезмерное потребление продуктов, содержащих липиды, способствует β-окислению жирных кислот, для чего требуется значительное количество кислорода. Сужение синусоидов печени из-за набухания гепатоцитов сопровождается гипоксией печени и провоцирует НЖДП. Одновременно есть мнение, что гипоксическая гипоксия может стимулировать функцию митохондрий и стать новой стратегией лечения НЖДП [12].
Поэтому, целью сообщения является изложение результатов исследования влияния гипобарической гипоксии на структурную организацию печени крыс, страдающих НЖДП.
Материалы и методы
Работа выполнена на 180 беспородных крысах-самцах массой 150–200 г. Перед началом эксперимента животных разделили на 2 серии: контрольную, где животные содержались на диете по Ackerman, состоящую из 21% белков (порошковый казеин), 5% жиров (топленое говяжье сало), 60% углеводов (кристаллическая фруктоза), 14% зернового корма (8% целлюлозы, 6% минеральной смеси и витаминов) [13] и основную, в которой животные находящиеся на идентичной диете [13], одновременно подвергались действию барокамерной гипоксии (Таблица 1).
Таблица 1
РАСПРЕДЕЛЕНИЕ ЖИВОТНЫХ В ЭКСПЕРИМЕНТЕ
|
Серии |
|
|
Контрольная (г.Бишкек, 760 м над ур.моря) |
Барокамерная (6000 м над ур.м) |
|
Группы |
|
|
I группа – интактные животные (n=20) |
Iа – группа –интактные животные (n=20) |
|
II группа – животные, находящиеся в течении 35-и дней на модифицированной диете по Ackerman (n=30) |
IIа группа – животные, находящиеся в течении 35-и дней на модифицированной диете по Ackerman (n=30) |
|
III группа – животные, находящиеся в течении 70-и дней на модифицированной диете по Ackerman (n=30) |
IIIа группа – животные, находящиеся в течении 70-и дней на модифицированной диете по Ackerman (n=30) |
Для изучения закономерностей сложной формы адаптации печени к предъявленной диете и прерывистой гипоксии в эксперименте использовалась климатическая барокамера.
При этом имитировался подъем на высоту 6000 м над ур. м. со скоростью 3,3 км/ч, а время экспозиции составило 6 часов, продолжительность эксперимента 35 и 70 суток. По истечении срока опытов животных декапитировали, проводили патологоанатомическое исследование и забор материала. Кусочки печени фиксировались в 10% растворе формалина, проводились по спиртам возрастающей концентрации, заливались в парафин, изготавливались гистологические препараты, окрашенные гематоксилин-эозином и по Ван-Гизону. Экспериментальные вмешательства проводились с соблюдением правил лабораторной практики, утвержденной приказом министерства здравоохранения и социального развития Российской Федерации от 23 августа 2010 г. №708 Н «Об утверждении правил лабораторной практики». Протокол исследования одобрен локальным этическим комитетом при НПО «Профилактическая медицина МЗ КР.
Готовые гистологические препараты изучались под микроскопом Olympus B×40 (Япония) одновременно проводились фотосъемка с протоколированием регистрируемых данных. Морфометрия осуществлялась при помощи встроенной компьютерной программы Top View.
Площадь гепатоцита рассчитывалась по формуле:
-
$ _ 3х7зха , ^е а — Диаметр гепатоцита;
Объем ядра гепатоцита определяли по формуле:
-
V = ~ ^( ~ ) 3 , где d — диаметр ядра.
Статистическая обработка данных проводилась в программе SPSS 16.0.
Результаты и обсуждение
Среди животных, находящихся 70 суток на диете по Ackerman в сочетании с действием барокамерной гипоксии, падеж животных составил 16%, а в группе контроля — 7%. Крысы IIIа группы отличались редкой, тусклой на вид шерстью, цианотичной мордочкой, исхуданием и малым весом, с потерявшими блеск глазами, отсутствием внутренностного и подкожного жира, тонкими и слабо развитыми мышцами. Не смотря на достаточное питание их желудочно-кишечный тракт был пуст, а печень отличалась не естественной окраской с явлениями застойного полнокровия, в то время как у животных, находящихся на названной диете в течение 35-и суток макроскопически печень характеризовалась увеличенными размерами, мелкозернистой бугристой поверхностью и бледноватым цветом.
Микроскопически в пределах классической дольки печени у крыс, находящихся на модифицированной диете Ackerman, на 35 сутки эксперимента отмечаются нарушения балочного строения с явлениями вакуолизации цитоплазмы гепатоцитов, достоверно значимое увеличение их площади на 70% без существенных изменений ядер (Таблица 2, Рисунок 1).
К 70 дню эксперимента площадь гепатоцитов увеличивается на 85%, а объем ядра — на 50% от исходных значений. Регистрируется выраженная жировая дистрофия гепатоцитов, а в отдельных участках — некротические повреждения гепатоцитов.
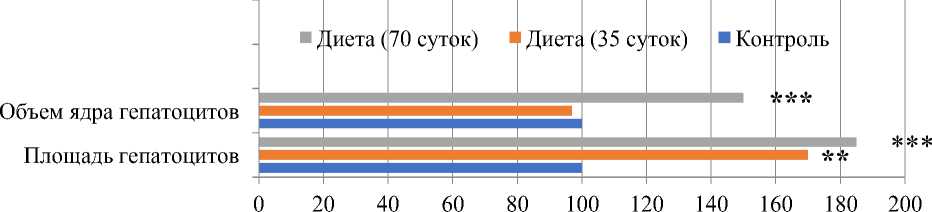
Рисунок 1. Изменение морфометрических показателей печени у крыс, находящихся на модифицированной диете Ackerman (%)
В синусоидах классической печеночной дольки визуализируется сепарация форменных элементов и плазмы с преобладанием плазменного компонента. Строма и межбалочные пространства отечные. В условиях барокамерной гипоксии (Таблица 3, Рисунок 2) у животных на 35 день эксперимента отмечается увеличение площади гепатоцитов на 30% (P<0,05), а объема ядра — на 5%. На 70 сутки площадь гепатоцитов увеличивается на 7%, а объем ядра — на 41%(P<0,001) в сравнении с аналогичными показателями контроля. Отмечается наличие безъядерных гепатоцитов (Рисунок 3).
ИЗМЕНЕНИЕ МОРФОМЕТРИЧЕСКИХ ПОКАЗАТЕЛЕЙ ПЕЧЕНИ У КРЫС, НАХОДЯЩИХСЯ НА МОДИФИЦИРОВАННОЙ ДИЕТЕ, ПОДВЕРГШИХСЯ БАРОКАМЕРНОЙ ГИПОКСИИ
Таблица 3
|
Площадь гепатоцита (нм2) |
Объем ядра гепатоцита (нм3) |
|
|
Iа группа |
8416,7±290,88 |
12318,68±431,17 |
|
IIа группа |
10930,80±535,50** |
12958,99±655,01 |
|
IIIа группа |
9057,76±371,6 |
17396,86±743,26*** |
Примечание: **P<0,05, ***P<0,001. Значения достоверны в группе животных на модифицированной диете Ackerman в сравнении с соответствующим результатом в контрольной группе
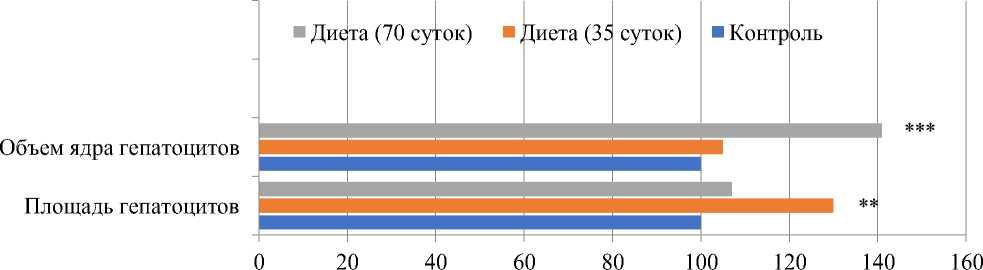
Рисунок 2. Изменение морфометрических показателей печени у крыс, находящихся на модифицированной диете Ackerman в условиях барокамерной гипоксии (%)
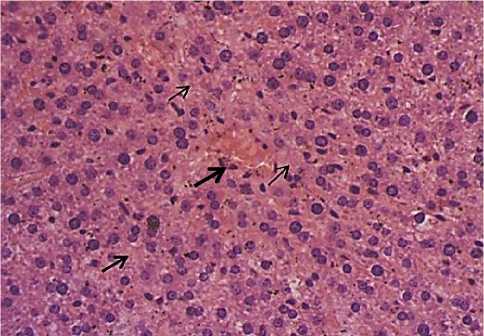
Рисунок 3. Кареолизис в гепатоцитах (гематоксилин-эозин, ув. 400)
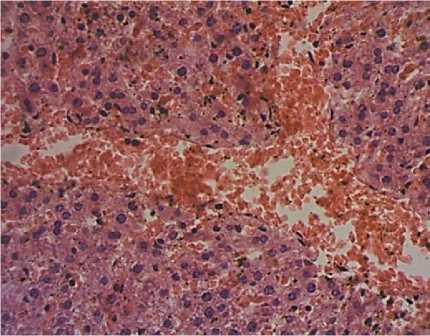
Рисунок 4. Гиперкапилляризация и полнокровие сосудов печени, сладжирование эритроцитов по типу монетных столбиков (гемотоксилин-эозин, ув. 400)
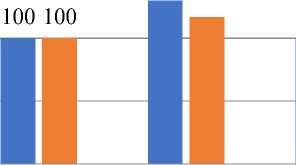
Как видно из Таблицы 4 и Рисунка 5, у животных, которые в течение 35-и суток находились на модифицированной диете по Ackerman и при этом подвергались действию барокамерной гипоксии отмечается увеличение объема ядра на 26% (P<0,05), и тенденция к снижению площади гепатоцита.
Таблица 4
СРАВНИТЕЛЬНЫЙ АНАЛИЗ МОРФОМЕТРИЧЕСКИХ ПОКАЗАТЕЛЕЙ ГЕПАТОЦИТОВ НА МОДИФИЦИРОВАННОЙ ДИЕТЕ ACKERMAN
У КРЫС НИЗКОГОРЬЯ И БАРОКАМЕРНОЙ ГИПОКСИИ НА 35-Е СУТКИ (нм)
|
Низкогорье |
Барокамера |
|||
|
Интактные животные |
Диета по Ackerman |
Интактные животные |
Диета по Ackerman |
|
|
Площадь гепатоцита (нм2) |
6472,09±210,5 |
11018,57±522,64 |
8416,7±290,88** |
10930,80±535,50 |
|
Объем ядра гепатоцита (нм3) |
10514,49±437,03 |
10224,77±652,79 |
12318,68±431,17** |
12958,99±655,01** |
Примечание: **P<0,05. Различия достоверны у животных, подвергшихся подъему в барокамере по сравнению с низкогорной серией
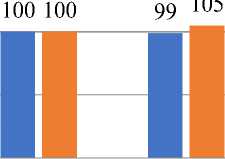
Микроциркуляторное русло печени в группе IIIа характеризуется гиперкапилляризацией и полнокровием; признаками реологических нарушений в виде сладжирования форменных элементов крови (Рисунок 5). На 70 сутки сочетанного действия модифицированной диеты по Ackerman и барокамерной гипоксии (Рисунок 6, Таблица 5) площадь гепатоцитов снижается на 25% (P<0,001), объем ядра имеет тенденцию к увеличению.
Процессы отложения гликогена, поставки энергетических субстратов тканям, реализуемые печенью, требуют значительного количества кислорода, что вызывает резкий градиент его во всех печеночных долях. Измененный печеночный метаболизм и ремоделирование тканей при НЖДП еще больше нарушают кислородный гомеостаз печени, что приводит к тяжелой гипоксии. Факторы, индуцируемые гипоксией (HIF), играют центральную роль в адаптации клеток и тканей к гипоксии. Являясь главными регуляторами адаптивных реакций на гипоксический стресс, индуцируемые гипоксией факторы (HIFS)
модулируют клеточные и органные функции, включая эритропоэз, ангиогенез, метаболическую потребность и выживание клеток.
130 117
низкогорье барокамера низкогорье (интактные) (интактные) (диета 35 суток)
барокамера (диета 35 суток)
■ Площадь гепатоцитов ■ Объем ядра
Рисунок 5. Сравнительный анализ морфометрических показателей гепатоцитов на модифицированной диете Ackerman у крыс низкогорья и барокамерной гипоксии на 35 сутки (%)
Таблица 5.
СРАВНИТЕЛЬНЫЙ АНАЛИЗ МОРФОМЕТРИЧЕСКИХ ПОКАЗАТЕЛЕЙ ГЕПАТОЦИТОВ НА МОДИФИЦИРОВАННОЙ ДИЕТЕ ACKERMAN
У КРЫС НИЗКОГОРЬЯ И БАРОКАМЕРНОЙ ГИПОКСИИ НА 70 СУТКИ (нм)
|
Низкогорье |
Барокамера |
|||
|
Интактные животные |
Диета по Ackerman |
Интактные животные |
Диета по Ackerman |
|
|
Площадь гепатоцита (нм2) |
6472,09±210,5 |
12006,16±575,75 |
8416,7±290,88** |
9057,76±371,6*** |
|
Объем ядра гепатоцита (нм3) |
10514,49±437,03 |
15832,60±1011,06 |
12318,68±431,17** |
17396,86±743,26 |
Примечание: ***P<0,001. Различия достоверны у животных, подвергшихся подъему в барокамере по сравнению с низкогорной серией.
130 117
низкогорье (интактные)
барокамера низкогорье барокамера
(интактные) (диета 70 суток)(диета 70 суток)
-
■ Площадь гепатоцитов ■ Объем ядра
Рисунок 6. Сравнительный анализ морфометрических показателей гепатоцитов на модифицированной диете у крыс низкогорья и барокамерной гипоксии на 70-е сутки (%).
Выводы:
-
1. У крыс, находящихся на модифицированной диете по Ackerman к 35 суткам эксперимента в гепатоцитах формируются стойкие изменения, характерные для неалкогольной жировой дистрофии печени.
-
2. Развитие неалкогольной жировой дистрофии печени в эксперименте приводит к значительному увеличению площади гепатоцитов (на 70% на 35 сутки и на 85% на 70 сутки), при этом объем ядер подвергается увеличению на 50% только к 70-м суткам эксперимента.
-
3. Барокамерная гипоксия снижает явления клеточной инфильтрации, что выражается отсутствием выраженного увеличения площади гепатоцитов, однако объем ядра нарастает на 41%.
Список литературы Влияние гипобарической барокамерной гипоксии на состояние гепатоцитов крыс с неалкогольной жировой дистрофией печени
- Adams L. A., Angulo P. Recent concepts in non-alcoholic fatty liver disease // Diabetic medicine. 2005. V. 22. №9. P. 1129-1133. https://doi.org/10.1111/j.1464-5491.2005.01748.x
- Samuel V. T., Shulman G. I. Nonalcoholic fatty liver disease as a nexus of metabolic and hepatic diseases // Cell metabolism. 2018. V. 27. №1. P. 22-41. https://doi.org/10.1016/j.cmet.2017.08.002
- Browning J. D., Szczepaniak L. S., Dobbins R., Nuremberg P., Horton J. D., Cohen J. C., Hobbs H. H. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity // Hepatology. 2004. V. 40. №6. P. 1387-1395. https://doi.org/10.1002/hep.20466
- Jimba S. et al. Prevalence of non-alcoholic fatty liver disease and its association with impaired glucose metabolism in Japanese adults // Diabetic medicine. 2005. V. 22. №9. P. 11411145. https://doi.org/10.1111/j.1464-5491.2005.01582.x
- Drapkina O., Evsyutina Y., Ivashkin V. Prevalence of non-alcoholic fatty liver disease in the Russian Federation: the open, multicenter, prospective study, DIREG 1 // American Journal of Clinical Medicine Research. 2015. V. 3. №2. P. 31-36. https://doi.org/10.12691/ajcmr-3-2-3
- Ивашкин В. Т., Драпкина О. М., Маев И. В. Распространенность неалкогольной жировой болезни печени у пациентов амбулаторно-поликлинической практики в Российской Федерации: результаты исследования Direg 2 // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2015. Т. 25. №6. С. 31-41.
- Browning J. D., Horton J. D. Molecular mediators of hepatic steatosis and liver injury // The Journal of clinical investigation. 2004. V. 114. №2. P. 147-152. https://doi.org/10.1172/JCI22422
- Янко Р. В., Березовский В. А., Чака Е. Г., Левашов М. И., Плотникова Л. Н., Литовка И. Г. Морфофункциональная характеристика гепатоцитов нормотензивных и гипертензивных крыс после воздействия прерывистой нормобарической гипоксии // Regulatory Mechanisms in Biosystems. 2017. Т. 2. №8. С. 265-270. https://doi.org/10.15421/021741
- Cai J., Hu M., Chen Z., Ling Z. The roles and mechanisms of hypoxia in liver fibrosis // Journal of Translational Medicine. 2021. V. 19. №1. P. 1-13. https://doi.org/10.1186/s12967-021-02854-x
- Henly D. C., Berry M. N. Effect of palmitate concentration on the relative contributions of the P-oxidation pathway and citric acid cycle to total O2 consumption of isolated rat hepatocytes // Biochimica et Biophysica Acta (BBA)-Molecular Cell Research. 1993. V. 1175. №3. P. 269-276. https://doi.org/10.1016/0167-4889(93)90216-C
- Kondo K., Sugioka T., Tsukada K., Aizawa M., Takizawa M., Shimizu K., Goda N. Fenofibrate, a Peroxisome Proliferator-Activated Receptor a Agonist, Improves Hepatic Microcirculatory Patency and Oxygen Availability in a High-Fat-Diet-Induced Fatty Liver in Mice // Oxygen transport to tissue XXXI. Springer, Boston, MA, 2010. P. 77-82. https://doi.org/10.1007/978-1-4419-1241-1_10
- Song K. et al. High-altitude chronic hypoxia ameliorates obesity-induced non-alcoholic fatty liver disease in mice by regulating mitochondrial and AMPK signaling // Life sciences. 2020. V. 252. P. 117633. https://doi.org/10.1016/j.lfs.2020.117633
- Ackerman Z., Oron-Herman M., Grozovski M., Rosenthal T., Pappo O., Link G., Sela B. A. Fructose-induced fatty liver disease: hepatic effects of blood pressure and plasma triglyceride reduction // Hypertension. 2005. V. 45. №5. P. 1012-1018. https://doi.org/10.1161/01.HYP.0000164570.20420.67


