Влияние гипоксии на конформацию и перераспределение гемоглобина в эритроцитах человека
Автор: Громова Н.В., Мартынова М.И., Просникова К.В., Ревин В.В., Ревина Э.С., Сейкина А.И., Столбова Т.А.
Журнал: Огарёв-online @ogarev-online
Статья в выпуске: 24 т.4, 2016 года.
Бесплатный доступ
Проведено исследование эритроцитов человека в норме и в условиях гипоксии. Установлено, что в условиях гипоксии наблюдается изменение конформации гемопорфирина гемоглобина.
Гемоглобин, гемопорфирин, гипоксия, кислород, лиганды, раман спектроскопия, эритроциты
Короткий адрес: https://sciup.org/147249252
IDR: 147249252 | УДК: 611.018.51:616.155.16
Текст научной статьи Влияние гипоксии на конформацию и перераспределение гемоглобина в эритроцитах человека
В последние десятилетия большой интерес представляет изучение влияния гипоксии на эритроциты. Гипоксия – состояние кислородного голодания. Данное явление широко распространено и возникает при различных патологических состояниях, связанных с нарушением функций дыхательной, сердечнососудистой систем и транспортной функции крови [6].
В условиях гипоксии в эритроцитах возрастает скорость процессов дезинтеграции и увеличивается количество поврежденных эритроцитов. Гипоксическое состояние приводит к изменению конформации гемоглобина, нарушению биоэнергетических процессов в эритроцитах, снижению выработки АТФ. Также оно деструктивно действует на мембрану эритроцитов, снижая содержание дискоцитов и увеличивая количество эхиноцитов и дегенеративных форм [4; 5].
В крови на фоне гипоксии происходят сложные конформационные изменения в молекулах гемоглобина, приводящие к расстройству их структуры и основной функции – отдачи кислорода тканям [2].
Развитие гипоксии оказывает значительное влияние на метаболизм эритроцитов. Первоначально это проявляется развитием окислительного стресса активацией гликолиза и накоплением 2,3 дифосфоглицерата. В условиях гипоксии происходит освобождение железа из внутриклеточных белковых комплексов, что рассматривается как один из факторов активации окислительного стресса. Допустимо, что в условиях гипоксии меняется фосфорилирование тирозиновых остатков белков эритроцитов, что оказывает влияние на внутриклеточную сигнализацию, метаболизм, а также на мембранный транспорт, объем клеток и их форму [1]. В условиях гипоксии окислительный стресс в эритроцитах значительно влияет на активность глицероальдегид -3-фосфатдегидрогеназы и активность белка 3 полосы [7].
Существует предположение, что повышение дезоксигемоглобина может ограничивать постоянство эритроцитов к окислительному стрессу. Эритроциты человека способны регулировать образование супероксиданионов в зависимости от напряжения кислорода и конформации гемоглобина. Конформация гемоглобина определяет переход основных путей метаболизма глюкозы в эритроцитах, что вносит вклад в устойчивость эритроцитов к окислительному стрессу. Предполагается, что конформация гемоглобина контролирует метаболизм не только глюкозы, но и тиолов в эритроцитах. В условиях гипоксии эритроциты демонстрировали снижение восстановительного потенциала системы глутатиона [3].
Молекула гемоглобина может находиться в двух конформациях - напряженной и расслабленной. Расслабленная конформация связывает кислород в 70 раз быстрее, чем напряженная. Если переход от напряженной формы гемоглобина к расслабленной больше, то увеличивается сродство гемоглобина к кислороду, и наоборот. Одной из значительных причин нарушения кислородно-транспортной системы может быть изменение конформации гемопорфирина гемоглобина и его сродства к кислороду (О 2 ) [8].
Проведено исследование влияния условия гипоксии на конформацию гемоглобина крови доноров. Установлено, что при гипоксии наблюдались изменения гемоглобина эритроцитов по отношению к контролю.
Материалы и методы исследования. Объектом исследования послужили эритроциты периферической крови человека, полученной из цельной крови доноров с ГБУЗ «Мордовская республиканская станция переливания крови» г. Саранска (возраст 25-45 лет, n=10). Все исследования проводили с соблюдением принципов Хельсинской декларации Всемирной медицинской ассоциации (WMA Declaration of Helsinki). В качестве антикоагулянта использовали Na-цитрат, конечная концентрация которого составляла 13ммоль/л, pH = 7,4. Форменные элементы крови осаждали центрифугированием при 1000 g в течение 10 минут. Плазму и лейкоцитарный слой отбрасывали, осадок ресуспендировали в десятикратном объеме среды промывания и инкубации эритроцитов, которая содержала 10мМ KH2PO4, 3,5мМ KCl, 1,5мМ MgCl2, 145мМ NaCl, 6мМ глюкозу pH= 7,4. Осаждали эритроциты центрифугированием при 1000 g 15 минут, T = 4° С. Процедуру промывания повторяли трехкратно. Полученный осадок эритроцитов разводили средой промывания в соотношении 1:5 (V:V). Суспензию использовали в течение часа. В течение этого времени эритроциты использовали для проведения дальнейших экспериментов.
Гипоксию вызывали путем воздействия на эритроцитарную массу газовой смеси азота в течение 10 мин.
Исследование конформации и свойств гемоглобина проводили с использованием рамановской спектроскопии комбинационного рассеяния на приборе In Via Renishaw (Великобритания) [*Максимов и др., 2001] с короткофокусным высокосветосильным монохроматором (фокусное расстояние не более 250 мм). Для возбуждения рамановских спектров использовался лазер (длина волны излучения 532 нм, максимальная мощность излучения 100 мВт, объектив 100х). Регистратор данных – CCD детектор (1024х256 пикселей с пельтье-охлаждением до –70º С) с решеткой 1800 штр/мм. Оцифрованные спектры обработаны в программе WIRE 3.3. Произведена коррекция базовой линии, сглаживание спектров.
Результаты и обсуждение. Гипоксия сопровождается изменением кислородсвязывающей способности гемоглобина. Нами показано, что при гипоксии в эритроцитах уменьшается относительное показание оксигемоглобина на 13,86% по отношению к контролю (рисунок 1).
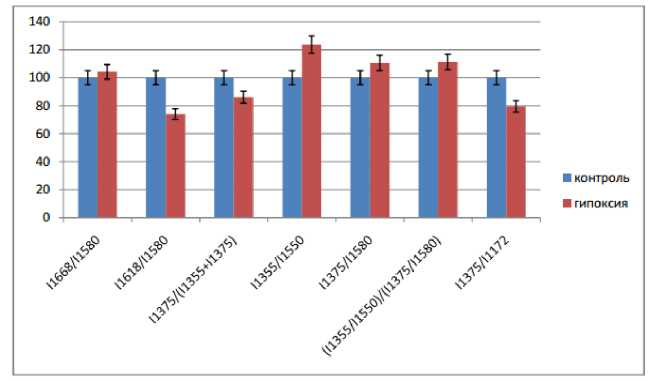
Рис. 1. Изменения кислородсвязывающей способности гемоглобина эритроцитов при гипоксии (*p≤0,05).
Относительное количество оксигемоглобина в эритроцитах человека уменьшилось на 13,83%. Известно, что при гипоксическом состоянии изменения конформации гемопорфирина гемоглобина способствуют меньшему погружению атома железа в пиррольное кольцо, что обеспечивает менее стабильное удержание кислорода, и, как следствие, повышение способности связывать и выделять лиганды. Относительная способность гемоглобина связывать лиганды увеличилась на 23,77%. Относительная способность гемоглобина выделять лиганды увеличилось на 10,57%.
Комплекс I Hb с оксидом азота (NO) при отсутствии связи между белком и гемопорфирином, регулирует способность Hb отдавать О 2. Его количество при гипоксии практически не изменилось. Содержание комплексов II Hb с NO при наличии связи между атомом Fe2+ и глобином уменьшилось на 25,92% по сравнению с контролем. Выраженность симметричных и асимметричных колебаний пиррольных колец (связано с конформационными изменениями пирролов) уменьшилось на 20,40% по сравнению с контролем.
Сродство гемоглобина к лигандам, в первую очередь, к кислороду, увеличилось на 11,28%. Повышение сродства обеспечивает большее взаимодействие между гемоглобином и кислородом, снижая эффективность отдачи кислорода, т.е. способствует снижению кислородтранспортной функции крови. Скорее всего при гипоксии гемоглобин отдает O 2 не попадая в периферические кровеносные сосуды, тем самым усугубляя ветвление гипоксии.
Заключение. Полученные данные, отражающие изменения структуры гемопорфирина гемоглобина при гипоксии, подтверждаются литературными источниками. Воздействие недостатка кислорода оказывает негативное влияние на нативные свойства гемоглобина и его способность переносить кислород за счет изменения сродства к лигандам. Повышение сродства обеспечивает большее взаимодействие между гемоглобином и кислородом, снижая эффективность отдачи кислорода, т.е. способствует снижению кислородтранспортной функции крови [1].


