Влияние гипоксии на молекулярное состояние гемоглобина эритроцитов крыс при физических нагрузках
Автор: Федяшкина Анастасия Николаевна, Максимов Георгий Владимирович
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Краткие сообщения
Статья в выпуске: 3-4, 2013 года.
Бесплатный доступ
В статье рассматриваются изменения конформации гемопорфирина при развитии гипоксии, связанной с разной физической нагрузкой у крыс.
Гемопорфирин, гипоксия, физическая нагрузка, спектр комбинационного рассеяния
Короткий адрес: https://sciup.org/14720024
IDR: 14720024 | УДК: 599.323.4:
Текст краткого сообщения Влияние гипоксии на молекулярное состояние гемоглобина эритроцитов крыс при физических нагрузках
Молекула гемоглобина может находиться в двух конформациях – напряженной и расслабленной. Расслабленная комформация связывает кислород в 70 раз быстрее, чем напряженная. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Одной из важных причин нарушения кислородтранспортной системы может быть изменение конформации гемопорфирина гемоглобина (Гб) и его сродства к кислороду (О2) [4]. Применение спектроскопии комбинационного рассеяния (КР) позволяет выявить изменения конформации гемопорфирина при развитии гипоксии, связанной с разной физической нагрузкой.
В эксперименте использовались беспородные крысы обоего пола с массой тела от 130 до 230 г, разделенные на 4 группы. Первую (контрольную) группу составляли интактные животные; во второй группе животные подвергались физическим нагрузкам малой интенсивности (4 ч в месяц, что со- ставляло 1 ч в неделю); в третьей группе животные подвергались средним физическим нагрузкам (10 ч. в месяц, или 2–3 раза в неделю по 1 ч); в четвертой группе животные подвергались сильным физическим нагрузкам (24 ч в месяц, или 6 раз в неделю по 1 ч). В ходе исследований у крыс проводили забор крови из хвостовой вены, кровь гепаринизировали, затем отмывали эритроциты и готовили мазок эритроцитарной массы на предметном стекле.
Исследование выполнялось с помощью рамановского спектрометра in via Basis, для получения спектров геморфирина гемоглобина использовался микроскоп с регистрацией комбинационного рассеяния света in via Basis фирмы Renishaw с короткофокусным высокосветосильным монохроматором (фокусное расстояние не более 250 мм), длина волны излучения используемого лазера составляла 532 нм, мощность излучения 100 мВт, объектив 50х. Регистратор данных — CCD детектор (1024 х 256 пикселей с пельтье-охлаждением до -70 °С) с решет
кой 1 800 штр/ мм. Оцифрованные спект- Производилась коррекция базовой линии, ры обрабатывались в программе WIRE 3.3. сглаживание спектров (рис. 1).
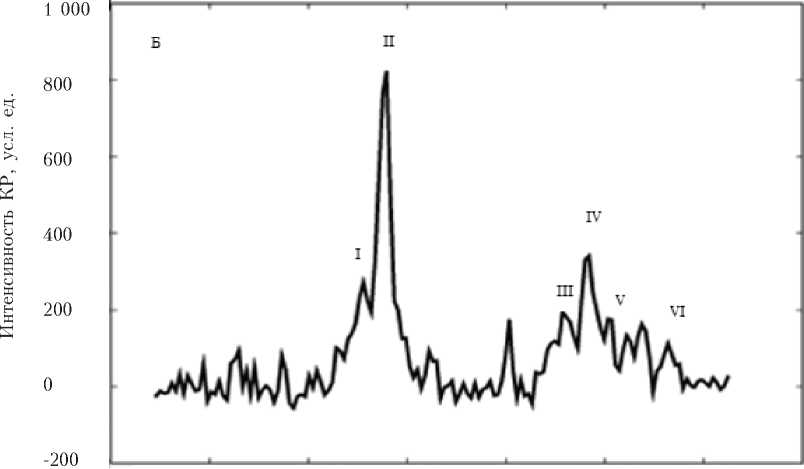
Частотный сдвиг, см-1
Р и с. 1 . Спектр гемопорферина гемоглобина
В работе для анализа конформации и О2-связывающих свойств Гб использовались определенные характерные полосы спектра КР, которые позволяли исследовать конформацию ГП в дезоксигемоглобине (д-Гб) и способность д-Гб связывать лиганд, а также конформацию ГП в оксигемоглобине (о-Гб) и способность о-Гб сбрасывать кислород: 1 355, 1 375, 1 548–1 552, 1 580– 1 588 см– 1. Полосы 1 355 и 1 375 см–1 связаны с симметричными колебаниями пиррольных колец (связи СаСb, СaN и СaNСa) в молекулах дезоксигемоглобина и гемоглобина, связанного с лигандами, соответственно [3]. Данное соотношение интенсивностей I1375/(I1355 + I1375) является характеристикой относительного количества о-Гб в суспензии эритроцитов. Полосы 1 548–1 552 см–1 и 1 580–1 588 см–1 связаны с колебанием метиновых мостиков между пирролами (связи CaCm, CaCmH) в молекулах Гб, в одних из которых гемопорфирин растянут и деформирован (1 548–1 552 см–1) а в других имеет более компактную недеформированную конформацию (1 580–1 588 см–1) [1]. Если сравниваемые пробы отличаются по содержанию относительному о-Гб, то необходимо учитывать зависимость интенсивностей полос 1 548–1 552 см–1 и 1 580–1 588 см–1 от количеств д-Гб и о-Гб. При такой нормировке отношение интенсивностей I1355/I1550 отражает относительную способность всего Гб в пробе связывать лиганды (в том числе О2), а соотношение I1375/I1580 – относительную способность Гб выделять лиганды [2].
Относительное количество о-Гб в суспензии эритроцитов снижалось при слабых и средних интенсивностях физических нагрузок (4 и 10 ч) на 3 и 12 % по отношению к контролю, которое восстанавливался при более длительном воздействии (24 ч) (рис. 2).
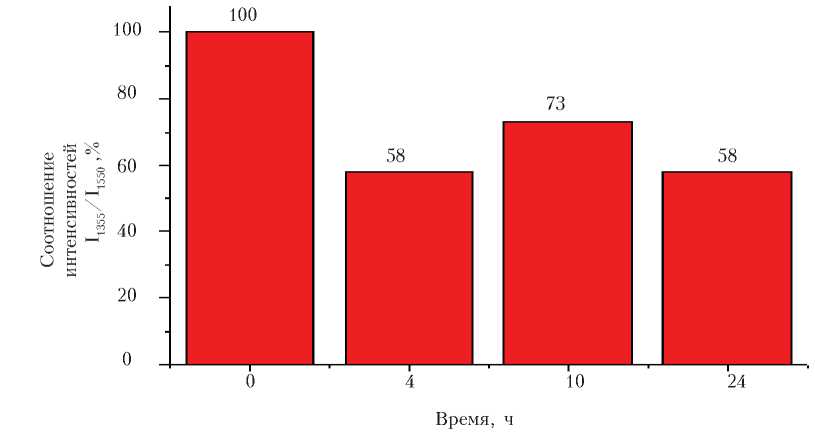
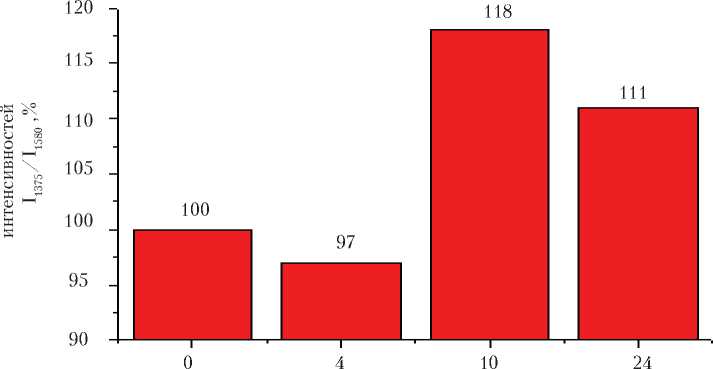
X х Рис. 2. Диаграмма относительного количества о-Гб в суспензии эритроцитов Способность Гб связывать лиганды контролем. При воздействии средней ин-в том числе О2) значительно снижалось тенсивности (10 ч) также происходило при слабых (4 ч) и высоких интенсив- снижение связывающей способности на ностях (24) на 42 % по сравнению с 27 % (рис. 3). Рис. 3. Диаграмма относительной способности Гб в пробе связывать лиганды Способность Гб выделять лиганды практически не изменялась при слабой интенсивности (3 %), но при более длительном воздействии способность выделять О2 увеличивалась на 11 и 18 % (рис. 4). Время, ч Рис. 4. Диаграмма относительной способности Гб в пробе выделять лиганды На основе полученных экспериментальных данных было установлено, что при физических нагрузках относительное содержание о-Гб и способность Гб связывать лиганды (в том числе О2) в суспензии эритроцитов ниже по сравнению с контролем, но способность Гб выделять лиганды увеличивается. Показано, что функциональное состояние крыс при слабой и высокой интенсивности физических нагрузок отражается в способности связывать и сбрасывать кислород.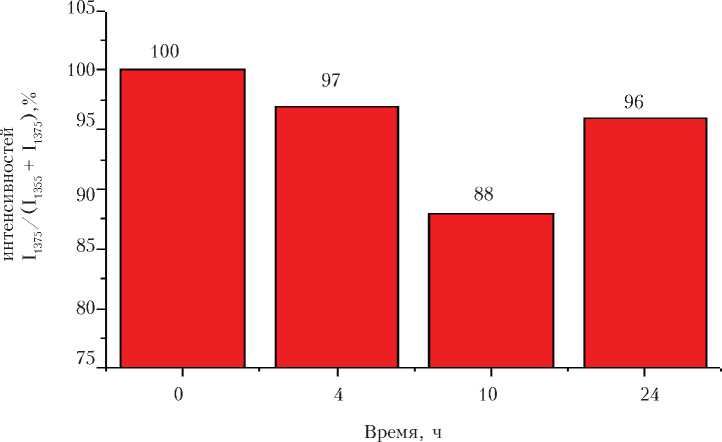
Список литературы Влияние гипоксии на молекулярное состояние гемоглобина эритроцитов крыс при физических нагрузках
- Кэри П. Применения спектроскопии КР и РКР в биохимии/П. Кэри. -М.: Мир, 1985. -272 с.
- Нанобиотехнологии: практикум/А. М. Абатурова [и др.]. -М.: БИНОМ. -Лаб. знаний, 2012. -384 с.
- Спектроскопия порфиринов: колебательные состояния/К. Н. Соловьев [и др.]. -Минск: Наука и техника, 1985. -415 с.
- Сродство гемоглобина к кислороду: Изменение сродства гемоглобина к кислороду: Эффект Бора. [Электронный ресурс]//МедУнивер -медицинский информационный портал для интересующихся медициной. -Режим доступа: http://meduniver.com/Medical/Physiology/432.html. -Дата обращения 09.07.2013.


