Влияние химической предыстории сорбента-минерализатора на процесс его карбонизации в водных средах
Автор: Морозова Алла Георгиевна, Лонзингер Татьяна Мопровна, Скотников Вадим Анатольевич, Судариков Михаил Викторович, Лонзингер Петр Владимирович, Морозов Андрей Павлович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 2 т.15, 2023 года.
Бесплатный доступ
Обнаружена способность сорбента-минерализатора к необратимому связыванию углекислого газа как в пресной, так и в морской воде путем формирования химически и термически устойчивых карбонатных структурных форм на базе мелилита Ca2[Al2Mg,Si]Si2O7. Выявлено влияние химической предыстории сорбента-минерализатора на процесс его карбонизации в водных средах. Показано, что CO32--группы в составе исходного сорбента-минерализатора являются первичными активными центрами при поверхностном фазообразовании карбонизированных алюмосиликатов кальция, магния в водных средах. Установлено, что термическая устойчивость структуры карбонизированных алюмосиликатов кальция, магния сохраняется после нагревания до 1000 °C. Образование карбонизированных гидроалюмосиликатов кальция, магния в морской воде сопровождается увеличением pH, что характеризует способность сорбента-минерализатора к регулированию кислотно-щелочного баланса и поддержанию карбонатного равновесия в гидросфере. Помимо необратимого связывания CO2, сорбент-минерализатор обнаруживает в морской воде способность к необратимой сорбции примесных катионов Pb2+, Cu2+, Zn2+, а также фосфора.
Сорбент-минерализатор, карбонизация, мелилит, гидролитическая активность, необратимая сорбция, карбонатное равновесие
Короткий адрес: https://sciup.org/147240603
IDR: 147240603 | УДК: 544.344 | DOI: 10.14529/chem230211
Текст научной статьи Влияние химической предыстории сорбента-минерализатора на процесс его карбонизации в водных средах
Одной из гипотез причин глобальных климатических изменений за последние 100–150 лет является парниковый эффект, связанный с увеличением количества CO2 в атмосфере на 25– 30 %. Рост содержания CO 2 в атмосфере совпадает с темпами сжигания органического топлива, наложением техногенной миграции CO 2 на естественные природные биогеохимические циклы [1]. Естественный природный сток CO 2 из атмосферы обеспечивает гидросфера, так как растворимость CO 2 в воде в 40 раз больше, чем его содержание в воздухе. Карбонатная система вод – одна из наиболее равновесных систем в биосфере [2]. В этой связи мировой океан является планетарным демпфером, компенсационной системой, регулирующей содержание CO2 в атмосфере и гидросфере [3–5]. Карбонатное равновесие в гидросфере поддерживается в основном за счет биологических процессов с участием растворенного CO 2 [6, 7]. Появление избыточного техногенного CO2 создает опасность нарушения кислотно-щелочного баланса гидросферы, локального закисления природных вод, нарушения термодинамического равновесия экосистем гидросферы [8].
Роль абиотических факторов в поддержании кислотно-щелочного баланса и карбонатного равновесия учитывается недостаточно. В работах [9, 10] установлена способность сорбента-минерализатора к необратимой сорбции катионов Cu2+ в результате реакций катионного обмена Ca2+ и Cu2+, Mg2+ и Cu2+ путем внедрения в мелилитовые твердые растворы. Показано, что первичные активные центры на поверхности сорбента-минерализатора участвуют в реакциях анионного обмена 2OH– ↔ CO32–; 2OH– ↔ SO42–; CO32– ↔ SO42– и поверхностного фазообразования с формированием смешанных карбонатных и сульфатных новообразований, структурно связанных с силикатной матрицей. Установлено, что процессы сорбции и поверхностного фазообразования происходят параллельно, не составляют конкуренцию друг другу, формируя тем самым сорбци-онно-минерализующие свойства, блокирующие миграцию катионов и анионов в окружающую среду. Физико-химические функции сорбента-минерализатора в природных водных средах изучены недостаточно.
Экспериментальная часть
Объектами исследования служили образцы сорбента-минерализатора: в исходном состоянии, после выдержки в дистиллированной воде, после выдержки в морской воде. Эксперимент проводили в статических условиях методом ограниченного объема при соотношении твердое:жидкое = 1:30. Время экспозиции – 14 суток.
Методы исследования: термический анализ на дериватографе Q-1500D системы F. Paulik, J. Paulik, L. Erdei, электронно-микроскопический анализ на электронном микроскопе JEOL JSM 6460LV с приставкой для микрорентгеноспектрального анализа, химический анализ на атомноэмиссионном спектрометре с индукционно-связанной плазмой Optima 2100DV.
Поверхность исходного сорбента-минерализатора фрагментирована (рис. 1, табл. 1), по составу соответствует алюмосиликату кальция-магния мелилитового ряда Ca2[Al2Mg,Si]Si2O7. В составе материала присутствует остаточный углерод. По данным [2] остаточный углерод присутствует в виде CO 3 2–-групп, структурно связанных с силикатной матрицей. Поверхность сорбента-минерализатора структурирована (рис. 2).

Рис. 1. Микрофотография сорбента-минерализатора

Рис. 2. Размеры структурных элементов исходного сорбента-минерализатора
Таблица 1
Результаты микрорентгеноспектрального анализа с прямоугольной области на рис. 1
|
Элемент |
C |
O |
Mg |
Al |
Si |
Ca |
Итого |
|
Содержание, мас. %, рис. 1 |
4,92 |
41,84 |
8,17 |
7,20 |
17,79 |
20,08 |
100,00 |
Данные термического анализа подтверждают наличие карбонатных группировок, связанных с силикатной матрицей. Об этом свидетельствует эндоэффект при 685 °C и потеря массы в интервале температур 600–800 °C – 1,3 мас. %, составляющая в пересчете на CaCO 3 – 2,95 мас. % (рис. 3). Снижение температурного интервала декарбонизации на 150–200 °C по сравнению с индивидуальным структурно-свободным CaCO3 является подтверждением связи карбонатных группировок с алюмосиликатной матрицей. Линейный характер обезвоживания в интервале температур 200–500 °C свидетельствует о том, что физически адсорбированная вода при взаимодействии с алюмосиликатом на воздухе переходит в межслойную и гидроксильную. Удаление всех форм связанной воды сопровождается потерей массы 0,5 %.
В понятие химической предыстории сорбента-минерализатора мы вкладываем представления о его химическом и структурном состоянии, определяемых условиями его синтеза.
При выдержке в дистиллированной воде материал обнаруживает гидролитическую активность (рис. 4), количество связанной воды возрастает на 1,4 %. Судя по энергетическим характеристикам и кинетике обезвоживания при термическом анализе, связанная вода представлена несколькими видами – хемосорбированная, межслойная (цеолитового типа), гидроксильная.
Физическая химия
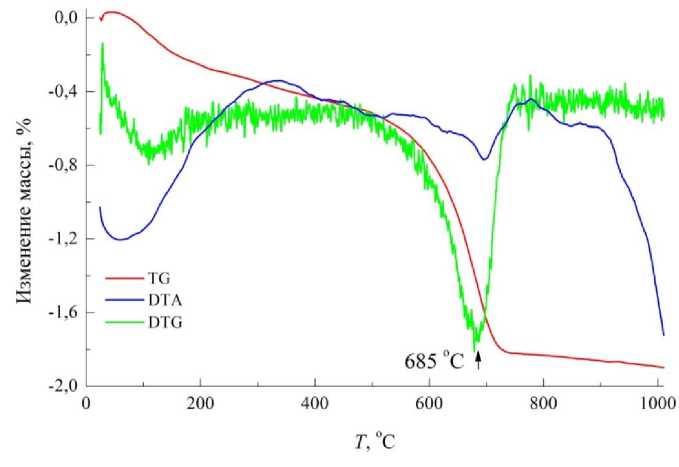
Рис. 3. Дериватограмма образца исходного сорбента-минерализатора
Потери массы в интервале температур 730–870 °C с максимумом скорости выделения при 845 °C свидетельствует о декарбонизации CaCO3, трансформированного в устойчивую структурную форму. Потери массы в интервале декарбонизации 1,8 мас. % соответствуют 4,1 % в пересчете на CaCO 3 .
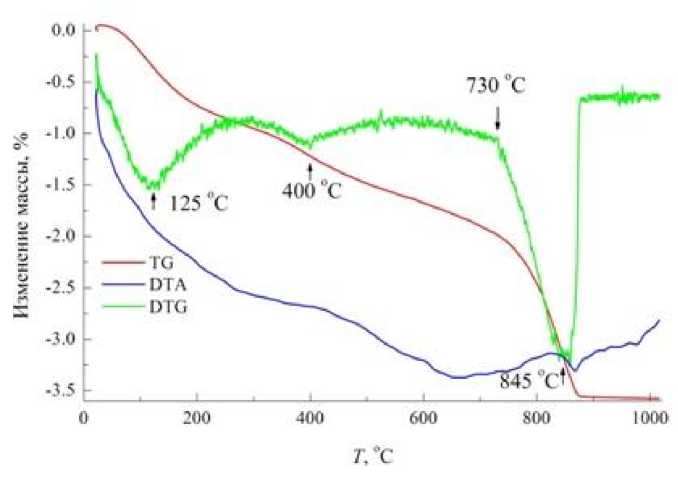
Рис. 4. Дериватограмма образца сорбента-минерализатора после выдержки в дистиллированной воде
Микроскопические исследования подтверждают способность разработанного материала к поверхностной карбонизации. Гидролитическая активность проявляется в формировании смешанных карбонизированных алюмосиликатов кальция, магния (рис. 5, 6, табл. 2).
Активными центрами для развития процесса карбонизации служат CO 3 2–-группировки в составе исходного сорбента-минерализатора.
Таблица 2
Результаты микрорентгеноспектрального анализа
|
Элемент |
C |
O |
Mg |
Al |
Si |
Ca |
Итого |
|
Содержание, мас. %, рис. 5 |
13,78 |
48,62 |
13,09 |
6,82 |
7,30 |
10,38 |
100,00 |
|
Содержание, мас. %, рис. 6 |
16,51 |
36,26 |
5,76 |
1,70 |
2,46 |
37,30 |
100,00 |

Рис. 5. Структура карбонизированного алюмосиликата кальция, магния

Рис. 6. Карбонат кальция, магния, структурно связанный с алюмосиликатом
Для оценки гидролитической активности сорбента-минерализатора в морской воде была использована вода Средиземного моря, взятая у берегов о. Родос (Греция). Химический состав морской воды до и после взаимодействия с сорбентом-минерализатором представлен в табл. 3.
Таблица 3
Результаты химического анализа морской воды
|
№ п/п |
Элемент |
Содержание, мг/дм3 |
|
|
исходное |
после взаимодействия |
||
|
1 |
Алюминий |
0,11 |
0,25 |
|
2 |
Кальций |
414,9 |
1116,37 |
|
3 |
Кобальт |
Не обн. |
Не обн. |
|
4 |
Хром |
0,02 |
0,02 |
|
5 |
Медь |
1,51 |
0,33 |
|
6 |
Железо |
Не обн. |
Не обн. |
|
7 |
Калий |
111,53 |
120,78 |
|
8 |
Магний |
1241,35 |
797,89 |
|
9 |
Марганец |
0,07 |
0,07 |
|
10 |
Натрий |
12589,9 |
18325,0 |
|
11 |
Никель |
0,02 |
0,02 |
|
12 |
Фосфор |
0,93 |
0,54 |
|
13 |
Свинец |
0,67 |
0,29 |
|
14 |
Кремний |
0,70 |
3,10 |
|
15 |
Титан |
Не обн. |
Не обн. |
|
16 |
Цинк |
0,38 |
0,29 |
Как следует из таблицы, сорбент-минерализатор активно снижает содержание в морской воде свинца, меди, цинка, фосфора, магния. Содержание кальция, алюминия и кремния увеличивается и сопровождается повышением pH с 6,90 до 7,87. Результаты взаимодействия сорбента-минерализатора с растворенным CO 2 иллюстрируют данные электронно-микроскопического анализа (рис. 7, 8, табл. 4, 5).
Физическая химия

а)

б)
Рис. 7. Микроструктура сорбента-минерализатора после выдержки в морской воде: а – общий вид поверхности; б – карбонизированный алюмосиликат кальция
Таблица 4
Результаты микрорентгеноспектрального анализа
|
Элемент |
C |
O |
Na |
Mg |
Al |
Si |
S |
Cl |
Ca |
Fe |
Итого |
|
Содержание, мас. %, рис. 7а |
10,67 |
47,20 |
1,39 |
8,86 |
3,29 |
10,70 |
0,41 |
2,10 |
14,90 |
0,49 |
100,00 |
|
Содержание, мас. %, рис. 7б |
7,21 |
49,28 |
0,69 |
4,57 |
13,23 |
10,11 |
– |
0,94 |
13,97 |
– |
100,00 |
а) б)
Рис. 8. Фрагменты микроструктуры сорбента-минерализатора после выдержки в морской воде, участки с повышенным содержанием углерода: а – локальная область с повышенным содержанием натрия и хлора;
б – локальная область с пониженным содержанием кальция
Таблица 5
Результаты микрорентгеноспектрального анализа
|
Элемент |
C |
O |
Na |
Mg |
Al |
Si |
S |
Cl |
Ca |
Fe |
Итого |
|
Содержание, мас. %, рис. 8а |
16,64 |
47,86 |
1,29 |
8,97 |
1,75 |
9,67 |
0,37 |
2,43 |
10,66 |
0,37 |
100,00 |
|
Содержание, мас. %, рис. 8б |
18,10 |
52,55 |
0,68 |
5,52 |
8,73 |
5,58 |
0,18 |
1,07 |
7,60 |
– |
100,00 |
Содержание углерода на поверхности сорбента-минерализатора в локальных областях колеблется в пределах 7–18 мас. %. Индивидуальные карбонаты отсутствуют, углерод, по-видимому, в виде CO 3 2–-групп входит в состав алюмосиликата кальция, магния. Последнее подтверждают результаты термогравиметрического анализа (рис. 9).
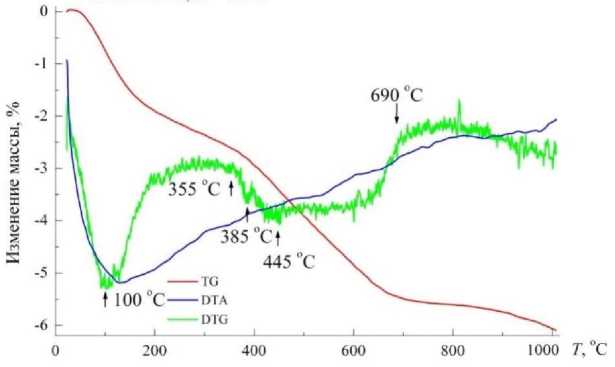
Рис. 9. Дериватограмма образца сорбента-минерализатора после выдержки в морской воде
Судя по характеру обезвоживания, вода в составе сорбента-минерализатора присутствует в трех видах:
-
• 80–180 °C, потери массы 1,75 %, адсорбированная;
-
• 180–385 °C, потери массы 0,85 %, межслойная, цеолитового типа;
-
• 385–690 °C, потери массы 3,00 %, структурная (гидроксильная).
Следует особо подчеркнуть, что эффект декарбонизации на дериватограмме отсутствует, несмотря на значительное содержание углерода в составе образцов после их выдержки в морской воде.
Неопределенность в структурном состоянии углерода устраняется в результате электронномикроскопического исследования сорбента-минерализатора после термического анализа (рис. 10, табл. 6).

Рис. 10. Микроструктура сорбента-минерализатора, выдержанного в морской воде, после нагрева до 1000 °С: а – общий вид поверхности; б –карбонизированные алюмосиликаты кальция-магния. Область с повышенным содержанием магния и кальция; в – карбонизированные алюмосиликаты кальция-магния. Область с повышенным содержанием кальция; г – карбонизированные алюмосиликаты кальция-магния. Область с повышенным содержанием алюминия


Физическая химия
Таблица 6
Результаты микрорентгеноспектрального анализа
|
Элемент |
C |
O |
Mg |
Al |
Si |
S |
Ca |
Итого |
|
Содержание, мас.%, рис. 10а |
6,42 |
48,35 |
6,47 |
10,67 |
14,02 |
0,52 |
13,45 |
100,00 |
|
Содержание, мас.%, рис. 10б |
11,35 |
42,83 |
11,42 |
2,48 |
15,31 |
0,38 |
16,22 |
100,00 |
|
Содержание, мас.%, рис. 10в |
8,02 |
53,75 |
5,20 |
5,58 |
7,79 |
— |
19,66 |
100,00 |
|
Содержание, мас.%, рис. 10г |
12,74 |
47,29 |
2,30 |
14,56 |
9,08 |
1,11 |
12,91 |
100,00 |
Результаты электронно-микроскопического анализа показывают, что в составе выдержанного в морской воде сорбента-минерализатора после нагрева до 1000 °С диагностируется углерод в количестве, соизмеримом с непрокаленными образцами. Состав образцов после прокалки соответствует карбонизированному алюмосиликату кальция, магния мелилитового ряда Ca 2 [Al 2 Mg,Si]Si 2 O 7 .
Изменение среднего содержания углерода на поверхности сорбента-минерализатора в исходном состоянии и после выдержки в пресной и морской воде представлено в диаграмме на рис. 11.
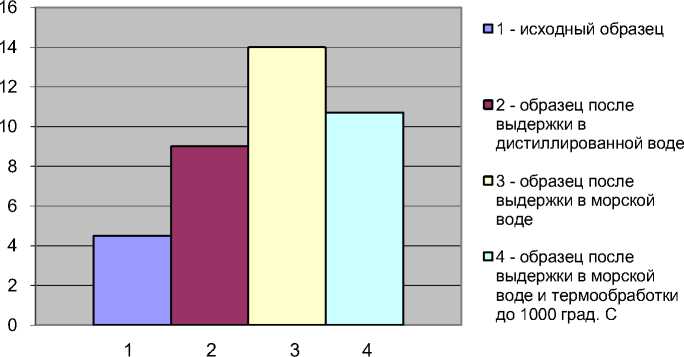
Исследуемые образцы
Рис. 11. Изменение содержания углерода на поверхности сорбента-минерализатора
Выводы
-
1. Выявлено влияние химической предыстории сорбента-минерализатора на процесс его карбонизации в водных средах.
-
2. Показано, что CO 3 2–-группы в составе исходного сорбента-минерализатора являются первичными активными центрами при поверхностном фазообразовании карбонизированных алюмосиликатов кальция, магния в водных средах.
-
3. Обнаружена способность сорбента-минерализатора к необратимому связыванию растворенного углекислого газа как в пресной, так и в морской воде путем формирования химически и термически устойчивых структурных форм.
-
4. Образование карбонизированных гидроалюмосиликатов кальция, магния в морской воде сопровождается увеличением pH, что характеризует способность сорбента-минерализатора к регулированию кислотно-щелочного баланса и поддержанию карбонатного равновесия в гидросфере. После дегидратации (температура нагрева – 1000 °С) в структуре алюмосиликатов кальция-магния присутствует углерод.
-
5. Помимо необратимого связывания CO 2 , сорбент-минерализатор обнаруживает в морской воде способность к необратимой сорбции катионов свинца, меди, цинка, а также фосфора.
Список литературы Влияние химической предыстории сорбента-минерализатора на процесс его карбонизации в водных средах
- Маккавеев П.Н. Растворенный неорганический углерод в океане и климат // Геоэкология. Инженерная экология, гидрогеология, геокриология. 2012. № 3. С. 197-204.
- Еремин О.В., Сергутская О.С., Юргенсон Г.А. О термодинамическом равновесии сульфат-карбонатных растворов в анаэробной среде (на примере озерной воды Шерловогорского карьера) // Минералогия и геохимия ландшафта горнорудных территорий. Современное минералообразование. 2010. С. 94-98.
- Маккавеев П.Н. Изменчивость карбонатного равновесия вод мирового океана: автореф. дис. … д-ра геогр. наук. М.: Институт океанологии им. П.П. Ширшова (РАН), 2009. 48 с.
- Разумов С.О., Григорьев М.Н. Береговые криогенные процессы как фактор дестабилизации углекисло-карбонатного равновесия в морях Восточной Сибири // Криосфера Земли. 2011. Т. 15, № 4. С. 75-79.
- Тищенко П.Я. Кислотно-основное равновесие в морской воде // Дальневосточные моря России. М.: ФГУП "Академический научно-издательский, производственно-полиграфический и книгораспространительный центр "Наука", 2007. С. 17-186.
- Кожаева Д.К., Жантеголов Д.В. Влияние биоорганических веществ на гидрохимические показатели Черекского водохранилища // Аграрная наука. 2017. № 1. С. 5-8.
- Бородина А.В. Динамика содержания гидрокарбонатов и карбонатов в среде Зарукка при выращивании микроводоросли spirulina platensis (nordst.) Geitler в накопительной культуре // Экология моря. 2002. Т. 60. С. 48-52.
- Рыженко Б.Н., Крайнов С.Р., Шваров Ю.В. Физико-химические факторы формирования состава природных вод (верификация модели "порода-вода") // Геохимия. 2003. № 6. С. 630.
- Morozova A.G., Lonzinger T.M., eds. Utilization of Metallurgical Slag With Presence of Novel CaO-MgO-SiO2-Al2O3 as a Composite Sorbent for Wastewater Treatment Contaminated by Cerium //j. Cleaner Prod. 2020. Vol. 255, №120286.
- Morozova A.G., Lonzinger T.M., eds. Insights into Sorption-Mineralization Mechanism for Sustainable Granular Composite of MgO-CaO-Al2O3-SiO2-CO2 Based on Nanosized Adsorption Centers and its Effect on Aqueous Cu(II) Removal // Nanomaterials. 2022; 12(1): №116.


